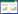文章信息
- 姜小萍, 雷有栋
- JIANG Xiao-ping, LEI You-dong
- 共沉淀法制备四氧化三铁的工艺
- Ferroferric Oxide Coprecipitation Preparation Process are Discussed
- 广西民族大学学报(自然科学版), 2017, 23(2): 93-96
- Journal of Guangxi University for Nationalities(Natural Science Edition), 2017, 23(2): 93-96
-
文章历史
- 收稿日期: 2017-04-07
随着科技的发展,由于四氧化三铁颗粒粒径小、比表面积大、磁性敏感等特性,四氧化三铁颗粒在磁记录材料、特殊催化剂、磁流体等领域广泛应用.四氧化三铁制备方法主要有:化学沉淀法、沉淀氧化法等.[1]但是化学共沉淀法因制备条件温和、工艺简单、工艺流程短、成本低设备简单因而被广泛采用.[2-4]
1 实验材料与方法 1.1 实验材料和实验仪器Fecl3·6H2O(天津市大茂化学试剂厂)、Fecl2·4H2O(天津市大茂化学试剂厂)、NaOH(天津市大陆化学试剂厂)、NH3·H2O(四川西陇化工有限公司)、Fe3O4均为分析纯.
752N型紫外分光光度计(上海仪电分析仪器有限公司制造)、XH-50E数字温控搅拌器(北京祥鹄科技发展有限公司)、SHB-Ⅲ循环水式真空泵(巩义市英峪高科仪器厂)、恒温鼓风干燥箱(上海琅玕实验设备有限公司).
1.2 实验方法采用化学共沉淀法制备四氧化三铁颗粒,此法通常是将二价铁和三价铁的可溶性盐配成溶液,然后按照一定的比例混合,用氢氧化钠和浓氨水作沉淀剂,将混合液中的二价铁和三价铁共同沉淀出来,沉淀转化为四氧化三铁后静置抽滤、烘干、称量.
氢氧化钠:Fe2++2Fe3++8OH-=Fe3O4↓
浓氨水:Fe2++2Fe3++8NH3·H2O=Fe3O4↓+8NH4++4H2O[6]
1.3 实验测定 1.3.1 正交试验溶液配制准确称取108.1160 g六水氯化铁,在1000 ml容量瓶中配制成0.4 mol/L的Fe3+溶液, 分别准确称量4.9702 g、9.9405 g、14.9108 g、19.8810 g四水氯化亚铁配制成0.1 mol/L、0.2 mol/L、0.3 mol/L、0.4 mol/L的Fe2+溶液各250 ml备用.
1.3.2 紫外可见分光光度计测定 1.3.2.1 配置标准溶准确称量0.3859 g的四氧化三铁(分析纯)加入20.00 ml盐酸加热一小时使其溶解,在100 ml容量瓶中配置成0.01 mol/L的标准溶液,放置12小时,待用.
1.3.2.2 最大吸收波长的测定用1 cm比色皿,以蒸馏水为空白为参比溶液,在300~520 nm之间,每隔10 nm测一次吸光度,在最大吸收峰附近2 nm测定一次吸光度.
在坐标纸上,以波长λ为横坐标,吸光度A为纵坐标,绘制A与λ关系的吸收曲线.从吸收曲线上选择测定Fe3O4的适宜波长,一般选用最大吸收波长(λmax)为测定波长.
1.3.2.3 氢氧化钠和浓氨水为沉淀剂测定其含量准确称取产物0.1577 g、0.2315 g、0.3473 g、0.4631 g,分别配制成0.005 mol/L、0.010 mol/L、0.015 mol/L、0.020 mol/L的溶液分别在最大波长下测其吸光度A,从标准曲线上查出和计算出产物中四氧化三铁的浓度.
2 结果与分析 2.1 正交试验将配制好的一定浓度的Fe3+和Fe2+溶液各取25.00 ml放入圆底烧瓶中在一定的摩尔比、温度、时间下进行各自的正交试验,迅速加入氢氧化钠溶液控制pH>10.记录反应的摩尔比、温度、时间等,最后烘干.[5-6]
从表 1可以看出以NaOH为沉淀剂,因素A(Fe3+/Fe2+摩尔比)的极差R最大.说明因素A对四氧化三铁的制备影响最大,然后影响从大到小依次为因素C(温度),因素B(时间).最优方案为A4B2C2即Fe3+/Fe2+摩尔比为4:4,反应时间为1.5 h,反应温度为50 ℃.
| 样号 | A | B | C | 实验结果 |
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 | 4:1 4:1 4:1 4:1 4:2 4:2 4:2 4:2 4:3 4:3 4:3 4:3 4:4 4:4 4:4 4:4 | 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 | 30 40 50 60 40 30 60 50 50 60 30 40 60 50 40 30 | 1.8952 2.0015 1.9003 1.8074 2.0449 2.0731 1.9952 2.0237 2.1262 2.1614 2.1533 2.1740 2.3436 2.1986 2.3098 2.1545 |
| K1 K2 K3 K4 | 7.6044 8.1369 8.6149 9.0065 | 8.4099 8.4346 8.3586 8.1596 | 8.2761 8.5302 8.2488 8.3076 | |
| K1 K2 K3 K4 | 1.9011 2.0342 2.1537 2.2516 | 2.1025 2.1086 2.0896 2.0399 | 2.0690 2.1325 2.0622 2.0769 | |
| 极差R | 0.3505 | 0.0687 | 0.0703 | |
| 因素主次顺序 | A>C>B | |||
| 最优条件 | A4 | B2 | C2 | |
| 优组合 | A4B2C2 |
从表 2可以看出以NH3·H2O为沉淀剂,因素A(Fe3+/Fe2+摩尔比)的极差R最大.说明因素A对四氧化三铁的制备影响最大,然后影响从大到小依次为因素C(温度),因素B(时间).最优方案为A4B4C3即Fe3+/Fe2+摩尔比为4:4,反应时间为2.5 h,反应温度为50 ℃.
| 样号 | A | B | C | 实验结果 |
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 | 4:1 4:1 4:1 4:1 4:2 4:2 4:2 4:2 4:3 4:3 4:3 4:3 4:4 4:4 4:4 4:4 | 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 1.0 1.5 2.0 2.5 | 30 40 50 60 40 30 60 50 50 60 30 40 60 50 40 30 | 1.8254 1.8476 1.8909 1.8358 1.9923 1.8547 2.0061 1.9848 2.1285 2.0958 2.1147 2.2113 2.3380 2.3663 2.2631 2.2705 |
| K1 K2 K3 K4 | 7.3997 7.8379 8.5503 9.2379 | 8.2842 8.1644 8.2748 8.3024 | 8.0653 8.3143 8.3705 8.2757 | |
| K1 K2 K3 K4 | 1.8499 1.9595 2.1376 2.3095 | 2.0710 2.0411 2.0687 2.0756 | 2.0163 2.0759 2.0926 2.0689 | |
| 极差 | 0.4596 | 0.0345 | 0.0763 | |
| 因素主次顺序 | A>C>B | |||
| 最有条件 | A4 | B4 | C3 | |
| 优组合 | A4B4C3 |
2.2 紫外可见分光光度法的实验结果及分析 2.2.1 最大吸收波长的测定和标准曲线的绘制
表 3和图 1反映了所配的标准溶液在752 N紫外可见分光光度计上测定的四氧化三铁的最大吸收波长为380 nm.
| 波长λ | 吸光度A | 波长λ | 吸光度A | 波长λ | 吸光度A | 波长λ | 吸光度A |
| 300 302 304 306 308 310 312 314 316 318 320 322 324 326 328 | 1.575 1.059 1.604 1.685 1.732 1.776 1.796 1.812 1.819 1.802 1.801 1.797 1.808 1.800 1.789 | 332 334 336 338 340 342 346 348 350 352 354 356 358 360 362 | 1.769 1.765 1.758 1.496 1.770 1.773 1.790 1.795 1.811 1.825 1.847 1.852 1.866 1.883 1.895 | 366 368 370 372 374 378 380 382 384 386 388 390 392 394 396 | 1.930 1.929 1.955 1.982 1.988 2.025 2.043 2.032 2.015 1.918 1.914 1.853 1.790 1.685 1.610 | 400 402 404 406 410 420 430 440 450 460 470 480 490 500 510 | 1.496 1.414 1.314 1.270 1.123 0.879 0.687 1.516 0.386 0.286 0.270 0.146 0.116 0.105 0.114 |
| 330 | 1.782 | 364 | 1.914 | 398 | 1.573 | 520 | 0.135 |
|
| 图 1 四氧化三铁最大吸收波长的确定 Fig. 1 Determination of the maximum absorption wavelength |
2.2.2 标准曲线的绘制
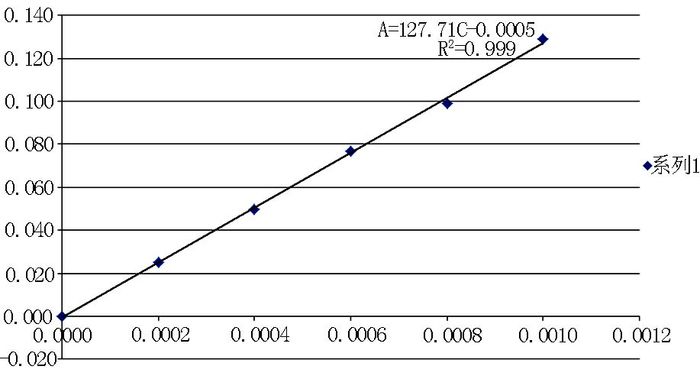
精确移取0.00 ml、1.00 ml、2.00 ml、3.00 ml、4.00 ml、5.00 ml标准溶液定容到50 ml容量瓶中,用1 cm比色皿,以蒸馏水为空白,在最大波长下,测量各溶液的吸光度,以四氧化三铁的含量为横坐标,以吸光度A为纵坐标,绘制标准曲线.
图 2和表 4反映了所配标准溶液在最大吸收波长380 nm处,在752N紫外风光光度计上所测绘制的标准曲线,并得到线性回归方程.
|
| 图 2 紫外可见分光光度法标准曲线的制作 Fig. 2 The standard curve of UV visible spectrophotometry |
| λ=380 nm | ||||||
| 样号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 浓度(mol/L) | 0.0000 | 0.0002 | 0.0004 | 0.0006 | 0.0008 | 0.0010 |
| 吸光度(A) | 0.000 | 0.025 | 0.050 | 0.077 | 0.099 | 0.129 |
2.2.3 试样含量计算公式
| ${\rm{A = }}127.71{\rm{C}} - {\rm{0}}{\rm{.0005}}$ | (1) |
A-表示标准溶液的吸光度:C-表示标准溶液的浓度(mol/L).
| $\rho \left( {{\rm{g}}/{\rm{ml}}} \right){\rm{ = nM}}/{\rm{V}}$ | (2) |
ρ-表示产物的含量(g/ml); n-表示产物物质的量(mol):M-表示产物的分子量(g/mol):V-表示体积(ml)
2.2.4 试样含量的分析由图 2、表 5和(1) 式、(2) 式得到了以NaOH为沉淀剂所制备的试样所配的溶液在752 N紫外可见分光光度计最大波长处所测得的吸光度,在标准曲线线性回归方程中找到对应的浓度,计算出其含量.
| λ=380 nm | |||
| 吸光度(A) | 浓度(n) | 含量(ρ) | 含量平均(ρ) |
| 1.946 | 0.0152 mol/L | 0.0035 g/ml | |
| 2.014 | 0.0158 mol/L | 0.0037 g/ml | |
| 2.020 | 0.0158 mol/L | 0.0037 g/ml | 0.00365 g/ml |
| 2.054 | 0.0160 mol/L | 0.0037 g/ml | |
由图 2、表 6和(1) 式、(2) 式得到了以NH3·H2O所制备的试样所配的溶液在752N紫外可见分光光度计最大波长处所测得的吸光度,并在标准曲线线性回归方程中找到对应的浓度,并计算出其含量.
| λ=380 nm | |||
| 吸光度(A) | 浓度(n) | 含量(ρ) | 含量平均(ρ) |
| 1.963 | 0.0154 mol/L | 0.0036 g/ml | |
| 2.157 | 0.0169 mol/L | 0.0039 g/ml | |
| 2.215 | 0.0173 mol/L | 0.0040 g/ml | 0.0039 g/ml |
| 2.225 | 0.0174 mol/L | 0.0040 g/ml | |
3 结果与讨论
实验以共沉淀法在无表面活性剂的作用下以氢氧化钠和浓氨水分别为沉淀剂制备四氧化三铁颗粒,结果表明:
1) 在以氢氧化钠为沉淀剂时,Fe3+/Fe2+的摩尔比对四氧化三铁颗粒的制备影响最大,然后影响从大到小依次为因素C(温度),因素B(时间).Fe3+/Fe2+摩尔比为4:4,反应时间
2) 以浓氨水为沉淀剂时,Fe3+/Fe2+的摩尔比对四氧化三铁的制备影响最大,然后影响从大到小依次为因素C(温度),因素B(时间).Fe3+/Fe2+摩尔比为4:4,反应时间为2.5 h,反应温度为50 ℃时制备出的四氧化三铁颗粒的产量最大;
3) 在752 N紫外可见分光光度计上对两种不同沉淀剂作用下制备的四氧化铁颗粒进行分析,实验结果表明:以浓氨水为沉淀剂时,溶液四氧化三铁的含量较高.
| [1] | 赵晓东, 冯启明, 王维清. 磁性纳米四氧化三铁的制备工艺及其表面改性[J]. 应用化工, 2010(2): 171–174. |
| [2] | 王晓斌, 黄国林. 纳米Fe3O4颗粒的制备及应用[J]. 化工时刊, 2010(9): 38–43. |
| [3] | 邵晓萍, 代波, 马拥军. 共沉淀制备不同粒径Fe3O4纳米颗粒及磁性能的研究[J]. 功能材料, 2011(01): 178–181. |
| [4] | 张杰, 胡登华. 磁性纳米Fe3O4粒子的制备与应用[J]. 武汉工程大学学报, 2011(10): 4–8. DOI:10.3969/j.issn.1674-2869.2011.10.002. |
| [5] | 汪永丽, 乔南宁. 共沉淀法制备Fe3O4纳米颗粒过程中沉淀剂种类对样品的影响[J]. 广东化工, 2014(20): 44–45. DOI:10.3969/j.issn.1007-1865.2014.20.021. |
| [6] | 黄菁菁, 徐祖顺, 易昌凤. 化学共沉淀法制备纳米四氧化三铁粒子[J]. 湖北大学学报:自然科学版, 2007(1): 50–52. |
| [7] | 于文广, 张同来, 张建国, 等. 纳米四氧化三铁(Fe3O4)的制备和形貌[J]. 化学进展, 2007(6): 884–892. |
| [8] | 马千里, 董相廷, 王进贤, 等. 纳米四氧化三铁的化学制备方法研究进展[J]. 化工进展, 2012(3): 562–573. |
| [9] | 张鑫, 李鑫钢, 姜斌. 四氧化三铁纳米粒子合成及表征[J]. 化学工业与工程, 2006(1): 45–48. |
| [10] | 付云芝, 牟敏仁, 向伟, 等. 共沉淀法合成小粒径单分散Fe3O4纳米颗粒[J]. 广东化工, 2009(9): 2–3, 47. |
| [11] | 林本兰, 沈晓冬, 崔升. 液相共沉淀法制备四氧化三铁纳米粉[J]. 无机盐工业, 2005(3): 24–25. |
| [12] | 徐海泉, 梁晓娟, 陈静, 等. 共沉淀法制备四氧化三铁包覆云母珠光颜料[J]. 无机盐工业, 2011(10): 25–28. DOI:10.3969/j.issn.1006-4990.2011.10.008. |
| [13] | 林本兰, 沈晓冬, 崔升. 纳米四氧化三铁磁性微粒的表面有机改性[J]. 无机盐工业, 2006(3). |
 2017, Vol. 23
2017, Vol. 23