动物细胞培养可用于生产具有重要医用价值的酶、疫苗、生长因子和单抗等,但由于其原始来源数量不足,需要进行体外大规模扩增后才能用以制备主细胞库或工作细胞库的细胞,而利用生物反应器则是实现细胞体外大规模扩增的主要方法。但对于贴壁依赖性细胞而言,如何在扩增后将其从材料表面有效地收获则成为一个重要的问题[1, 2]。酶解法是目前最常用的方法[3],但这种方法会破坏细胞之间以及细胞与细胞外基质(extracellular matrix, ECM)之间的连接蛋白,导致细胞膜蛋白损伤致使细胞功能缺失[4~6],削弱它们的医用价值。因此有必要减少酶解法的使用频次或者选用其它的方法收获细胞。
温敏性材料聚N-异丙基丙烯酰胺(poly (N-isopropylacrylamide), PNIPAAm)的研发为解决上述问题提供了新的思路。贴壁依赖性细胞在材料表面上黏附生长时对材料表面的性质具有一定的选择性,而PNIPAAm会随温度的改变呈现不同的整体构型和表面润湿性[7],37℃时,其表面呈弱疏水性,适于细胞黏附和生长;当温度低于其最低临界溶解温度(lower critical solution temperature, LCST)32℃时,表面呈亲水性并发生溶胀,从而使细胞脱附[8, 9]。由于PNIPAAm在溶胀状态下过于柔软,难以定型,通常都是将其接枝到基底材料上,克服其柔软性的同时,还可以使其修饰后的基底也表现出明显的温度响应性。
Yamada等人[10]率先在聚苯乙烯(TCPS)培养板上接枝PNIPAAm用于牛肝细胞的培养,并采用降温脱附法成功收获了细胞。随后,越来越多的科研团队采用不同的方法将PNIPAAm用于不同基底表面[11~17]或聚合物[18~31]进行温敏改性,考察不同细胞在所制备的温敏材料表面能否采用降温脱附法有效回收,以及回收后细胞能否保持其原有的特性,或者是建立由回收的细胞片层构建工程组织的概念等。这些研究显然为无损伤收获细胞提供了实验依据,但都只是限于培养器皿中静态条件下细胞的培养与增殖,得到的细胞数量有限,无法满足临床或生产生物制剂的需要。虽然也有研究者将微载体表面包覆PNIPAAm后进行贴壁细胞培养与收获[32, 33]方面的研究,以便日后用于反应器中大规模培养细胞,但流体剪切力或微载体间的碰撞会对细胞造成损伤;微载体还会吸附培养液成分及代谢产物,容易造成细胞聚集或受到代谢产物毒害作用等。而中空纤维膜生物反应器[34]用于细胞培养时,可以通过纤维膜管内灌流并充氧与膜管外壁供细胞黏附生长的方法,避免剪切力对细胞的伤害;同时营养物质与代谢产物还可以通过半透膜得以及时供给与排除;对于血清等大分子营养物,则可从管外灌入。因此,若能将温敏膜材料与生物反应器结合起来,得到温敏性中空纤维膜生物反应器用于细胞大规模扩增,当温度降低时便可实现细胞无损伤收获从而最大限度保持细胞功能的目的。在已有的温敏膜材料中,聚偏氟乙烯(Polyvinylidene fluoride, PVDF)接枝PNIPAAm的方法比较简单易操作[35, 36],但所制备的PVDF-g-PNIPAAm温敏膜目前都还只是用于水处理方面的研究[35, 36],未见用于细胞大规模扩增方面的报道。
基于上述分析,本文在静态条件下于培养皿内采用PVDF-g-PNIPAAm温敏膜培养Hela细胞,考察细胞在PVDF-g-PNIPAAm温敏膜上的黏附生长与降温脱附行为,并将降温脱附法与传统胰酶消化法收获细胞的效果进行比较,为下一步采用温敏性PVDF-g-PNIPAAm中空纤维膜生物反应器大规模扩增并无损伤收获细胞奠定基础。
2 材料与方法 2.1 材料 2.1.1 药品与材料浸没沉淀相转化法获得的PVDF膜及四种PVDF-g-PNIPAAm温敏膜[33, 35] M21,M32,M11和M23(PVDF粉末与NIPAAm单体反应质量比分别为2:1,3:2,1:1和2:3);FBS (Hyclone,美国);DMEM,双抗(青霉素/链霉素,100×),MTT,Calcein-AM,PI均购自美国SIGMA公司;EDTA和Trypsin购自美国GIBCO公司;其它试剂均为分析纯。
2.1.2 仪器倒置相差显微镜(IX70-131, Olympus Optical co. Ltd.,日本);显微摄像/图像分析系统(Sony, DXC-390P/CMS800, Cold Spring Corporation,日本);离心机(Z323,HERM,德国);超纯水机(Millipore-Q-Synthesis, Millipore, 美国);CO2培养箱(Hera cell,Kendro Laboratory Products,德国);酶标仪(ELx800,BioTech,美国);电热干燥箱(MC 02200124,宁波自动化仪表研究所);其它所用玻璃仪器均购自北京欣维尔玻璃仪器有限公司。
2.1.3 细胞Hela细胞购自上海哈灵生物科技有限公司,在DMEM+10%FBS常规培养液中常规培养并传代以备用。
2.2 方法 2.2.1 膜预处理将膜MPVDF,M21,M32,M11和M23剪至24孔板大小的形状,用壳聚糖-醋酸水溶液将其粘贴至24孔板底面上,干燥24 h,超纯水浸泡24 h,75%酒精浸泡三次,每次1 h;无菌干燥,紫外灭菌4 h,待用。
2.2.2 Hela细胞在PVDF-g-PNIPAAm温敏膜上的黏附生长将Hela细胞以5×104 cells·mL-1分别接种于粘贴不同膜(实验组)及未粘贴膜的24孔板(对照组)中,置37℃、5%CO2、饱和湿度的培养箱内培养。24 h和72 h后分别于倒置显微镜下观察细胞的生长状态并拍片。在各组细胞分别生长至24,48,72 h时,采用胰酶消化并计数,得到细胞增殖率。
2.2.3 细胞活率检测将Hela细胞以5×104 cells·mL-1分别接种至实验组和对照组,连同各自的空白组置37℃、5%CO2、饱和湿度的培养箱内培养。MTT法分别检测细胞生长至24,48,72 h时的OD值,按下式(a)计算细胞活率:
| $ {\rm{Cell viability}} = \frac{{O{D_{{\rm{Experiment}}}}-O{D_{{\rm{Experimental}}\;{\rm{blank}}\, }}}}{{O{D_{{\rm{Control}}}}-O{D_{{\rm{Control}}\;{\rm{blank}}\, }}}} \times {\rm{100}}\% $ | (a) |
式中,ODControl与ODControl blank 分别为对照组中含细胞孔与不含细胞孔的吸光度值;ODExperiment与ODExperimental blank分别为实验组中含细胞孔与不含细胞孔的吸光度值。
2.2.4 Hela细胞在PVDF-g-PNIPAAm温敏膜上的脱附待对照组与实验组细胞生长至80%~90%融合后,取出孔板,置20℃环境中吸出培养基,加入新鲜温度约为15℃的冷培养基,观察细胞脱附过程并拍片,筛选出细胞较易脱附的温敏膜,用以日后比较降温脱附法与传统胰酶消化法收获细胞时的效果。
将各组降温脱附下来的细胞采用胰酶处理并计数,未脱附的细胞用胰酶消化下来后计数,按下式(b)计算细胞的脱附率:
| $ {\rm{Cell detachment}} = \frac{{{\rm{Detached}}\;{\rm{cell}}\;{\rm{number}}}}{{{\rm{Detached}}\;{\rm{cell}}\;{\rm{number}} + {\rm{Undetached}}\;{\rm{cell}}\;{\rm{number}}}} \times {\rm{100}}\% $ | (b) |
对照孔内的细胞采用胰酶消化法收获,温敏膜孔内的细胞采用降温脱附法,将两种方法收集的细胞均用PBS重悬后置新的孔板内,每孔加入500 µL细胞死活染色工作液(2 μmol·L-1Caclein-AM+4 μmol·L-1 PI),置37℃、5%CO2、饱和湿度培养箱中孵育15 min,PBS反复漂洗几次,倒置荧光显微镜下观察细胞死活,拍片。
在荧光显微镜下,死细胞呈红色,活细胞呈绿色,二者之和为总细胞数,绿色细胞数与总细胞数之比为细胞活率。将两种方法收获的细胞死活染色照片均随机选取10个视野,采样计算每个视野中这一比值,取其平均值,可得到细胞的活率。
2.2.6 统计学分析每组实验重复三次,采用Origin 7.5软件进行统计学处理,所有数据以“均值±标准方差”表示,组间比较采用单因素方差分析和t检验。p < 0.05时认为有显著性差异。
3 结果 3.1 膜表面形貌分析图 1为MPVDF、M21、M32、M11、M23的扫描电镜照片。由图 1可以看出,所制备的MPVDF与四种PVDF-g-PNIPAAm膜表面均呈现蜂窝状孔结构,大孔内套着小孔,孔径大小在1~10 μm。观察图 1A~1E可知,膜表面孔径随着NIPAAm反应比的增加而增大,这主要是由于NIPAAm链段的致孔作用所致。

|
图 1 不同膜表面的扫描电镜图片 Fig.1 SEM micrographs of different membrane surfaces (A: MPVDF; B: M21; C: M32; D: M11; E: M23) |
对接枝改性后的膜分别测定了25℃和37℃下的静态接触角,结果如表 1所示。可见,没有接枝PNIPAAm的PVDF膜在25℃和37℃时的接触角基本相同,均为91°左右,表现为疏水性;而将PVDF接枝PNIPAAm后形成的四种PVDF-g-PNIPAAm膜,即M21、M32、M11和M23在37℃时其静态接触角均大于90°,表现为疏水性;当温度降至25℃时,这四种膜的静态接触角也随之降低,均小于90°,表现为亲水性。可见,经PNIPAAm接枝改性所制备的四种PVDF-g-PNIPAAm膜均具有温度敏感的特性,在温度改变时膜表面能发生亲/疏水性转变。
| 表 1 25℃和37℃下各膜表面的静态接触角() Table 1 Water contact angles of different membranes at 25℃ and 37℃ () |
图 2为Hela细胞接种至不同表面24,72 h后的生长图片。可以看出,细胞在这几种表面上均能正常黏附、铺展并增殖,说明PVDF-g-PNIPAAm温敏膜细胞相容性良好。其中,在MPVDF、M21、M32表面生长至24 h就出现片层状生长状态,而在M11和M23表面培养至72 h后才出现片层状生长。如图 2F所示,与其它表面相比,24 h内M23表面细胞黏附数量明显较少。
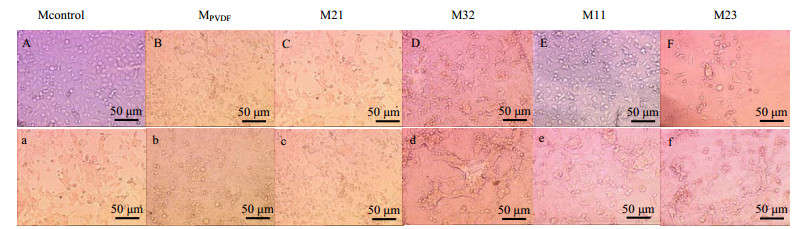
|
图 2 不同时间不同基底表面上Hela细胞的生长状态 Fig.2 Hela cells cultured on different surfaces at different times (A, B, C, D, E and F are Hela cells grow on the surfaces of conventional culture plate, PVDF membrane, PVDF-g-PNIPAAm membrane M21, M32, M11 and M23, respectively at 24 h; a, b, c, d, e and f are Hela cells grow on these different surfaces at 72 h.) |
将图 2所示的细胞生长至不同时间胰酶消化计数后得到细胞的增殖率,如图 3所示。可见,除常规培养板外,细胞接种至其它五种不同基底表面24 h内并没有翻倍增殖,而是经过一个逐渐适应的过程后增殖能力才明显提高;待培养至72 h时,细胞在这几种基底表面上均能增殖4~5倍,这也说明了PVDF-g-PNIPAAm温敏膜细胞相容性良好,适宜用作细胞培养的基底材料。
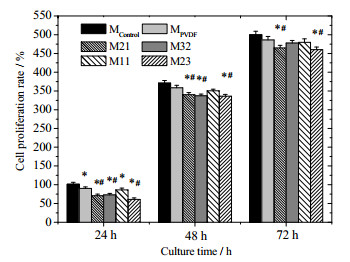
|
图 3 Hela细胞在不同基底表面上的增殖率 Fig.3 Proliferation rate of Hela cells on different surfaces. *p < 0.05, statistically different from control group; #p < 0.05, statistically different from MPVDF group. |
图 4为培养至24,48,72 h后,不同基底表面上Hela细胞的活率。可见,培养至24 h时,MPVDF、M21、M32、M11和M23上细胞活率均显著性低于MControl孔板表面,同时四种温敏膜除M11外其它三种温敏膜上细胞活率均显著性低于MPVDF组;随着培养时间的延长,细胞逐渐适应了这一生长环境,其生存能力得到了一定提高,到72 h时,在M32和M11上的细胞活率分别达(91.58±4.43)%与(88.25±6.09)%,与MControl及MPVDF组相比均无显著性差异。

|
图 4 MTT检测不同基底表面对Hela细胞活率的影响 Fig.4 Viability of Hela cell by MTT detection on different surfaces. *p < 0.05, statistically different from control group; # p < 0.05, statistically different from MPVDF group. |
实验分别观察了不同基底表面上Hela细胞的降温脱附过程,如图 5所示。可见,MControl和MPVDF在加入冷培养基后120 min内细胞形态无明显变化,细胞无法从膜上自动脱附;而四种PVDF-g-PNIPAAm温敏膜在温度降低时均可实现细胞不同程度的自动脱附。如M21表面细胞降温脱附较慢,加入冷培养基后30 min细胞形态才开始出现变化,细胞形态由多角形向圆形回缩,至150 min细胞才完全变成圆形从膜上脱附下来;M32表面细胞脱附较M21快一些,加入冷培养基后,30 min细胞形态即发生明显变化,至120 min时,细胞基本上全部变成圆形从膜上脱附;M11表面上细胞脱附明显较快,加入冷培养基后5 s内细胞即开始回缩,30 s内细胞变圆从膜上脱附,在膜边缘轻轻吹打,60 s内细胞均可以从膜上脱附下来;M23表面细胞脱附最慢,虽然在刚加入冷培养基1 min内就有个别细胞形态发生了变化,但直至90 min视野范围内细胞才逐渐变圆,且直至150 min时细胞仍维持此状态,只有少量细胞从膜上脱附。

|
图 5 Hela细胞在不同基底表面上的降温脱附过程 Fig.5 Hela cell detachment from different membrane surfaces |
将图 5所示的Hela细胞脱附过程进行定量分析,可以得到细胞的脱附率,如表 2所示。可以看出,采用降温脱附法在常规培养板及PVDF膜上无法实现收获细胞的目的;而采用本文所制备的四种PVDF-g-PNIPAAm温敏膜则可在不同程度上使细胞自动脱附。M21、M32、M11及M23表面PNIPAAm摩尔百分含量经计算后分别为8.03%,11.03%,18.55%和22.56%,细胞的脱附速率为M11> M32> M21> M23。可见,M21、M32及M11这三种膜表面上随着PNIPAAm含量的增加,细胞脱附速率逐渐增快;但当PNIPAAm含量超过一定数值时,其脱附速率反而降低,如四种温敏表面上M23表面PNIPAAm含量最高,但细胞在其表面的脱附速率却最慢;而在PNIPAAm接枝量为18.55%的M11表面,细胞能较快地自动脱附。
| 表 2 Hela细胞在不同基底表面上的降温脱附率(%) Table 2 Detachment rates of Hela cells on different surfaces by lowering temperature (%) |
由此看来,PVDF粉末与NIPAAm单体反应质量比为1:1时获得的M11表面用于Hela细胞培养时,细胞粘附生长、活率与脱附都比较令人满意,能够达到无损伤收获细胞的目的。因此,选择温敏性表面M11与常规空白培养板来考察降温脱附法与传统胰酶消化法收获细胞时的效果。
3.6 降温脱附法与胰酶消化法收获的Hela细胞死活染色图 6为MControl表面上利用胰酶消化法与M11表面上利用降温脱附法收获的细胞死活染色照片。Calcein-AM活细胞染色结果(图 6A, 6C)显示,两种方法均能收获较多的活细胞,但降温脱附法收获时细胞更易成团脱落,细胞外基质保存较完整些;PI死细胞染色结果(图 6B, 6D)表明,降温法收获的细胞中死细胞较少,细胞活性较高。通过采样计算绿色细胞数与总细胞数之比,得到两种方式收获的细胞活率,胰酶消化法约为(81±2.26)%,降温脱附法约为(95±3.47)%。可见,降温脱附法比胰酶消化法在收获细胞上具有明显的优势。

|
图 6 不同方法收获的Hela细胞死活染色 Fig.6 Live/dead fluorescence staining of Hela cells harvested by different methods (A and B are living cells and dead cells, by trypsinization, respectively; C and D are living cells and dead cells, by temperature droping, respectively) |
细胞与材料间的黏附是以蛋白质为介导而发生的,材料表面的亲/疏水性以及多孔结构会影响材料表面对蛋白质的吸附,因此也会直接影响到细胞在材料表面的粘附与脱附行为。一般疏水性的表面更容易吸附蛋白质,亲水性太强或疏水性太强的表面均不利于细胞的粘附和增殖,只有具有适度亲/疏水性能的表面才适宜细胞的粘附、生长与脱附,即存在着一个亲/疏水的平衡值,且培养细胞种类不同,该平衡值也各不相同。同时有研究发现[37],在基底材料表面引入多孔结构不仅能为细胞伪足提供更多的黏附位点,加强细胞与材料表面间的相互作用,而且多孔结构有利于细胞营养物质与代谢产物的运输与交换,利于细胞的黏附与生长;同时孔结构又利于水的渗透,降温时能促进细胞脱附。
所制备的四种PVDF-g-PNIPAAm温敏膜以及PVDF膜的表面均呈蜂窝状多孔结构,适宜细胞在其表面黏附生长。四种温敏多孔结构中同时存在亲水部分和疏水部分,不同温度下两者会竞争性地与水分子作用,在37℃时,高分子链段收缩,疏水作用占主体,利于细胞的黏附、铺展和增殖;当温度低于LCST(约32℃)时,高分子链段伸展,亲水作用占主体,在多孔结构与细胞间形成水化层并发生溶胀,促使细胞从材料表面自动脱附。其中,M23表面24 h内细胞黏附数量较少,脱附时细胞又较难脱附,这主要是由于PVDF与NIPAAm单体进行共聚反应时,小分子单体NIPAAm的浓度相对较高,因空间位阻以及大分子链段卷曲等因素的影响,NIPAAm单体之间自聚的倾向大于其向PVDF大分子接枝的倾向[38],致使其表面PNIPAAm的接枝链较长,含量较高,表面负电荷密度过大,细胞膜表面存在的酸性粘多糖多带有羧基、磺酸基等负电荷,因而细胞与材料表面之间电荷排斥作用增强,并最终阻碍细胞在表面的粘附、铺展与生长。与其它三种温敏膜表面相比,M23表面上PNIPAAm含量较高,其接枝链长度与密度都较大且有可能相互缠绕,从而会导致温度降低时,表面由疏水性向亲水性构型转变所需时间较长,因而细胞脱附速率也较慢。Takahashi等[39]通过实验证明,PNIPAAm的接枝链长度与密度均会影响细胞在材料表面的黏附与脱附行为,接枝链的链长与接枝密度超过一定阈值的材料表面不利于细胞的黏附、生长及脱附。
PVDF-g-PNIPAAm温敏膜中含有的PVDF对细胞是没有毒性的,而一定浓度的NIPAAm单体及其聚合物PNIPAAm对细胞则有一定的毒性作用[40],并且在将NIPAAm单体接枝到PVDF分子链上的共聚反应过程中,需要引入引发剂及其它一些有机溶剂,制备成膜后,会有少量毒性物质残留在膜上,从而对细胞造成一定的毒害作用,所以在接种初期细胞的活率明显低于在常规培养板上的生长活率。由于制备的温敏膜表面结构以及表面PNIPAAm的含量各不相同,因此短时间内细胞在不同膜表面的黏附状态及活率也有所差异;但随着培养时间的延长,细胞会逐渐适应这一生长环境,其生存能力也得到一定的提高,到72 h时细胞在M32和M11上的细胞活率分别达到(91.58±4.43)%与(88.25±6.09)%,与常规培养板以及PVDF膜表面上的细胞活率均无显著差异。
在材料表面有效黏附对于贴壁细胞而言是一个重要过程,同样从培养基底上有效脱附也是贴壁细胞繁衍后代和维持性状的一个必要过程。常见的胰酶消化法能够收获大规模扩增的细胞,但会破坏细胞间的连接蛋白以及整联蛋白与纤维连接蛋白之间的连接,导致细胞膜蛋白的损伤致使细胞功能缺失;传统的细胞刮刀法可以保留ECM的完整性,但细胞会变得支离破碎,同时这对于我们下一步要采用温敏性PVDF-g-PNIPAAm中空纤维膜生物反应器大规模扩增细胞而言,细胞刮刀法显然是不适用的;而降温脱附法不仅可以使大部分的纤维连接蛋白随细胞脱附,还可获得较完整的细胞片层和ECM,有效降低其它传统回收方法对细胞造成的伤害,保持细胞的功能,提高它们的医用价值,而且降低温度时,细胞便可自动从温敏性PVDF-g-PNIPAAm中空纤维膜表面脱附,从而有效回收生物反应器内大规模扩增的细胞。
5 结论本文通过对Hela细胞在PVDF-g-PNIPAAm温敏膜上粘附、生长与脱附的研究,得出以下结论:
(1) Hela细胞在不同温敏膜表面生长状态不同,但均能正常粘附生长,培养72 h后均能增殖4~5倍,且在表面PNIPAAm摩尔百分含量分别为11.03%和18.55%的M32和M11上细胞活率较高,分别为(91.58±4.43)%与(88.25±6.09)%。
(2) 随着PNIPAAm含量在M21、M32及M11这三种膜表面上的增加,细胞脱附速率逐渐增快,在M21与M32表面上分别降温脱附150,120 min后脱附率可达100%,而在M11表面上60 s即可达100%;当PNIPAAm含量超过22.56%(M23)时,其脱附速率反而降低,降温脱附150 min后脱附率只达5.5%;在四种不同温敏膜表面上的脱附速率为M11> M32> M21> M23。
(3) 降温脱附法与胰酶消化法均能收获较多的活细胞,细胞活率分别为(95±3.47)%和(81±2.26)%,降温脱附法收获时细胞更易成团脱落,细胞外基质保存较完整,存在回收细胞的优势。
| [1] | Da Silva R M, Mano J F, Reis R L . Smart thermoresponsive coatings and surfaces for tissue engineering:switching cell-material boundaries[J]. Trends in Biotechnology , 2007, 25 (12) : 577-583 DOI:10.1016/j.tibtech.2007.08.014 |
| [2] | JIANG Li-li(姜丽丽), LIU Tian-qing(刘天庆), SONG Ke-dong(宋克东) . Growth characteristics of human adipose-derived stem cells during long time culture(脂肪干细胞生长特性研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2014, 28 (2) : 275-281 |
| [3] | Cooperstein M A, Canavan H E . Biological cell detachment from poly(N-isopropyl acrylamide) and its applications[J]. Langmuir , 2009, 26 (11) : 7695-7707 |
| [4] | Canavan H E, Cheng X H, Graham D J . Cell sheet detachment affects the extracellular matrix:a surface science study comparing thermal liftoff, enzymatic, and mechanical methods[J]. Journal of Biomedical Materials Research Part A , 2005, 75A (1) : 1-13 DOI:10.1002/jbm.a.v75a:1 |
| [5] | Baskovich B, Sampson E M, Schultz G S . Wound dressing components degrade proteins detrimental to wound healing[J]. International Wound Journal , 2008, 5 (4) : 543-551 DOI:10.1111/iwj.2008.5.issue-4 |
| [6] | Sun G, Gerecht S . Vascular regeneration:engineering the stem cell microenvironment[J]. Regenerative Medcine , 2009, 4 (3) : 435-447 DOI:10.2217/rme.09.1 |
| [7] | Gil E S, Hudson S A . Stimuli-responsive polymers and their bioconjugates[J]. Progress in Polymer Science , 2004, 29 (12) : 1173-1222 DOI:10.1016/j.progpolymsci.2004.08.003 |
| [8] | Yang L, Pan F, Zhao X . Thermoresponsive copolymer nanofilms for controlling cell adhesion, growth, and detachment[J]. Langmuir , 2010, 26 (22) : 17304-17314 DOI:10.1021/la102411u |
| [9] | Cole M A, Voelcker N H, Thissen H . Stimuli-responsive interfaces and systems for the control of protein-surface and cell-surface interactions[J]. Biomaterials , 2009, 30 (9) : 1827-1850 DOI:10.1016/j.biomaterials.2008.12.026 |
| [10] | Yamada N, Okano T, Sakai H . Thermo-responsive polymeric surfaces; control of attachment and detachment of cultured cells[J]. Die Makromolekulare Chemie, Rapid Communications , 1990, 11 (11) : 571-576 DOI:10.1002/marc.1990.030111109 |
| [11] | Ide T, Nishida K, Yamato M . Structural characterization of bioengineered human corneal endothelial cell sheets fabricated on temperature-responsive culture dishes[J]. Biomaterials , 2006, 27 (4) : 607-614 DOI:10.1016/j.biomaterials.2005.06.005 |
| [12] | Yang J, Yamato M, Shimizu T . Reconstruction of functional tissues with cell sheet engineering[J]. Biomaterials , 2007, 28 (34) : 5033-5043 DOI:10.1016/j.biomaterials.2007.07.052 |
| [13] | Masuda S, Shimizu T, Yamato M . Cell sheet engineering for heart tissue repair[J]. Advanced Drug Delivery Reviews , 2008, 60 (2) : 277-285 DOI:10.1016/j.addr.2007.08.031 |
| [14] | Williams B C, Tsuda Y, Isenberg B C . Aligned cell sheets grown on thermo-responsive substrates with microcontact printed protein patterns[J]. Advanced Materials , 2009, 21 (21) : 2161-2164 DOI:10.1002/adma.v21:21 |
| [15] | Cooperstein M A, Canavan H E . Biological cell detachment from poly(N-isopropyl acrylamide) and its applications[J]. Langmuir , 2010, 26 (11) : 7695-7707 DOI:10.1021/la902587p |
| [16] | Kumashiro Y, Fukumori K, Takahashi H . Modulation of cell adhesion and detachment on thermo-responsive polymeric surfaces through the observation of surface dynamics[J]. Colloids and Surfaces B:Biointerfaces , 2013, 106 : 198-207 DOI:10.1016/j.colsurfb.2013.01.029 |
| [17] | Park B R, Nabae Y, Surapati M . Poly(N-isopropylacrylamide)-modified silica beads with hyperbranched polysiloxysilane for three-dimensional cell cultivation[J]. Polymer Journal , 2013, 45 (2) : 210-215 DOI:10.1038/pj.2012.124 |
| [18] | Nie P P, He X L, Chen L . Temperature-sensitive chitosan membranes as a substrate for cell adhesion and cell sheet detachment[J]. Polymers for Advanced Technologies , 2012, 23 (3) : 447-453 DOI:10.1002/pat.v23.3 |
| [19] | Ricardo M P, Paula M, Carlos E . Poly(N-Isopropylacrylamide) surface-grafted chitosan membranes as a new substrate for cell sheet engineering and manipulation[J]. Biotechnology and Bioengineering , 2008, 101 (6) : 1321-1331 DOI:10.1002/bit.v101:6 |
| [20] | He X L, Wang J Y, Xiao F . Syntheses of glcosylated thermo-responsive hydrogels and their interactions with HepG2 CHLLS[J]. Acta Polymeric Sinica , 2009 (12) : 1274-1281 |
| [21] | Wang J Y, Xiao F, Zhao Y P . Cell proliferation and thermally induced cell detachment of galactosylated thermo-responsive hydrogels[J]. Carbohydrate Polymers , 2010, 82 (3) : 578-584 DOI:10.1016/j.carbpol.2010.05.011 |
| [22] | MA Dan(马丹). Preparation of temperature-sensitive PNIPAAm-g-PDMS intelligent surface and its performace and applications incell culture(智能表面的制备、性能研究及在细胞培养中的应用)[D]. Hangzhou(杭州):Zhejiang University(浙江大学), 2010. |
| [23] | Li L H, Wu J D, Gao C Y . Surface-grafted block copolymer brushes with continuous composition gradients of poly(poly(ethylene glycol)-monomethacrylate) and poly[J]. Science China Chemistry , 2011, 54 (2) : 334-342 DOI:10.1007/s11426-010-4192-8 |
| [24] | Yang N, Chen L, Yang M K . In vitro study of the interactions of galactosylated thermo-responsive hydrogels with cells[J]. Carbohydrate Polymers , 2012, 88 (2) : 509-516 DOI:10.1016/j.carbpol.2011.12.036 |
| [25] | Lin J B, Isenberg B C, Shen Y . Thermo-responsive poly(N-isopropylacrylamide) grafted onto microtextured poly(dimethylsiloxane) aligned cell sheet engineering[J]. Colloids and Surfaces B:Biointerfaces , 2012, 99 : 108-115 DOI:10.1016/j.colsurfb.2011.10.040 |
| [26] | Pan G Q, Guo Q P, Ma Y . Thermo-responsive hydrogel layers imprinted with RGDS peptide:a system for harvesting cell sheets[J]. Angewandte Chemie International Edition , 2013, 52 (27) : 6907-6911 DOI:10.1002/anie.201300733 |
| [27] | Nagase K, Hatakeyama Y, Shimizu T . Hydrophobized thermoresponsive copolymer brushes for cell separation by multistep temperature change[J]. Biomacromolecules , 2013, 14 (10) : 3423-3433 DOI:10.1021/bm4006722 |
| [28] | Yuan W, Zhao N N, Yu B R . Thermo-responsive gelatin-functionalized PCL film surfaces for improvement of cell adhesion and intelligent recovery of gene-transfected cells[J]. Science China Chemistry , 2011, 57 (4) : 586-595 |
| [29] | Zhang Y, Ng S S, He T . Effect of adhesive ligand on cell deadhesion kinetics on poly[J]. Bio-Medical Materials and Engineering , 2014, 24 (2) : 1433-1445 |
| [30] | Sakuma M, Kumashiro Y, Nakayama M . Control of cell adhesion and detachment on Langmuir-Schaefer surface composed of dodecyl-terminated hermo-responsive polymers[J]. Journal of Biomaterials Science-Polymer Edition , 2014, 25 (5) : 431-443 DOI:10.1080/09205063.2013.866761 |
| [31] | YANG Lei(杨磊). Construction of a new temperature-sensitive film and its applications in stem cells culture and harvest(新型温敏膜的构建及其培养收获干细胞的研究)[D], Dalian(大连):Dalian University of Technology(大连理工大学), 2012. |
| [32] | Barroso T, Viveiros R, Temtem Mr . A combined strategy to surface-graft stimuli-responsive hydrogels using plasma activation and supercritical carbon dioxide[J]. ACS Macro Letters , 2012, 1 (3) : 356-360 DOI:10.1021/mz200145w |
| [33] | Wadajkar A S, Santimano S, Tang L P . Magnetic-based multi-layer microparticles for endothelial progenitor cell isolation, enrichment, and detachment[J]. Biomaterials , 2014, 35 (2) : 654-663 DOI:10.1016/j.biomaterials.2013.10.015 |
| [34] | LI Xiang-qin(李香琴), LIU Tian-qing(刘天庆), ZHU Lin(朱琳) . Culture and expansion of mesenchymal stem cells in air-lift loop hollow fiber membrane bioreactor(气升式环流中空纤维膜生物反应器内骨髓间充质千细胞的培养与扩增)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2008, 22 (6) : 985-991 |
| [35] | LI Wan-chao(李万超). Preparation of PVDF-g-PNIPAAm intelligent membrane and the study on the relationship between structure and properties of the membrane(PVDF-g-PNIPAAm智能膜的制备与结构和性能关系研究)[D]. Tianjin(天津):Tianjin Polytechnic University(天津工业大学), 2009. |
| [36] | BAI Jing-na(白静娜), FENG Xia(冯霞), CHEN Li(陈莉) . Research on preparation and performance of temperature-sensitive antifouling poly(vinylidene fluoride)-graft-poly(N-isopropylacrylamide)(PVDF-g-PNIPAAm温敏抗污染膜的制备及性能研究)[J]. Functional Materials(功能材料) , 2012, 43 (6) : 794-797转802 |
| [37] | GE Quan-bo(葛泉波), HE Shu-lan(何淑兰), MAO Jin-shu(毛津淑) . The Interaction between Biomaterials and Cells and Surface modification of Biomaterials(生物材料与细胞相互作用及表面修饰)[J]. Chemistry Report(化学通报) , 2005, 68 (1) : 43-48 |
| [38] | CHEN Li(陈莉), LU Er-li(陆尔力), WANG Wen-yu(王闻宇) . Synthesis and characterization of temperature-sensitive poly(vinylidene fluoride) membrane materials(温敏型聚偏氟乙烯膜材料的合成及表征)[J]. Functional Materials(功能材料) , 2007, 38 (12) : 1990-1992 |
| [39] | Takahashi H, Nakayama M, Yamato M . Controlled chain length and graft density of thermoresponsive polymer brushes for optimizing cell sheet harvest[J]. Biomacromolecules , 2010, 11 (8) : 1991-1999 DOI:10.1021/bm100342e |
| [40] | Wadajkar A S, Koppolu B, Rahimi M . Cytotoxic evaluation of N-Isopropylacrylamide monomers and temperature-sensitive poly(N-Isopropylacrylamide) nanoparticles[J]. Journal of Nanoparticle Research , 2009, 11 (6) : 1375-1382 DOI:10.1007/s11051-008-9526-5 |





