厌氧发酵是一种能减少有机污染物的同时产生生物能源的有效方法,世界各地均有广泛应用[1, 2]。沼气发酵是在厌氧条件下,有机质经微生物发酵产生沼气的过程,分为水解、酸化、乙酸化和甲烷化4个阶段[3]。甲烷化有两条反应路径:
| ${\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}} \to {\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{ + C}}{{\rm{O}}_{\rm{2}}}{\rm{,}}\Delta {G^{Ɵ}}{\rm{ = -31}}\,{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (1) |
| ${\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O,}}\Delta {G^{Ɵ}}{\rm{ = -136}}\,{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - {\rm{1}}}}$ | (2) |
沼气中的甲烷约70%来自于路径(1),此时CH4和CO2产生比例为1:1,CH4浓度只能占50%,而路径(2) 的气相产物只有CH4,且从热力学角度来看,路径(2) 也更为有利,但往往由于H2的限制,路径(2) 产甲烷贡献只占30%[3~5]。因此,沼气中一般含有60%~70%的CH4,30%~40%的CO2以及H2S、CO和H2O等其他微量气体。沼气能量密度低,通常只用于发电和供热。将其进行提纯(脱碳)后,CH4的含量达到90%以上,升级为生物甲烷,可作为天然气的替代品并入现有天然气管网,作民用或工业用燃料,也可用作车用燃料[6, 7],极大地拓宽了用途。
目前发展较成熟的沼气提纯技术主要有水洗法、变压吸附法、膜分离法和物理化学吸收法等[8~10],这些技术需额外投加处理设备,投资大、能耗高,削弱了经济竞争力[11]。另外,这些技术在沼气提纯过程中,小部分CH4也随着CO2一起排放到大气中,不仅造成资源浪费,同时这部分温室气体也影响了环境[12]。为克服以上这些不利之处,近些年有学者通过向沼气厌氧发酵体系中添加外源H2,目的在于利用食氢产甲烷菌的生物活动,原位转化CO2合成CH4,提高路径(2) 的甲烷贡献率;同时降低沼气中CO2浓度,提高沼气中甲烷的浓度,实现沼气的提纯[13~15]。外源H2也是一种清洁能源,但其热值仅约为CH4的1/4,运输储存成本却是CH4的3倍左右[16],所以通过外源H2的通入提高沼气中CH4纯度,前后并没有造成多大的能量损失,又使能源利用更便捷、更广泛。此外,外源H2的获得可以通过可再生能源电解水得到[14],也可通过其他资源获得,比如煤气、石油精炼厂、石化工厂和碳酸饮料制造厂等[17],进一步降低该技术的成本。
此前,课题组已建立一套利用外源H2原位脱除CO2提纯沼气的小试装置,并取得初步研究成果[18],但该装置中外源H2的通入未能实现连续化,这导致外源H2的利用率不高,也缺乏对于技术工业应用的指导意义。本文在此基础上,重新设计并建立了能连续导入外源H2的小试装置,选择水稻秸秆为发酵底物,分别在中温发酵和高温发酵条件下,探索外源H2通入量对厌氧发酵过程中产气规律和沼气组成的影响和外源H2利用率,初步分析外源H2导入对发酵体系中挥发性脂肪酸(VFAs)等参数的变化。
2 材料与方法 2.1 实验材料本文使用的水稻秸秆取自浙江省建德市下涯镇联合村,秸秆的总固体(TS)为(91.0±0.3)%,挥发性固体(VS)为(77.6±0.6)%,使用前用粉碎机将其粉碎。沼液取自杭州正兴牧业有限公司浙江大学奶业科学研究所实验牧场,TS为(3.6±0.1)%,VS为(1.9±0.1)%。
2.2 实验装置及说明实验装置如图 1所示,沼气发酵装置由1 L的发酵瓶构成,工作体积为600 mL。加入40.8 g秸秆和300 mL沼液,并用水稀释至600 mL,控制TS为(8±0.1)%,橡胶塞密封后用氩气驱赶瓶内残余空气,使之完全处于厌氧状态;发酵瓶置于恒温水浴锅中,分别在中温(35±1)℃和高温(55±1)℃条件下发酵。来自钢瓶的H2首先连接转子流量计,用于初步控制和稳定H2的流量,然后经蠕动泵计量后由分气头均匀分流至三个发酵瓶中。其中,蠕动泵流量由皂膜流量计预先校验。根据发酵系统中食氢产甲烷路径H2与CO2之间的化学计量关系(1 mol CO2转化为CH4需要4 mol H2)确定H2的通入量分别为CO2产生量的4、5和6倍。根据前期预实验沼气产量及CO2的含量,中温发酵条件下H2的通入量分别为1070、1330和1600 mL·L-1·day-1,高温发酵条件下分别为2130、2670和3200 mL·L-1·day-1。每组设置三个平行,并设置不通外源H2的对照组。发酵周期为36 d,每日沼气产生量通过小型顶空罐计量。
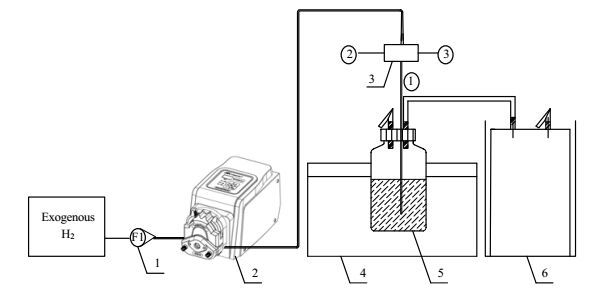
|
图 1 厌氧发酵实验小试装置示意图 Fig.1 Schematic diagram of the batch fermentation setup (② and ③ device were the same as ①) 1. rotor flowmeter 2. peristaltic pump 3. gas distribution device 4. water bath thermostat 5. fermentation bottle 6. biogas collection |
秸秆和沼液的TS、VS根据美国公共卫生协会(APHA)水和废水检验的标准方法[19]测得。批试结束后发酵液经离心过滤并检测其pH和VFAs。用便携式pH计(雷磁PHB-4) 测量pH,气相色谱法(GC-6890N,Agilent Technologies)测定VFAs浓度,采用火焰离子化检测器(FID)和FFAP毛细管柱。
每周2次采顶空集气罐中沼气样,并用气相色谱(GC-1690,科晓)测定其中CH4、CO2和H2的体积分数,采用TDX-01和5A分子筛填充柱以及热导检测器(TCD)。
为消除外源H2残留对沼气产量的影响,沼气的实际产量可用下式修正:
V*=(1-y)V
其次,较大量残留的外源H2将影响沼气中各组分体积分数,因此将扣除残留的H2、N2、H2S、H2O等杂气后所得CH4和CO2的体积分数定义为CH4和CO2的相对体积分数,以CH4*和CO2*表示。
3 结果与讨论 3.1 外源H2的通入量厌氧发酵体系中沼气各组分体积分数变化如图 2所示。对照组中,平均CH4相对体积分数分别约为61.3% (中温发酵)、61.1% (高温发酵)。4、5及6倍的外源H2通入量下,沼气中CH4相对体积分数分别增加到68.6%、73.3%、74.7% (中温发酵)与71.4%、81.9%、83.4% (高温发酵),CO2相对体积分数分别降至31.4%、26.7%、25.3% (中温发酵)与28.6%、18.1%、16.6% (高温发酵)。在微生物作用下,外源H2与厌氧发酵产生的CO2原位合成CH4。沼气中CO2浓度的降低和甲烷浓度的提高,实现了沼气的提纯。
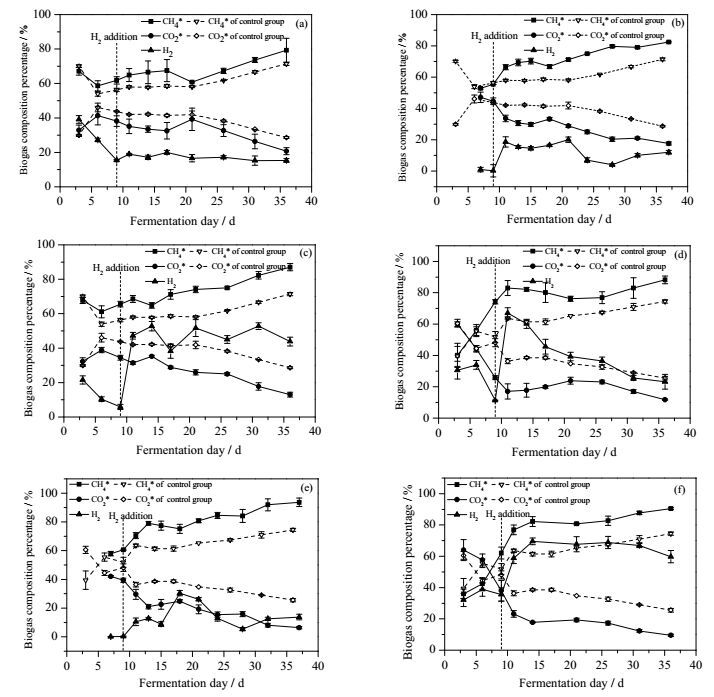
|
图 2 中温(a、b、c)发酵和高温(d、e、f)发酵沼气中各组分变化图 Fig.2 Biogas composition at mesophilic (a, b, c) and thermophilic (d, e, f) fermentation conditions a, d: 4 times of H2 b, e: 5 times of H2 c, f: 6 times of H2) |
由式(2) 可知,H2与CO2以4:1的比例生成CH4,因此理论上通入4倍的外源H2为宜,但由于H2气液传质的限制,实际适宜的外源H2通入量需要经过实验来确定。从上图中可以看出,随着外源H2通入量的增加,CH4相对体积分数也呈现逐步递增的趋势。其中,5倍通入量较4倍通入量提纯效果明显,相比之下,6倍较5倍通入量效果无明显提高。另一方面,从CH4产量来看(图 3),通入外源H2的发酵体系CH4产量均高于对照组,但并不与通入量成正比,外源H2通入量为CO2产生量5倍时CH4产量最高,当外源H2通入量增加至6倍时,CH4产量反而有所减少。
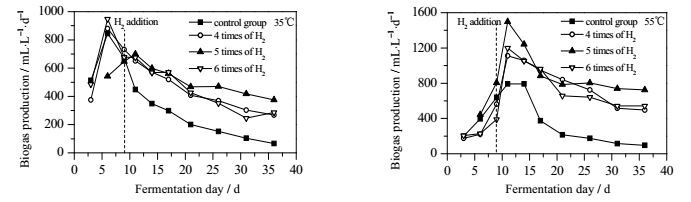
|
图 3 中温发酵和高温发酵CH4产量图 Fig.3 Methane yields in mesophilic and thermophilic fermentation reactors |
分析其原因,当通入量为4倍时,由于H2难溶于水,气液传质速率小,外源H2不能完全被利用;当通入量增加至5倍时,强化了气液传质速率,溶于发酵体系从而被微生物利用的外源H2增加,CH4的产量和体积分数均随之提高;然而当外源H2通入量继续增加为6倍时,发酵罐内气泡聚并严重,使单位液体体积中的气泡数目减少,气液传质速率可能随着气体流量的增大先呈增大趋势,到一定值时继而呈减小趋势[20],故此时CH4体积分数并未有明显提高,甚至CH4产量较5倍时反而有所减少。另外,当外源气体通入量增加为6倍时,沼液pH升高呈碱性环境,不利于厌氧发酵。综上所述,5倍的外源H2通入量为最佳通入量。
3.2 外源H2转化率与利用率如前所述,外源H2的利用取决于气液传质速率,这决定了通入发酵瓶的外源H2不能完全转化或利用,少部分残留在沼气中。根据外源H2的通入量和沼气中H2的残余量,可以计算出外源H2消耗量,消耗量与通入量的比值定义为外源H2转化率,公式如下:
| $T = \frac{{A - R}}{A} \times 100\% $ |
通过对比对照组和实验组的CH4产量,可估算出消耗的外源H2中实际被用于转化为CH4的量,将此被利用的量与通入量的比值定义为外源H2利用率,公式如下:
| $U = \frac{{\left( {{P_{\rm{t}}} - {P_{\rm{c}}}} \right) \times 4}}{A} \times 100\% $ |
外源H2转化率与利用率如表 1所示,结果表明二者非常接近,说明消耗的外源H2几乎全部转化为CH4,CH4产量的增加来源于外源H2的通入。
| 表 1 外源H2转化率与利用率 Table 1 Conversion and utilization of exogenous H2 |
表 1可见,随着外源H2通入量的增加,H2转化率并不是呈正相关,当外源H2通入量为5倍时,转化率达到最高,再次验证此时外源H2的气液传质速率最强,当通入量增加至6倍时,外源H2转化率急速下降,造成H2能源的浪费。综合考虑,虽然6倍的外源H2通入量使得CH4体积分数有所提高,但相比较5倍外源H2来说,提高程度不明显,却造成H2的浪费,因此外源H2通入量为5倍为宜。
3.3 中温发酵和高温发酵对比外源H2的通入,中温和高温发酵体系中均实现CH4体积分数的显著提高。然而,与中温发酵相比,高温发酵外源H2利用率增加不多,但沼气中CH4相对体积分数却明显高于中温发酵。另一方面,对比沼气总产量(图 4),中温发酵也不及高温发酵。比较两者发酵后沼液的VS(中温发酵9.8%,高温发酵9.0%),高温发酵比低温发酵多出8%生物质被分解,说明有机质在高温情况下更容易被降解,高温发酵较中温发酵更有优势,这与其他研究者结果一致[21]。一般情况下,随着温度的升高,微生物活性增强,发酵产气效率也随之提高[22]。因此高温发酵有更高的沼气产量和CH4产量,CH4体积分数也更高。
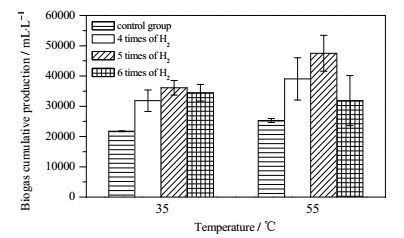
|
图 4 不同温度和外源H2通入量下的总产气量 Fig.4 Total biogas yields under different exogenous gas fluxes at 35℃ and 55℃ |
发酵结束后,发酵液的pH和其中VFAs浓度如表 2所示,结果表明液相中的VFAs未发现明显累积,乙酸、丙酸、异丁酸和正丁酸都维持在相对较低水平,较对照组反而降低。外源H2的通入丰富了发酵系统中同型产乙酸菌,并使氢营养菌处于优势地位[23],所以外源H2的通入并没有抑制VFAs的降解,反而提高了沼气中的CH4含量。沼液中CO2主要是以碳酸氢盐(酸式碳酸盐)的形式存在[24],过量外源H2通入使得食氢产甲烷菌消耗大量碳酸氢盐,导致沼液pH升高[14, 15],形成不利于厌氧发酵产沼气的偏碱性的环境。
| 表 2 中温和高温厌氧发酵后沼液中pH和VFAs数据表 Table 2 pH and VFAs after mesophilic and thermophilic anaerobic fermentation |
中温或高温沼气发酵系统中,外源H2的引入能有效提高系统中沼气产量和CH4的相对体积分数,其中CH4相对体积分数随外源H2通入量的增加而增加,合适的外源H2通入量确定为体系中CO2产生量的5倍。相比对照组,此通入量下CH4的体积分数分别提高了20%和34%,实现了沼气的原位提纯。通入沼气发酵系统的外源H2能被充分地转化和利用,在最佳外源H2通入量下,中温和高温条件下外源H2利用率分别达到79%和85%。与中温发酵相比,高温发酵外源H2利用率增加不多,但高温发酵沼气中CH4相对体积分数明显高于中温发酵,最大高出12%,沼气产量和CH4产量也相对较高,高温发酵更具优势。外源H2的导入会使发酵系统pH升高而不利于沼气发酵,但明显改善了发酵液中VFAs的累积问题,从而有利于沼气发酵。
符号说明:
| A | —外源H2通入量,mL·L-1·d-1 | U | —外源H2利用率,% |
| Pc | —对照组CH4产量,mL·L-1·d-1 | V | —修正前的沼气产量,mL·L-1·d-1 |
| Pt | —实验组CH4产量,mL·L-1·d-1 | V* | —修正后的沼气产量,mL·L-1·d-1 |
| R | —沼气中残余H2量,mL·L-1·d-1 | y | —沼气中残余H2量的体积分数,% |
| T | —外源H2转化率,% |
| [1] | Angelidaki I, Chen X X, Cui J B, et al. Thermophilic anaerobic digestion of source-sorted organic fraction of household municipal solid waste:start-up procedure for continuously stirred tank reactor[J]. Water Research , 2006, 40(14): 2621-2628. DOI:10.1016/j.watres.2006.05.015. |
| [2] | Boe K, Angelidaki I. Serial CSTR digester configuration for improving biogas production from manure[J]. Water Research , 2009, 43(1): 166-172. DOI:10.1016/j.watres.2008.09.041. |
| [3] | Weiland P. Biogas production:current state and perspectives[J]. Applied Microbiology and Biotechnology , 2010, 85(4): 849-860. DOI:10.1007/s00253-009-2246-7. |
| [4] | Demirel B, Scherer P. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass to methane:a review[J]. Reviews in Environmental Science and Bio/Technology , 2008, 7(2): 173-190. DOI:10.1007/s11157-008-9131-1. |
| [5] | Hu Y, Hao X, Zhao D, et al. Enhancing the CH4 yield of anaerobic digestion via endogenous CO2 fixation by exogenous H2[J]. Chemosphere , 2014, 140: 34-39. |
| [6] | Deng L, Hägg M B. Techno-economic evaluation of biogas upgrading process using CO2 facilitated transport membrane[J]. International Journal of Greenhouse Gas Control , 2010, 4(4): 638-646. DOI:10.1016/j.ijggc.2009.12.013. |
| [7] | Pires J, Saini V K, Pinto M L. Studies on selective adsorption of biogas components on pillared clays:approach for biogas improvement[J]. Environmental Science & Technology , 2008, 42(23): 8727-8732. |
| [8] | Ryckebosch E, Drouillon M, Vervaeren H. Techniques for transformation of biogas to biomethane[J]. Biomass & Bioenergy , 2011, 35(5): 1633-1645. |
| [9] | Petersson A, Wellinger A. Biogas upgrading technologies-developments and innovations[R]. Paris:IEA Bioenergy, 2009. |
| [10] | ZANG Xiao-ya(臧小亚), LIANG De-qing(梁德青), WU Neng-you(吴能友). CO2 removal from simulated biogas using semi-clathrate hydrates of different concentration tetra-n-butyl ammonium bromide aqueous solutions(不同浓度TBAB半笼型水合物法分离沼气中CO2过程的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(6): 1241-1248. |
| [11] | Lindeboom R E, Weijma J, van Lier J B. High-calorific biogas production by selective CO retention at autogenerated biogas pressures up to 20 bar[J]. Environmental Science & Technology , 2012, 46(3): 1895-1902. |
| [12] | TU Rui(涂睿), LI Jun(黎军), WANG Meng(王萌), et al. Research progress of biogas upgrading with external resource of hydrogen gas(利用外源氢气纯化升级沼气的研究进展)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2014, 65(5): 1587-1593. |
| [13] | Nordberg Å, Edström M, Uusipenttilä M, et al. Selective desorption of carbon dioxide from sewage sludge for in-situ methane enrichment:enrichment experiments in pilot scale[J]. Biomass & Bioenergy , 2012, 37(37): 196-204. |
| [14] | Luo G, Johansson S, Kanokwan B, et al. Simultaneous hydrogen utilization and in situ biogas upgrading in an anaerobic reactor[J]. Biotechnology and Bioengineering , 2012, 109(4): 1088-1094. DOI:10.1002/bit.24360. |
| [15] | Luo G, Angelidaki I. Co-digestion of manure and whey for in situ biogas upgrading by the addition of H2:process performance and microbial insights[J]. Applied Microbiology and Biotechnology , 2013, 97(3): 1373-1381. DOI:10.1007/s00253-012-4547-5. |
| [16] | Balat M. Potential importance of hydrogen as a future solution to environmental and transportation problems[J]. International Journal of Hydrogen Energy , 2008, 33(15): 4013-4029. DOI:10.1016/j.ijhydene.2008.05.047. |
| [17] | Ni B J, Liu H, Nie Y Q, et al. Coupling glucose fermentation and homoacetogenesis for elevated acetate production:experimental and mathematical approaches[J]. Biotechnology and Bioengineering , 2011, 108(2): 345-353. DOI:10.1002/bit.22908. |
| [18] | LIN Chun-mian(林春绵), YU You(俞游), ZHANG Yi-ma(章祎玛), et al. Research on the in-situ synthesis of methane from exogenous hydrogen by anaerobic fermentation(外源氢厌氧发酵原位合成甲烷的实验研究)[J]. Journal of Zhejiang University of Technology(浙江工业大学学报) , 2015, 43(6): 595-599. |
| [19] | Clescerl L S. Standard methods for the examination of water and wastewater 20th Ed[M]. Washington D C:Amer Public Health Assn, 1998. |
| [20] | LIU You-zhi(刘有智), LUO Wen-hao(罗文浩), SHANG Hai-ru(尚海茹), et al. Gas liquid mass transfer specific area in microporous membrane gas distributor(微孔膜气体分布器气液传质比表面积的研究)[J]. Chemical Industry and Engineering Progress(化工进展) , 2009, 28(9): 1536-1539. |
| [21] | Bassani I, Kougias P G, Treu L, et al. Biogas upgrading via hydrogenotrophic methanogenesis in two-stage continuous stirred tank reactors at mesophilic and thermophilic conditions[J]. Environmental Science & Technology , 2015, 49(20): 12585-12593. |
| [22] | BAI Na(白娜), MEI Zi-li(梅自力), FU Zheng-ge(符征鸽), et al. The effects of temperature on anaerobic digestion of three different straws for biogas production(三种秸秆在不同温度下发酵产气特性研究)[J]. China Biogas(中国沼气) , 2011, 29(1): 16-21. |
| [23] | Wang W, Xie L, Luo G, et al. Performance and microbial community analysis of the anaerobic reactor with coke oven gas biomethanation and in situ biogas upgrading[J]. Bioresource Technology , 2013, 146(10): 234-239. |
| [24] | Kim H W, Marcus A K, Shin J H, et al. Advanced control for photoautotrophic growth and CO2-utilization efficiency using a membrane carbonation photobioreactor[J]. Environmental Science & Technology , 2011, 45(11): 5032-5038. |




