磷脂是一类存在于生物界的含磷脂类[1],其中植物磷脂主要存在于油料种子中,并与蛋白质、糖类、脂肪酸、菌醇、维生素等物质以结合状态存在,是一类重要的油脂伴随物[2]。目前,以油料作物、藻类为原料制备航空燃油技术备受关注,该技术包括水解、脱氧和重整等多步工艺[3~5]。原料油脂中除了甘油三酯,还有磷脂和糖脂等[6]。甘油酯(磷脂)水解后水油分离,上层的游离脂肪酸可用于脱氧反应,下层水相中的磷酸可直接除去,避免了磷脂、磷酸在脱氧和重整反应中引起催化剂中毒失活[7]。甘油三酯在高温液态水中的水解反应已有较多的研究,陈良等[8]系统研究了高温液态水中大豆油的水解动力学,并采用二级自催化反应动力学模型对数据进行了拟合,得到大豆油在高温液态水中水解反应的活化能。孙辉等[9]系统研究了碘值对油脂水解的影响。磷脂在高温液态水中的水解尚未见报道,因此须单独研究磷脂的水解动力学。高温液态水中生物质水解反应工艺简单,对环境友好[10, 11]。因此,本文以高温液态水为反应介质,以磷脂中的主要成分卵磷脂作为模型物质,系统地研究其在高温液态水中的水解反应动力学,并对其水解机理进行探究。
2 实验部分 2.1 试剂与仪器卵磷脂( ≥ 98%,PC)、磷酸( ≥ 85%(wt)水溶液)购自阿拉丁试剂(中国)公司;甘油( ≥ 99.5%)购自于美国Sigma-Aldrich 公司;硫酸( ≥ 98%)、无水甲醇( > 99.5%)购于国药集团化学试剂有限公司;甘油磷酸胆碱(99%,GPC)、胆碱(45%(wt)水溶液)购于百灵威科技有限公司。
反应釜由釜体、锥堵和压帽三部分组成,反应釜容积为12 mL、内径为10 mm、设计压力为22 MPa、设计温度为320℃,反应釜和加热炉购于大连科贸实验设备有限公司。
2.2 实验方法称取一定量的卵磷脂加入12 mL反应釜中,然后加入6 mL去离子水,密封后放入已达到设定温度加热炉中。根据预先测试的升温曲线,升温时间为20 min,因此,本文实验数据均是在20 min后开始计时,达到预设反应时间后,将反应釜放入冷水中冷却以终止反应。反应釜冷却至室温后,将其中所有物质洗至容量瓶中,用无水甲醇定容至25 mL,经过0.45 μm的微孔滤膜过滤后用HPLC分析。本文所有实验点都是两次实验的平均值,并标出了误差棒。
2.3 分析方法采用安捷伦科技有限公司的高效液相色谱仪(Agilent 1100) 分析。原料卵磷脂的色谱分析条件为[12]:色谱柱为Luna 5u Silica(2) 100A(250 mm×4.6 mm),流动相为乙腈:甲醇:水 = 65:25:10(v/v),进样量为5 μL,流量1 mL⋅min-1,柱温35℃,紫外检测器,检测波长212 nm。
产物甘油的色谱分析条件:色谱柱为Hi-Plex配体交换柱(安捷伦科技有限公司),流动相为4×10-3 mol·L-1硫酸,流量为0.4 mL·min-1,进样量为10 μL,柱温为75℃,检测器采用示差折光检测器,检测器温度35℃。
本文中卵磷脂水解转化率(X)、甘油收率(Y)和甘油选择性(S)定义如下:
| $X=\frac{({{c}_{\text{a0}}}-{{c}_{\text{a}}})}{{{c}_{\text{a0}}}}\times 100\text{ }\!\!%\!\!\text{ }$ | (1) |
| $Y=\frac{{{c}_{\text{s}}}}{{{c}_{\text{a0}}}}\times 100\text{ }\!\!%\!\!\text{ }$ | (2) |
| $S=\frac{{{c}_{\text{s}}}}{({{c}_{\text{a0}}}-{{c}_{\text{a}}})}\times 100\text{ }\!\!%\!\!\text{ }$ | (3) |
式中:为卵磷脂的初始浓度,mol⋅L-1;为反应后卵磷脂浓度,mol⋅L-1;为反应后甘油浓度,mol⋅L-1。
3 结果与讨论 3.1 初始浓度对卵磷脂水解反应的影响在反应温度160℃、反应时间2 h下,考察了卵磷脂的初始浓度对卵磷脂水解转化率的影响,如图 1所示。从图 1可见,当加入反应釜内卵磷脂的初始浓度在0.01~0.06 mol·L-1时,初始浓度对卵磷脂水解反应转化率基本没有影响。从卵磷脂的结构上看,甘油酰基Sn-3位上的磷酸胆碱是亲水基,因而卵磷脂比甘油三酯具有更好的亲水性,在高温液态水中有更高的溶解度,因而实验没定的初始浓度范围内,卵磷脂的初始浓度对其水解反应基本没有影响。为了甘油定量分析需要,本文以下实验采用卵磷脂的初始浓度为0.044 mol·L-1。
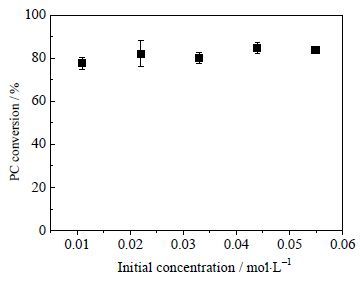
|
图 1 初始浓度对卵磷脂水解反应转化率的影响 Fig.1 Effects of initial concentration on PC conversion |
在卵磷脂的初始浓度为0.044 mol·L-1下,测定了不同反应温度(160、170、180和190℃)和反应时间(0.5、1、2、3、4 h)对卵磷脂转化率和甘油收率的影响,结果如图 2和3所示,计算的甘油选择性如图 4所示。从图 2~4可见,随着反应温度提高,卵磷脂转化速率显著加快,但甘油收率明显低于卵磷脂的转化率,说明反应过程存在中间产物。160、170、180、190℃下卵磷脂水解达到90% 转化率需要的反应时间分别约为3、2、1、0.5 h。
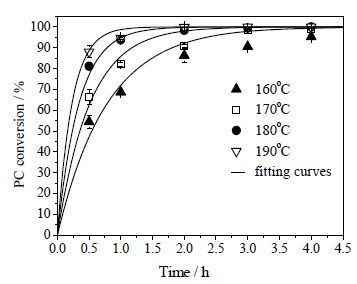
|
图 2 反应温度及时间对卵磷脂转化率的影响 Fig.2 Effects of reaction temperature and time on the PC conversion |
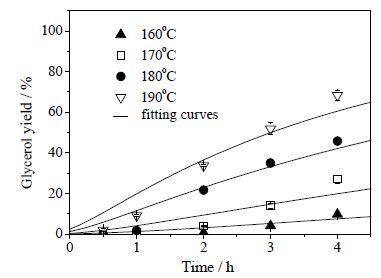
|
图 3 反应温度及时间对甘油收率的影响 Fig.3 Effects of reaction temperature and time on the glycerol yield |
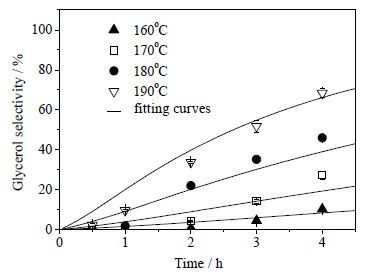
|
图 4 反应温度及时间对甘油选择性的影响 Fig.4 Effects of reaction temperature and time on the glycerol selectivity |
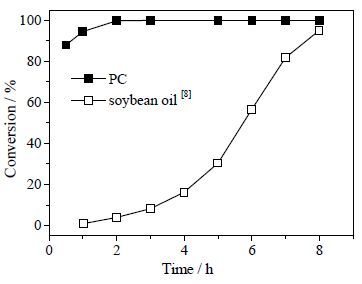
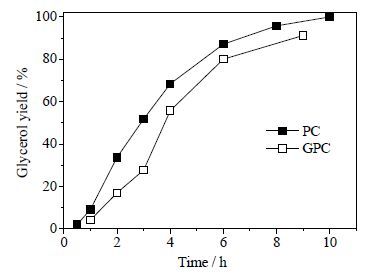
反应温度为190℃ 时,比较了卵磷脂、大豆油(甘油酯)[8]水解率数据。结果如图 5。从图 5可见,卵磷脂水解转化速率明显大于甘油酯,说明卵磷脂甘油酰基的Sn-3位侧链比Sn-1位、Sn-2位酯键更易水解断裂。图 6比较了卵磷脂、甘油磷酸胆碱(GPC)水解生成甘油收率,图 6表明卵磷脂与甘油磷酸胆碱的甘油生成速率接近,说明不可能是甘油磷酸键先水解,即卵磷脂水解第一步生成磷脂酸(1,2-二脂酰基-Sn-甘油-3-磷酸)、胆碱。第二步磷脂酸的酯键逐渐水解,最终生成甘油、游离脂肪酸、磷酸。
|
图 5 190℃下卵磷脂和大豆油水解率[8]对比 Fig.5 Comparison of the conversion of PC and soybean oil hydrolysis at 190℃ |
|
图 6 190℃下卵磷脂、甘油磷酸胆碱水解生成甘油收率对比 Fig.6 Comparison of glycerol yields of PC and GPC hydrolysis at 190℃ |
高温液态水自身具备酸碱催化能力,可电离出H+,卵磷脂的酯键均属于羧酸、磷酸与伯醇、仲醇形成的酯键,其在酸催化下的水解为酸性双分子酰氧断裂(Aac2) 机理[13]。卵磷脂甘油酰基Sn-3位上的季铵盐侧链基团带正电荷,具有强吸电子效应,可增强磷原子的正电性,有利于水分子进攻形成中间过渡态的磷正离子,因此磷酸胆碱键更易水解断裂。
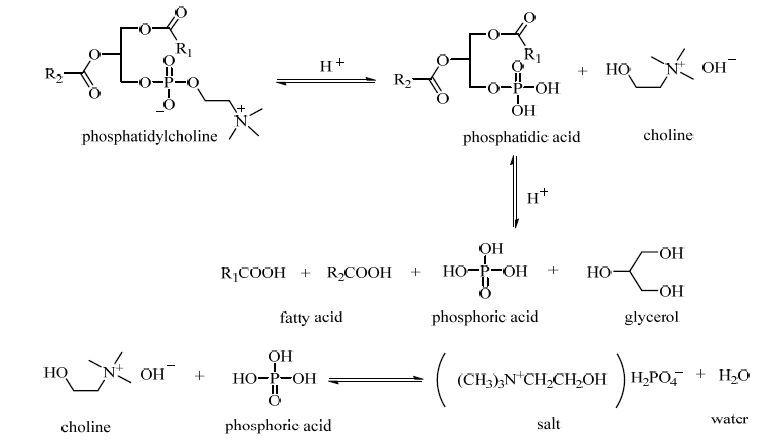
根据以上结果,提出了高温液态水中卵磷脂的水解机理,如图 7所示。卵磷脂水解分为两步进行,第一步水解生成磷脂酸、胆碱,第二步中间产物磷脂酸进一步水解生成脂肪酸、甘油、磷酸。同时,胆碱与磷酸在水相中发生酸碱成盐反应。
|
图 7 卵磷脂水解机理图 Fig.7 Mechanism of PC hydrolysis |
假设卵磷脂在高温液态水中的水解反应为一级连串反应,并且水的浓度视为恒定不变,反应模型可表示为:
| $卵磷脂\overset{{{k}_{1}}}{\mathop{\to }}\,磷脂酸\overset{{{k}_{2}}}{\mathop{\to }}\,甘油$ |
则卵磷脂水解速率(r1)方程可表示为:
| ${{r}_{1}}={{k}_{1}}{{c}_{\text{a}}}$ |
甘油生成速率(r2)可表示为:
| ${{r}_{2}}={{k}_{2}}{{c}_{\text{p}}}$ |
式中:r1——卵磷脂水解速率;k1——卵磷脂水解速率常数;r2——甘油生成速率;k2——磷脂酸水解速率常数;cp——磷脂酸浓度,mol·L-1。
在反应体系中,卵磷脂水解速率方程、磷脂酸净生成、甘油生成速率方程的微分式分别为:
| $\frac{d{{c}_{\text{a}}}}{dt}=-{{k}_{1}}{{c}_{\text{a}}}$ | (4) |
| $\frac{d{{c}_{\text{p}}}}{dt}={{k}_{1}}{{c}_{\text{a}}}-{{k}_{2}}{{c}_{\text{p}}}$ | (5) |
| $\frac{d{{c}_{\text{s}}}}{dt}={{k}_{2}}{{c}_{\text{p}}}$ | (6) |
| ${{c}_{\text{a}}}={{c}_{\text{a0}}}{{e}^{-{{k}_{1}}t}}$ | (7) |
积分上式可得:
| ${{c}_{\text{p}}}=\frac{{{k}_{1}}}{{{k}_{1}}-{{k}_{2}}}{{c}_{\text{a0}}}({{e}^{-{{k}_{2}}t}}-{{e}^{-{{k}_{1}}t}})$ | (7) |
| ${{c}_{\text{s}}}={{c}_{\text{a0}}}\left( 1+\frac{{{k}_{2}}}{{{k}_{1}}-{{k}_{2}}}{{e}^{-{{k}_{1}}t}}-\frac{{{k}_{1}}}{{{k}_{1}}-{{k}_{2}}}{{e}^{-k_{2}^{{}}t}} \right)$ | (9) |
故卵磷脂的转化率()可表示为:
| $X=1-{{e}^{-{{k}_{1}}t}}$ | (10) |
甘油的产率()可表示为:
| $Y=1+\frac{{{k}_{2}}}{{{k}_{1}}-{{k}_{2}}}{{e}^{-{{k}_{1}}t}}-\frac{{{k}_{1}}}{{{k}_{1}}-{{k}_{2}}}{{e}^{-{{k}_{2}}t}}$ | (11) |
根据动力学模型(10) ,利用Origin软件拟合不同时间和温度下的卵磷脂水解转化率数据,可求出。根据动力学模型(11) ,基于MATLAB非线性数据拟合函数lsqcurvefit,可进一步求出,结果如表 1所示,从结果可见第一步的反应速率远大于第二步。
| 表 1 不同温度下k1、k2拟合结果 Table 1 Fitting results of k1 and k2 at different temperatures |
对于一般的化学反应,其速率与温度之间的关系遵循Arrhenius方程:
| $k={{A}_{0}}{{e}^{-{{E}_{\text{a}}}/RT}}$ | (12) |
即
| $\ln k=\ln {{A}_{0}}-{{E}_{\text{a}}}/RT$ | (13) |
式中:
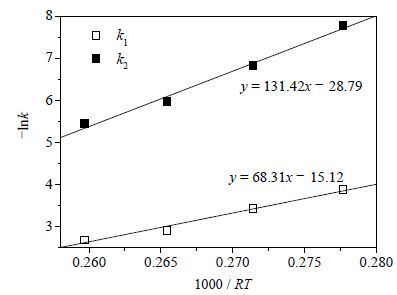
由此可知与1/T为线性关系,用Arrhenius方程关联表 1中的数据,如图 8所示,所得直线的斜率即为、。 图 8可知= 68.3 kJ·mol-1,= 131.4 kJ·mol-1。
|
图 8 卵磷脂水解反应的Arrhenius关联 Fig.8 Arrhenius plot for the PC hydrolysis |
本文研究了不同条件对卵磷脂水解的影响,探究了高温液态水中卵磷脂的水解机理,给出卵磷脂水解的动力学数据,并得到以下结论:
(1) 高温液态水中卵磷脂的水解反应分两步进行,第一步水解生成磷脂酸、胆碱,第二步磷脂酸水解为脂肪酸、甘油、磷酸。同时,磷酸、胆碱在水中发生酸碱成盐反应。
(2) 采用一级连串反应动力学方程,得到卵磷脂水解的表观活化能为68.3 kJ·mol-1,磷脂酸水解生成甘油的表观活化能为131.4 kJ·mol-1。
| [1] | LU Xing-fang(卢行芳), LU Rong(卢荣) . The processing and application of natural phospholipid products(天然磷脂产品的加工及应用)[M]. Beijing (北京): Chemical Industry Press(化学工业出版社), 2004 : 19 -21. |
| [2] | CAO Dong(曹栋), QIU Ai-yong(裘爱泳), CAO Xing-guo(曹兴国) . The structure, nature, function and researching situation of phospholipid(1) (磷脂结构、性质、功能及研究现状(1))[J]. Journal of Cereals and Oils(粮食与油脂) , 2004, 5 (5) : 3-6 |
| [3] | Santillan-Jimenez E, Crocker M . Catalytic deoxygenation of fatty acids and their derivatives to hydrocarbon fuels via decarboxylation/decarbonylation[J]. Journal of Chemical Technology & Biotechnology , 2012, 87 (8) : 1041-1050 |
| [4] | Fu J, Shi F, Thompson L T . Activated carbons for hydrothermal decarboxylation of fatty acids[J]. ACS Catalysis , 2011, 1 (3) : 227-231 DOI:10.1021/cs1001306 |
| [5] | Yang C, Nie R, Fu J . Production of aviation fuel via catalytic hydrothermal decarboxylation of fatty acids in microalgae oil[J]. Bioresource Technology , 2013, 146 (1) : 569-573 |
| [6] | Hilditch T P, Zaky Y A . The component fatty acids of some vegetable seed phosphatides[J]. Biochemical Journal , 1942, 36 (4) : 815-821 |
| [7] | Kubička D, Horáček J . Deactivation of HDS catalysts in deoxygenation of vegetable oils[J]. Applied Catalysis A General , 2011, 394 (1) : 9-17 |
| [8] | CHEN Liang(陈良), LU Xiu-yang(吕秀阳) . Kinetics of non-catalyzed hydrolysis of soybean oil in near-critical water(近临界水中大豆油无催化水解反应动力学研究)[J]. Transactions of CSAE(农业工程学报) , 2006, 22 (4) : 230-232 |
| [9] | SUN Hui(孙辉), LU Xiu-yang(吕秀阳), CHEN Liang(陈良) . Comparison of hydrolysis kinetics of different vegetable oils in near-critical water(不同植物油脂在近临界水中水解反应动力学的比较)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2007, 58 (4) : 925-929 |
| [10] | ZHU Xian(朱宪), YANG Lei(杨磊), ZHAO Liang(赵亮) . The hydrolysis technology optimization for amino acids production from feather in sub-critical water(近临界水中羽毛水解制备氨基酸的工艺优化研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2008, 22 (6) : 1032-1036 |
| [11] | LIU Ti-feng(刘体锋), ZHANG Jian-fei(张建飞), LÜ Xiu-yang(吕秀阳) . Kinetics of hydrolysis of ethylene-vinyl acetate copolymer in near-critical water(近临界水中乙烯-醋酸乙烯酯共聚物水解反应动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24 (6) : 960-966 |
| [12] | XU Hai-dan(许海丹), LU Xiu-yang(吕秀阳), LI Ying-hua(李英华) . Recent advances on lecithin stability(卵磷脂稳定性的研究进展)[J]. Bulletin of Science and Technology(科技通报) , 2006, 22 (2) : 267-269 |
| [13] | Krammer P, Vogel H . Hydrolysis of esters in subcritical and supercritical water[J]. Journal of Supercritical Fluids , 2000, 16 (3) : 189-206 DOI:10.1016/S0896-8446(99)00032-7 |




