在全国实施“控源减排”后,废水有机污染得到有效治理,氮素污染上升为主要环境问题[1, 2]。传统反硝化菌以有机物作为电子供体,而我国目前废水处理所面临的最大问题是C/N比低,故而寻求新型自养反硝化菌迫在眉睫[3]。1996年,德国学者Straub首次报道了硝酸盐型厌氧铁氧化现象[4],从此揭开了铁型自养反硝化研究序幕。
铁型自养反硝化是指微生物利用二价铁作为电子供体、硝酸盐作为电子受体的自养脱氮过程。其反应方程式如下所示:
| $\text{2N}{{\text{O}}_{\text{3}}}^{-}\text{+10F}{{\text{e}}^{\text{2+}}}\text{+24}{{\text{H}}_{\text{2}}}\text{O=10Fe(OH}{{\text{)}}_{\text{3}}}\text{+}{{\text{N}}_{\text{2}}}\text{+18}{{\text{H}}^{\text{+}}}\ \ \ \ {{\text{ }\!\!\Delta\!\!\text{ }}_{\text{r}}}G_{\text{m}}^{\text{ }\!\!\theta\!\!\text{ }}\text{= - 472}\text{.72 kJ}\cdot \text{mo}{{\text{l}}^{-}}^{1}$ |
从上述反应不难看出,铁型自养反硝化具有独特优势,可广泛应用于多个学科。就环境工程应用领域而言,以自养反硝化技术替代异养反硝化技术,可避免外加有机物,降低废水处理成本,同时避免二次污染、减少温室气体排放;利用酸洗废水中的亚铁盐作为电子供体进行废水脱氮,还可实现以废治废,一举两得[5~8]。就环境微生物学研究领域而言,采用亚铁作为电子供体,分离自养型反硝化菌,可丰富反硝化菌种资源库,开发新型生物脱氮工艺[9]。就物质循环领域而言,研究铁盐反硝化菌耐盐脱氮特性,可丰富微生物生理学内容,深化对铁、氮循环的认识[10]。
能够利用亚铁盐进行铁型自养反硝化的微生物统称为铁盐反硝化菌。目前报道的铁盐脱氮菌多分布在β变形菌纲和γ变形菌纲,代表菌种包括Acidovorax sp.、Pseudogulbenkiania sp.和Rhodocyclaceaeazospira sp.等[11~14]。然而目前鲜见关于可耐受极端环境的铁盐自养反硝化菌的报道。
本研究针对高盐、低C/N比废水硝氮去除难题,分离获得了一株耐盐自养反硝化菌株,并确定了其脱氮特性和耐盐特性,以期为铁型自养反硝化技术的研发提供理论依据和操作参数。
2 实验 (材料与方法) 2.1 材料 2.1.1 菌源分别从自然生境和人为生境取样。自然生境采样点包括海洋底泥、盐湖底泥、潮间带污泥和煤矿矿坑底泥,人为生境采样点包括铁盐脱氮反应器、厌氧消化反应器。
2.1.2 培养基含盐自养反硝化培养基:以亚铁为电子供体,以硝酸钠为电子受体,以碳酸氢钠为碳源,以氯化钠营造高盐环境,添加量分别为:NaNO3 0.30 g⋅L-1、FeSO4·7H2O 5.0 g⋅L-1、NaHCO3 2.0 g⋅L-1、NaCl 30 g⋅L-1,其他成分见基础培养基。
基础培养基:MgSO4·7H2O 0.50 g⋅L-1、CaCl2·2H2O 0.010 g⋅L-1、(NH4)2SO4 0.28 g⋅L-1、KH2PO4 1.0 g⋅L-1,微量元素溶液1.0 mL⋅L-1、维生素溶液1.0 mL⋅L-1,琼脂2%。
微量元素溶液配方:EDTA 3.0 g⋅L-1、MnCl2·2H2O 0.50 g⋅L-1、NiCl3·6H2O0.024 g⋅L-1、ZnCl2 0.070 g⋅L-1、CuCl2·2H2O 0.010 g⋅L-1、CoCl2·6H2O 0.19 g⋅L-1、H3BO30.010 g⋅L-1、Na2MoO4·2H2O 0.036 g⋅L-1。
维生素溶液:2粒21金维他药片溶于1 L纯净水。
采用NaOH (1 mol⋅L-1) 和HCl (1 mol⋅L-1) 调节培养基pH至6.2。培养基经灭菌处理后方可使用。
2.1.3 试剂与仪器DNA抽提试剂盒、柱式DNA胶回收试剂盒、API厌氧菌鉴定试剂盒、革兰氏染色试剂盒、活/死细胞染色试剂盒。
岛津UV-2450紫外分光光度计、TECNAI 10透射电子显微镜、THERMO生物安全柜、依莱泰科厌氧培养箱、BIO-RAD PCR仪。
2.2 方法 2.2.1 富集培养以250 mL三角瓶作为培养器皿,加100 mL含盐自养反硝化培养基,再加10%菌源污泥,置37℃、150 r⋅min-1摇床进行富集培养,每周转接一次,转接5次后,用作分离目标菌的富集培养物。
2.2.2 涂布接种制备富集培养物悬浊液,对悬浊液进行10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8浓度梯度稀释,以系列稀释液作为接种物,在平板上作涂布接种,置37℃厌氧培养箱中静置培养,观察菌落生长情况。
2.2.3 分离纯化待平板上长出肉眼可见的菌落后,用接种环挑取单菌落进行划线分离,置于37℃厌氧培养箱中静置培养;重复划线分离若干次,直至菌落形态一致。
2.2.4 革兰氏染色挑取形态一致的菌落,采用革兰氏染色试剂盒对菌株进行革兰氏染色,用光学显微镜观察,确定菌株革兰氏染色反应。
2.2.5 电镜观察挑取平板菌落,进行预处理,用扫描电镜 (Scanning electron microscope, SEM) 和透射电镜 (Transmission electron microscope, TEM) 观察菌株的表面形态和切片形态。
2.2.6 生理生化试验采用API鉴定系统,试验菌株的生理生化特性。
2.2.7 菌株16S rRNA序列测定采用细菌通用引物11F (5'-GTTTGATCCTGGCTCAG-3’) 和1387R (5'-GGGCGGWGTGTACAAGGC-3’) 进行16S rRNA的PCR扩增[15]。扩增体系 (25 μL):10 × PCR缓冲液2.5 μL,dNTPs 2.0 μL,模板DNA 2.0 μL,正反向引物各1.0 μL,Taq polymerase 0.20 μL,超纯水16.3 μL。扩增条件:94℃ 5.0 min;94℃ 45 s,52℃ 1.0 min,72℃ 2.0 min,30个循环;72℃ 5.0 min。测序委托华大基因研发中心进行。将测得的16S rRNA序列输入NCBI Gene Bank数据库 (National Center for Biotechnology Information, NCBI),进行BLASTN比对。利用MEGA4.1软件中基于Kimura 2-parameter模型的NJ邻接法来建立系统发育树,并用bootstrap法 (replication值为1000) 进行检验[16]。
2.2.8 功能检测采用10 mL血清瓶培养,测定菌株反硝化活性。分别接种1.0 mL菌悬液于8.0 mL含盐自养反硝化培养基中,置于37℃厌氧培养箱中培养,同时设置对照组。定期取样测定反应体系硝氮浓度。
2.2.9 盐耐受性设置系列盐度为1%、2%、3%、4%、5%,分别接种1.0 mL菌悬液于8.0 mL含盐自养反硝化培养基中,在37 ℃厌氧培养箱中培养1 d,测定硝氮浓度,计算硝氮去除率;同时采用活/死细胞染色试剂盒测定各试验组活细胞比例情况,确定菌体细胞对盐度的耐受性。
2.2.10 常规分析项目及方法NO3--N:紫外分光光度法[17];
NO2--N:N-(1-萘基)-乙二胺分光光度法[17];
pH:pHS-9V型酸度
3 结果 3.1 菌株分离筛选经过反复分离、纯化,获得6株耐盐自养反硝化菌,分别命名为NF-1、NF-2、NF-3、NF-4、NF-5、NF-6。以10%的接种量接种菌悬液至含盐自养反硝化培养基中,于37℃厌氧培养箱中培养7d,取样测定其脱氮效能,结果如图 1所示。检测结果表明,菌株NF-5(分离自实验室稳定运行的铁盐脱氮反应器) 的脱氮效能最佳,当起始硝氮浓度为50 mg⋅L-1、铁氮摩尔比为5:1时,硝氮去除率达82%。
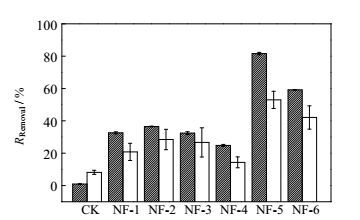
|
图 1 分离菌株的反硝化活性
Fig.1 Denitrifying activity of the isolated strains
 NO3--N NO3--N Fe2+ Fe2+
|
在含硝氮 (50 mg⋅L-1)、亚铁 (1000 mg⋅L-1) 和氯化钠 (30 g⋅L-1) 的固体培养基上培养菌株NF-5,10 d后可见菌落。采用数码相机观察菌落形态,结果如图 2-A所示;采用体视镜观察菌落个体形态,结果如图 2-B所示;采用光学显微镜观察菌株个体的革兰氏染色情况,结果如图 2-C所示。菌株NF-5的菌落呈乳白色,易挑起,边缘不整齐,表面粗糙,菌落直径约为0.80~1.5 mm,其个体革兰氏染色结果呈阳性。

|
图 2 菌株NF-5形态特征 Fig.2 Morphological characteristics of strain NF-5 A. colony image (digital camera) B. colony image (stereoscope) C. gram staining image (optical microscope) |
菌株NF-5的电镜照片如图 3所示,菌体呈杆状,两端钝圆,大小 (0.80~1.2) μm×(1.7~2.3) μm,无鞭毛和纤毛。利用亚铁作为基质所产生的三价铁沉积在细胞表面,形成细胞表面的凸起结构 (图 3-A & B)。将固体培养基上的菌株NF-5进行直接负染,菌体表面铁氧化沉积物呈链状 (图 3-C)。
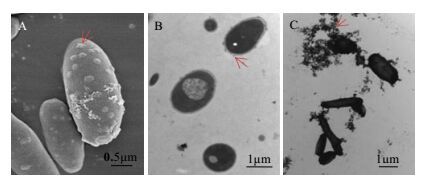
|
图 3 菌株NF-5电镜照片 Fig.3 Electronic microscope graphs of strain NF-5 A. SEM B. TEM C. negatively stained by osmic acid The arrows refer to iron precipitation |
利用API试剂条测验菌株NF-5的生理生化特性,结果见表 1。菌株NF-5兼性厌氧,可分解过氧化氢,可还原硝酸盐。从表 1结果看,菌株NF-5的吲哚、脲酶反应呈阴性;明胶、七叶灵反应呈阳性;菌株NF-5能利用葡萄糖、甘露糖、乳糖、蔗糖、纤维二糖、海藻糖、松叁糖、甘油,但不能利用鼠李糖、阿拉伯糖、麦芽糖、木糖、棉子糖、山梨醇、甘露醇及柳醇。
| 表 1 NF-5菌株生理生化特性 Table 1 Physiological characteristic of strain NF-5 |
采用DNA抽提试剂盒提取菌株DNA,PCR扩增,获得1374bp的DNA片段;采用pMD®19-T载体,导入大肠杆菌,进行克隆,并对克隆DNA测序;将测序结果输入Gene Bank数据库 (NCBI序列号为KX296768) 作BLAST比对[18];根据比对结果,可将菌株NF-5归入Actinobacteria纲,Micrococcales目,Promicromonosporaceae科,Isoptericola属。菌株NF-5与Isoptericolajiangsuensisstrain CLG的序列相似性高达99%。采用MEGA4.1建立的系统发育树如图 4所示。
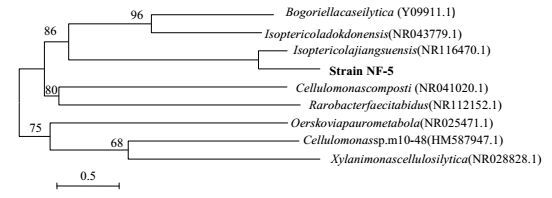
|
图 4 菌株NF-5系统进化发育树 Fig.4 Phylogenetic tree of strain NF-5 Numbers in parentheses represent sequence accession number in GenBank. The number at each branch point is the percentage supported by bootstrap (1000 re-samplings). Bar: 0.5 % sequence divergence |
采用批次试验测定了菌株NF-5的反硝化活性,以时间为横坐标、硝氮浓度和亚硝氮浓度为纵坐标作图 5。由图可知,菌株NF-5具有良好的反硝化活性,可利用亚铁作为电子供体还原硝酸盐。当接种量OD600为0.52 (稀释18倍) 时,菌株NF-5的最大反硝化速率为0.31 mg N·(L·h)-1。反硝化过程中,菌株NF-5产生亚硝氮;至24 h时,硝氮去除量与亚硝氮生成量相当,亚硝氮积累达到最大值4.63 mg⋅L-1;此后硝氮去除迅速,亚硝氮积累量减少,直至几乎检测不到。
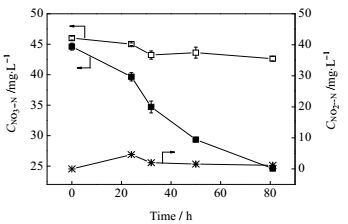
|
图 5 菌株NF-5反硝化活性图
Fig.5 Denitrifying activity of strain NF-5
—□— CNO3--N in Control group —■— CNO3--N in Experiment group —*—CNO2--N in Experiment group |
设置系列盐浓度 (以NaCl计) 于血清瓶中进行批次试验,考察了菌株NF-5对盐度的耐受性,检测了盐胁迫下菌株的存活状态和脱氮特性。
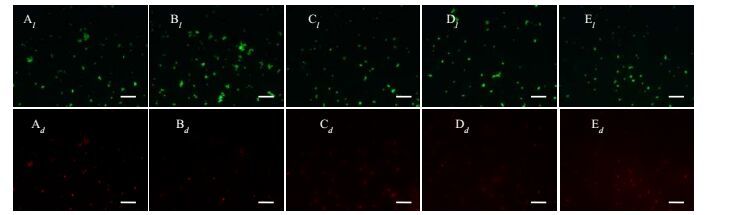
3.4.1 盐胁迫下菌株存活状态不同盐浓度体系中菌株NF-5的活细胞量与死细胞量占比如图 6所示。对图 6中活细胞及死细胞的总个数和总面积进行统计,结果见表 2。盐浓度为20 g⋅L-1时,体系中活细胞占比最大;随盐浓度的继续升高,体系中活细胞占比逐渐减小。即使在50 g⋅L-1的盐浓度下,菌株NF-5的存活率仍达54%。故就菌体存活状态而言,菌株NF-5的耐盐性能良好,能够耐受盐浓度范围为10~50 g⋅L-1,最适宜盐浓度为20 g⋅L-1。
|
图 6 不同盐浓度体系中菌株NF-5活细胞和死细胞荧光成像图 Fig.6 Images of live and dead cells in different salt concentrations l. the live cell d. the dead cell A. 10 g NaCl⋅L-1 B. 20 g NaCl⋅L-1 C. 30 g NaCl⋅L-1 D. 40 g NaCl⋅L-1 E. 50 g NaCl⋅L-1 The scale bar is 10 μm |
| 表 2 不同盐浓度体系中的活细胞占比 (%) Table 2 Percentages of live cells in different salt concentrations (%) |
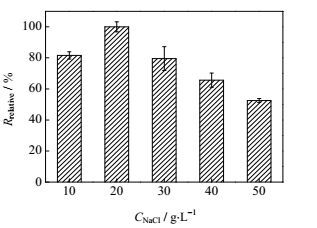
采用批次试验考察了不同盐浓度对菌株NF-5反硝化活性的影响,接种量OD600为0.34 (稀释18倍)。对试验数据进行“归一化”处理,即以最大反硝化速率为分母,计算其他组的相对反硝化活性。以时间为横坐标、相对反硝化活性为纵坐标作图 7。结果表明,在10~50 g⋅L-1的盐浓度下菌株NF-5均显现反硝化活性,在50 g⋅L-1盐浓度下菌株NF-5反硝化活性仅下降47%。故就菌体脱氮特性而言,菌株NF-5的耐盐性能良好,能够耐受盐浓度范围为10~50 g⋅L-1,最适宜盐浓度为20 g⋅L-1。
|
图 7 不同盐浓度体系中菌株NF-5反硝化活性 Fig.7 Denitrifying activity of strain NF-5 in different salt concentrations |
本研究中笔者从实验室铁盐脱氮反应器中分离获得了一株自养反硝化菌,并命名为NF-5。经鉴定,将菌株NF-5归入Isoptericola属。据已有文献报道,Isoptericola属的若干种,如I. variabilis、I. hypogeus、I. jiangsuensis和I. dokdonensis的硝酸盐还原试验结果呈阳性,说明其具有反硝化活性[18, 19];值得注意的是,I. nanjingensis被认为与地表矿物风化作用有关[20]。本研究中分离的菌株NF-5可利用亚铁进行反硝化,当起始硝氮浓度为50 mg⋅L-1时,7 d后硝氮去除率达80%,最大反硝化速率为0.31 mg N·(L·h)-1,略高于文献报道的铁基质自养反硝化菌Microbacterium sp. W5[21]。
4.2 菌株耐盐性鉴于含氮废水的复杂性,分离能够耐受极端环境的反硝化菌,并研究其对极端环境的耐受性能显得十分重要[22, 23]。据文献报道,Isoptericola属菌株均可耐受高盐,耐受盐度范围从3.0%~12%不等[18~20, 24]。本研究中,从高盐对菌株的致死效应和活性抑制两方面着手,探究了不同盐度对菌株NF-5的影响。结果表明,菌株NF-5有良好的耐盐性能,在盐度为5%(50 g⋅L-1 NaCl) 的条件下,菌株NF-5的存活比例仍保持在50%以上,相对反硝化活性也保持在50%以上。说明菌株即使在高盐环境下,也能进行自养反硝化。
5 结论从实验室高效铁盐脱氮反应器中分离获得一株耐盐自养反硝化菌,将其命名为NF-5。通过形态观察、生理生化试验和16S rRNA测序分析,将其归于Isoptericola属。菌株NF-5具有较高的反硝化活性,当起始硝氮浓度为50 mg⋅L-1,铁氮比为5:1时,7 d后硝氮去除率为82%,硝氮去除速率高达0.31 mg N·(L·h)-1。菌株具有良好的耐盐性能,能够耐受盐度 (以NaCl计) 范围为10~50 g⋅L-1,最适盐浓度为20 g⋅L-1。综上,建议可将该菌株应用于盐度为10~50 g⋅L-1、低C/N比废水的脱氮处理过程。
| [1] | Stone R. China aims to turn tide against lake pollution[J]. Science , 2011, 333(6047): 1210-1211. DOI:10.1126/science.333.6047.1210. |
| [2] | DENG Jian-cai(邓建才), CHEN Qiao(陈桥), ZHAI Shui-jing(翟水晶), et al. Spatial distribution characteristics and Environmental effect of N and P in water body of Taihu Lake(太湖水体中氮、磷空间分布特征及环境效应)[J]. Environmental Science(环境科学) , 2008, 29(12): 3382-3386. DOI:10.3321/j.issn:0250-3301.2008.12.015. |
| [3] | XUE Tong(薛通), XUE Yuan(薛源), YANG Feng-lin(杨凤林), et al. Nitrogen removal efficiency of a shortcut nitrification-denitrification process integrated with sludge anaerobic hydrolysis for treating low C/N ratio municipal wastewater(污泥厌氧水解与短程硝化反硝化耦合工艺处理低碳氮比城市污水)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24(1): 150-155. |
| [4] | Straub K L, Benz M, Schink B, et al. Anaerobic, nitrate-dependent microbial oxidation of ferrous iron[J]. Applied Environmental Microbiology , 1996, 62(4): 1458-1460. |
| [5] | Zhang M, Zheng P, Wang R, et al. Nitrate-dependent anaerobic ferrous oxidation (NAFO) by denitrifying bacteria:a perspective autotrophic nitrogen pollution control technology[J]. Chemosphere , 2014, 117: 604-609. DOI:10.1016/j.chemosphere.2014.09.029. |
| [6] | Zhang M, Zheng P, Li W, et al. Performance of nitrate-dependent anaerobic ferrous oxidizing (NAFO) process:a novel prospective technology for autotrophic denitrification[J]. Bioresource Technology , 2015, 179: 543-548. DOI:10.1016/j.biortech.2014.12.036. |
| [7] | Wang R, Zheng P, Zhang M, et al. Bioaugmentationofnitrate-dependent anaerobic ferrous oxidation by heterotrophic denitrifying sludge addition:a promising way forpromotion of chemoautotrophic denitrification[J]. Bioresource Technology , 2015, 197: 410-415. DOI:10.1016/j.biortech.2015.08.135. |
| [8] | Zhou J, Wang H, Yang K, et al. Nitrate removal by nitrate-dependent Fe (Ⅱ) oxidation in an upflow denitrifying biofilm reactor[J]. Water Science and Technology , 2015, 72(3): 377-383. DOI:10.2166/wst.2015.211. |
| [9] | Kumaraswamy R K, Sjollema K, Kuenen G, et al. Nitrate-dependent[Fe (Ⅱ) EDTA]2- oxidation by Paracoccusferrooxidans sp. nov., isolated from a denitrifying bioreactor[J]. Systematic Applied Microbiology , 2006, 29(4): 276-286. DOI:10.1016/j.syapm.2005.08.001. |
| [10] | Kappler A, Schink B, Newman D K. Fe (Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe (Ⅱ)-oxidizer strain BoFeN1[J]. Geobiology , 2005, 3(4): 235-245. DOI:10.1111/gbi.2005.3.issue-4. |
| [11] | Chakraborty A, Roden E E, Schieber J, et al. Enhanced growth of Acidovorax sp. strain 2AN during nitrate-dependent Fe (Ⅱ) oxidation in batch and continuous-flow systems[J]. Applied Environmental Microbiology , 2011, 77(24): 8548-8556. DOI:10.1128/AEM.06214-11. |
| [12] | Weber K A, Hedrick D B, Peacock A D, et al. Physiological and taxonomic description of the novel autotrophic, metal oxidizing bacterium, Pseudogulbenkiania sp. strain 2002[J]. Applied Microbiology and Biotechnology , 2009, 83(3): 555-565. DOI:10.1007/s00253-009-1934-7. |
| [13] | Mattes A, Gould D, Taupp M, et al. A Novel autotrophic bacterium isolated from an engineered wetland system links nitrate-coupled iron oxidation to the temoval of As, Zn and S[J]. Water Air & Soil Pollution , 2013, 224(4): 1-15. |
| [14] | WANG Ru(王茹), ZHENG Ping(郑平), ZHANG Meng(张萌), et al. Nitrate-dependent anaerobic ferrous/iron oxidation microorganism:review on its species, distribution and characteristics(硝酸盐型厌氧铁氧化菌的种类、分布和特性)[J]. Microbiology China(微生物学通报) , 2015, 42(12): 2448-2456. |
| [15] | WANG Ru(王茹), ZHENG Ping(郑平), LI Wei(厉巍), et al. Identification and function test of an alkali-tolerant denitrifying bacterium(耐碱反硝化菌株的分离鉴定与功能检测)[J]. Acta Microbiologica Sinica(微生物学报) , 2013, 53(4): 372-378. |
| [16] | Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution , 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092. |
| [17] | National Environmental Protection Agency (国家环保局). Standard methods for the rxamination of water and wastewater(水和废水监测分析方法)[M].(4th edition).Beijing(北京): China Environmental Science Press(中国环境科学出版社), 2002: 266-281. |
| [18] | Guan T W, Teng Y, Yang L L, et al. Isoptericola salitolerans sp. nov., a halotolerant filamentous actinobacterium isolated from a salt lake, China[J]. Extremophiles , 2013, 17(3): 471-476. DOI:10.1007/s00792-013-0531-y. |
| [19] | Tseng M, Liao H C, Chiang W P, et al. Isoptericola chiayiensis sp nov., isolated from mangrove soil[J]. International Journal of Systematic and Evolutionary Microbiology , 2011, 61(7): 1667-1670. DOI:10.1099/ijs.0.022491-0. |
| [20] | Huang Z, Sheng X F, Zhao F, et al. lsoptericola nanjingensis sp nov., a mineral-weathering bacterium[J]. International Journal of Systematic and Evolutionary Microbiology , 2012, 62(4): 971-976. |
| [21] | WANG Hong-yu(王弘宇), YANG Kai(杨开), ZHANG Qian(张倩), et al. Nitrate removal by a strain of nitrate-dependent Fe (Ⅱ)-oxidation bacteria(1株铁基质自养反硝化菌的脱氮特性)[J]. Environmental Science(环境科学) , 2014, 35(4): 1437-1442. |
| [22] | JIN Ren-cun(金仁村), MA Chun(马春), ZHENG Ping(郑平), et al. Short-term effects of salinity on Anammox(盐度对Anammox的短期影响研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27(2): 323-329. |
| [23] | ZHANG Lan-he(张兰河), FU Xiang-yu(伏向宇), YANG Tao(杨涛), et al. Effects of NaCl salinity on short-cut nitrification and denitrification using SBR(NaCl盐度对SBR工艺短程硝化反硝化的影响)[J]. Journal of Beijing University Technology(北京工业大学学报) , 2013, 39(2): 280-286. |
| [24] | Zhang Y Q, Schumann P, Li W J, et al. Isoptericola halotolerans sp nov., a novel actinobacterium isolated from saline soil from Qinghai Province, north-west China[J]. International Journal of Systematic and Evolutionary Microbiology , 2005, 55(5): 1867-1870. DOI:10.1099/ijs.0.63641-0. |




