纳米纤维素纤维(cellulose nanofibrils, CNF)是天然纤维素经化学水解、机械处理得到的一种纳米材料,其直径通常在3~15 nm、长度可达几百纳米[1]。CNF水分散(或悬浮)液在较低质量分数下即会形成凝胶,主要归因于其较高的长径比和多层次自组装结构[2]。纤维质量分数、温度和离子强度等都是影响CNF凝胶性能的重要因素[3-5]。CNF表面带有一定量的负电荷,因此考察离子强度变化对CNF凝胶微观结构与流变性质的影响已引起广泛重视[6-7]。研究表明,盐离子对表面电荷的屏蔽作用能促使CNF发生快速聚集,从而显著提高其凝胶的储能模量与损耗模量,但是这种作用效果会致使凝胶抵抗外力的能力变差,表现在流变性能上就是线性黏弹区间应变值变小[8-9]。
为满足人们对优良凝胶性能的需求,常用的方法是对CNF进行表面修饰来改善其聚集和凝胶性质[10-13]。乙酰化改性作为一种简单化学修饰方法是指用乙酰基来部分取代纤维表面的羟基[14-15],其在CNF表面功能化上具有独特优势。此外,CNF可与其他聚合物复合形成相互缠绕的网络结构[16-18],该方法不仅能保留CNF凝胶性能,而且能提高凝胶体系的稳定性与机械性能。甲基纤维素(methylcellulose,MC)是一种不带电荷的水溶性纤维素衍生物,作为增稠剂被广泛应用。MC分子链结构简单,在水溶液中以无规则的线团形式存在[19],这也使得MC成为制备复合凝胶的理想材料。当MC溶解于水时,其分子链的缠结程度会随着MC浓度和相对分子质量的增加而增加;当MC与CNF共存时,MC会自发吸附并包裹在CNF表面[18]。有关MC与CNF之间复杂相互作用的研究,特别是在CNF临界凝胶相边界时,由CNF质量分数涨落而导致的凝胶相转变行为会存在一些敏感的结构信息,这将有助于优化CNF复合凝胶的机械性能。
水凝胶具有多尺度结构特征,各种表征方法如电子显微镜[20-22]、小角光散射[15]和热分析[23-24]等方法都可以提供其在不同尺度上的结构信息;环境条件如pH值[25-26]、盐浓度[7]和温度[18, 23-24]的变化均对凝胶性质产生影响,这种影响与其体系的结构形态密切相关,更能通过体系的流变性质来反映。流变法可通过测定振荡剪切模量来跟踪体系相变过程的黏弹性质变化[27-28]。与其他静态结构测试性质相比,流变性能则是凝胶体系中诸多粒子间相互作用的宏观表现,能直观地反映结构的形成、破坏以及转变等过程[28-29],有助于加深对凝胶机理的理解。
本文基于前期报道的乙酰化纳米纤维素纤维(acetylated cellulose nanofibrils, ACNF)制备方法[15],选用不同分子量的MC与ACNF进行复合来制备水凝胶;利用激光共聚焦显微镜与振荡剪切流变测试手段,考察MC在ACNF临界凝胶质量分数附近对复合凝胶微观结构与动态流变性质的影响,围绕微观结构-介观形态-宏观流变性质间的关系探讨复合凝胶化的内在机理。
2 实验(材料与方法) 2.1 实验材料与仪器甲基纤维素(MC)购于Sigma-Aldrich有限公司,相对分子质量分别为17 000、44 000、88 000 g·mol-1,依次简称MC1、MC2、MC3;ACNF由前期报道的无溶剂反应+高压均质法制备所得[15],其取代度为1.35;聚乙二醇20000均购于国药集团化学试剂有限公司;Solarbio MD44透析袋(截留相对分子质量为8 000~14 000 g·mol-1)。实验用水均为去离子水。
DHR-3流变仪(美国TA公司),LSM710激光共聚焦显微镜(德国Zeiss公司),IS10傅里叶红外光谱仪(美国Nicolet公司)。
2.2 ACNF-MC复合凝胶的制备将制备好的质量分数为0.5%的ACNF悬浮液装入透析袋,并放入高浓度的聚乙二醇溶液,待浓缩至一定质量分数时取出备用;将ACNF悬浮液与MC溶液按1:1体积比混合,充分搅拌后静置超过10 h,得到ACNF质量分数为3%或2%、MC质量分数为1%的ACNF-MC复合水凝胶样品。
2.3 傅里叶红外光谱测试(Fourier Transform infrared spectroscopy, FTIR)经过冷冻干燥的ACNF、MC及ACNF-MC3粉末,分别利用溴化钾压片方法进行测试,仪器光谱范围500~4 000 cm-1,分辨率2 cm-1,扫描次数16次。
2.4 动态流变测试采用DHR-3流变仪进行动态流变测试,使用40 mm不锈钢平板夹具,测试间隙1 000 μm。样品在测试过程中均用石蜡油油封,防止水分蒸发。每个样品在测试前通过平板加热10 min,测试温度25 ℃或65 ℃;应变扫描测试固定频率1 Hz,应变范围0.01%~1 000%;频率扫描测试的固定应变0.5%(线性黏弹区范围内),频率范围0.1~10 Hz;获得弹性模量G’和黏性模量G"对应变γ和频率f的函数曲线。
2.5 激光共聚焦显微镜测试(confocal laser scanning microscope, CLSM)利用带有凹槽的载玻片,装入水凝胶样品,用卡尔福克鲁尔荧光白进行染色并密封,利用激光共聚焦物镜进行观察,激发波长为408 nm,物镜放大倍数为40倍。
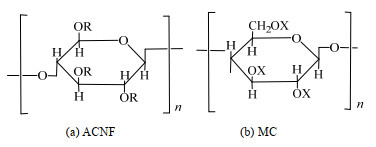
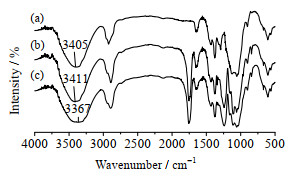
3 实验结果与讨论从MC与ACNF的分子结构(见图 1)可以看出,两者表面均存在大量羟基。当MC与ACNF混合时,分子间可形成氢键,这在FTIR谱图(见图 2)中会表现出特征吸收峰的变化。其中,3 100~3 500 cm-1谱带与分子中羟基形成氢键强弱有关,氢键越强,谱带向低波数方向位移也越大[29]。试样在这一谱带中的峰值均滞后于3 500 cm-1,而ACNF-MC3样品在该谱带的峰值最低(3 367 cm-1),表明混合样品形成了更强的氢键。ACNF样品在1 754 cm-1与1 378 cm-1处的特征峰分别对应乙酰基中C=O与C–O键,MC样品在1 128 cm-1处的特征峰对应不对称C–O–C的伸缩振动[30]。ACNF表面的酯基以及MC表面的醚基预示着ACNF-MC体系会产生范德华力与疏水作用。类似地HYNNINEN等[19]也发现MC与纳米纤维素晶体(CNC)会在氢键与范德华力等作用下相互缠结。
|
图 1 ACNF与MC的分子结构,R是H或者乙酰基,X是H或者甲基 Fig.1 Molecular structures of ACNF and MC. (R = H or acetyl, X = H or methyl) |
|
图 2 ACNF、MC3及ACNF-MC3干燥样品的傅里叶红外光谱图 Fig.2 FT-IR spectra of dried ACNF, MC3, and ACNF-MC3 (a) MC3 (b) ACNF (c) ACNF-MC3 |
如图 3所示为ACNF悬浮液随着质量分数的增加(从1.5%到3.0%)发生的从溶胶到凝胶的转变过程,其临界凝胶质量分数在2.5%左右。MC与ACNF的作用方式与ACNF的网络结构是否连续有关,而微观结构与流变行为的相互关系是决定复合凝胶最终性能的重要因素。因此,本研究选取低于临界凝胶质量分数(2%)与高于临界凝胶质量分数(3%)2种条件下的ACNF悬浮液与不同分子量MC溶液(质量分数1%)进行复合来制备水凝胶。

|
图 3 ACNF悬浮液在不同质量分数下的形态 Fig.3 Pictures of suspensions with different mass fractions of ACNF |
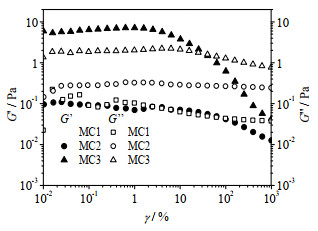
MC的相对分子质量差异会导致其水溶液具有不同的流动特性。如图 4所示为不同相对分子质量MC溶液(MC1、MC2和MC3)在质量分数为1%条件下的流变测试结果,其应变扫描范围从0.01%至1 000%,频率固定为1 Hz。结果表明,G’随着MC相对分子质量的增加而增加;MC1和MC2表现出近似液体的流变行为(G’ < G"),而MC3则表现为近似固体的流变行为(G’ > G"),这是因为高相对分子质量的MC物理交联能力强,其网络越密集,导致黏弹性增强。
|
图 4 不同分子量MC溶液的的弹性模量G’与黏性模量G"随应变变化曲线 Fig.4 Profiles of storage modulus G' and loss modulus G" as a function of strain amplitude for 1% MC solution |
激光共聚焦显微镜测试可直观反映ACNF与MC复合并自组装形成凝胶时的介观形态变化,其结果如图 5所示。图 5(a)~(d)分别为ACNF质量分数为2%的ACNF、ACNF-MC1、ACNF-MC2、ACNF-MC3复合水凝胶的结构形态,从图中可以看出MC的加入使得凝胶变得更加均匀、连续。图 5(e)~(h)分别是ACNF质量分数为3%的相应复合凝胶的测试结果,可以发现该条件下凝胶内部出现暗纹地带,表明ACNF聚集体数量增多、尺寸变大,并在整个凝胶空间中通过紧密连接形成网络结构。当ACNF质量分数低于临界凝胶质量分数时,MC可以均匀地分散在凝胶内部,这使得MC分子链有机会与ACNF纤维相互缠结形成更加连续、均匀的复合凝胶;而ACNF质量分数为3%的复合凝胶则呈现不均匀的复杂形态,这可能是因为ACNF质量分数的升高增强了纤维间的缠结能力,从而连接形成尺寸较大的聚集体。

|
图 5 ACNF-MC复合凝胶的激光共聚焦显微镜图片 Fig.5 CLSM images of ACNF-MC composite hydrogels (a) ACNF 2% (b) ACNF 2 %-MC1 1 % (c) ACNF 2 %-MC2 1 % (d) ACNF 2 %-MC3 1 % (e) ACNF 3 % (f) ACNF 3 % -MC1 1 % (g) ACNF 3% -MC2 1 % (h) ACNF 3 % -MC3 1% |
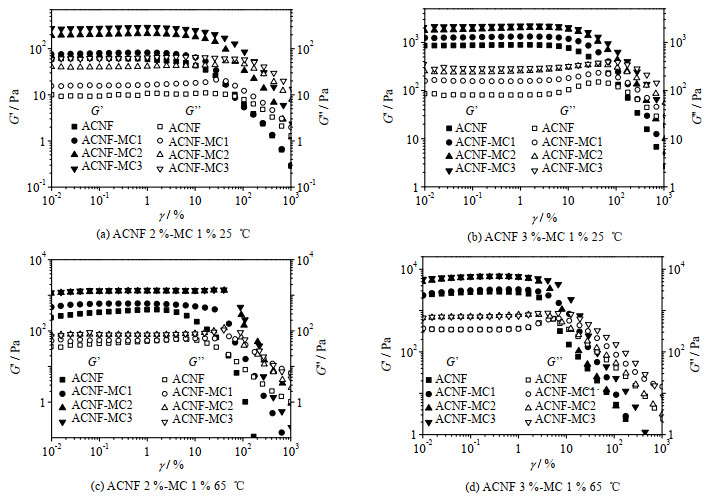
复合凝胶中存在氢键、范德华力及疏水作用等多种相互作用,各种作用对凝胶化的贡献将随温度变化而变化,从而使体系在不同温度下表现出不同的流变行为。选择25与65 ℃这2种温度下对复合凝胶进行了动态流变测试,结果如图 6所示。图 6(a)为ACNF质量分数为2%的复合凝胶在25 ℃时的应变扫描结果。复合凝胶在线性黏弹区的G’和G"相比于MC溶液以及ACNF悬浮液都得到显著的提高,且随着MC相对分子质量增加而增加。超过线性黏弹区后随着应变值的增大,G’和G"逐渐减小,表明样品在大应变流场下发生屈服;当继续增加应变值,试样进入流动区(G’ < G");图 6(b)是ACNF质量分数为
|
图 6 复合凝胶的弹性模量G’与黏性模量G"随应变变化曲线 Fig.6 Profiles of storage modulus G' and loss modulus G" as a function of strain amplitude for hydrogels |
3%的复合凝胶在25 ℃时的应变扫描结果。可以观察到,MC也会提高复合凝胶的G’和G";与前面不同的是,G"先呈现1个过冲峰然后减小;随着MC相对分子质量的增加,过冲峰强度减弱。G"曲线随应变增大而出现的峰与样品屈服过程的结构不均匀有关,过冲峰强度减弱反映出样品屈服前网络结构得到改善。图 6(c)和(d)是2种ACNF质量分数下复合凝胶在65 ℃时的应变扫描结果,此时复合凝胶呈现出与25 ℃下类似的屈服模式,但黏弹性模量与线性黏弹区均发生改变。
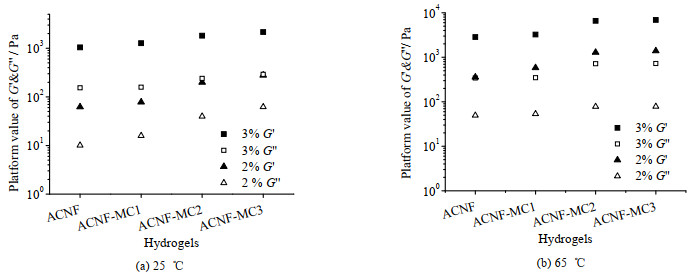
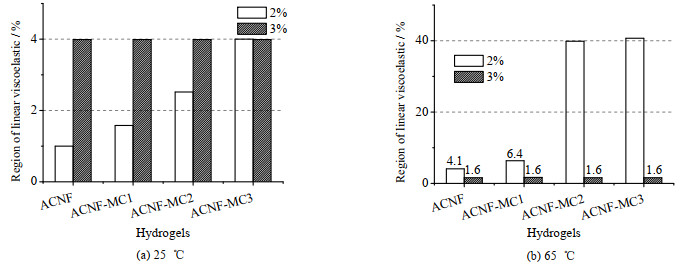
为进一步比较2类复合凝胶流变性质的差异性,计算应变扫描过程中G’和G"的平台值、线性黏弹区应变值,分别如图 7和8所示。在25 ℃与65 ℃下复合凝胶的G’和G"的平台值均随着MC相对分子质量增大而增大;且65 ℃下复合凝胶的平台值均高于25 ℃。图 8(a)是25 ℃这2种体系的线性黏弹区应变值,当ACNF质量分数为2%时,随着MC分子量增加,凝胶的线性黏弹区应变值从1%增加到4%;而当ACNF质量分数为3%时,线性黏弹区几乎维持在4%左右。当温度升高到65 ℃时,ACNF质量分数为2%的复合凝胶的线性黏弹区明显增大,尤其是ANCF-MC2及ACMF-MC3的应变值提高了5~10倍,而ACNF质量分数为3%的复合凝胶却从4%下降到1.6%(图 8(b))。在25 ℃下低质量分数的ACNF凝胶中,高相对分子质量的MC分子可以同时吸附在多个ACNF粒子上,产生氢键并通过缠结作用形成桥接结构,这有助于黏弹性模量及线性黏弹区的同时提高;而在高质量分数的ACNF凝胶中,其内部的三维网格结构已经形成,MC仅进入到网络结构的空隙中起填充作用,表现为黏弹性模量增加而线性黏弹性区间保持不变。温度升高会减弱体系的氢键却增强疏水作用,使MC链段产生形态变化(折叠以及环化)[19, 31],这种形态特征使得复合凝胶三维网格结构更加紧密,表现出很高的线性黏弹性。另外,当ACNF质量分数较低时,凝胶中纤维密度小、缠结能力较弱,疏水作用占比的提高使纤维间交联加强,导致凝胶的G’、G"与线性黏弹区增加;当ACNF质量分数较高时,疏水作用占比的提高使ACNF相互靠近产生更大的纤维束,但参与交联的纤维数量减少导致网络化程度降低,因而凝胶的G’和G"提高但线性黏弹区有所降低。
|
图 7 复合水凝胶应变扫描曲线弹性模量G’与黏性模量G"平台值 Fig.7 Platform values of storage modulus G' and loss modulus G" of hydrogels |
|
图 8 复合凝胶应变扫描曲线的线性黏弹区应变值 Fig.8 Values of linear viscoelastic region of hydrogels |
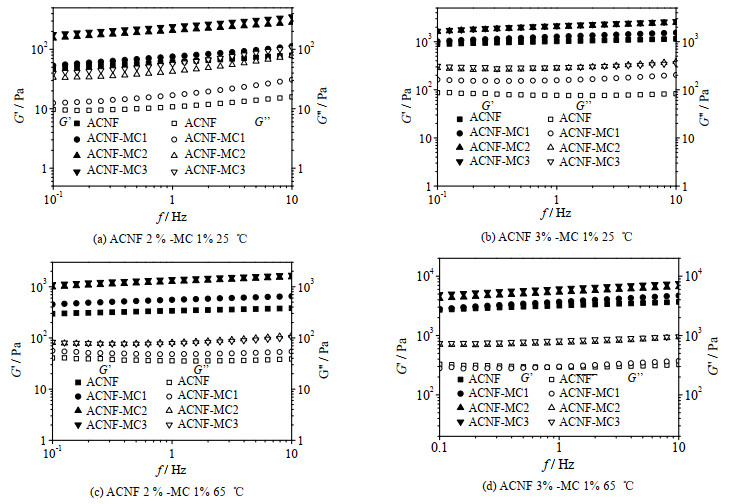
如图 9所示为ACNF质量分数为2%与3%的复合凝胶的频率扫描结果,在测试频率范围内,G’始终大于G";从模量的大小上来看,MC的引入均提高了2%与3%凝胶的G’与G",2种复合凝胶的模量均随MC分子量增加而增加。图 9(a)与(b)分别为2%与3%的复合凝胶在25 ℃下的测试结果,ACNF质量分数为3%的复合凝胶强度与频率几乎无关,呈现出较强的网络结构特征;而ACNF质量分数为2%的复合凝胶对频率显示出一定的依赖性,表明凝胶的网络结构较弱。图 9(c)与(d)是上述2种凝胶在65 ℃下的频率扫描结果,与应变扫描结果类似,温度升高增强了复合凝胶的黏弹性,特别是ACNF质量分数为2%的复合凝胶对频率的依赖性明显降低。
|
图 9 复合凝胶的弹性模量G’与黏性模量G"随频率变化曲线 Fig.9 Profiles of storage modulus G' and loss modulus G" as a function of frequency for ACNF-MC composite hydrogels |
(1) 当ACNF质量分数为2%时,复合凝胶的黏弹性模量与线性黏弹性区间均随着MC相对分子质量的增加而增加;当ACNF质量分数为3%时,复合凝胶的黏弹性模量随着MC相对分子质量的增加而增加,而线性黏弹性区间几乎保持不变。
(2) MC在ACNF质量分数为2%时能提供更多的交联点促进凝胶三维网络结构的形成(桥连作用),而在ACNF质量分数为3%时主要是强化已有凝胶网络结构特征(填充作用)。复合凝胶通过氢键、范德华力及疏水作用等形成网络结构;随着温度的升高,在氢键作用减弱而疏水作用增强的综合影响下,复合凝胶的黏弹性明显增强,而线性黏弹区应变值的变化与ACNF质量分数有关。
| [1] |
IWAMOTO S, LEE S H, ENDO T. Relationship between aspect ratio and suspension viscosity of wood cellulose nanofibers[J]. Polymer Journal, 2013, 46(1): 73-76. |
| [2] |
JIANG F, HAN S, HSIEH Y L. Controlled defibrillation of rice straw cellulose and self-assembly of cellulose nanofibrils into highly crystalline fibrous materials[J]. Rsc Advances, 2013, 3(30): 12366-12375. DOI:10.1039/c3ra41646a |
| [3] |
FAN W X, TU Z D, HUANG C M, et al. Preparation of cellulose nanofibers and their improvement on ultradrawing properties of ultrahigh molecular weight polyethylene nanocomposite fibers[J]. Polymers for Advanced Technologies, 2016, 28(6): 708-716. |
| [4] |
HEGGSET E B, CHINGA-CARRASCO G, SYVERUD K. Temperature stability of nanocellulose dispersions[J]. Carbohydrate Polymers, 2017, 157: 114-121. DOI:10.1016/j.carbpol.2016.09.077 |
| [5] |
AZZAM F, MOREAU C, COUSIN F, et al. Cellulose nanofibril-based multilayered thin films:Effect of ionic strength on porosity, swelling, and optical properties[J]. Langmuir, 2014, 30(27): 8091-8100. DOI:10.1021/la501408r |
| [6] |
ZHANG Y, SONG P, FU S, et al. Morphological structure and mechanical properties of epoxy/polysulfone/cellulose nanofiber ternary nanocomposites[J]. Composites Science & Technology, 2015, 115: 66-71. |
| [7] |
DONG H, SNYDER J F, WILLIAMS K S, et al. Cation-induced hydrogels of cellulose nanofibrilswith tunable moduli[J]. Biomacromolecules, 2013, 14(9): 3338-3345. DOI:10.1021/bm400993f |
| [8] |
FUKUZUMI H, TANAKA R, SAITO T, et al. Dispersion stability and aggregation behavior of TEMPO-oxidized cellulose nanofibrils in water as a function of salt addition[J]. Cellulose, 2014, 21(3): 1553-1559. DOI:10.1007/s10570-014-0180-z |
| [9] |
LUKASHEVA N V, TOLMACHEV D A. Cellulose nanofibrils and mechanism of their mineralization in biomimetic synthesis of hydroxyapatite/native bacterial cellulose nanocomposites. molecular dynamic simulations[J]. Langmuir, 2016, 32(1): 125-134. DOI:10.1021/acs.langmuir.5b03953 |
| [10] |
QU P, ZHOU Y T, ZHANG X L, et al. Surface modification of cellulose nanofibrils for poly(lactic acid) composite application[J]. Journal of Applied Polymer Science, 2012, 125(4): 3084-3091. DOI:10.1002/app.36360 |
| [11] |
MULYADI A, DENG Y. Surface modification of cellulose nanofibrils by maleated styrene block copolymer and their composite reinforcement application[J]. Cellulose, 2016, 23(1): 519-528. DOI:10.1007/s10570-015-0787-8 |
| [12] |
FUJISAWA S, SAITO T, KIMURA S, et al. Comparison of mechanical reinforcement effects of surface-modified cellulose nanofibrils and carbon nanotubes in PLLA composites[J]. Composites Science & Technology, 2014, 90(90): 96-101. |
| [13] |
KALIA S, BOUFI S, CELLI A, et al. Nanofibrillated cellulose:surface modification and potential applications[J]. Colloid and Polymer Science, 2014, 292(1): 5-31. |
| [14] |
CUNHA A G, ZHOU Q, LARSSON P T, et al. Topochemical acetylation of cellulose nanopaper structures for biocomposites:mechanisms for reduced water vapour sorption[J]. Cellulose, 2014, 21(4): 2773-2787. DOI:10.1007/s10570-014-0334-z |
| [15] |
李英豪, 耿延训, 徐化能. 乙酰化纳米纤维素纤维的制备及其凝胶机制研究[J]. 高校化学工程学报, 2018, 32(1): 212-218. LI Y H, GENG Y X, XU H N. Preparation of acetylated cellulose nanofibrils and its gelation behavior[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 212-218. |
| [16] |
SAITO T, UEMATSU T, KIMURA S, et al. Self-aligned integration of native cellulose nanofibrils towards producing diverse bulk materials[J]. Soft Matter, 2011, 7(19): 8804-8809. DOI:10.1039/c1sm06050c |
| [17] |
XU X, LIU F, JIANG L, et al. Cellulose nanocrystals vs. cellulose nanofibrils:a comparative study on their microstructures and effects as polymer reinforcing agents[J]. ACS Applied Materials & Interfaces, 2013, 5(8): 2999-3009. |
| [18] |
KEDZIOR S A, DUBÉ M A, CRANSTON E D. Cellulose nanocrystals and methyl cellulose as costabilizers for nanocomposite latexes with double morphology[J]. ACS Sustainable Chemical Engineering, 2017, 5(11): 10509-10517. DOI:10.1021/acssuschemeng.7b02510 |
| [19] |
HYNNINEN V, HIETALA S, MCKEE J R, et al. Inverse thermoreversible mechanical stiffening and birefringence in a methylcellulose/cellulose nanocrystal hydrogel[J]. Biomacromolecules, 2018, 19(7): 2795-2804. DOI:10.1021/acs.biomac.8b00392 |
| [20] |
SANNA R, FORTUNATI E, ALZARI V, et al. Poly (N-vinylcaprolactam) nanocomposites containing nanocrystalline cellulose:a green approach to thermoresponsive hydrogels[J]. Cellulose, 2013, 20(5): 2393-2402. DOI:10.1007/s10570-013-9988-1 |
| [21] |
ZHANG W, ZHANG Y, LU C, et al. Aerogels from crosslinked cellulose nano/micro-fibrils and their fast shape recovery property in water[J]. Journal of Materials Chemistry, 2012, 22(23): 11642-11650. DOI:10.1039/c2jm30688c |
| [22] |
ZHONG L, FU S, PENG X, et al. Colloidal stability of negatively charged cellulose nanocrystalline in aqueous systems[J]. Carbohydrate Polymers, 2012, 90(1): 644-649. DOI:10.1016/j.carbpol.2012.05.091 |
| [23] |
XU S, GIROUARD N, SCHUENEMAN G, et al. Mechanical and thermal properties of waterborne epoxy composites containing cellulose nanocrystals[J]. Polymer, 2013, 54(24): 6589-6598. DOI:10.1016/j.polymer.2013.10.011 |
| [24] |
SOMAN S, CHACKO A S. Semi-interpenetrating network composites of poly(lactic acid) with cis-9-octadecenylamine modified cellulose-nanofibers from Areca catechu husk[J]. Composites Science & Technology, 2017, 141: 65-73. |
| [25] |
CHINGA-CARRASCO G, SYVERUD K. Pretreatment-dependent surface chemistry of wood nanocellulose for pH-sensitive hydrogels[J]. Journal of Biomaterials Applications, 2014, 29(3): 423-432. DOI:10.1177/0885328214531511 |
| [26] |
TANAKA R, SAITO T, ISOGAI A. Cellulose nanofibrils prepared from softwood cellulose by TEMPO/NaClO/NaClO2 systems in water at pH 4.8 or 6.8[J]. International Journal of Biological Macromolecules, 2012, 51(3): 228-234. DOI:10.1016/j.ijbiomac.2012.05.016 |
| [27] |
NECHYPORCHUK O, BELGACEM M N, PIGNON F. Current progress in rheology of cellulose nanofibril suspensions[J]. Biomacromolecules, 2016, 17(7): 2311-2320. DOI:10.1021/acs.biomac.6b00668 |
| [28] |
XU H N, TANG Y Y, OUYANG X K. Shear-induced breakup of cellulose nanocrystal aggregates[J]. Langmuir, 2016, 33(1): 235-242. |
| [29] |
ZHOU C, WU Q, ZHANG Q. Dynamic rheology studies of in situ polymerization process of polyacrylamide-cellulose nanocrystal composite hydrogels[J]. Colloid & Polymer Science, 2011, 289(3): 247-255. |
| [30] |
RANGELOVA N, RADEV L, NENKOVA S, et al. Methylcellulose/SiO2hybrids:Sol-gel preparation and characterization by XRD, FTIR and AFM[J]. Central European Journal of Chemistry, 2011, 9(1): 112-118. DOI:10.2478/s11532-010-0123-y |
| [31] |
SINGH R P, KUNDU P P. DSC and micro structural studies of methylcellulose gels in N, N dimethylformamide[J]. Journal of Polymer Research, 2013, 20(9): 1-12. |




