甲壳素(chitin)是一种天然可再生的生物多糖资源,广泛存在于虾、蟹的外壳以及藻类、菌类的细胞壁之中,其年产量仅次于自然界中的纤维素[1-2]。壳聚糖(chitosan,CS)是甲壳素经脱乙酰化反应后得到的一种带正电荷的链状聚氨基弱碱性多糖[2-3],具有优异的生物组织相容性、生物可降解性和生物黏附性,且安全无毒,因而在化工、食品、生物和医药领域常被加工制作成支架、微米或纳米粒的形式[4-6],并作为活性载体用来包埋一些有价值的多肽、酶蛋白、维生素、氨基酸、茶多酚、胰岛素和抗癌药物等[6-9]。因此,壳聚糖微粒/纳米粒的制备一直是生物质壳聚糖资源高值化加工与利用的研究热点。
离子交联法是目前壳聚糖微粒制备中的一种常用方法[9-10]。该法以三聚磷酸钠(sodium tripolyphosphate,TPP)、偏磷酸钠等带负电荷的阴离子化合物为交联剂,通常采用机械搅拌的方式促使其与壳聚糖分子链经质子化后带正电荷的NH3+通过静电吸附作用实现交联,属于物理交联过程[9-11]。但是,机械搅拌属于从宏观上实现液体之间的混合,存在混合效率低、微观传质效果差和能耗大等问题,而水力空化作为一项新型的过程强化技术,可以有效地解决以上问题[12-15]。例如:占叶勇等[13]采用水力空化强化大豆油脱臭馏出物与甲醇间的混合以促进酯化脱酸反应,在相同原料配比下,酯化率比机械搅拌提高12.1%。BOKHARI等[14]研究表明当橡胶籽油与三醋酸甲酯之间的甲酯转化率达88.2 %时,孔板水力空化和机械搅拌分别耗时20和90 min,这归因于相比于机械搅拌,孔板空化强化了橡胶籽油与三醋酸甲酯二者间微观水平上的混合效果,大大降低了反应间的传质阻力;CHUAH等[15]也证实了这一结论。
水力空化(Hydrodynamic cavitation,HC)是指管道中的流体流过一个局部收缩的节流件(如文丘里管)时,流速剧增,压力骤减,当压力减小至或小于液体的饱和蒸汽压时,液体内部产生大量的空化泡。空化泡在随液体流动过程中,遇到环境压力增大时发生溃灭,并在其周围狭小的空间范围内产生高温(1 000~5 000℃)、瞬时高压(1~50 MPa)等极端环境效应,即形成“热点”,并伴有强烈的冲击波、微射流和剧烈湍动等机械效应,同时水溶液可产生羟自由基等活化效应[12, 16],以上效应可用来强化物理过程和化学过程[12-15, 17-19]。例如,已有报道利用水力空化强化传热[20]、乳化[21]、细胞破碎[22]和除垢[23]等物理过程。此外,水力空化产生的空化效应在强化毫米级/微米级的颗粒制备工艺以获得粒度更细的颗粒领域也表现出了广阔的应用潜力[12, 17, 24-25]。例如,PINJARI等[24]以初始粒径为63 μm的生物质纤维素颗粒水悬液为处理样品,采用具有33个孔、孔径1.0 mm的孔板水力空化作用6 h后,纤维素颗粒的粒径减小为1.36 μm;SONAWANE等[25]使用孔板水力空化制备碳酸钙纳米粒的平均粒径为37 nm,显著小于机械搅拌(无水力空化)下的平均粒径101 nm。但是,截至目前尚未见有文丘里管空化强化离子交联法制备壳聚糖微粒的研究。
KONG等[26]研究证实壳聚糖空白微球水溶液分散体系具有一定的抑菌性能。为能够更好发挥壳聚糖和抗菌药物的抑菌、防腐性能,本课题组前期以甲基异噻唑啉酮(methylisothiazolinone,MIT)为模型抑菌剂,采用涡流空化强化离子交联法制备所得壳聚糖微球对MIT的包封率达50.17%[27]。本研究在前期工作的基础上,以MIT为模型抑菌剂,探讨文丘里管空化强化离子交联法制备壳聚糖抗菌微粒,并和传统机械搅拌的制备效果相比较,以期为文丘里管空化强化离子交联法制备壳聚糖微粒提供理论依据。
2 实验材料和方法 2.1 材料壳聚糖(脱乙酰度86.6%,分子量50~90 kDa),购自上海市卡博工贸有限公司;甲基异噻唑啉酮(质量分数10%),购自湖北巨胜科技有限责任公司;冰醋酸、三聚磷酸钠、氢氧化钠:分析纯,购自广西柳州市益嘉化工有限公司。实验用水为去离子水,电导率≤ 4.0 μs·cm-1。
2.2 仪器与设备文丘里管空化元件自行研制;电子分析天平,ISO9001,北京赛多利斯仪器系统有限公司;pH计,PE20型,上海梅特勒-托利多仪器有限公司;精密增力电动搅拌器,JJ-1型,江苏常州国华电器有限公司;冷冻高速离心机,J-26 XPI型,美国Beckman Coulter公司;真空干燥箱,DZ-2AII,天津市泰斯特仪器有限公司;紫外分光光度计,Cary 60,美国Agilent Technologies公司;激光纳米粒度分析仪,Nano-ZS90型,英国Malven公司;高清数字光学显微摄像仪,MC-D310U,凤凰光学仪器集团有限公司;场发射扫描电镜(SEM),SIGMN,德国蔡司Zeiss公司。
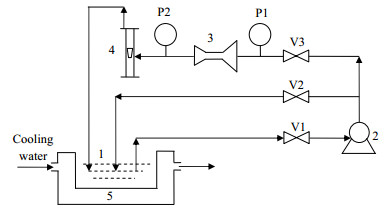
2.3 实验装置与流程文丘里管空化实验装置如图 1所示[28]。实验操作步骤如下:称取适量的壳聚糖缓慢倒入pH 4.0的醋酸溶液中,边倒入边搅拌至固体溶解后,静置1.0 h,用双层滤布除去不溶性杂质。配制并量取所需浓度的MIT溶液500 mL和TPP溶液400 mL,将二者充分混匀。取1.0 L配制好的壳聚糖溶液倒入料液贮槽(1)中,开启驱动泵(2),调节阀门V2和V3控制文丘里管(3)的入口压力,并通过压力计P1、P2分别监测文丘里管的入口和出口压力,同时开启冷凝水通过恒温水槽(5),控制反应温度保持在35℃,在达到所需的入口压力后,将MIT和TPP二者的混合液加入到料液槽(1)中,每隔一段时间在料液槽(1)中可收集得到包埋MIT抑菌剂的壳聚糖微粒。
|
图 1 水力空化实验装置流程图 Fig.1 Schematic diagram of the experimental set-up with Venturi cavitation 1. feed reservoir 2. magnetic pump 3. Venturi 4. rotameter 5. circulation tank V1, V2, V3.valve P1, P2. manometer |
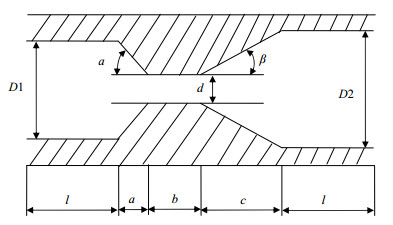
实验采用的文丘里管结构如图 2所示。入口直径D1为15.0 mm,出口直径D2为20.0 mm,进出口段长度l为35.0 mm,收缩段长度a为10.2 mm,喉管段长度b为12.0 mm,扩张段长度c为18.0 mm,喉管直径d为3.2 mm,入口锥角α为30°,出口锥角β为25°。
|
图 2 文丘里管结构示意图 Fig.2 Structure of the Venturi tube |
取适量空化反应后含有微粒的水分散体系,添加至专用比色皿中,然后用Nano-ZS90型激光粒度分析仪进行测量,测定其平均粒径大小和粒度分布。
2.4.2 微粒的形态学观察移取空化反应后含微粒的水分散体系,滴加少量与MC-D31OU高清数字光学显微摄像仪配套使用的载玻片上,随后调整高清数字摄像仪至适当的放大倍数,观察微粒的形态。移取空化反应后含微粒的水分散体系,用蒸馏水稀释至适当倍数后,将其滴加到铝箔纸上,70℃下真空干燥后,取一小块用导电双面胶将其固定在样品台上,经喷金处理后,用扫描电镜观察微粒的形态。
2.4.3 微粒对MIT的包封率测定取10.0 mL制备好的壳聚糖-MIT微粒胶体液,加入2.0 mL 2.0 mol·L-1 NaOH溶液使未反应的壳聚糖及微粒充分沉淀,于离心机8 000 r·min-1下离心10 min,取上清液用紫外分光光度计在波长273 nm下测定游离MIT的吸光度,计算出游离MIT的浓度。壳聚糖微粒对MIT的包封率按如下公式计算[27]:
| $ 包封率/\% {\rm{ = }}\frac{{{m_1}-{m_2}}}{{{m_1}}} \times 100 $ | (1) |
式(1)中,m1为反应前总的MIT量,mmol;m2为空化反应后游离的MIT量,mmol。
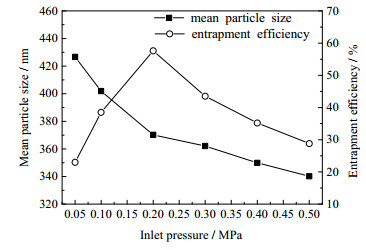
3 实验结果与讨论 3.1 文丘里管空化制备微粒的工艺优化结果 3.1.1 空化入口压力对微粒平均粒径和包封率的影响在空化时间为20 min、壳聚糖质量浓度为3.0 g·L-1、TPP质量浓度为2.0 g·L-1、MIT浓度为0.5 mmol·L-1的条件下,空化入口压力(用Pi表示,下同)的影响结果见图 3。如图 3所示,随着Pi的增大,微粒的平均粒径呈降低趋势。这主要是由于Pi增大,流速增大,空化数减小,空化强度增大,分子间传质效果更好,碰撞更剧烈,促使交联剂TPP与壳聚糖分子接触更加迅速,从而生成的微粒粒径也更小。MIT包封率随Pi的增大呈先增大后降低的趋势,在Pi为0.2 MPa时包封率达到最大为57.6%。这是由于Pi增大,空化强度增大,促使微粒更易生成,对MIT抑菌剂包埋的量也随之增大;但当Pi过大时,使得空化泡未充分发育足够大的气泡就发生溃灭,空化效果变差[12, 17],造成新生微粒对MIT包埋的效果变差。综合两方面因素,Pi以0.1~0.3 MPa为宜。
|
图 3 空化入口压力对微粒平均粒径和包封率的影响 Fig.3 Effects of cavitation inlet pressure on mean particle size and encapsulation efficiency |
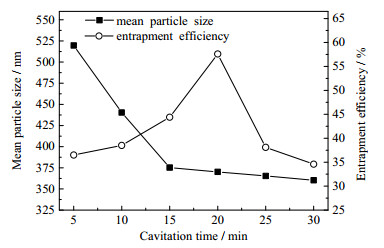
在Pi为0.2 MPa、壳聚糖质量浓度为3.0 g·L-1、TPP质量浓度为2.0 g·L-1、MIT浓度为0.5 mmol·L-1的条件下,空化时间(用tc表示,下同)的影响结果见图 4。如图 4所示,随着tc的延长,微粒的平均粒径呈先急剧降低后缓慢降低趋势。这主要是由于空化开始时,壳聚糖、TPP和MIT三者混合不均,易造成多个壳聚糖大分子与TPP相交联形成较大的颗粒;继续延长tc,三者逐渐混合均匀,同时壳聚糖分子不断降解生成分子量更小的壳寡糖分子[28, 29],从而粒径也随之减小。MIT包封率随tc的延长呈先增大后降低的趋势,在空化时长20 min时包封率增至最大为57.6%。这主要是由于微粒包埋MIT达到平衡后,微粒之间相互碰撞,同时受到空化的“热点”效应促使微粒自身发生破裂,使MIT重新释放到溶液中。为制备粒径小、包埋率高的微粒,tc以15~25 min为宜。
|
图 4 空化时间对微粒平均粒径和包封率的影响 Fig.4 Effects of cavitation time on mean particle size and encapsulation efficiency |
在Pi为0.2 MPa、tc为20 min、TPP质量浓度为2.0 g·L-1、MIT浓度为0.5 mmol·L-1的条件下,壳聚糖质量浓度(用cf表示,下同)的影响结果见图 5。如图 5所示,当cf为1.0 g·L-1时,溶液中TPP和壳聚糖质量比为4:5,实验中出现了絮状沉淀,继续增大至2.0 g·L-1时,微粒的平均粒径降至最低为289.5 nm,随后呈增大趋势。而包封率随cf呈先增大后降低趋势,并在cf增至3.0 g·L-1时达到最大为57.6%。这主要是由于当cf较低时,增大cf相当于提高了反应物浓度,增大了壳聚糖分子与交联剂TPP分子交联的几率,从而生成微球的数量增多,对MIT抑菌剂包埋的量也随之增大;当壳聚糖增大到一定的浓度时,由于壳聚糖的醋酸水溶液属于非牛顿假塑型流体,继续提高其浓度会使其黏度进一步加大,此时空化泡膨胀生成过程中所需克服液体分子间的作用力也随之增大,因而空化核较难产生,在相同Pi下,空化泡难以生长成足够大的气泡,从而空化振幅减小,空化强度减弱所致[12, 17]。综合两方面因素,cf以2.0~4.0 g·L-1为宜。
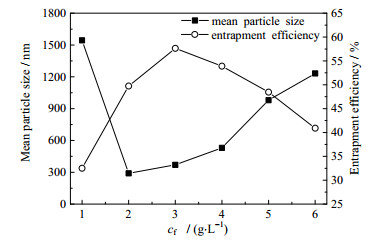
|
图 5 壳聚糖质量浓度对微粒平均粒径和包封率的影响 Fig.5 Effects of chitosan mass concentration on mean particle size and encapsulation efficiency |
在空化Pi为0.2 MPa、tc为20 min、cf为3.0 g·L-1、MIT浓度为0.5 mmol·L-1的条件下,TPP与壳聚糖质量比(用m(TPP):m(CS)表示,下同)的影响结果见图 6。如图 6所示,当m(TPP):m(CS)增大至6:15时,微粒的平均粒径降至最低,包封率也增至最大,随后继续增大TPP用量至二者质量比为7:15时,微粒的平均粒径急剧增大,并出现絮凝沉淀,而包封率也呈现降低趋势。这主要是由于当TPP用量增至一定的程度时,继续增大TPP用量,使带负电荷的磷酸根阴离子在混合液中的数量增多,从而与带正电荷的壳聚糖分子交联密度增加,促使交联生成微粒的粒径增大过快,在实验过程中出现了壳聚糖微粒聚集的絮状沉淀[30-32]。这一现象和刘慧[30]、费轶博[31]和BULMER[32]等的研究结果相一致。综合两方面因素,m(TPP):m(CS)以6:15为宜。
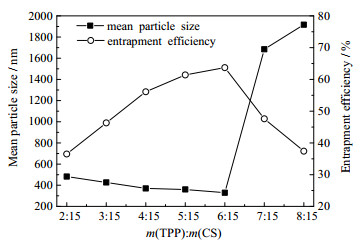
|
图 6 TPP与壳聚糖质量比对微粒平均粒径和包封率的影响 Fig.6 Effects of mass ratio of TPP and chitosan on mean particle size and encapsulation efficiency |
在Pi为0.2 MPa、tc为20 min、cf为3.0 g·L-1、m(TPP):m(CS)为6:15的条件下,MIT浓度的影响结果见图 7。如图 7所示,MIT浓度增大对微粒的粒径影响不大。这主要是由于交联仅发生在壳聚糖与TPP之间,MIT仅作为药物被微粒包裹或吸附,其不参与交联。当MIT浓度增至0.5 mmol·L-1时,包封率增至最大,随后继续增大MIT浓度,包封率呈降低趋势。这是由于当MIT增大时,微粒对MIT包埋的量也增大,但当MIT增大至一定浓度时,微粒对MIT的负载增量不及抑菌剂MIT的增加量,由式(1)可知,包封率下降。因此,选取MIT浓度0.5 mmol·L-1作为后续制备条件。
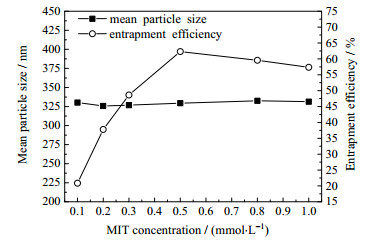
|
图 7 MIT浓度对微粒平均粒径和包封率的影响 Fig.7 Effects of MIT concentration on mean particle size and encapsulation efficiency |
在单因素实验基础上,选取空化入口压力(A)、空化时间(B)、壳聚糖质量浓度(C)、TPP与壳聚糖质量比(D)这4个因素,以壳聚糖微粒的平均粒径和包封率为评价指标,按L9(34)进行正交试验,确定制备微粒的优化工艺和配方,试验结果见表 1。
|
|
表 1 正交试验设计及结果 Table 1 Experimental results and design of orthogonal matrix |
由表 1的极差(R)分析结果可知,TPP与壳聚糖质量比是影响壳聚糖微粒平均粒径大小的关键因素,这一结论和Hashad等[33]在无水力空化作用下的研究结果相一致。各因素对平均粒径影响的大小顺序依次为:TPP与壳聚糖质量比(D) > 壳聚糖质量浓度(C) > 空化入口压力(A) > 空化时间(B);各因素对包封率影响的大小顺序依次为:空化时间(B) > TPP与壳聚糖质量比(D) > 空化入口压力(A) > 壳聚糖质量浓度(C)。
由表 1的各因素水平和均值(k)还可知,以平均粒径为指标优化得到壳聚糖微粒制备的最优工艺条件为A2B2C1D2,以包封率为指标优化得到的最优工艺条件为A2B2C2D2。为获得粒径小、包封率高的微粒,综合考虑选择壳聚糖质量浓度为3.0 g·L-1,即最终制备工艺条件为A2B2C2D2,空化入口压力0.2 MPa、空化时间20 min、壳聚糖质量浓度3.0 g·L-1、TPP与壳聚糖质量比6:15。
3.3 微粒的粒度分布及形貌观察在上述优化条件下制备壳聚糖抗菌微粒,取其分散体系于室温25℃下采用马尔文激光粒度仪测定其粒度大小及粒度分布,结果如图 8所示。由图 8可知,所制备的壳聚糖微粒粒径小,粒度分布窄,粒径大小较为均匀,平均粒径为329.4 nm。通过紫外分光光度计实验测定,优化条件下制备的壳聚糖微粒对MIT的包封率为(62.3±2.57)%。
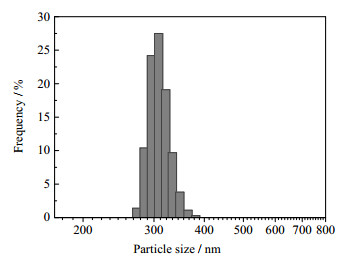
|
图 8 壳聚糖微粒的粒度分布 Fig.8 Particle size distribution of the chitosan microparticles |
图 9(a)和(b)分别为高清数字光学显微摄像仪MC-D310U对文丘里管空化制备得到含微粒的水分散体系样品放大1 000倍后的微观形貌图,和场发射扫描电镜SIGMN对真空干燥后的微粒进行表征的微观形貌图。由图 9(a)和(b)可知,文丘里管空化制备得到的壳聚糖微粒呈球性好,形态圆整,颗粒饱满,分散性佳,且粒径大小较为均匀,这与马尔文激光粒度分析仪的表征结果相一致。
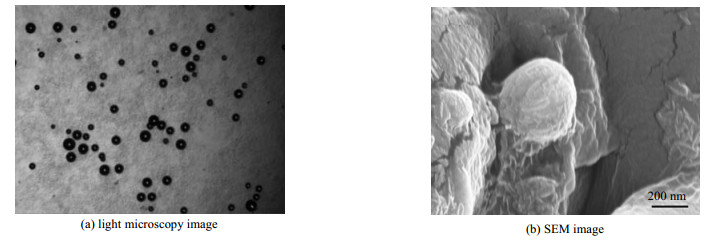
|
图 9 壳聚糖微粒的微观形貌 Fig.9 SEM micrographs of the chitosan microparticles |
传统离子交联法制备壳聚糖微粒时采取的机械搅拌转速通常为300~900 r·min-1[6, 11]。实验在固定壳聚糖质量浓度3.0 g·L-1,TPP与壳聚糖质量比6:15,MIT浓度0.5 mmol·L-1的条件下,控制机械搅拌器的转速分别为360和900 r·min-1,文丘里管空化制备时空化入口压力为0.2 MPa,在相同原料配比下,比较2种制备方式在不同交联时间内对壳聚糖微粒平均粒径和包封率的影响,结果见图 10。
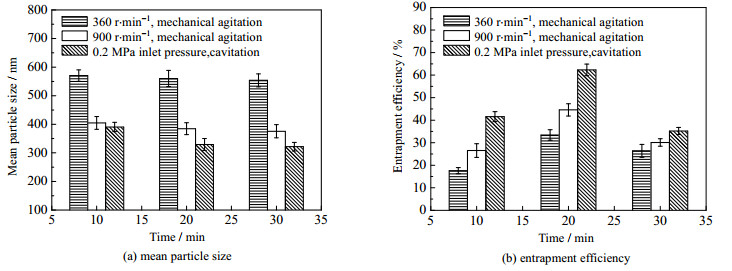
|
图 10 文丘里管空化与机械搅拌比较试验结果 Fig.10 Comparison of results obtained by Venturi-tube based cavitation and mechanical agitation |
如图 10(a)所示,在相同原料配比下,交联反应10 min时,搅拌转速360和900 r·min-1下制备的壳聚糖微粒平均粒径分别为570.5和404.8 nm,这大于文丘里管空化制备的微粒平均粒径390.6 nm。随着交联时间的继续延长,2种机械搅拌下制备的微粒平均粒径基本没有太大变化,而文丘里管空化制备的微粒平均粒径继续呈降低趋势,这一结果和3.1.2节的研究结果相一致。在交联时间为30 min时,文丘里管空化制备的微粒平均粒径为321.7 nm,比机械搅拌制备的微粒平均粒径减小20.5%以上。
如图 10(b)所示,在相同原料配比下,交联时间为10 min时,搅拌转速360和900 r·min-1下制备的微粒对MIT的包封率分别为17.6%和26.5%,这小于文丘里管空化制备的微粒对MIT的包封率41.6%。当交联时间延长至20 min时,机械搅拌和文丘里管空化制备的包封率均达到了最大,其中360和900 r·min-1两种搅拌转速下的包封率分别为33.4%和44.6%,而文丘里管空化制备的包封率为62.3%,比两种搅拌转速下的包封率分别提高了28.9%和17.7%。以上研究结果说明,基于文丘里管的水力空化适用于强化离子交联法制备得到粒径更细、包封率更高的壳聚糖抗菌微粒。
4 结论采用文丘里管空化强化离子交联法制备壳聚糖抗菌微粒过程,TPP与壳聚糖质量比是影响其空化制备微粒平均粒径大小的关键性因素,且当TPP与壳聚糖质量比为2:15~6:15时,文丘里管空化可稳定制备得到微粒。在空化入口压力0.2 MPa、空化时间20 min、壳聚糖质量浓度3.0 g·L-1、TPP与壳聚糖质量比6:15、MIT浓度0.5 mmol·L-1的优化工艺条件下,所制备得到的壳聚糖微粒采用场发射扫描电镜、高清数字光学显微摄像仪和马尔文激光粒度分析仪对其微观形貌及粒度分布进行表征,实验结果表明所制备的微粒呈球性好、形态圆整、颗粒饱满、分散性佳,且粒度分布窄,平均粒径为329.4 nm,包封率测定为(62.3±2.57)%,和传统机械搅拌相比,平均粒径减小20.5%,包封率提高17.7%以上。以上研究结果表明文丘里管空化适用于强化离子交联法制备粒径更细、包封率更高的壳聚糖抗菌微粒。后续可对壳聚糖抗菌微粒的释药规律和抑菌效果进一步展开深入研究。
| [1] |
LOPES C, ANTELO L T, FRANCO-URÍA A, et al. Chitin production from crustacean biomass:sustainability assessment of chemical and enzymatic processes[J]. Journal of Cleaner Production, 2018, 172: 4140-4151. DOI:10.1016/j.jclepro.2017.01.082 |
| [2] |
HAMED I, ÖZOGUL F, REGENSTEIN J M. Industrial applications of crustacean by-products (chitin, chitosan, and chitooligosaccharides):a review[J]. Trends in Food Science & Technology, 2016, 48: 40-50. |
| [3] |
LI B, MU X. Recent progress in the utilization of chitin/chitosan for chemicals and materials, in:fuels, chemicals and materials from the oceans and aquatic sources [M]. New York:John Wiley & Sons Ltd, 2017:151-187.
|
| [4] |
DEEPTHI S, VENKATESAN J, KIM S K, et al. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering[J]. International Journal of Biological Macromolecules, 2016, 93(Part B): 1338-1353. |
| [5] |
林越呈, 王宏鹏, 龚金炎, 等. 改性壳聚糖微球制备及其对阴离子染料的吸附行为研究[J]. 高校化学工程学报, 2017, 31(2): 470-477. LIN Y C, WANG H P, GONG J Y, et al. Preparation of modified chitosan microspheres and their anionic dye adsorption behaviors[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(2): 470-477. DOI:10.3969/j.issn.1003-9015.2017.02.029 |
| [6] |
CHEN M C, MI F L, LIAO Z X, et al. Recent advances in chitosan-based nanoparticles for oral delivery of macromolecules[J]. Advanced Drug Delivery Reviews, 2013, 65(6): 865-879. |
| [7] |
CHO Y, KIM J T, PARK H J. Size-controlled self-aggregated N-acyl chitosan nanoparticles as a vitamin C carrier[J]. Carbohydrate Polymers, 2012, 88(3): 1087-1092. DOI:10.1016/j.carbpol.2012.01.074 |
| [8] |
LIANG J, YAN H, PULIGUNDLA P, et al. Applications of chitosan nanoparticles to enhance absorption and bioavailability of tea polyphenols:a review[J]. Food Hydrocolloids, 2017, 69: 286-292. DOI:10.1016/j.foodhyd.2017.01.041 |
| [9] |
BHATIA S. Chitosan based nanomaterials and its applications, in:systems for drug delivery[M]. Berlin: Springer Cham, 2016: 55-117.
|
| [10] |
DESAI K G. Chitosan nanoparticles prepared by ionotropic gelation:an overview of recent advances[J]. Critical Reviews™ in Therapeutic Drug Carrier Systems, 2016, 33(2): 107-158. DOI:10.1615/CritRevTherDrugCarrierSyst.v33.i2 |
| [11] |
AGNIHOTRI S A, MALLIKARJUNA N N, AMINABHAVI T M. Recent advances on chitosan-based micro- and nanoparticles in drug delivery[J]. Journal of Controlled Release, 2004, 100(1): 5-28. DOI:10.1016/j.jconrel.2004.08.010 |
| [12] |
CARPENTER J, BADVE M, RAJORIYA S, et al. Hydrodynamic cavitation:an emerging technology for the intensification of various chemical and physical processes in a chemical process industry[J]. Reviews in Chemical Engineering, 2017, 33(5): 1-37. |
| [13] |
占叶勇, 聂勇, 陆向红, 等. 水力空化强化大豆油脱臭馏出物酯化脱酸反应研究[J]. 中国油脂, 2015, 40(6): 62-65. ZHAN Y Y, NIE Y, LU X H, et al. Enhancement of hydrodynamic cavitation in the esterification reaction of soybean oil deodorizer distillate[J]. China Oils and Fats, 2015, 40(6): 62-65. DOI:10.3969/j.issn.1003-7969.2015.06.016 |
| [14] |
BOKHARI A, YUSUP S, CHUAH L F, et al. Pilot scale intensification of rubber seed (Hevea brasiliensis) oil via chemical interesterification using hydrodynamic cavitation technology[J]. Bioresource Technology, 2017, 242: 272-282. DOI:10.1016/j.biortech.2017.03.046 |
| [15] |
CHUAH L F, YUSUP S, ABD AZIZ A R, et al. Intensification of biodiesel synthesis from waste cooking oil (Palm Olein) in a hydrodynamic cavitation reactor:effect of operating parameters on methyl ester conversion[J]. Chemical Engineering and Processing:Process Intensification, 2015, 95: 235-240. DOI:10.1016/j.cep.2015.06.018 |
| [16] |
张晓冬, 杨会中, 李志义. 水力空化强度与空化自由基产量的关系[J]. 化工学报, 2007, 58(1): 27-32. ZHANG X D, YANG H Z, LI Z Y. Relationship between strength of hydrodynamic cavitation and amount of induced hy droxy l radical[J]. Journal of Chemical Industry and Engineering (China), 2007, 58(1): 27-32. DOI:10.3321/j.issn:0438-1157.2007.01.005 |
| [17] |
MOHOLKAR V, GOGATE P R, PANDIT A. Process intensification and green processing using cavitational reactors, in:process intensification for green chemistry:engineering solutions for sustainable chemical processing[M]. New York:John Wiley & Sons Ltd, 2013:199-225.
|
| [18] |
PANDIT A B, AMBULGEKAR G V, GOGATE P R. Hydrodynamic cavitation: a process intensification technology for the future[C]//2005 AIChE Spring National Meeting, Conference Proceedings, Atlanta: 10-14, 2005: 5-6.
|
| [19] |
蔡美强, 关怡新, 姚善泾, 等. 水力空化混合强化超临界流体辅助雾化制备罗红霉素超细微粒[J]. 化工学报, 2008, 59(2): 293-300. CAI M Q, GUAN Y X, YAO S J, et al. Supercritical fluid assisted atomization introduced by hydrodynamic cavitation mixer for micronization of roxith romycin[J]. Journal of Chemical Industry and Engineering (China), 2008, 59(2): 293-300. DOI:10.3321/j.issn:0438-1157.2008.02.005 |
| [20] |
蔡军, 徐根花, 淮秀兰, 等. 文丘里管内水力空化强度影响因素研究[J]. 工程热物理学报, 2011, 32. CAI J, XU G H, HUAI X L, et al. Study on the intensify of hydrodynamic cavitation in a venturi tube[J]. Journal of Engineering Thermophysics, 2011, 32(suppl.): 178-181. |
| [21] |
CARPENTER J, GEORGE S, SAHARAN V K. Low pressure hydrodynamic cavitating device for producing highly stable oil in water emulsion:effect of geometry and cavitation number[J]. Chemical Engineering and Processing:Process Intensification, 2017, 116: 97-104. DOI:10.1016/j.cep.2017.02.013 |
| [22] |
BALASUNDARAM B, HARRISON S T L. Optimising orifice geometry for selective release of periplasmic products during cell disruption by hydrodynamic cavitation[J]. Biochemical Engineering Journal, 2011, 54(3): 207-209. DOI:10.1016/j.bej.2011.03.002 |
| [23] |
李虹霞, 淮秀兰, 李勋锋, 等. 水力空化防除垢实验研究[J]. 工程热物理学报, 2010, 31(9): 1531-1534. LI H X, HUAI X L, LI X F, et al. Experimental investigation of antiscale and scale removal by hydrodynamical cavitation[J]. Journal of Engineering Thermophysics, 2010, 31(9): 1531-1534. |
| [24] |
PINJARI D V, PANDIT A B. Cavitation milling of natural cellulose to nanofibrils[J]. Ultrasonics Sonochemistry, 2010, 17(5): 845-852. DOI:10.1016/j.ultsonch.2010.03.005 |
| [25] |
Sonawane S H, Gumfekar S P, Kate K H, et al. Hydrodynamic cavitation-assisted synthesis of nanocalcite[J]. International Journal of Chemical Engineering, 2010, 2010: 1-8. |
| [26] |
KONG M, CHEN X G, XUE Y P, et al. Preparation and antibacterial activity of chitosan microshperes in a solid dispersing system[J]. Frontiers of Materials Science in China, 2008, 2(2): 214-220. DOI:10.1007/s11706-008-0036-2 |
| [27] |
张昆明, 刘宝彪, 黄永春, 等. 水力空化强化壳聚糖抗菌微球制备工艺的研究[J]. 保鲜与加工, 2017, 17(2): 12-18. ZHANG K M, LIU B b, HUANG Y C, et al. Preparation of chitosan antibacterial microspheres intensified by hydrodynamic cavitation[J]. Storage and Process, 2017, 17(2): 12-18. |
| [28] |
HUANG Y, WU Y, HUANG W, et al. Degradation of chitosan by hydrodynamic cavitation[J]. Polymer Degradation and Stability, 2013, 98(1): 37-43. DOI:10.1016/j.polymdegradstab.2012.11.001 |
| [29] |
WU Y, HUANG Y, ZHOU Y, et al. Degradation of chitosan by swirling cavitation[J]. Innovative Food Science & Emerging Technologies, 2014, 23: 188-193. |
| [30] |
刘慧.壳聚糖微球/纳米粒的制备及其性能研究[D].杭州: 浙江大学, 2007. LIU H. Preparation and characterization of chitosan microspheres/nanoparticles[D]. Hangzhou: Zhejiang University, 2007. http://cdmd.cnki.com.cn/article/cdmd-10335-2007078085.htm |
| [31] |
费轶博, 李凤前, 胡晋红, 等. 用离子交联-匀化工艺制备乙肝疫苗壳聚糖纳米粒[J]. 药学服务与研究, 2008, 8(2): 119-122. FEI Y B, LI F Q, HU J H, et al. Preparation of chitosan nanoparticles loaded with HB vaccine by ionotropic gelation-homogenization process[J]. Pharmaceutical Care and Research, 2008, 8(2): 119-122. DOI:10.3969/j.issn.1671-2838.2008.02.008 |
| [32] |
BULMER C, MARGARITIS A, XENOCOSTAS A. Production and characterization of novel chitosan nanoparticles for controlled release of rHu-Erythropoietin[J]. Biochemical Engineering Journal, 2012, 68: 61-69. DOI:10.1016/j.bej.2012.07.007 |
| [33] |
HASHAD R A, ISHAK R A H, FAHMY S, et al. Chitosan-tripolyphosphate nanoparticles:optimization of formulation parameters for improving process yield at a novel pH using artificial neural networks[J]. International Journal of Biological Macromolecules, 2016, 86: 50-58. DOI:10.1016/j.ijbiomac.2016.01.042 |




