2. 青海省盐湖资源化学重点实验室,青海 西宁 810008
2. Key Laboratory of Salt Lake Resources Chemistry of Qinghai Province, Xining 810008, China
金属锂及其化合物应用广泛,是国民经济发展不可或缺的资源。目前,从盐湖卤水中提锂具有资源丰富、耗能少、成本低等特点,已成为锂资源开发利用的主要方向[1]。我国固体硼资源日益枯竭,硼资源高效开发和硼资源即将枯竭的双重挑战,发展以减量、再利用、再循环为基本特征的硼循环经济已经迫在眉睫。锂硼酸盐在现代无机盐工业中占有重要地位,广泛应用于光学材料国防工业和其他高科技产业。在我国,锂、硼资源大部分分布于青海、西藏、新疆、四川等地的盐湖卤水之中。青藏高原某些硫酸镁亚型硼酸盐盐湖卤水,经蒸发浓缩析出钠盐和钾盐以后,可以看作Li+,Mg2+//Cl-,SO42-,Borate-H2O体系[2]。硼酸盐溶液结构复杂,受到水合作用、离解、聚合、溶质浓度、温度和压力等因素的影响。一系列含锂和硼酸盐水盐体系的热力学研究报道,为我国锂、硼资源的开发提供了可靠的数据支撑,如Li2B4O7+H2O[3-5],LiB(OH)4+H2O[6-7],LiCl+Li2B4O7+H2O[8-9],MgCl2+Li2B4O7+H2O[10],MgB4O7+H2O[11-12]等。
电解质水溶液的体积性质能够提供溶液中结构相互作用的信息,在阐明溶液中发生的结构相互作用中起非常重要的作用。表观摩尔体积可以揭示由浓度和温度变化引起的溶液体积的变化,并对水溶液的结构和离子相互作用提供了一些基本的见解。为了进一步了解硼酸盐水溶液中离子相互作用,本文采用密度仪测定了偏硼酸锂和五硼酸锂水溶液体系在不同温度和不同浓度下的密度,计算得到相应的表观摩尔体积。利用Pitzer电解质溶液离子相互作用表观摩尔体积模型,获得了不同温度下偏硼酸锂和五硼酸锂的Pitzer单盐参数,对于构建具有我国盐湖卤水组成特征的盐湖卤水体系热力学化学模型及促进盐湖卤水资源开发利用具有参考价值。
2 实验部分 2.1 试剂与仪器偏硼酸锂(LiBO2·8H2O分析纯,国药集团化学试剂有限公司);硼酸(H3BO3分析纯,天津恒兴化学试剂有限公司);氢氧化锂(LiOH·H2O分析纯,北京中联化学试剂有限公司)。LiB(OH)4和LiB5O6(OH)4储备液配置、分析以及待测样品制备的细节前文中已经详细描述[15]。二次蒸馏去离子水(电导率 < 1×10-4 S·m-1)。
Anton Paar 5000 M振荡管密度仪,在实验温度范围内控温精度为±0.01 K,测量精度小于±0.000 005 g·cm-3。
2.2 实验方法五硼酸锂合成按照Li2O–B2O3–H2O多温相图[13],将一定摩尔比的H3BO3、LiOH·H2O和H2O加热溶解、蒸发、冷却得到LiB5O8·5H2O晶体。LiB5O8·5H2O晶体的表征细节在文献中已详细表述[14]。
每个样品密度测量通过一式两份,计算测定平均值得到样品密度。在测量之前,使用蒸馏去离子水作为参考物质校准仪器。在每次测定前,使用蒸馏去离子水洗涤U型管3次,并使用待测液润洗2次。在测量过程中,保证U型管没有出现结晶和鼓泡。
3 结果与讨论 3.1 密度与表观摩尔体积从稀到饱和浓度的LiB(OH)4和LiB5O6(OH)4水溶液在288.15~323.15 K时的密度ρ测定结果见表 1。按式(1)计算溶质表观摩尔体积为
|
|
表 1 在288.15 K≤T≤323.15 K下,LiB(OH)4和LiB5O6(OH)4的不同浓度实验密度ρ和表观摩尔体积Vφ Table 1 Experimental densities ρ and apparent molar volumes Vφ of LiB(OH)4 and LiB5O6(OH)4 at 288.15 K≤T≤323.15 K |
| ${V_\varphi } = \frac{M}{\rho } - \frac{{{1_{}}000(\rho - {\rho _0})}}{{{m_B}\rho {\rho _0}}}$ | (1) |
式中:ρ和ρ0 (g·cm-3)分别为溶液和溶剂水的密度;M (g·mol-1)为溶质的摩尔质量;mB(mol·kg-1)为溶质的质量摩尔浓度。将计算得到的LiB(OH)4和LiB5O6(OH)4表观摩尔体积Vφ列于表 1。
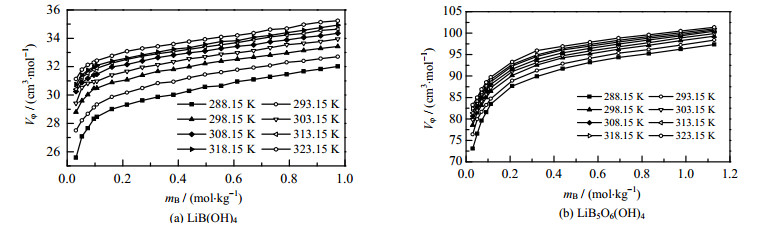
以表观摩尔体积对浓度作图(见图 1)。由图 1可见,在同一温度下,随着溶液浓度的增大,LiB(OH)4表观摩尔体积迅速增加;当溶液的浓度大于0.1 mol·kg-1时,LiB(OH)4表观摩尔体积随着浓度的增加缓慢增加。结果表明溶液中存在强烈的溶质-溶剂相互作用,在稀溶液中,溶液中主要存在自由水合离子,溶液中主要存在溶质-溶剂相互作用;随着浓度进一步增加,出现溶质-溶质相互作用,所以Vφ值缓慢增加。在同一浓度下,LiB(OH)4表观摩尔体积Vφ随着温度增加而增加。LiB5O6(OH)4表观摩尔体积随着浓度和温度变化有着和LiB(OH)4同样的变化规律。当溶液浓度大于0.32 mol·kg-1时,LiB5O6(OH)4表观摩尔体积随着浓度的缓慢增加。
|
图 1 不同温度下LiB(OH)4和LiB5O6(OH)4水溶液的表观摩尔体积Vφ随浓度的变化 Fig.1 Apparent molar volumes Vφ of LiB(OH)4 and LiB5O6(OH)4 aqueous solutions as a function of concentration at different temperatures |
二元盐水体系的表观摩尔体积可通过Pitzer离子相互作用体积模型表达[16]
| ${V_\varphi } = \bar V_\varphi ^0 + \nu \left| {{Z_M}} \right.\left. {{Z_X}} \right|(\frac{{{A_V}}}{{2b}}){\ln _{}}(1 + b\sqrt I ) + 2RT{\nu _M}{\nu _X}m[{B^V} + m{\nu _M}{Z_M}{C^V}]$ | (2) |
| ${B^V} = {\beta ^{(0)V}} + {\beta ^{(1)V}}(\frac{2}{{\alpha _1^2I}})[1 - (1 + {\alpha _1}{I^{{1 \mathord{\left/ {\vphantom {1 2}} \right. } 2}}}){\exp _{}}( - {\alpha _1}{I^{{1 \mathord{\left/ {\vphantom {1 2}} \right. } 2}}})] + {\beta ^{(2)V}}(\frac{2}{{\alpha _2^2I}})[1 - (1 + {\alpha _2}{I^{{1 \mathord{\left/ {\vphantom {1 2}} \right. } 2}}}){\exp _{}}( - {\alpha _2}{I^{{1 \mathord{\left/ {\vphantom {1 2}} \right. } 2}}})]$ | (3) |
式中:
根据Pitzer体积作用模型方程,分别针对不同温度溶质表观摩尔体积Vφ值进行多元拟合计算,分别获得LiB(OH)4和LiB5O6(OH)4在不同温度下的单盐参数,将计算得到的单盐参数
|
|
表 2 LiB(OH)4和LiB5O6(OH)4在不同温度下的体积Pitzer参数 Table 2 Volumetric Pitzer parameters of LiB(OH)4 and LiB5O6(OH)4 at different temperatures |
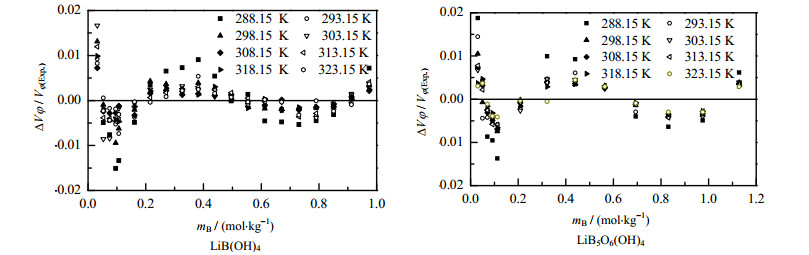
根据计算的得到的Pitzer模型参数分别计算LiB(OH)4和LiB5O6(OH)4表观摩尔体积,表观摩尔体积计算值与实验值的相对偏差绘于图 2,由图 2可知,所有表观摩尔体积实验值与模型计算值的相对偏差在±0.02之内,表明Pitzer方程可较好地表述该体系的热力学性质。
|
图 2 在温度范围288.15 K≤T≤323.15 K,根据表 2中参数计算LiB(OH)4-H2O和LiB5O6(OH)4-H2O体系表观摩尔体积的相对偏差 Fig.2 Relative deviations of apparent molar volumes Vφ of the LiB(OH)4-H2O and LiB5O6(OH)4-H2O systems calculated using the Pitzer model with parameters in Table 2 at 288.15 K≤T≤323.15 K |
LiB(OH)4和LiB5O6(OH)4极限偏摩尔体积
| $ f(i, T)=a_{0}+a_{1}(T-298.15)+a_{2}(T-298.15)^{2}+a_{3}(T-298.15)^{3} $ | (4) |
将拟合系数a0,a1,a2,a3的值和σ列于见表 3。
|
|
表 3 LiB(OH)4和LiB5O6(OH)4的Pitzer参数的温度相关系数 Table 3 Temperature related coefficients for Pitzer parameters of LiB(OH)4 and LiB5O6(OH)4 |
采用振荡管密度计测定测定了不同浓度LiB(OH)4和LiB5O6(OH)4水溶液分别在288.15 K≤T/K≤323.15 K下的密度,并算得到LiB(OH)4和LiB5O6(OH)4在不同浓度和温度下的表观摩尔体积。应用Pitzer电解质溶液离子相互作用表观摩尔体积模型分别计算LiB(OH)4和LiB5O6(OH)4在不同温度下的极限偏摩尔体积
| [1] |
高峰, 郑绵平, 乜贞, 等. 盐湖卤水锂资源及其开发进展[J]. 地球学报, 2011, 32(4): 483-492. GAO F, ZHENG M P, NIE Z, et al. Brine lithium resource in the salt lake and advances in its exploitation[J]. Acta Geoscientica Sinica, 2011, 32(4): 483-492. DOI:10.3975/cagsb.2011.04.13 |
| [2] |
郑绵平, 向军. 青藏高原盐湖[M]. 北京: 科学与技术出版社, 1989: 52. ZHENG M P, XIANG J. Saline lakes on the QingHai-XiZang(Tibet) plateau[M]. Beijing: Science and Technology Press, 1989: 52. |
| [3] |
ZHANG Z H, YIN G Y, TAN Z C, et al. Heat capacities and thermodynamic properties of a H2O+ Li2B4O7 solution in the temperature range from 80 to 356 K[J]. Journal of solution chemistry, 2006, 35(10): 1347-1355. DOI:10.1007/s10953-006-9065-6 |
| [4] |
ZHANG A Y, YAO Y, LI L J, et al. Isopiestic determination of the osmotic coefficients and Pitzer model representation for Li2B4O7 (aq) at T= 298.15 K[J]. The Journal of Chemical Thermodynamics, 2005, 37(2): 101-109. DOI:10.1016/j.jct.2004.07.028 |
| [5] |
GUO Y, ZHAO K, LI L, et al. Volumetric properties of aqueous solution of lithium tetraborate from 283.15 to 363.15 K at 101.325 kPa[J]. The Journal of Chemical Thermodynamics, 2018, 120: 151-156. DOI:10.1016/j.jct.2018.01.018 |
| [6] |
CORTI H, CROVETTO R, FERNÁNDEZ-PRINI R. Properties of the borate ion in dilute aqueous solutions[J]. Journal of the Chemical Society, Faraday Transactions, 1980, 76: 2179-2186. DOI:10.1039/f19807602179 |
| [7] |
CORTI H, CROVETTO R, FERNÁNDEZ-PRINI R. Mobilities and ion-pairing in LiB(OH)4 and NaB(OH)4 aqueous solutions. A conductivity study[J]. Journal of Solution Chemistry, 1980, 9(8): 617-625. DOI:10.1007/BF00649035 |
| [8] |
YANG J, YAO Y, XIA Q, et al. Isopiestic determination of the osmotic coefficients and pitzer model representation for the Li2B4O7+LiCl+ H2O System at T= 298.15 K[J]. Journal of Solution Chemistry, 2008, 37(3): 377-389. DOI:10.1007/s10953-007-9244-0 |
| [9] |
YANG J, YAO Y, ZHANG R, et al. Osmotic coefficients of the Li2B4O7+LiCl+H2O system at T=273.15 K[J]. Journal of solution chemistry, 2009, 38(4): 429-439. DOI:10.1007/s10953-009-9386-3 |
| [10] |
张爱云, 姚燕, 杨吉民, 等. Li2B4O7-MgCl2(B)-H2O体系热力学性质的等压研究及离子相互作用模型[J]. 化学学报, 2004, 62(12): 1089-1094. ZHANG A Y, YAO Y, YANG J M, et al. Isopiestic studies of thermodynamic properties and representation with ion-interaction model for Li2B4O7-MgCl2(B)-H2O system at 298.15 K[J]. Acta Chim Sinica, 2004, 62(12): 1089-1094. DOI:10.3321/j.issn:0567-7351.2004.12.001 |
| [11] |
戈海文, 邓天龙, 姚燕. 308.15K下MgB4O7-H2O体系热力学性质研究[J]. 高校化学工程学报, 2016, 30(5): 1007-1013. GE H W, DENG T L, YAO Y. Thermodynamic properties of the MgB4O7-H2O system at 308.15 K[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(5): 1007-1013. DOI:10.3969/j.issn.1003-9015.2016.05.004 |
| [12] |
ZHAO K, LI L, LI J, et al. Apparent molar volumes of aqueous solutions of magnesium tetraborate from 283.15 to 363.15 K and 0.1 MPa[J]. Journal of Solution Chemistry, 2018, 47(5): 827-837. DOI:10.1007/s10953-018-0761-9 |
| [13] |
Reburn W T, Gale W A. The system lithium oxide–boric oxide–water[J]. The Journal of Physical Chemistry, 1955, 59(1): 19-24. |
| [14] |
戈海文, 房春晖, 房艳, 等. LiB5O8溶液物理化学性质研究[J]. 盐湖研究, 2015, 23(1): 44-50. GE H W, FANG C H, FANG Y, et al. Physical properties of aqueous LiB5O8 solution: density, viscosity, conductivity and pH[J]. Journal of Salt Lake Research, 2015, 23(1): 44-50. |
| [15] |
GE H W, FANG Y, FANG C H, et al. Density, electrical conductivity, pH, and polyborate distribution of LiB(OH)4, Li2B4O5(OH)4, and LiB5O6(OH)4 solutions[J]. Journal of Chemical & Engineering Data, 2014, 59(12): 4039-4048. |
| [16] |
KRUMGALZ B S, POGORELSKY R, SOKOLOV A, et al. Volumetric ion interaction parameters for single-solute aqueous electrolyte solutions at various temperatures[J]. Journal of Physical and Chemical Reference Data, 2000, 29(5): 1123-1140. DOI:10.1063/1.1321053 |




