草甘膦是一种高效、广谱的灭生性有机磷除草剂,随着抗草甘膦转基因作物的推广,草甘膦已发展为世界销量最大,应用最广的农药品种[1]。目前草甘膦的工业生产方法有甘氨酸法和亚氨基二乙酸法(IDA法)[2~4]。与甘氨酸法相比,IDA法具有工艺过程简单、经济效益好等优点,IDA法的关键步骤为双甘膦催化氧化生成草甘膦[5]。由于草甘膦母液含有大量甲醛,因此循环套用母液时副反应增加,草甘膦收率降低[6, 7]。如使用Pt/C催化剂,在催化氧化双甘膦合成草甘膦的同时催化氧化甲醛生成甲酸,并进一步氧化为二氧化碳和水,则可提高母液循环套用效率,减少废水排放。
国内外对于甲醛催化氧化已有较多报道[8~10]。彭家喜等[11]研究了Pt/TiO2催化氧化甲醛反应的本征动力学,在空速300 L·g-1·h-1、333 K时甲醛脱除率为94.7%,甲醛本征反应活化能为47.50 kJ·mol-1。Chuang等[12]采用氟化碳负载Pt催化剂于336~432 K、空速1120 h-1条件下考察甲醛氧化表观反应动力学,得到表观活化能为37.29 kJ·mol-1。Pt/C催化氧化甲醛气液固三相反应未见报道,本文采用自制Pt/C催化剂研究甲醛和甲酸氧化反应动力学,为Pt/C催化剂的工业应用提供参考。
2 实验部分 2.1 催化剂制备称取定量活性炭,加入适量NaHCO3和NH4HCO3混合均匀后装填至管式炉内,以10 K·min-1升温速率升至1123.15 K后保温3 h,保温结束冷却、酸洗及水洗后烘干备用。
称取2 g上述活性炭于30 mL乙二醇中,超声分散30 min,按质量比3%加入氯铂酸溶液,室温浸渍搅拌2 h。加入定量甲醛溶液,用NaOH调节体系pH值,363.15 K搅拌3 h,经冷却、过滤和洗涤后,378.15 K干燥6 h得3% Pt/C催化剂[13~15]。
2.2 催化剂表征XRD谱表征在Rigaku UltimaIV型粉末衍射仪上进行,采用日本JEOL公司JEM2100F型高分辨透射电镜观测催化剂形貌,分析Pt纳米颗粒的粒径分布及其在活性炭载体上的分散情况,采用AUTOSORB–IQ2–MP全自动比表面分析仪测定活性炭比表面积。
2.3 催化氧化实验甲醛催化氧化实验在250 mL高压反应釜中进行,采用夹套加热,温度由PID控温加热仪控制,釜上配有进气和出气管路以调节釜内压力及氧气流量,反应装置如图 1所示。经预实验发现甲醛氧化过程中间产物甲酸的浓度较低,求取动力学参数时误差偏大,为此本文对于甲酸催化氧化反应单独进行实验研究。
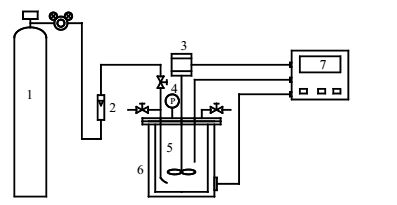
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental setup 1. oxygen cylinder 2. flowmeter 3. stirring motor 4. pressure gage 5. reactor 6. heating jacket 7. console |
甲醛的定量分析采用乙酰丙酮法[16],在乙酸–乙酸铵缓冲溶液中、沸水浴条件下甲醛与乙酰丙酮反应生成稳定的黄色化合物,在413 nm波长处测得吸光度,标准曲线如图 2所示。甲酸采用氢氧化钠溶液酸碱滴定分析,酚酞为指示剂[17]。
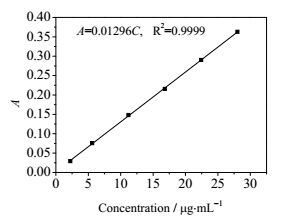
|
图 2 甲醛浓度标准曲线 Fig.2 Standard curve for HCHO concentration |
图 3为Pt/C催化剂的XRD谱图,2θ为25°和43°时分别对应碳(009) 和(002) 晶面,没有发现明显的Pt晶面衍射峰,但由图 4的TEM分析可知黑色Pt纳米颗粒分布在活性炭表面,且分散均匀,粒径均一,采用SigmaScan软件统计得到平均粒径为1.4 nm。活性炭平均孔径4.19 nm,比表面积997.5 m2·g-1。
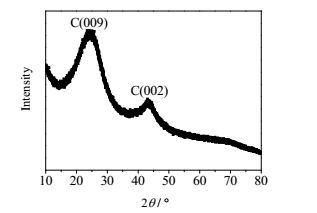
|
图 3 Pt/C催化剂的XRD图 Fig.3 XRD pattern of the Pt/C catalyst |
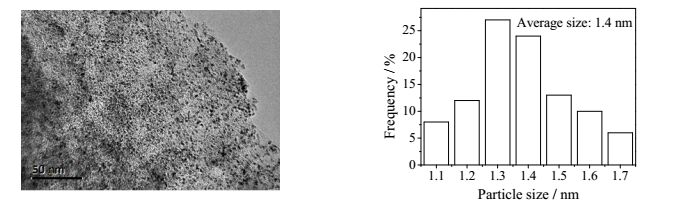
|
图 4 Pt/C催化剂的TEM照片及Pt的粒径分布图 Fig.4 TEM micrograph of the Pt/C catalyst and Pt particle distribution |
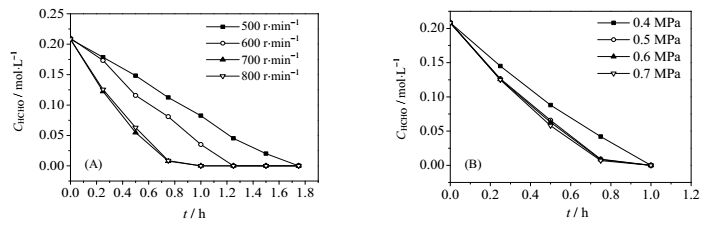
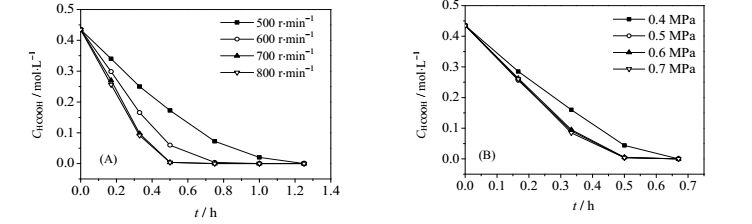
气液固三相反应外扩散阻力同时存在于气液相界面和液固相界面,改变搅拌转速,反应压力进行实验,当甲醛,甲酸氧化速率不随搅拌转速或反应压力的增大而增大时,可认为外扩散对反应的影响已经消除。在甲醛(0.21mol·L-1)或甲酸(0.44 mol·L-1)初始浓度恒定,Pt/C催化剂用量不变(0.2 g),氧气流量为120 mL·min-1,反应温度为353.15 K的条件下分别考察搅拌转速和反应压力对甲醛和甲酸氧化反应速率的影响,结果如图 5、6所示,当搅拌转速不小于700 r·min-1,反应压力不小于0.5 MPa时,外扩散对反应的影响已消除。
|
图 5 不同搅拌转速(A)和反应压力(B)下HCHO浓度随时间变化 Fig.5 HCHO concentration as a function of time under different stirring rates (A) and pressures (B) |
|
图 6 不同搅拌转速(A)和反应压力(B)下HCOOH浓度随时间变化 Fig.6 HCOOH concentration as a function of time under different stirring rates(A) and pressures(B) |
内扩散对反应的影响可通过Weisz–Prater判据进行判定。
| ${{C}_{\text{WP}}}=\frac{-{{r}_{\text{A}}}{{\rho }_{\text{c}}}{{r}^{2}}}{D\text{e}{{C}_{\text{As}}}}$ | (1) |
当CWP<<1时,反应过程不受内扩散影响,当CWP>>1时,反应过程为强内扩散控制。本文所用的活性炭颗粒粒径较小,约为30 μm,密度为500 kg·m-3,反应速率数量级为10-4mol·g-1·s-1,有效扩散系数数量级为10-7m2·s-1,甲醛和甲酸的初始浓度分别为0.21 mol·L-1和0.44 mol·L-1,CWP数量级为10-4,远远小于1,可以忽略内扩散对反应的影响。
3.3 动力学模型 3.3.1 动力学模型的建立及参数求取甲醛氧化反应途径已比较明确[18~21],在催化剂作用下先氧化为甲酸,进而氧化生成二氧化碳和水。本文作者发现中间产物甲酸的浓度较低,如用该浓度进行拟合求解则所得动力学参数误差较大,因此对甲酸氧化反应进行实验研究,将拟合得到的动力学参数用于甲醛氧化反应动力学参数的求解。甲酸氧化反应步骤如下:
| $\text{HCOOH}+\text{S}\underset{{{k}_{-3}}}{\overset{{{k}_{3}}}{\leftrightharpoons}}\text{HCOOH}\cdot \text{S}$ | (2) |
| $\text{HCOOH}\cdot \text{S}+\frac{1}{2}{{\text{O}}_{2}}\xrightarrow{{{k}_{4}}}\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\text{O}+\text{S}$ | (3) |
向娟等[22]研究发现,甲酸在活性吸附氧化过程中,氧化反应相对于吸附脱附速率较慢,以此为依据假设表面反应为速率控制步骤。将每步视为基元反应,根据吸附速率方程可得:
| ${{C}_{\text{HCOOH}\cdot \text{S}}}=\frac{{{k}_{3}}}{{{k}_{-3}}}{{C}_{\text{HCOOH}}}{{C}_{\text{S}}}={{K}_{3}}{{C}_{\text{HCOOH}}}{{C}_{\text{S}}}$ | (4) |
表面反应速率方程为:
| $-{{r}_{\text{HCOOH}}}={{k}_{4}}{{C}_{\text{HCOOH}\cdot \text{S}}}C_{{{\text{O}}_{2}}}^{0.5}\text{=}{{k}_{4}}{{K}_{3}}{{C}_{\text{HCOOH}}}{{C}_{\text{S}}}C_{{{\text{O}}_{2}}}^{0.5}$ | (5) |
对于该反应体系,活性位的平衡方程如下:
| ${{C}_{\text{HCOOH}\cdot \text{S}}}+{{C}_{\text{S}}}={{C}_{\text{t}}}$ | (6) |
代入(4) 得:
| ${{C}_{\text{S}}}\text{=}\frac{{{C}_{\text{t}}}}{1+{{K}_{3}}{{C}_{\text{HCOOH}}}}$ | (7) |
反应速率方程为:
| $-{{r}_{\text{HCOOH}}}=\frac{{{k}_{4}}{{K}_{3}}{{C}_{\text{HCOOH}}}{{C}_{\text{t}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{3}}{{C}_{\text{HCOOH}}}+1}\text{=}\frac{k_{4}^{'}{{K}_{3}}{{C}_{\text{HCOOH}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{3}}{{C}_{\text{HCOOH}}}+1}, 其中\ k_{4}^{'}\text{=}{{k}_{4}}\cdot {{C}_{\text{t}}}$ | (8) |
液相中饱和氧浓度根据亨利定律求得,亨利系数[23]由下式计算:
| $\text{ln(}\frac{H}{{{H}_{0}}})=A(1-\frac{{{T}_{0}}}{T})+B\text{ln}(\frac{T}{{{T}_{0}}})$ | (9) |
其中,T0为298.15 K,H0为4420 MPa·m3·mol-1,A=29.339,B=-24.453。不同温度下液相中氧气饱和浓度计算值如表 1所示。
| 表 1 0.6 MPa时不同反应温度下液相中氧气的饱和浓度 Table 1 Oxygen saturation concentrations in liquid phase at 0.6MPa and different temperatures |
对方程(8) 采用龙格–库塔法通过Matlab软件结合323.15~353.15 K下反应物浓度进行拟合求解,拟合结果如表 2。
| 表 2 不同温度下甲酸氧化反应速率常数和吸附平衡常数 Table 2 Reaction rate constants and adsorption equilibrium constants of HCOOH oxidation at different temperatures |
Christoskova等[24]采用镍基氧化物液相催化氧化甲醛,研究发现甲醛首先吸附到催化剂表面,随后与溶解氧反应生成吸附态甲酸,甲酸进而与溶解氧反应生成二氧化碳和水。以该机理为依据推得甲醛氧化反应步骤如下:
| $\text{HCHO}+\text{S}\underset{{{k}_{-1}}}{\overset{{{k}_{1}}}{\leftrightharpoons}}\text{HCHO}\cdot \text{S}$ | (10) |
| $\text{HCHO}\cdot \text{S}+\frac{1}{2}{{\text{O}}_{2}}\overset{{{k}_{2}}}{\mathop{\to }}\,\text{HCOOH}\cdot \text{S}$ | (11) |
| $\text{HCOOH}+\text{S}\underset{{{k}_{-3}}}{\overset{{{k}_{3}}}{\leftrightharpoons}}\text{HCOOH}\cdot \text{S}$ | (2) |
| $\text{HCOOH}\cdot \text{S+}\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\overset{{{k}_{4}}}{\mathop{\to }}\,\text{C}{{\text{O}}_{\text{2}}}\text{+}{{\text{H}}_{\text{2}}}\text{O+S}$ | (3) |
根据甲酸氧化反应机理的推导,同理可得甲醛氧化反应速率为:
| $-{{r}_{\text{HCHO}}}=\frac{{{k}_{2}}{{K}_{1}}{{C}_{\text{HCHO}}}{{C}_{\text{t}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{1}}{{C}_{\text{HCHO}}}+{{K}_{3}}{{C}_{\text{HCOOH}}}+\text{1}}\text{=}\frac{k_{_{2}}^{'}{{K}_{1}}{{C}_{\text{HCHO}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{1}}{{C}_{\text{HCHO}}}+{{K}_{3}}{{C}_{\text{HCOOH}}}+1},其中\ k_{2}^{'}\text{=}{{k}_{2}}\cdot {{C}_{\text{t}}}$ | (12) |
| $-{{r}_{\text{HCOOH}}}=\frac{k_{4}^{'}{{K}_{3}}{{C}_{\text{HCOOH}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{3}}{{C}_{\text{HCOOH}}}+1}-\frac{k_{_{2}}^{'}{{K}_{1}}{{C}_{\text{HCHO}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{1}}{{C}_{\text{HCHO}}}+{{K}_{3}}{{C}_{\text{HCOOH}}}+1}$ | (13) |
将已求得的K3、k4’代入方程(12)、(13) 后,采用龙格–库塔法结合323.15~353.15 K下反应物浓度进行拟合求解,结果如表 3。
| 表 3 不同温度下甲醛氧化反应速率常数和吸附平衡常数 Table 3 Reaction rate constants and adsorption equilibrium constants of HCHO at different |
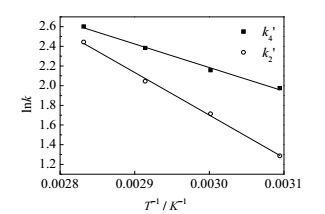
(1) 反应活化能的确定
根据阿伦尼乌斯公式
|
图 7 lnk和T-1 Fig.7 Profiles of lnk as a function of T-1 |
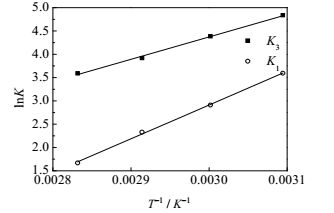
(2) 吸附热的确定
根据Van’t Hoff方程不定积分式
|
图 8 lnk和T-1 Fig.8 Profiles of lnk as a function of T-1 |
(3) 动力学方程表达式
排除内外扩散影响后,建立非均相催化反应动力学模型,拟合求解得到甲醛和甲酸氧化反应速率表达式分别为:
| $-{{r}_{\text{HCHO}}}=\frac{k_{_{2}}^{'}{{K}_{1}}{{C}_{\text{HCHO}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{1}}{{C}_{\text{HCHO}}}+{{K}_{3}}{{C}_{\text{HCOOH}}}+1}$ |
| $-{{r}_{\text{HCOOH}}}=\frac{k_{4}^{'}{{K}_{3}}{{C}_{\text{HCOOH}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{3}}{{C}_{\text{HCOOH}}}+1}-\frac{k_{_{2}}^{'}{{K}_{1}}{{C}_{\text{HCHO}}}C_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}{{{K}_{1}}{{C}_{\text{HCHO}}}+{{K}_{3}}{{C}_{\text{HCOOH}}}+1}$ |
| $\begin{align} & 其中,k_{2}^{'}=2.45\times {{10}^{6}}{{\text{e}}^{-\frac{4335.21}{T}}}\quad {{K}_{1}}=6.64\times {{10}^{-9}}{{\text{e}}^{\frac{7248.61}{T}}} \\ & k_{4}^{'}=1.18\times {{10}^{4}}{{\text{e}}^{-\frac{2397.36}{T}}}\quad {{K}_{3}}=4.32\times {{10}^{-5}}{{\text{e}}^{\frac{4806.50}{T}}} \\ \end{align}$ |
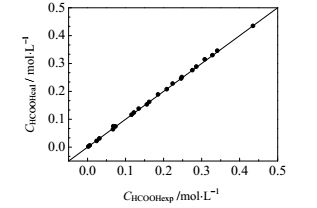
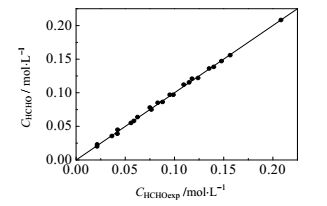
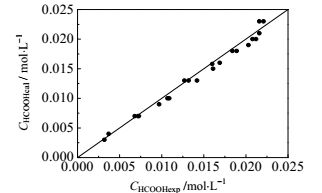
将氧化反应过程中甲酸、甲醛浓度的计算值与实验值进行对比,结果如图 9、图 10和图 11所示,其中甲酸氧化反应的最大偏差为9.73%,平均偏差为2.23%;甲醛氧化反应的最大偏差为7.95%,平均偏差为2.65%,甲酸的最大偏差为9.23%,平均偏差为5.10%,计算结果与实验结果符合较好,表明所得动力学模型可靠。
|
图 9 甲酸浓度实验值与计算值对比图 Fig.9 Comparison of calculated and experimental data of HCOOH concentration |
|
图 10 甲醛浓度实验值与计算值对比图 Fig.10 Comparison of calculated and experimental data of HCHO concentration |
|
图 11 甲醛氧化中甲酸浓度实验值与计算值对比图 Fig.11 Comparison of calculated and experimental data of HCOOH concentration in HCHO oxidation |
(1) 采用溶液浸渍还原法制备Pt/C催化剂,TEM和XRD表征结果表明Pt/C催化剂中Pt的平均粒径为1.4 nm,分散性较好。
(2) 采用高压反应釜研究甲醛和甲酸催化氧化反应动力学,催化剂粒径为30 μm,搅拌转速不小于700 r·min-1,反应压力不小于0.5 MPa的条件下可以消除催化剂内外扩散的影响。
(3) 分别建立了甲醛和甲酸氧化反应动力学模型,采用龙格–库塔法通过Matlab软件拟合求解,得到了甲醛和甲酸的本征反应速率表达式,模型检验结果表明该动力学模型可靠。
符号说明:
| CWP | —Weisz–Prater参数 | K1 | —甲醛吸附平衡常数,L·mol-1 |
| CS | —空活性位浓度,mol·L-1 | K3 | —甲酸吸附平衡常数,L·mol-1 |
| CAs | —反应物A初始浓度,mol·L-1 | k2’ | —甲醛氧化本征反应速率常数,mol0.5·L-0.5·h-1 |
| CHCOOH | —甲酸浓度,mol·L-1 | k4’ | —甲酸氧化本征反应速率常数,mol0.5·L-0.5·h-1 |
| CHCHO S | —甲醛占据的活性位浓度,mol·L-1 | r | —催化剂颗粒半径,m |
| CHCOOH S | —甲酸占据的活性位浓度,mol·L-1 | rA | —反应速率,mol·g-1·s-1 |
| CHCHO | —甲醛浓度,mol·L-1 | rHCHO | —甲醛氧化本征反应速率,mol·L-1·h-1 |
| CO2 | —溶解氧浓度,mol·L-1 | rHCOOH | —甲酸氧化本征反应速率,mol·L-1·h-1 |
| Ct | —活性位总浓度,mol·L-1 | R | —气体常数,8.314 J·mol-1·K-1 |
| De | —有效扩散系数,m2·s-1 | T | —反应温度,K |
| E | —活化能,J·mol-1 | ρC | —催化剂密度,kg·m-3 |
| H | —亨利系数,MPa·m3·mol-1 |
| [1] | Franz J E, Mao M K, Sikorski J A. Glyphosate:a unique global herbicide[M].Washington DC: American Chemical Society, 1997. |
| [2] | CHEN Dan(陈丹), LI Jian(李健), LI Guo-ru(李国儒), et al. Synthesis technologies for glyphosate(草甘膦合成工艺研究进展)[J]. Chemical Industry and Engineering Progress(化工进展) , 2013, 32(7): 1635-1640. |
| [3] | KE Min(柯敏), WEI Shao-ping(韦少平), WENG De-hong(翁德宏), et al. Comparation and prospect of two production techniques of glyphosate(草甘膦两大工艺路线比较和展望)[J]. Technology and Development of Chemical Industry(化工技术与开发) , 2011, 40(1): 28-30. |
| [4] | MAO Qing-wen(茆庆文). Productive technology summarize and it's developing trend of glyphosate(草甘膦生产工艺综述及其发展趋势)[J]. Anhui Chemical Industry(安徽化工) , 2008, 34(3): 5-8. |
| [5] | Catherine P, Emmanuel L, Hedi L, et al. Effect of the nature of carbon catalysts on glyphosate synthesis[J]. Journal of Catalysis , 1999, 182(2): 515-519. DOI:10.1006/jcat.1998.2374. |
| [6] | Arnold H, Creve C. Process for producing N-phosphonomethyl glycine:US, 3969398[P]. 1976-07-13. |
| [7] | HUANG Ming(黄明), YIN Ying-wu(尹应武), CHA Zheng-jiong(查正炯). Study of side-reaction on synthesis of glyphosate induced by glycine method(甘氨酸法合成草甘膦中由甲醛引发的副反应研究)[J]. Chinese Journal of Pesticide Science(农药学学报) , 2010, 12(1): 37-41. |
| [8] | Tang X F, Chen J L, Huang X M, et al. Pt/MnOx-CeO2 catalysts for the complete oxidation of formaldehyde at ambient temperature[J]. Applied Catalysis B:Environmental , 2008, 81(1): 115-121. |
| [9] | Huang H B, Dennis Y. Complete elimination of indoor formaldehyde over supported Pt catalysts with extremely low Pt content at ambient temperature[J]. Journal of Catalysis , 2011, 280(1): 60-67. DOI:10.1016/j.jcat.2011.03.003. |
| [10] | Bai B Y, Qiao Q, Li J H, et al. Progress in research on catalysts for catalytic oxidation of formaldehyde[J]. Chinese Journal of Catalysis , 2016, 37(1): 102-122. DOI:10.1016/S1872-2067(15)61007-5. |
| [11] | PENG Jia-xi(彭家喜), WANG Shu-dong(王树东). Kinetic study on catalytic oxidation of formaldehyde at low temperature(甲醛低温催化氧化动力学研究)[J]. Journal of Fuel Chemistry and Technology(燃料化学学报) , 2006, 34(2): 252-256. |
| [12] | Chuang K T, Zhou B, Tong S M. Kinetics and mechanism of catalytic oxidation of formaldehyde over hydrophobic catalysts[J]. Industrial & Engineering Chemistry Research , 1994, 33(7): 1680-1686. |
| [13] | WANG Yun(王赟), LIAO Wei-ping(廖卫平), SUO Zhang-huai(索掌怀). Methanol electrocatalytic oxidation performance of carbon black-supported Pt-Fe bimetallic catalyst(炭黑负载Pt-Fe双金属催化剂对甲醇的电催化氧化性能)[J]. Journal of Molecular Catalysis(Journal of Molecular Catalysis) , 2013, 27(4): 356-361. |
| [14] | LIU Wei-feng(刘卫锋), HU Jun(胡军), YI Bao-lian(衣宝廉), et al. Fabrication and evaluation of the Pt/C catalyst for the anode of the PEMFC(Pt/C催化剂的制备与评价)[J]. Chinese Journal of Power Sources(电源技术) , 2005, 29(7): 431-433. |
| [15] | MA Ning(马宁). Choosing of Pt/C catalyst preparation method(Pt/C催化剂制备方法的选择)[J]. Chemical Engineer(化学工程师) , 2006, 132(9): 20-22. |
| [16] | Ministry of Environmental Protection of the People's Republic of China (中华人民共和国环境保护部). Water quality-Determination of formaldehyde-Acetyl acetone spectrophotometric method (水质甲醛的测定乙酰丙酮分光光度法): HJ601-2011[S]. Beijing (北京): China Environmental Press (中国环境科学出版社), 2011. |
| [17] | Standarization Adminstration of the People's Republic of China (中国国家标准化管理委员会). Formaldehyde solution for industrial use (工业用甲醛溶液): GB/T9009-2011[S]. Beijing (北京): China Standards Press (中国标准出版社), 2011. |
| [18] | Zhang C B, He H, Tanaka K. Perfect catalytic oxidation of formaldehyde over a Pt/TiO2 catalyst at room temperature[J]. Catalysis Communications , 2005, 6(3): 211-214. DOI:10.1016/j.catcom.2004.12.012. |
| [19] | Chen B B, Shi C, Crocker M, et al. Catalytic removal of formaldehyde at room temperature over supported gold catalysts[J]. Applied Catalysis B:Environmental , 2013, 132: 245-255. |
| [20] | Yu X H, He J H, Wang D H, et al. Facile controlled synthesis of Pt/MnO2 nanostructured catalysts and their catalytic performance for oxidative decomposition of formaldehyde[J]. The Journal of Physical Chemistry , 2012, 116(1): 851-860. |
| [21] | ZHU Shun(朱舜), YAO Yu-yuan(姚玉元), LIN Qi-song(林启松), et al. Degradation of formaldehyde by mesoporous carbon supported Pt(介孔碳负载铂催化剂的制备及降解甲醛的研究)[J]. Journal of Functional Materials(功能材料) , 2013, 21(44): 3190-3194. |
| [22] | XIANG Juan(向娟), WU Bing-liang(吴秉亮), CHEN Sheng-li(陈胜利). An EQCM investigation of the mechanism of surface electro-oxidation of formic acid on Pt-electrode(甲酸在铂电极上吸附氧化机理研究)[J]. Acta Physico-Chemica Sinica(物理化学学报) , 2000, 16(10): 906-911. DOI:10.3866/PKU.WHXB20001008. |
| [23] | Battino R. IUPAC solubility data series 7[M].London: Pergamon Press, 1981. |
| [24] | Christoskova S T, Stoyanova M. Catalytic degradation of CH2O and C6H5CH2OH in wastewaters[J]. Water Research , 2002, 36(9): 2297-2303. |




