2. 浙江工商大学 环境科学与工程学院,浙江 杭州 310018;
3. 浙江工商大学 应用化学系,浙江 杭州 310018
2. Department of Environmental Science and Engineering, Zhejiang Gongshang University, Hangzhou 310018, China;
3. Department of Applied Chemistry, Zhejiang Gongshang University, Hangzhou 310018, China
铬是最常见的污染重金属之一[1],其化合物在工业领域[2]的大量使用导致其在水土环境中的污染问题日益严重。尤其是在电镀领域中,电镀前镀件清洗废液、镀铬槽的报废液以及逆流漂洗废液均含有Cr(Ⅲ)和Cr(Ⅵ),需要处理后才能排放[3]。铬具有潜在的致突变性和致癌性[4],铬离子进入生物体,会在细胞中累积和富集,从而影响细胞的生物活性。铬元素在自然环境中通常是以三价与六价两种价态存在,会互相转化,且后者对人体毒性更大[5]。因只有Cr(Ⅵ)可通过细胞膜上的阴离子进入细胞,并在细胞内还原为Cr(Ⅲ),该过程中所产生的中间产物Cr(Ⅵ)、Cr(Ⅴ)、活性氧等是引起细胞毒效应及癌变的关键因素[6]。因此,寻找有效的方法去除工业废水中六价铬离子对于控制污染源头与环境保护尤显重要。
近年来,国内外常用分离富集废水中铬的方法有化学还原法、电解还原法、化学沉淀法以及吸附法等[7, 8],尤其是吸附法,凭借其能耗低,用途广,操作简便等优势获得广泛关注[9]。树脂是一种常见的吸附剂,具有交换容量大、速度快,机械强度高,化学稳定性好,二次污染少等优点。经预处理后的D296离子交换树脂是一种较为理想的吸附剂[10],其特有的功能基团季胺[-N(CH3)3]提供-OH与铬离子进行交换,达到吸附去除的效果。较之前选用的D301G树脂[11]对Cr(Ⅵ)拥有更强的吸附量(>300 mg·g-1)、良好的再生性(>94 %),更适于富集、去除废水中六价铬离子。
本文就D296离子交换树脂在醋酸-醋酸钠缓冲溶液中对铬离子的吸附行为进行了系统性研究,并进一步优化了吸附条件,为该树脂在环保领域的推广应用提供了理论依据。
2 实验部分 2.1 实验仪器Cr(Ⅵ)离子浓度测定:Shimadzu UV-2550紫外-可见分光光度计;pH测定:Mettler toledo delta 320 pH计;恒温振荡:DSHZ-300A型水浴恒温振荡器;热重分析:TGA/DSC1 STAR;傅立叶红外光谱:NICOLET-380;实验用水:Molresearch分析型超纯水净化器。
2.2 实验试剂D296强碱性阴离子交换树脂由天津南开大学提供,pH = 2.5~5.0缓冲溶液由醋酸与醋酸钠溶液制备。Cr(Ⅵ)溶液由K2CrO4溶解并稀释定容,实验中使用的其余试剂皆为分析纯。
2.3 树脂预处理甲醇:水= 1:3的溶液浸泡树脂8 h,水洗至中性;用2 mol·L-1的HCl溶液浸泡4 h,水洗至中性;用2 mol·L-1的NaOH溶液浸泡4 h,水洗至中性。以上操作重复两次,蒸馏水清洗树脂,烘干至恒重。
2.4 吸附实验一定量的预处理后D296树脂加入锥形瓶中,加入预设pH缓冲液溶胀24 h后加入一定量的CrO42-离子溶液,恒温振荡吸附至平衡后取上清液进行检测[12]。
2.5 洗脱实验在吸附达到平衡后,将吸附后的树脂过滤并用缓冲液洗涤3次,加入30 mL 5% NaOH-5% NaCl溶液,恒温振荡24 h后测定上清液中的铬离子浓度计算解吸率。
2.6 分析方法吸附、解吸前后溶液中铬离子含量的变化由紫外-可见分光光度计测定,具体计算公式如下:
| $Q = \frac{{{C_{\text{o}}} - C{}_{\text{e}}}}{W}V$ |
式中:C0与Ce代表初始浓度与吸附平衡后浓度(mg·mL-1);Q 代表饱和吸附量(mg·g-1);V代表溶液体积(mL);W 代表吸附剂重量(g)。
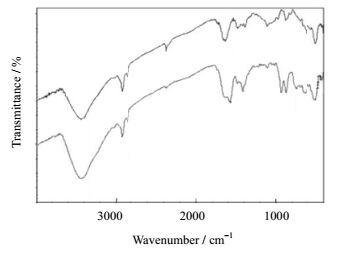
3 结果与分析 3.1 树脂红外表征吸附前后的红外图谱是该吸附过程为化学吸附的直接证据[13]。图.1描述了D296树脂吸附前后的红外光谱变化。该树脂的骨架为苯乙烯,特征功能基为[-N(CH3)3]。在2924.37 cm−1处的伸缩振动是-CH3的存在证据,1600~1400 cm−1的峰群表明存在苯环,而1108.58 cm−1处的伸缩振动说明碳氮单键(C-N)的存在。在吸附后,1108.58 cm−1处的碳氮单键伸缩振动减弱,且945.78和869.88 cm−1出现的新吸收峰,显示CrO42-与-OH进行了离子交换,Cr(Ⅵ)被吸附于树脂表面。
|
图 1 D296树脂吸附Cr(Ⅵ)前后红外光谱 Fig.1 FTIR spectra of the D296 resin before and after adsorption |
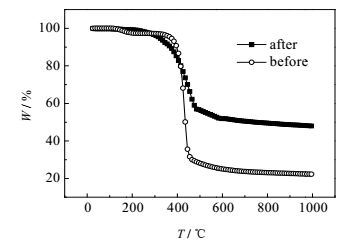
通过热重分析对D296树脂的结构与热稳定性进行了探讨,并研究了其吸附Cr(Ⅵ)后树脂的热稳定性及变化,结果如图 2所示。吸附前D296树脂在加热条件下的失重分为2个阶段,25℃升温至395℃阶段内失重率9.3%,推测为树脂表面季胺基的分解,405℃升温至495℃阶段内失重率71.2%,推测为树脂的苯乙烯骨架结构断裂,485℃后重量缓慢下降是由于树脂的致密球形结构对内部的骨架起了保护的作用。吸附后D296树脂与吸附前的热稳定性相似,而吸附后自255℃始开始缓慢失重,推测其原因为加热条件下吸附于树脂表面的铬酸分解;残渣重量高于吸附前推测为铬单质残留。该实验验证了该树脂的吸附能力[14, 15]。
|
图 2 D296树脂吸附Cr(Ⅵ)前后热重图 Fig.2 TGA o of the D296 resin before and after adsorption |
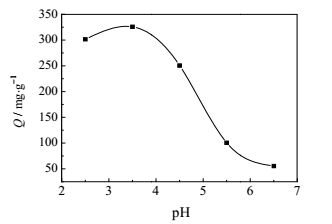
吸附体系的pH是吸附过程的一个关键控制因素[16],图 3显示了不同pH值下D296树脂对Cr(Ⅵ)的吸附量变化,在pH = 3.5时吸附容量最大,实际静态饱和吸附量达到325.8 mg·g-1,随着pH值的升高急剧减少,因此本实验条件下树脂的最佳吸附pH = 3.5。
|
图 3 pH变化对D296树脂吸附量的影响 Fig.3 Effects of pH on Cr(Ⅵ) adsorption capacity of D296 |
吸附等温线是用来显示在给定温度下溶液中的吸附质浓度与吸附剂饱和吸附量之间关系的曲线17,筛选最佳吸附材料的根据。
Langmuir等温方程表达式为:
| $\frac{{{C_{\text{e}}}}}{{{Q_{\text{e}}}}} = \frac{1}{{{Q_{\text{o}}}{K_{\text{L}}}}} + \frac{{{C_{\text{e}}}}}{{{Q_{\text{o}}}}}$ |
式中Ce代表吸附平衡Cr(Ⅵ)浓度(mg·mL-1);Qe与Qo代表平衡吸附量与理论吸附量(mg·g-1);KL为方程常数(mL·mg-1)。
以Ce/Qe对Ce作图得到直线,由此可计算出Qo和KL。
Freundilich等温方程是通过多年的经验整理得到的公式,其表达式为:
| $\lg {Q_{\text{e}}} = \frac{1}{n}\lg {C_{\text{e}}} + \lg {K_{\text{F}}}$ |
式中Ce代表吸附平衡Cr(Ⅵ)浓度(mg·mL-1);Qe代表平衡吸附量(mg·g-1);KF和n是等温方程常数。使用lgCe和lgQe作图,从直线中的截距和斜率可得到Freundlich常数KF和n,其中KF即理论饱和吸附量(mg·g-1),n是吸附推动力的大小的参数,较大的n值显示了良好的吸附能力[18]。本次试验涉及的Langmuir和Freundlich参数如表 1所示,对比表 1中两种等温模型的拟合相关系数(R12与R22)可知,在本实验的条件下,吸附行为更加符合Frundlich等温吸附模型[19]。
| 表 1 D296树脂吸附Cr(Ⅵ)的等温吸附参数 Table 1 Isotherm fitting constants of Cr(Ⅵ) adsorption by D296 |
热力学研究的目的是探讨吸附过程所能达到的程度,焓变和熵变是最普遍地判断吸附反应在自然条件下是否能自发进行的参考。由下式计算。
| $\begin{gathered} \ln K = - \frac{{\Delta H}}{{RT}} + \frac{{\Delta S}}{R} \hfill \\ \Delta G = \Delta H - T\Delta S \hfill \\ \end{gathered} $ |
式中ΔH、ΔS、ΔG 分别是焓变(kJ·mol-1)、熵变(kJ·(mol·K)-1)、自由能变(kJ·mol-1);K 是分配系数;T 是温度(K);气体摩尔常数R = 8.3145 J·(mol·K)-1。
表 2显示了D296树脂吸附Cr(Ⅵ)过程中的热力学参数,由该表可知,吸附过程中焓变值ΔH为正值,说明吸附为吸热过程[20],间接解释了饱和吸附量与吸附温度一同上升的现象。吸附过程中的ΔG都为负值,说明在实验温度区域(288~318 K)该吸附过程自发进行。而离子交换所引起的表面离子移动是ΔS小幅度上升的原因[21]。
| 表 2 D296树脂吸附Cr(Ⅵ)的热力学参数 Table 2 Thermodynamic parameters of Cr(Ⅵ) adsorption by D296 |
重复使用性能是评价一种吸附剂吸附性能的重要性能指标。本实验中使用5% NaOH-5% NaCl、5% NaCl-5% HCl、5% Na2SO4-5% H2SO4、5%NH3·H2O-5%NH4Cl溶液为解吸剂,通过研究不同解吸剂对洗脱率的影响,结果显示以5%NaOH-5%NaCl溶液为解吸剂时,解吸率达到94.7%,表明D296树脂有出色的洗脱能力与良好的再生性能。
3.7 动态吸附及动态解吸研究准确称取D296树脂150.0 mg,用pH为3.5的醋酸-醋酸钠缓冲溶液室温浸泡24 h后装柱,设定铬金属离子初始浓度为0.2 mg·mL-1(pH为3.5的醋酸-醋酸钠缓冲溶液),流速为0.3 mL·min-1,取每25 mL流出液测得其吸光度,直至Ce= Co。以Ce/Co对流出液体积作出动态吸附曲线并计算吸附量,动态吸附量根据下式计算:
| $Q = \sum ({C_{\text{o}}} - {C_{\text{e}}}) \cdot V$ |
上式中Co代表上柱液浓度(mg·mL-1);Ce代表流出液浓度(mg·mL-1);V代表流出液体积(mL)。
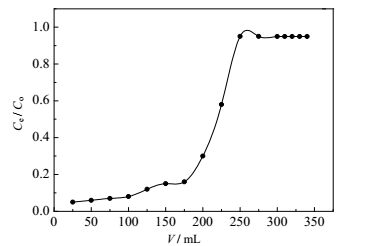
在225 mL之前,Ce= 0,说明这一阶段树脂没有吸附饱和,铬离子完全被吸附。在200 mL到250 mL段,流出液的浓度急剧上升。并在250 mL后达到饱和。通过曲线计算得出其动态饱和吸附量为295 mg·g-1。
托马斯(Thomas)模型是动态分析中最成熟且常用的理论模型,该模型通过将动态实验数据对数线性拟合,计算其动态饱和吸附容量Q和表观吸附速率常数值kT,该模型的公式为
| $\ln (\frac{{{C_{\text{o}}}}}{{{C_{\text{e}}}}} - 1) = \frac{{{k_{\text{T}}}Qm}}{\theta } - \frac{{{k_{\text{T}}}{C_{\text{o}}}}}{\theta }V$ |
式中,C0、Ce是过柱前后溶液浓度(mg·mL-1),V是过柱后溶液体积(mL),kT是常数(L·(min·mg)-1),Q是理论动态吸附容量(mg·g-1),m是吸附剂的干重(g)。
计算得理论吸附值为267.3 mg·mL-1,拟合曲线相关系数R2为0.8944。理论值与实验数据接近,从动态吸附效率及柱利用率两方面考虑,实验条件(初始浓度0.2 mg·mL-1,流速0.3 mL·min-1)下动态吸附能迅速达到平衡。
使用5% NaOH-5% NaCl溶液作为洗脱液,对已吸附平衡的吸附柱进行洗脱实验,流速为0.3 mL·min-1,取每10 mL流出液测量得吸光度。从图 5可知完全洗脱铬离子所需洗脱液体积V = 30 mL。
|
图 4 D296树脂动态吸附Cr(Ⅵ)曲线 Fig.4 Dynamic adsorption curve of Cr(Ⅵ) adsorption by D296 |

|
图 5 D296树脂吸附Cr(Ⅵ)动态洗脱曲线 Fig.5 Dynamic elution curve of Cr(Ⅵ) elution from D296 |
本实验结果显示,在HAc-NaAc缓冲液体系中D296强碱性阴离子交换树脂吸附铬Cr(Ⅵ)的最佳条件为pH = 3.5,T = 308 K。理论静态饱和吸附容量达到了325.8 mg·g-1,该条件下吸附速率常数k308 K= 2.05·10-5s-1,吸附符合Frundlich模型。用5% NaOH-5% NaCl溶液进行解吸,洗脱率为94.7%。综上所述,该树脂吸附容量大,再生性能优,去除、富集水溶液中Cr(Ⅵ)的能力突出,有望应用于环保领域防治铬污染。
符号说明:
| C0 | -初始浓度,mg·mL-1 | n | -Freundlich传质常数 |
| Ce | -平衡后浓度,mg·mL-1 | Q | -饱和吸附量,mg·g-1 |
| Ea | -表观吸附活化能,kJ·moL-1 | R | -气体摩尔常数,J·mol-1·K-1 |
| KL | -Langmuir方程常数,mL·mg-1 | ΔG | -标准吉布斯自由能变化,kJ·mol-1 |
| KF | -Freundlich常数,mg·mL-1 | ΔH | -标准焓变,kJ·mol-1 |
| kT | -表观吸附数率常数,L·(min·mg)-1 | ΔS | -标准熵变,kJ·mol-1·K-1 |
| [1] | Singh S, Kumar M. Heavy metal load of soil, water and vegetables in peri-urban Delhi[J]. Environmental Monitoring and Assessment, 2006, 120(1-3): 79-91.DOI:10.1007/s10661-005-9050-3. |
| [2] | Hanif A, Bhatti H N, Hanif M A. Removal and recovery of Cu(Ⅱ) and Zn(Ⅱ) using immobilized Mentha arvensis distillation waste biomass[J]. Ecological Engineering, 2009, 35(10): 1427-1434.DOI:10.1016/j.ecoleng.2009.05.013. |
| [3] | LIU Cun-hai(刘存海), WANG Ting-ping(王廷平), LIAO Quan-yi(廖全义). Recover of chromium in plating wastewater and application in chrome tanning(镀铬废水中铬的回收及铬鞣中的应用)[J]. Electroplating & Finishing(电镀与涂饰), 2007, 26(4): 52-54. |
| [4] | ZHU Jian-hua(朱建华). The toxicity of different valence chromium and effect on human body(不同价态铬的毒性及其对人体影响)[J]. Environment and Development(环境与开发), 1997, 12(3): 34-37. |
| [5] | HUANG Shui-e(黄水娥). Research progress on treatment of chrome wastewater from tannery(皮革工业中铬污染治理的研究进展)[J]. West Laether(西部皮革), 2011, 33(14): 47-50.DOI:10.3969/j.issn.1671-1602.2011.14.015. |
| [6] | ZHANG Ji(张济), LI Gui-rong(李桂荣), LIU Lan-zhen(刘岚铮), et al. Chromium content in erythrocytes serving as the exposure biomarker for workers exposed to soluble chromate(红细胞中铬含量作为铬盐接触者生物标志物的研究)[J]. Chinese Journal of Preventive Medicine(中华预防医学杂志), 2006, 40(6): 390-394. |
| [7] | Shvoeva O, Dedkova V, Savvin S. Adsorption-spectroscopic method for multielement analysis: determination of Cr, V, Cr, and Cu(Ⅱ) from one sample using a two-layer adsorbent[J]. Journal of Analytical Chemistry, 2010, 65(7): 669-703. |
| [8] | Ji M, Su X, Zhao Y X, et al. Effective adsorption of Cr(Ⅵ) on mesoporous Fe-functionalized Akadama clay: optimization, selectivity, and mechanism[J]. Applied Surface Science, 2015, 344: 128-136.DOI:10.1016/j.apsusc.2015.03.006. |
| [9] | Hu B, Liu W X, Gao W W, et al. Pseudo-Janus Zn/Al-based nanocomposites for Cr(Ⅵ) sorption/remediation and evolved photocatalytic functionality[J]. Chemical Engineering Journal, 2015, 277: 150-158.DOI:10.1016/j.cej.2015.04.104. |
| [10] | Xiong C H, Jia Q, Chen X Y, et al. Optimization of polyacrylonitrile-2-aminothiazole resin synthesis, characterization, and its adsorption performance and mechanism for removal of Hg(Ⅱ)from aqueous solutions[J]. Industrial & Engineering Chemistry Research, 2013, 52(14): 4978-4986. |
| [11] | Liu X Z, Xiong C H, Yao C P, et al. Sorption of Cr(Ⅵ) from aqueous solution with D301G resin[J]. Nonferrous Metals, 2008, 60(4): 67-72. |
| [12] | Xiong C H, Zhou S G, Liu X Z, et al. 2-Aminothiazole functionalized polystyrene for selective removal of Au(Ⅲ) in aqueous solutions[J]. Industrial & Engineering Chemistry Research, 2014, 53(6): 2441-2448. |
| [13] | Wu X L, Zhao D, Yang S T. Impact of solution chemistry conditions on the sorption behavior of Cu(Ⅱ) on Lin'an montmorillonite[J]. Desalination, 2011, 269(1-3): 84-91.DOI:10.1016/j.desal.2010.10.046. |
| [14] | Chen M L, Myog-Il A. Selenium adsorption and speciation with Mg-FeCO3 layered double hydroxides loaded cellulose fibre[J]. Talanta, 2012, 95: 31-35.DOI:10.1016/j.talanta.2012.03.038. |
| [15] | Mohamad R I, Zulkiflle L, Mohd S S, et al. IFSS, TG, FT-IR spectra of impregnated sugar palm (Arenga pinnata) fibres and mechanical properties of their composites[J]. Journal of Thermal Analysis and Calorimetry, 2013, 111(2): 1375-1383.DOI:10.1007/s10973-012-2457-5. |
| [16] | Oeztuerk N, Kavak K. Adsorption of boron from aqueous solutions using fly ash: batch and column studies[J]. Journal of Hazardous Materials, 2005, 127(1): 81-88. |
| [17] | Gode F, Pehlivan E. Removal of chromium(Ⅲ) from aqueous solutions using Lewatit S 100: the effect of pH, time, metal concentration and temperature[J]. Journal of Hazardous Materials, 2006, 136(2): 330-337.DOI:10.1016/j.jhazmat.2005.12.021. |
| [18] | Xiong C H, Zhu S, Yao C P, et al. Adsorption behavior of Pd(Ⅱ) from aqueous solutions by D201 resin[J]. Rare Metals, 2011, 30(5): 470-476.DOI:10.1007/s12598-011-0415-1. |
| [19] | BAI Yang(白杨), TANG Shao-kun(唐韶坤), XIE Chen-zhong(谢承中). Adsorption properties of camellia oleifera abel polyphenols on mix macroporous resin(大孔树脂复配纯化油茶多酚的吸附特性研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2014, 28(6): 1399-1404. |
| [20] | Brykina G D, Marchak T V, Krysina L S. Ion sorption of copper and nickel by AV-17X8 anion-exchager, modified with 1-(2-thiazolylazo)-2-naphthol-3, 6-disulfonic acid disodium salt[J]. Zhurnal Fizicheskoi Khimii, 1980, 54(8): 2094-2097. |
| [21] | Boyd G E, Adamson A W, Myers L S. The exchange adsorption of ions from aqueous solutions by organic zeolites; kinetics[J]. Journal of the American Chemical Society, 1947, 69(11): 2836.DOI:10.1021/ja01203a066. |




