2. 浙江大学 化学工程与生物工程学院,浙江 杭州 310027
2. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
苯乳酸是一种典型的高值有机酸,能抑制革兰氏阴性菌、阳性菌和部分真菌的生长,具有良好的抗菌性,也是合成新型高分子材料聚苯乳酸的单体,还可以作为合成新药的中间体,在化工、食品、材料、医药等领域具有重要用途[1-4]。由于化学法合成苯乳酸路径复杂,存在较为严重的环境污染问题,目前尚不能大规模生产,而生物法合成苯乳酸条件温和,工艺路线简单,是近几年国内外重点关注的研究方向[5-6]。但是,微生物发酵合成苯乳酸存在成本高、高产菌株缺乏、工业化困难等难题。酶法合成苯乳酸虽合成效率高于野生菌株,但其制备过程成本高,步骤复杂,稳定性和安全性仍有待考究[7-8]。固定化全细胞生物催化剂将为解决上述问题提供新的发展方向,它将游离的微生物细胞通过化学或物理的方法截留在一定的有限的空间内,既可以保持微生物细胞原有的催化活性,又可以改善活性流失,具有易于分离、减轻底物抑制和提高稳定性等优点[9-14]。
晶胶介质是近年来出现的一种新型生物分离介质,内有尺寸数十到数百微米的超大孔隙并相互连通,在水中有良好的连通性和弹性,可以允许含有微生物细胞或细胞碎片的复杂料液通过,在生化分离领域具有广阔的应用前景[15-18]。其中聚甲基丙烯酸羟乙酯(poly(2-hydroxyethyl methacrylate),pHEMA)晶胶具有生物相容性好、机械强度高、制备成本低等优点。SAVINA等[19]提出pHEMA晶胶以其优秀的力学性能,可以用作细胞培养支架载体;NIMET等[20]将干细胞包埋于HEMA复合葡聚糖晶胶,用于修复骨损伤;EFREMENKO等[14]利用聚乙烯醇晶胶复合用于酿酒酵母细胞长时间储存。但是,将pHEMA晶胶用作制备生物催化剂合成苯乳酸,尚未见报道。
本文通过结晶致孔法制备pHEMA晶胶,然后在其骨架上接枝带有胺基阴离子的甲基丙烯酸二甲氨基乙酯(2-(dimethylamino)ethyl methacrylate,DMAEMA)得到阴离子交换晶胶,将该晶胶与微生物表面的负电基团通过静电力吸附结合,制得复合生物催化剂,并考察了所得复合生物催化剂合成苯乳酸的能力。
2 材料和方法 2.1 材料 2.1.1 试剂L-苯乳酸(phenyllactic acid,PLA)、甲基丙烯酸羟乙酯(2-hydroxyethyl methacrylate,HEMA)、聚乙二醇二丙烯酸酯(poly(ethylene glycol) diacrylate,PEGDA)、四甲基乙二胺(N, N, N, N’– tetramethylethylenediamine,TEMED)、甲醇及牛血清白蛋白(Bovine albumin serum,BSA)购于Sigma公司;三氟乙酸、DMAEMA购于阿拉丁试剂;葡萄糖、蛋白胨、牛肉膏、酵母膏、柠檬酸氢二铵及无水乙酸钠购于生工生物工程有限公司;硫酸镁、硫酸锰、磷酸氢二钾、吐温80及盐酸购于华东医药股份有限公司;其他试剂均为国产分析纯。
2.1.2 仪器Agilent 1260 infinity高效液相色谱系统(Agilent,美国);CR21N高速冷冻离心机(Hitachi Koki,日本);Milli-Q Synthesis超纯水机(Millipore,美国);SPX-150B-Z生化培养箱(上海博迅实业有限公司医疗设备厂);HZ-2411KB叠式中型恒温摇床(太仓市华利达实验设备有限公司);HS-1300-U超净工作台(苏州安泰空气技术有限公司);DW-HL290超低温冷冻储存箱(中科美菱);LDZX-50KBS立式压力蒸汽灭菌器(上海申安医疗器械厂);THD-3030低温恒温槽,宁波天恒仪器厂。
2.1.3 菌种和培养基副干酪乳杆菌L. paracasei 16C3菌株分离自泡菜,本课题组保藏。
肉汤培养基(MRS培养基):葡萄糖20 mg·mL-1,蛋白胨10 mg·mL-1,酵母膏5 mg·mL-1,牛肉膏10 mg·mL-1,柠檬酸二胺2 mg·mL-1,无水乙酸钠5 mg·mL-1,硫酸锰0.25 mg·mL-1,硫酸镁0.58 mg·mL-1,磷酸氢二钾2 mg·mL-1,吐温801 mL·L-1。
2.2 实验方法 2.2.1 阴离子交换晶胶制备实验使用的阴离子交换晶胶pHEMA-DMAEMA,采用课题组建立的结晶致孔、聚合反应和接枝修饰方法进行制备[16-17]。在直径4~6 mm,高为10 mm的玻璃管中通过低温冷冻结晶致孔制备得到晶胶基质,按3~5 mm的厚度切片,然后用浓度为0.5 mol·L-1的DMAEMA单体进行接枝而得。
2.2.2 阴离子交换晶胶基础性能测试[21]阴离子交换晶胶的孔隙率采用称重法测定;吸附容量通过考察晶胶介质对模型蛋白BSA的吸附进行评价:用磷酸盐缓冲液(0.02 mol·L-1,pH 7.2)在不同流速(1、2和3 cm·min-1)下进行吸附层析,测定阴离子交换晶胶介质的吸附容量,蛋白浓度的测量采用考马斯亮蓝法;晶胶介质内部结构通过扫描电镜表征:将晶胶在不同体积浓度(10%~100%)的乙醇溶液中进行梯度脱水、冷冻干燥,然后用离子溅射仪进行喷金处理,最后用扫描电镜观察并拍摄照片。
2.2.3 复合生物催化剂的制备与微观结构表征将甘油保藏的副干酪乳杆菌菌株经活化一次,按6%接种量接种于肉汤培养基中,35 ℃静置培养8 h,再将干燥后的pHEMA阴离子交换晶胶投入发酵液,于35 ℃继续静置培养16 h,沥干晶胶表面水分,得到pHEMA种子晶胶。最后,将pHEMA种子晶胶投入肉汤培养基中,继续35 ℃静置培养48 h,沥干晶胶表面水分,得到复合生物催化剂。其内部结构通过扫描电镜进行表征,过程与上述晶胶介质相同。
2.2.4 复合生物催化剂发酵合成苯乳酸将pHEMA种子晶胶于30 mL培养基中发酵培养,以传统发酵方式为对照实验,每隔12 h(12、24、36、48、60、72和84 h)取样,考察不同时间点发酵液中苯乳酸浓度。
2.2.5 复合生物催化剂转化合成苯乳酸复合生物催化剂和无晶胶的全细胞催化剂经透性化处理后,以5 mL 0.1 mol·L-1的PB 8.0缓冲溶液为底物溶液,葡萄糖浓度为2 mg·mL-1,调节苯丙氨酸浓度分别为0.5、1、2和3 mg·mL-1,摇床转速为75 r·min-1,摇床控温35 ℃,转化48 h,考察2种生物催化剂生物转化能力,其中复合生物催化剂的用量按其固载细胞的量为100 mg·mL-1计算,无晶胶的全细胞催化剂用量也为100 mg·mL-1。
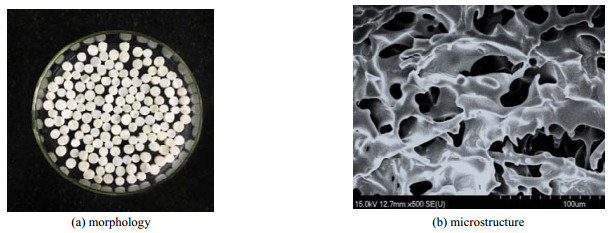
3 结果与讨论 3.1 阴离子交换晶胶的形态结构分析图 1是阴离子交换晶胶切片的形貌特征和内部微观结构扫描电镜图像。从图中可见,pHEMA-DMAEMA阴离子交换晶胶内部具有相互连通的超大孔隙,其孔径范围为10~200 μm,介质壁面光滑。孔隙率反映了晶胶介质内流体流动空间的相对大小,以水为测试流体,测得该晶胶的有效孔隙率为75.1%,绝干孔隙率为82.7%,说明该晶胶介质孔隙空间大,相互连通形成了网络结构,适用于微生物细胞的生长,有利于底物和代谢产物的交换和传质。
|
图 1 阴离子交换pHEMA晶胶的形貌与微观结构 Fig.1 Morphology and microstructure of the anion exchange pHEMA cryogels |
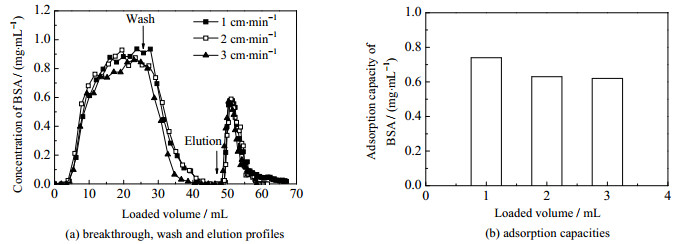
文献中常以BSA为模型蛋白,来间接评价阴离子交换晶胶介质吸附容量和吸附性能[15-18]。因此,以BSA为模型蛋白质,在不同流速条件下对pHEMA-DMAEMA晶胶介质的吸附性能进行了研究。用磷酸盐缓冲液(0.02 mol·L-1,pH 7.2)平衡床柱,上样蛋白浓度1 mg·mL-1,洗脱液为1 mol·L-1 NaCl (相同磷酸盐缓冲液配置)。不同流速下BSA的吸附曲线和吸附容量如图 2所示。可见,不同流速下的BSA层析曲线无明显差异,同时洗脱峰对称性较好。通常,用于生物分离的pHEMA阴离子交换晶胶的吸附容量较大,例如DONG等[16]制备的pHEMA-DMAEMA晶胶,其在1、2和3 cm·min-1流速条件下对BSA的吸附容量分别为4.04、3.71和3.69 mg·mL-1。因此,通过控制接枝条件,适当降低吸附容量,以便适度吸附细胞,形成复合生物催化剂,结果见图 2(b)。可见,在流速1、2和3 cm·min-1流速下,pHEMA-DMAEMA晶胶介质对BSA的吸附容量分别为0.75、0.63和0.62 mg·mL-1,说明pHEMA晶胶具有一定数量的阴离子交换基团,适于后续吸附细胞,适合用于制备复合生物催化剂。
|
图 2 不同流速下晶胶对BSA的吸附层析性能与吸附容量 Fig.2 Chromatographic behaviors and BSA absorption capacities of the pHEMA-DMAEMA cryogel at various flow rates |
复合生物催化剂内部结构如图 3所示。由图中可以看出,大量杆状的副干酪乳杆菌在晶胶孔隙内沉积,并成堆生长,与晶胶孔隙内壁紧密结合。基于晶胶介质较大的比表面积和较多的吸附位点,形成了高浓度生物催化剂。

|
图 3 晶胶复合生物催化剂内部结构电镜照片 Fig.3 SEM micrographs of the cell-immobilized cryogel biocatalysts |
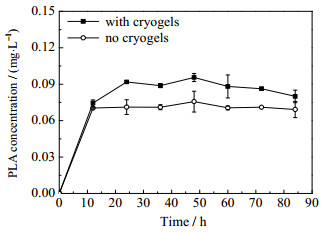
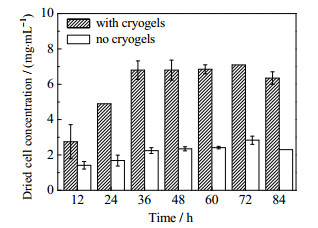
通过高效液相色谱分析发酵上清液中的苯乳酸含量,浓度变化如图 4所示。从图中可以看出,发酵开始后12 h内,代谢苯乳酸浓度快速上升后逐渐趋平,到24 h时,复合生物催化剂代谢的苯乳酸含量明显高于传统发酵下的细胞代谢,由0.71 mg·mL-1提升到0.95 mg·mL-1。图 5是复合生物催化剂发酵过程中生物量变化。由图可见,按常规发酵,无晶胶时发酵液中的细胞生物量比较低,但随时间呈稳定上升趋势;发酵36 h后,生物量趋于平衡,细胞干重最高为2.83 mg·mL-1。而副干酪乳杆菌在pHEMA-DMAEMA阴离子交换载体中生长的速度迅速上升,经过72 h发酵,细胞干重达到最高,为7.10 mg·mL-1,细胞浓度是无晶胶常规发酵时的2.5倍。因此,以离子交换晶胶为载体,利用晶胶对副干酪乳杆菌细胞的吸附作用,在发酵过程中可以形成高浓度生物催化剂,通过减轻底物抑制和提高酶系的稳定性,提高了发酵过程的生物量,这与本课题组关于晶胶微球固定化细胞培养实验效果一致[22],进而提高了苯乳酸产量。
|
图 4 晶胶复合生物催化剂发酵与无晶胶发酵时产苯乳酸浓度的对比 Fig.4 Comparison of PLA concentrations with and without cell-immobilized cryogel biocatalysts during fermentation synthesis |
|
图 5 晶胶复合生物催化剂发酵与无晶胶发酵过程中细胞干重随时间变化的对比 Fig.5 Comparison of dried cell concentrations with and without cell-immobilized cryogel biocatalysts during fermentation synthesis |
以苯丙氨酸为底物,利用复合生物催化剂进行生物转化,在不同底物浓度下合成苯乳酸,如图 6所示。从图中可见,当底物浓度为0.5 mg·mL-1时,复合生物催化剂转化生成的苯乳酸的产量明显大于全细胞催化下的产量,苯乳酸浓度最高为0.15 mg·mL-1,苯丙氨酸转化率达30%,约为全细胞催化剂苯乳酸产量的3倍;当底物浓度为1 mg·mL-1时,复合生物催化剂的转化能力仍然大于全细胞催化剂,苯乳酸浓度最高为0.23 mg·mL-1,转化率可达20%,约为全细胞催化剂下苯丙氨酸转化率的2.5倍;当底物浓度为2 mg·mL-1时,苯乳酸浓度最高为0.23 mg·mL-1,苯丙氨酸转化率可达10%,约为全细胞催化剂苯丙氨酸转化率1.5倍;当底物浓度为3 mg·mL-1时,苯乳酸浓度最高为0.41 mg·mL-1,苯丙氨酸转化率仍为10%与全细胞催化剂转化能力相当。由此可以推断,细胞表面带负荷,晶胶骨架吸附位点通过离子交换作用将细胞固定在孔隙内表面,在一定程度上提高了细胞内酶系的稳定性,从而提高了细胞对PHE底物和苯乳酸产物抑制的耐受性;同时,复合生物催化剂内发达的孔隙有利于底物充分向细胞表面扩散[22];当底物浓度越低时,单位体积晶胶内细胞生物量充足,大部分苯丙氨酸有较高的概率扩散到达细胞表面和内部,在酶的催化下进行转化合成苯乳酸,转化率高;随底物浓度的增大,晶胶内细胞生物量不足以为所有的苯丙氨酸底物分子提供反应机会,一部分苯丙氨酸分子将不能到达酶位点,底物利用率低,从而转化率下降,但合成的苯乳酸产物浓度仍然提高。
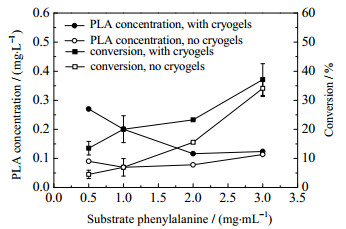
|
图 6 不同底物浓度下晶胶复合生物催化剂与使用全细胞催化剂转化合成苯乳酸的对比 Fig.6 Comparison of PLA concentrations and conversion ratios with cell-immobilized cryogel biocatalysts and whole-cell biocatalysts during biotransformation synthesis |
利用阴离子交换功能pHEMA-DMAEMA晶胶对副干酪乳杆菌的吸附作用,在发酵过程中可以形成高菌体浓度复合生物催化剂,能够用于苯乳酸的发酵合成和转化合成。pHEMA-DMAEMA晶胶内部有尺寸10~200 μm量级的超大孔隙,其相互连通且十分发达,有效孔隙率75.1%,绝干孔隙率为82.7%,对BSA蛋白吸附容量为0.75 mg·mL-1,适于吸附固定副干酪乳杆菌,并提供有利于菌体生长。复合生物催化剂发酵的生物量及苯乳酸产量均明显高于常规游离细胞发酵情况,其生物量由常规的2.83 mg·mL-1提高到7.1 mg·mL-1,苯乳酸产量由常规的0.71 mg·mL-1提升到0.95 mg·mL-1。复合生物催化剂转化生成的苯乳酸产量也明显高于常规的全细胞催化剂,当底物苯丙氨酸的浓度为0.5 mg·mL-1时,苯丙氨酸转化率高达30%,是全细胞催化剂的3倍;当底物苯丙氨酸的浓度为1 mg·mL-1时,苯丙氨酸转化率可达20%,是全细胞催化剂的2.5倍;当底物苯丙氨酸的浓度增加至2 mg·mL-1时,苯丙氨酸转化率为10%,是全细胞催化剂的1.5倍。因此,复合型生物催化剂合成苯乳酸的性能明显优于常规全细胞催化剂,且制备过程简单,分离容易,安全性好,易于放大,具有广阔的应用前景。
| [1] |
MU W M, YU S H, ZHU L J, et al. Recent research on 3-phenyllactic acid, a broad-spectrum antimicrobial compound[J]. Applied Microbiology and Biotechnology, 2012, 95(5): 1155-1163. DOI:10.1007/s00253-012-4269-8 |
| [2] |
CORT S-ZAVALETA O, L PEZ-MALO A, HERN NDEZ-MENDOZA A, et al. Antifungal activity of Lactobacilli and its relationship with 3-phenyllactic acid production[J]. International Journal of Food Microbiology, 2014, 173(3): 30-35. |
| [3] |
关今韬, 贠军贤, 关怡新, 等. 生物基聚苯乳酸新材料及其单体制备的研究进展[J]. 高校化学工程学报, 2018, 32(4): 739-747. GUAN J T, YUN J X, GUAN Y X, et al. Recent advances in the preparation of bio-based poly(phenyllactic acid)s and its monomer[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(4): 739-747. DOI:10.3969/j.issn.1003-9015.2018.04.001 |
| [4] |
HICU D N, XIN J, DAISAKU K, et al. Syntheses of high molecular weight poly(L-phenyllactic acid)s by a direct polycondensation in the presence of stable lewis acids[J]. The Chemical Society of Japan, 2011, 40(6): 584-585. |
| [5] |
倪正, 关今韬, 沈绍传, 等. 苯乳酸的微生物合成及分离研究进展[J]. 化工进展, 2016, 35(11): 3627-3633. NI Z, GUAN J T, SHEN S C, et al. An overview of recent advances in microbial synthesis and separation of phenyllactic acid[J]. Chemical Industry and Engineering Progress, 2016, 35(11): 3627-3633. |
| [6] |
朱银龙, 贠军贤, 沈绍传, 等. 透化性干酪乳杆菌细胞转化苯丙酮酸合成苯乳酸[J]. 高校化学工程学报, 2015, 29(2): 495-500. ZHU Y L, YUN J X, SHEN S C, et al. Biotransformation of phenylpyruvic acid into phenyllactic acid with permeabilized Lactobacillus casei cells[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(2): 495-500. |
| [7] |
ZHU Y B, HU F G, ZHU Y Y, et al. Enhancement of phenyllactic acid biosynthesis by recognition site replacement of D-lactate dehydrogenase from Lactobacillus pentosus[J]. Biotechnology Letters, 2015, 37(6): 1233-1241. DOI:10.1007/s10529-015-1778-4 |
| [8] |
ZHU Y B, WANG Y, XU J Y Z, et al. Enantioselective biosynthesis of L-phenyllactic acid by whole cells of recombinant Escherichia coli[J]. Molecules, 2017, 22(11): 1966. DOI:10.3390/molecules22111966 |
| [9] |
张秀霞, 秦丽姣, 黄聪聪, 等. 微生物固定化载体的选择及其性能[J]. 化工进展, 2011, 30(12): 2781-2786. ZHANG X X, QIN L J, HUANG C C, et al. Study on the selection of immobilized carrier and its performance[J]. Chemical Industry and Engineering Progress, 2011, 30(12): 2781-2786. |
| [10] |
KUYUKINA M S, IVSHINA I B, GAVRIN A Y, et al. Immobilization of hydrocarbon-oxidizing bacteria in poly(vinyl alcohol) cryogels hydrophobized using a biosurfactant[J]. Journal of Microbiological Methods, 2006, 65(3): 596-603. DOI:10.1016/j.mimet.2005.10.006 |
| [11] |
MAO Y, KRISCHKE M, HENGST C, et al. Comparison of the influence of pH on the selectivity of free and immobilized trypsin for β-lactoglobulin hydrolysis[J]. Food Chemistry, 2018, 253: 194-202. DOI:10.1016/j.foodchem.2018.01.151 |
| [12] |
MASLOVA O V, SEN'KO O V, STEPANOV N A, et al. Lactic acid production using free cells of bacteria and filamentous fungi and cells immobilized in polyvinyl alcohol cryogel:A comparative analysis of the characteristics of biocatalysts and processes[J]. Catalysis in Industry, 2016, 8(3): 280-285. |
| [13] |
GALAZZO J L, BAILEY J E. Growing saccharomyces cerevisiae in calcium-alginate beads induces cell alterations which accelerate glucose conversion to ethanol[J]. Biotechnology and Bioengineering, 2010, 36(4): 417-426. |
| [14] |
EFREMENKO E N, TATARINOVA N Y. The effect of long-term preservation of bacterial cells immobilized in poly(vinyl alcohol) cryogel on their viability and biosynthesis of target metabolites[J]. Microbiology, 2007, 76(3): 336-341. |
| [15] |
YE J L, YUN J X, LIN D Q, et al. Poly(hydroxyethyl methacrylate)-based composite cryogel with embedded macroporous cellulose beads for the separation of human serum immunoglobulin and albumin[J]. Journal of Separation Science, 2013, 36(24): 3813-3820. DOI:10.1002/jssc.201300911 |
| [16] |
DONG S S, CHEN L, DAI B, et al. Isolation of immunoglobulin G from bovine milk whey by poly(hydroxyethyl methacrylate)-based anion-exchange cryogel[J]. Journal of Separation Science, 2013, 36(15): 2387-2393. DOI:10.1002/jssc.201300306 |
| [17] |
GUAN J T, GUAN Y X, YUN J X, et al. Chromatographic separation of phenyllactic acid from crude broth using cryogel with dual functional groups[J]. Journal of Chromatography A, 2018, 1554: 92-100. DOI:10.1016/j.chroma.2018.04.043 |
| [18] |
PAN M M, SHEN S C, CHEN L, et al. Separation of lactoperoxidase from bovine whey milk by cation exchange composite cryogel embedded macroporous cellulose beads[J]. Separation and Purification Technology, 2015, 147: 132-138. DOI:10.1016/j.seppur.2015.04.026 |
| [19] |
SAVINA I N, CNUDDE V, D'HOLLANDER S, et al. Cryogels from poly(2-hydroxyethyl methacrylate):Macroporous, interconnected materials with potential as cell scaffolds[J]. Soft Matter, 2007, 3(9): 1176-1184. DOI:10.1039/b706654f |
| [20] |
B LGEN N, KORKUSUZ P, VARGEL İ, et al. Stem cell suspension injected HEMA-lactate-dextran cryogels for regeneration of critical sized bone defects[J]. Artificial Cells Nanomedicine and Biotechnology, 2014, 42(1): 70-77. DOI:10.3109/21691401.2013.775578 |
| [21] |
高亚伟, 关今韬, 张颂红, 等. 葡聚糖甲基丙烯酸甲酯水溶液的相变特性及其晶胶微球的制备[J]. 高校化学工程学报, 2018, 32(2): 414-420. GAO Y W, GUAN J T, ZHANG S H, et al. Freezing characteristics of dextran methacrylate aqueous solution and preparation of dextran-methacrylate-based cryogel beads[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 414-420. DOI:10.3969/j.issn.1003-9015.2018.02.021 |
| [22] |
关今韬.布氏乳杆菌转化合成苯乳酸及其晶胶分离特性研究[D].杭州: 浙江大学, 2018. GUAN J T. Biosynthesis of phenyllactic acid by Lactobacillus buchneri and the related separation performance with cryogels[D]. Hangzhou: Zhejiang University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018148104.htm |




