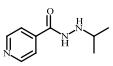
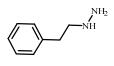
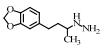
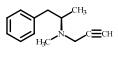
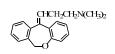
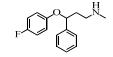
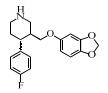
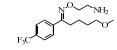
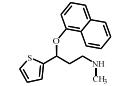
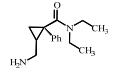
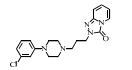
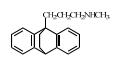
2. 上海大学 射线应用研究所,上海 200444;
3. 上海大学 生命科学学院,上海 200444
2. Institute of Applied Radiation, Shanghai University, Shanghai 200444, China;
3. School of Life Science, Shanghai University, Shanghai 200444, China
随着化学分析检测手段的不断进步,痕量水平的药物活性成分及其副产物被发现广泛存在于污染水体中,成为一类备受关注的新兴有机污染物。药物活性成份及其代谢产物通过病人排泄、直接处置闲置、过期的药物、泄漏等方式持续不断地向环境中释放,在欧洲和北美,据统计每年药物产品以t·y-1以上的排量通过污水处理厂的处理废水释放到地表水中[1]。药物类污染物一般都具有代谢稳定性的特点,因此很难在污水处理过程中通过微生物产生降解,并且其它非针对性的降解方式对其降解效率也不高,使其在到达水生生态系统后仍能保持一定的生物活性[2]。药物设计的初衷是为了治疗疾病和保障人类的健康,但是这些未处理完全的具有高生物活性的药物活性成分排放到河流、湖泊等水环境中,使得水生系统中的生物长期处在药物污染物的低剂量暴露中。抗抑郁药是一类较常见的精神类处方药物。随着现代社会生活压力的加大,失眠、抑郁等精神类疾病的发病率逐年增加,而人类社会的进步和人们对精神健康重视程度的不断增加,使抑郁症这类病症受到越来越多的重视,抗抑郁药的用量逐年增长,而随之引起的环境问题也越来越受到关注[3]。虽然抗抑郁类药物在环境中的浓度较低,但由于其较高的靶向生物活性和难以被水中微生物降解的特性,其药物活性成分在水体中的痕量污染仍然会对水生态系统中的非目标生物和人类健康造成潜在的威胁[4]。因此,系统了解抗抑郁类药物这类新兴有机污染物在水环境中的来源、分布和迁移转化规律及其生态毒性效应,对于今后制定药物类污染物的防控对策以保护水生生态系统是十分必要的。
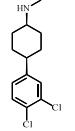
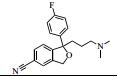
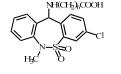
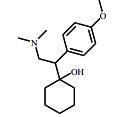
2 抗抑郁药的类型抑郁症在临床上是一种较为多见的精神类疾病。随着生活节奏的加快,人们精神压力逐渐增大,抑郁症的病发率呈逐年上升趋势,世界卫生组织统计抑郁症已成为一种全球性的高发病,目前位居世界10大病种的第5位,全球有超过3.5亿人患有抑郁性疾病。WHO全球疾病负担合作研究预测,到2020年,重度抑郁所导致的功能残疾将仅次于缺血性心脏病,居第2位。在全球范围内,全球精神类用药规模已超过360亿美元,占药品销售总额的5%,抗抑郁与焦虑症药物的销售总额可占中枢类神经药物市场份额的45%,抗抑郁与精神分裂症治疗剂的销售额可占总精神病药物销售总额的80%。已上市或正在研制中的抗抑郁药品种在2011年已达50~60种。已有统计数据显示,目前全球最畅销的8种抗抑郁药分别为氟西汀、帕罗西汀、舍曲林、氟伏沙明、文拉法辛、米氮平、度洛西汀和阿米替林,其总销售额超过全球抗抑郁药物市场份额的80%。我国2011年抗抑郁用药市场销售位于前5位的药物分别是:帕罗西汀、西酞普兰、舍曲林、文拉法辛、氟西汀,其中氟西汀和文拉法辛的市场份额呈逐年下滑趋势,而西酞普兰的市场份额呈逐年增长的趋势。赵紫楠等[4]的研究表明帕罗西汀、舍曲林和氟西汀是目前国内使用频率最高的抗抑郁药,均属于选择性5-羟色胺再摄取抑制剂类(SSRI)药物。目前,在临床工作中应用的抗抑郁类药物按其作用机制主要包括以下几类:单胺氧化酶抑制剂(MAOI)、三环类抗抑郁药(TCA)、选择性五羟色胺再摄取抑制剂(SSRIs)、选择性NA再摄取抑制剂(SNRI)、选择性5-羟色胺(5-HT)及NA双重再摄取抑制剂(SSNRI)等,其代表性药物及其结构等见表 1。Styrishave等[5]通过丹麦两家精神病医院氟西汀、舍曲林和西酞普兰的消费情况做的风险评价表明,这些药物排放到环境中的浓度要比他们的最低效应浓度低一到两个数量级。但根据Minguez等[6]人的研究,舍曲林、氯米帕明、阿米替林、氟西汀等常见的八种抗抑郁药的预测环境浓度(PEC)都高于10 ng⋅L-1,超过了欧盟国家认定的最低环境风险评估标准。
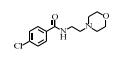
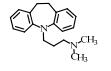
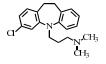
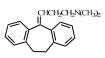
| 表 1 典型抗抑郁药 Table 1 Typical antidepressants |
大部分抗抑郁药主要通过抑制突触后膜对组胺和/或5-羟色胺的再摄取,起到抗抑郁的作用,其直接作用于中枢神经系统,破坏神经内分泌信号,在浓度较低时就能影响水生生物内分泌系统,特别是神经内分泌系统,从而干扰水生生物的正常生长发育。因此,污水处理厂排出的含有这类药物的污水能对水环境中动植物产生显著的危害。而且这类药物在组织里的半衰期相对较长,表明其具有较高潜在的慢性毒性[7]。标准的水生毒理实验表明,氟西汀浓度低至1 μg⋅L-1时就能产生危害。Yang等[8]利用斑马鱼胚胎作为研究模型,发现阿米替林在ng⋅L-1的浓度下就能对胚胎的生长和发育产生一定的影响,导致鱼卵的孵化率下降、幼鱼的体长变短,诱导鱼体内产生过量的活性氧自由基,从而对幼鱼产生氧化压迫。
3 抗抑郁药在水环境中的污染 3.1 抗抑郁药在水体中的环境浓度以目前的化学分析手段,常用的抗抑郁类药物(如阿米替林、氟西汀、舍曲林等)均能在城市污水或其它类型的环境水样中被检测到,特别是在污水处理厂(WWTP),包括城市污水处理厂及医院污水处理厂的废水中,被认为是精神类药物最重要的来源。表 2列出了21世纪初公开发表的文献中检测到的世界各地城市污水中不同类型的抗抑郁药的环境浓度,显示抗抑郁类药物在城市污水中的浓度范围在ng⋅L-1~μg⋅L-1之间。作为一种典型的SSRIs类抗抑郁药,氟西汀是欧美各国城市污水处理厂最常被检测到的抗抑郁类药物,其在加拿大、美国、挪威城市污水中的浓度分别为2.0~99、12~180、0.4~18.7 ng⋅L-1,其中医疗废水中氟西汀的浓度高达180 ng⋅L-1,在这三个国家所检测的水体中浓度最高。阿米替林是最常用的三环类(TCA)抗抑郁药,其在中国、加拿大、美国、法国城市污水中的浓度分别为1.2~3.0、0.87~21.0、0.5~290、1.4~6.0 ng⋅L-1,跟氟西汀类似,也是在医疗废水中检测到的浓度最高,为290 ng⋅L-1。西酞普兰也是SSRIs类抗抑郁药中的一员,在中国的医疗污水中浓度为61~72 ng⋅L-1、其在加拿大、美国、挪威的城市污水中的浓度分别为3.4~223、40~90、9.2~612 ng⋅L-1,Fick等人对印度帕坦切鲁的水体调研发现,西酞普兰在污水处理厂出水的浓度最高,能达到430 μg⋅L-1,其次是制药厂附近的湖水水样2~8 μg⋅L-1和污水处理厂下游附近村庄的井水水样1.4 μg⋅L-1。对现有的研究数据分析可以得出:现有的研究成果中最常检测的几类药物的环境最高浓度分别为,阿米替林(1055.5 ng⋅L-1),多塞平(920 ng⋅L-1),氟西汀(3465 ng⋅L-1),去甲氟西汀(51.2 ng⋅L-1),帕罗西汀(2000 ng⋅L-1),氟伏沙明(516 ng⋅L-1),舍曲林(120 ng⋅L-1),去甲舍曲林(30.5 ng⋅L-1),西酞普兰(840000 ng⋅L-1)和文拉法辛(2982 ng⋅L-1)等;医院污水处理厂或制药厂附近的污水处理厂进出水等地方抗抑郁药类的检测浓度是一般污水处理厂的几十上百倍,可以有力的说明医疗废水是抗抑郁类药物的最重要来源;药物在污水处理厂的进水和出水中的浓度变化不大,也可以说明一般的污水处理方法对这类药物的作用效果不太大。大部分药物类污染物都不能在污水处理过程中被完全降解,它们最终会进入地表水中[9]。电子辐照技术基于水的辐照分解,在水的辐照分解过程中产生羟基自由基和氢原子等可以促进有机化合物的氧化、减少、降解、分离[10],已有研究结果表明该类高级氧化技术可有效地降解污水中的抗抑郁类药物[11]。而对于抗抑郁药文法拉辛,除电子辐照技术以外[12],电催化臭氧化作用[13]和光催化通过TiO2/UV过程处理[14]均可对其有效的降解。同时,UV/H2O2过程也被认为是一种去除WWTP污水中文法拉辛等抗抑郁药物的有效方法[15]。从地区分布的特点而言,从表 2的数据也可以看出目前已有的研究数据较为集中关注欧美发达国家中该类药物在水环境中的分布,欧洲国家水环境中检测到的抗抑郁浓度普遍高于北美地区。首以氟西汀为例,表 2中列举了近十年来有检测过该药物环境浓度的文献,其中只有2篇来自于亚洲地区,其余20篇均来自于欧美地区,且欧洲地区的文献提到报道的氟西汀的环境最高浓度为3465 ng⋅L-1[16],是北美地区最高环境浓度180 ng⋅L-1[17]的十几倍。再以目前抗抑郁类药物中环境浓度最高的西酞普兰为例,表格中显示的近十年来已有报道的文献共14篇,其中有10篇是欧美国家地区的,其在北美地区水体中检测到的最高浓度为307 ng⋅L-1[18],但在欧洲国家挪威WWTP的出水中的最高检测浓度有612 ng⋅L-1[19],在亚洲国家中国医疗污水中最高检测浓度为72 ng⋅L-1[20],而在印度WWTP出水的最高检测浓度高达430 μg⋅L-1[21],是欧美各国检测浓度的几百倍。
| 表 2 典型抗抑郁药的环境浓度 Table 2 Environmental concentrations of typical antidepressants |
已有研究结果显示环境中的抗抑郁药类污染物主要来源于生活污水、医疗废水和医药工厂排放等(图 1)。人体摄入的抗抑郁药在体内不能被完全吸收,相当一部分以原药或代谢产物的形式经由尿液和粪便排出体外,然后通过环境或污水处理厂污水排放进入环境。已有研究表明,多种抗抑郁类药物及其代谢产物可在污水处理厂及其相关的水体中检测到,特别是城市污水处理厂及医院污水处理厂,被认为是抗抑郁类药物向环境释放的最主要的源头。大多数抗抑郁药在污水处理厂中不能被完全去除,大量抗抑郁药随着出水进入地表水,进而对地下水甚至饮用水造成污染。Snyder等[50]研究了美国某污水处理厂中不同处理工艺中氟西汀的去除效率,其中游离氯处理及紫外线照射处理对氟西汀的去除效果不理想,去除率均小于30%,臭氧处理工艺对氟西汀的去除率能达到70%以上;Zorita等[51]的研究也表明,氟西汀和去甲氟西汀的水解光降解或微生物降解的效率很低,其去除途径主要是沉积物的吸附。研究表明,氟西汀难以水解、光解和微生物降解,并会迅速地从水体转移到沉积物中,具有持久性污染物的一般特性[51]。而进入垃圾填埋中的抗抑郁药,可通过污水排放和雨水冲刷进入地表水和地下水,最后进入饮用水中。另外,抗抑郁药生产过程中排放的废水和废弃物可进入到水和土壤环境,进而通过多种途径在环境中进行迁移转化。同时,抗抑郁类药物的直接丢弃也是环境中抗抑郁药的来源之一。
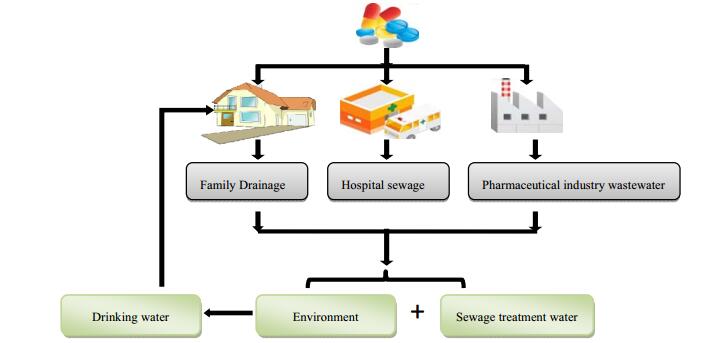
|
图 1 环境中抗抑郁药的来源与迁移 Fig.1 Source and migration of antidepressants in environment |
Kinney等[52]发现污水处理厂产生的生物固体中氟西汀的含量也高达100~4700 μg⋅L-1。此外,地表水中的抗抑郁药不仅可在底泥中累积,还可进入鱼虾等水生生物体内,通过食物链进行富集,生物富集取决于污染物的性质和鱼的表面积-体积比,一般通过生物富集系数或生物浓缩因子表征某种化合物的生物富集能力。表 3列出了氟西汀在不同生物和组织中的生物浓缩因子,从表中可以看出:实验室通过玻璃水箱设定的氟西汀水环境中,其水溶液中pH值是使用日本京都生产的酸度计(D-52,HORIBA)测得,当pH等于9的时候,氟西汀在鱼组织中的生物富集系数(BCF)可达到环境浓度的3100倍,表明抗抑郁类药物具有在水生生物组织中累积的能力,可能对水生生物具有潜在的毒性效应。另一方面,研究表明氟西汀的BCF会随着环境水体pH值的升高而增加,其原因在于氟西汀的pKa值为10.05,环境水体的pH值越接近氟西汀的pKa值其电离程度越低,疏水性越强,越容易被生物组织富集。Chu等[53]利用加压液相萃取的方法分析了帕罗西汀、氟西汀和去甲氟西汀在鱼体内的含量,分析表明三种化合物在鱼组织内的浓度约高达1 μg⋅kg-1(湿重)。
| 表 3 抗抑郁药氟西汀的生物富集 Table 3 Bioaccumulation coefficients of the antidepressant fluoxetine |
利用抗抑郁药的理化性质(表 1),可以预测该类药物的环境归属。脂溶性强的物质,容易被肝脏降解成更亲水的代谢产物,从而通过不同的路径进入水生态系统。辛醇-水分配系数(Log Kow)是与化学品的疏水性息息相关的一个参数,对于中性和疏水性化合物,土壤和沉积物中的有机碳含量与吸附机制相关,因此,普遍认为Log Kow能很好地预测抗抑郁药在环境中的行为。与其他的氯化氢盐酸盐类似,所有的SSRIs类盐酸盐的辛醇-水分配系数(1.21~1.39)都较低,且在水中的溶解度非常好。而且已有研究表明水体中的氟西汀浓度会随着时间的推移减少,并吸附在沉积物中,似乎是一种典型的持久性沉积物[59]。但Schultz等[36]调查了抗抑郁类药物在水体和沉积物中的浓度,并分析了其在鱼脑组织中的选择性富集,其研究表明,氟西汀、舍曲林、帕罗西汀等在沉积物中的浓度显著高于水体,且去甲氟西汀、舍曲林和去甲舍曲林在鱼体组织的检测浓度非常高,是水体中浓度的几十倍,文拉法辛主要存在于水体和底泥中,鱼组织样品中只有少量或没有。他们随后的研究也与此相符[60],通过分析暴露于氟西汀、舍曲林、布普品、文拉法辛等抗抑郁药的黑头呆鱼脑组织,发现与暴露浓度相比,脑组织中氟西汀、舍曲林、布普品偏高,文拉法辛的浓度则相对偏低。这类药物具有较高的吸附系数(Log Koc),从表 1中可以看出,这类药物的吸附系数主要分布在3.82~5.63,因此,SSRIs类抗抑郁药应该容易在泥土和沉积物中富集。Paterson等[58]人用日本青鳉研究抗抑郁药氟西汀在水生生物的吸收和清除的结果表明,暴露结束后,随着时间的增加氟西汀和去甲氟西汀的浓度呈线性降低,但是随着时间的推移,去甲氟西汀和氟西汀的浓度比值显著上升。Nakamura等[7]的研究表明暴露于30 μg⋅L-1的氟西汀溶液30 d后,去甲氟西汀和氟西汀的浓度比值为5.3。因此,长期的暴露可能更有利于这类药物的生物代谢,其代谢产物在体内的浓度随时间的推移而增加。
3.3 环境样品中抗抑郁药的分析检测方法近年来陆续报道了关于各种环境介质(城市污水、地表水和水生生物)中抗抑郁药的分析监测方法,一般包括样品采集和保存、前处理和化学分析。表 4列举了2004-2016年已有文献报道的环境样品中抗抑郁类药物的检测方法,包括液相色谱-串联质谱法(LC-MS/MS)和气相色谱法-质谱法(GC-MS)两种方法。在已有的针对药物类化合物的化学分析方法报道中,LC-MS/MS的应用相较于GC-MS而言更为广泛。LC-MS/MS分析需要首先对被分析的药物样品进行离子化处理,将样品分离得到带有样品信息的离子,从而进行质谱检测。根据不同的离子源,可将LC-MS/MS分为不同的种类,一般有电子电离源(EI)、化学电离源(CI)、快原子轰击源(FAB)、电喷雾电离源(ESI)、大气压化学电离源(APCI)等不同离子源的检测仪器。针对抗抑郁药类药物的检测,应用到较多的有电喷雾电离源液相色谱-质谱联用仪LC-(ESI)-MS/MS][34]、大气压化学电离源液相色谱-质谱联用仪[LC-APCI-MS/MS][55]等。而为了提高药物的检测效率,研究者们在检测中也会选择具有更高选择性和更高敏感度的高效液相色谱-质谱联用仪(HPLC-MS/MS)[61, 62]和超高效液相色谱-质谱联用仪(UPLC-MS/MS)[27]。美国环境保护局(EPA)发布的水体、土壤、底泥和生物样品中药品和个人护理品(PPCPs)的标准分析方法(Method 1694)[63]中对环境样品的采集和储存做了详细的描述。但是目前在环境样品中药物检测最主要的问题是样品具有基质复杂、目标物含量低等特点,因此样品前处理是影响整个分析方法准确度和灵敏度的关键步骤。已报道的环境样品中抗抑郁类药物的检测方法,固相萃取(Solid phase extraction, SPE)是最常用的样品前处理方法[21, 48, 49],从表 4可以看出在同一个分析检测方法中结合运用不同类型的SPE柱,能有效的去除环境基质对检测的干扰。如Schultz等[36]建立了测定环境样品中8种抗抑郁药物和2种衍生物的LC-MS/MS分析方法,基质加标回收率在70%~118%,并检测了城市污水处理厂进出水、下游径流和沉积物以及鱼脑组织中这些药物的浓度水平。Lajeunesse等[22]通过比较两种离子交换固相萃取柱对基质干扰的去除效果,使用ESI正离子源的LC-MS/MS分析了加拿大蒙特利尔市污水处理厂进出水中6种抗抑郁药和4中代谢产物的浓度。
| 表 4 环境样品中抗抑郁类药物检测方法 Table 4 Analytical methods of antidepressant pharmaceuticals in environmental samples |
急性和慢性毒性效应的测定主要依托于生物体内体外攻毒实验。目前关于抗抑郁药对生生物的毒性研究相对较多,因为水生生物的整个生命阶段都暴露在污染水体中,是污染物一个很重要的目标。Brooks等[70]通过氟西汀对藻(P. subcapitata)、网纹水蚤(Ceriodaphnia dubia)、大型溞(Daphnia magna)和黑头呆鱼(Pimephales promelas)几种淡水生物的毒性评估发现:在实验条件下,当氟西汀的质量浓度大于40 μg⋅L-1时,月牙藻生长受到抑制,基于细胞密度和浊度的半最大效应浓度EC50分别为39和24 μg⋅L-1;网纹水蚤、大型溞和黑头呆鱼以48 h存活率为测定终点的半致死浓度LC50分别为234、820和705 μg⋅L-1。Nakamura等[57]研究了pH对氟西汀的急性毒性和生物蓄积性的影响,研究表明氟西汀的生物积累依赖pH,越接近pKa的pH条件下毒性和生物蓄积性越强,pH为7、8和9时以96 h存活率为测定终点的半致死浓度分别为:5.5、1.3和0.20 mg⋅L-1。Minguez等[71]利用欧洲鲍血原代细胞探究了阿米替林、氯米帕明、西酞普兰和帕罗西汀四种常见抗抑郁药的对细胞细胞免疫能力的影响(细胞吞噬作用,活性氧水平,脂酶活性,溶酶体膜去稳定作用)以及体外细胞毒性,研究结果表明48 h的半致死浓度LC50(在比较各种污染物的毒性,不同种或不同发育阶段的动物对污染物的敏感性以及环境因素对毒性影响等方面的研究中,都以LC50为依据)分别为45.24、4.76、32.94和4.16 mg⋅L-1,不同的抗抑郁药具有不同的细胞毒性。QIU等[72]利用红鲤鱼原代巨噬细胞探究了阿米替林、米安色林、氟西汀三种抗抑郁药物对细胞的免疫毒性的影响,结果显示24 h阿米替林、氟西汀、米安色林的LC50分别为17.4、6.2、21.7 mg⋅L-1。Johnson等[73]用美国EPA的ECOSAR预测了SSRIs类抗抑郁药对浮游藻类的毒性,结果表明氟西汀对所测试的藻类毒性最强,其次是西酞普兰、氟伏沙明、舍曲林和帕罗西汀;而他们的藻类生长抑制试验则发现舍曲林的毒性最强,其次是氟西汀和氟伏沙明。从表 5的数据我们也可以看出,同一种药物对不同的受试生物的LC50或IC50往往不完全一致,但不会有太大的差异,而且pH会显著影响这类药物的毒性大小。从现有的研究结果来看,这类药物的LC50普遍在mg⋅L-1的级别,因此,环境浓度剂量下的抗抑郁药污染(ng⋅L-1)一般不会对水生生物造成急性致死效应。
| 表 5 抗抑郁药的效应浓度 Table 5 Lethal concentrations of antidepressants |
亚致死效应是指那些在引起直接的身体死亡的浓度或剂量以下产生的效应[82]。个体也许能在亚致死效应暴露中存活,但其生存状态会受到污染物暴露的影响,如逃避捕食者或有效取食的能力下降,这样在自然环境下长期暴露与亚致死剂量的污染物也会导致生物死亡[82]。抗抑郁药具有生物靶向效应,其直接作用中枢神经系统,干扰神经内分泌信号,在浓度较低时便能显现出生物活性。国际上对于抗抑郁药物的生态毒性研究目前正处于起步阶段,研究较多的抗抑郁药多为选择性5-羟色胺再摄取抑制剂(SSRI)类[75, 83]。在许多水生生物中,5-羟色胺能直接调节一些中枢神经系统上的细胞功能和行为[84],因此生物体内的5-羟色胺水平的改变会影响多种相关的生理行为。已有研究表明,SSRIs类抗抑郁药可通过影响内源激素水平,干扰环境中非目标生物的生殖、发育、生理或行为[74, 75, 85]。
测定污染物亚致死效应通常选择生长、发育、性别特征、生殖损伤和行为等作为终点检测指标。现有的研究结果发现:(1)在亚致死浓度下,抗抑郁药能够显著的影响水生生物的生长发育。如Yang等[8]就以斑马鱼为模式生物研究了抗抑郁药阿米替林对其生长和生理的影响,表明环境相关浓度水平的暴露能够抑制鱼卵的正常生长和发育,改变鱼卵体内促肾上腺皮质激素水平,刺激体内产生氧化压迫,增加细胞脂质过氧化。Foran等[86]发现日本青鳉暴露于氟西汀4周后会表现出明显的后代发育异常,并且雌性体内循环血浆中17β-雌二醇(E2)的水平明显下降。(2)环境相关浓度的抗抑郁药能够对目标生物的生殖产生损害。成年雌性斑马鱼暴露氟西汀7 d后会导致平均产卵率比对照组降低2到3倍,并且卵巢中E2的含量明显减低[87];氟西汀、舍曲林、文拉法辛等单独暴露能显著影响雄性黑头呆鱼第二性征,并且环境浓度的氟西汀暴露就能诱导卵黄蛋白原的生成,对性激素的内分泌产生干扰[60];氟西汀暴露后的雄性金鱼[88]和雄性食蚊鱼[74]分别表现出一致的性成熟推迟。(3)动物在环境相关浓度抗抑郁药的长期暴露下会导致行为异常。Perreault等[89]观察到蓝头濑鱼腹腔注射两周6 mg⋅g-1(湿重)的氟西汀后,雄鱼的侵略性降低;微克水平氟西汀暴露100 d,西方大肚鱼的交配行为延迟[74]。(4)高浓度的抗抑郁药暴露会影响水生生物的繁殖。如Henry等[74]将幼年网纹水蚤暴露在一定浓度的抗抑郁药中,舍曲林、帕罗西汀、氟伏沙明、氟西汀和西酞普兰等影响网纹水蚤繁殖能力的最低效应浓度分别为:0.045、0.44、1.466、1.789和8.0 mg⋅L-1。
所有毒性效应都开始于污染化合物与生物分子之间的相互作用,这种效应在分子作用→生化反应→亚细胞→细胞→组织→器官→个体→种群→群落→生态系统→景观→生物圈各个级别逐一放大,因此,阐明外源性化合物引发的分子起始事件(MIE)有助于理解其在生物个体或群体水平等更高层次上观察到有害结局路径(AOP)的根源。目前,已有文献报道的抗抑郁类药物对水生生物的毒性效应机制包括:(1)环境相关浓度的抗抑郁药暴露会使水生生物产生免疫毒性。如Minguez等[71]研究表明这类药物在1 μg⋅L-1的环境浓度下就能刺激细胞吞噬现象和活性氧的产生,且与SSRIs类药物西酞普兰和帕罗西汀相比,TCAs类抗抑郁药阿米替林和氯米帕明具有较高的免疫调节能力。但是,QIU等[72]的研究结果表明鱼巨噬细胞在阿米替林、氟西汀、米安色林或它们的混合溶液的急性暴露后,其抗氧化还原系统参数、抗菌活性、一氧化氮产生以及促炎细胞因子的表达都受到显著抑制,而抗炎细胞因子的表达受到显著诱导,表现出抗抑郁类药物对鱼类先天性免疫的抑制作用,同时该效应被认为与抗抑郁药物暴露引起的核因子nuclear factor-κB活性的下调密切相关。(2)亚致死浓度的抗抑郁药会对水生生物产生内分泌干扰作用。如Gonzalez-Rey等通过研究贻贝在环境相关浓度的氟西汀暴露下,抗氧化应激酶、神经毒性和内分泌干扰的变化表明,氟西汀主要通过内分泌干扰作用对贻贝产生影响,而不是具有氧化或神经毒性[74];van der Ven等[90]的研究发现在大脑和睾丸组织中,基于动情性生物标志物(例如:卵黄蛋白原和透明带蛋白),米安色林具有雌激素效力并能扰乱正常的内分泌活动。(3)抗抑郁药会影响水生生物的神经系统。De Abreu等[91]探究了氟西汀急性暴露对斑马鱼应激反应的影响,急性应激实验时与对照组相比,暴露组的皮质醇浓度相对较低,结果表明氟西汀急性暴露会损害鱼的应力轴,导致鱼类神经内分泌功能失调。Park等[92]利用Affymetrix基因芯片探究了斑马鱼幼鱼暴露于氟西汀和舍曲林后,致毒的生化途径和两种药物之间的差异,结果表明应激反应和乙酰胆碱酯酶活力显著的受到影响,该类基因可以作为SSRIs类暴露的生物标志物。表 6列举了近年来抗抑郁类药物对水生态系统中非目标生物的毒性效应数据汇总。
| 表 6 抗抑郁药对非靶向药物的毒性数据 Table 6 Toxicity data of antidepressants for non-target organisms |
尽管近年来国际上对于抗抑郁药这类新兴污染物的研究逐渐增多,提出并发现了一些抗抑郁类药物对水生生物的不利影响,但是其中也存在一些缺陷与不足。主要如下:(1)在全球范围内,针对该类药物开展的环境污染监测仍然集中在欧美发达地区,如在我国国内对抗抑郁类药物需求和消耗日益增加的背景下,针对我国人口密集的城市,开展的抗抑郁类精神药物在天然水体以及饮用水中的污染特性研究非常有限;(2)对于如何在污水处理过程中有效的去除该类药物,探究药物这种新兴污染物在排放到水体后的光解机理和动力学目前相关研究也十分不足,探明污染物在实际水体中的降解情况,可从崭新的角度揭示抗抑郁类药物的环境中的迁移转化规律;(3)在生态毒理学研究方面,已有研究较侧重于对其有害效应的评价,但对引起这种效应的毒理学机制较少涉及;另外,大多研究者只关注于一种或一类抗抑郁药,而对于水体中实际存在的多种作用机制不同的抗抑郁药对水生生物的复合作用还缺乏相应的研究。
对于药物在污水处理过程中不能被完全去除的问题,高级氧化技术如电子辐照、光催化氧化等技术可作为未来有效去除污水中药物类污染物的重要方法。但是,由于在处理过程中可能会产生降解中间产物,考虑到这些化合物排放到环境中所带来的潜在的生态毒性,因此,在未来的研究中还需考虑到实际污水处理条件进一步优化抗抑郁类药物等污染物的处理办法。另外,针对抗抑郁药这类新兴污染物的毒性效应与机制研究,考虑到斑马鱼基因与人类基因的高度同源性、对药物的敏感性和易操作性为实验提供的较大的便利,未来可大力开展以斑马鱼为实验动物模型的毒性终点检测方法,以期未来在生态风险评估方面,针对抗抑郁药等药物类污染物建立一套较为系统的评价体系。
总而言之,目前针对这一药物的研究基本上还处于初期的探索阶段,深入的了解具有较高生物活性的抗抑郁类药品在城市水系统中的迁移转化规律,鉴定饮用水中的抗抑郁类药物种类与残留水平,阐明这类新兴有毒污染物对水生生物的潜在毒性效应阈值,对于保障城市水质资源和水环境的健康发展将具有十分重要的现实意义。
| [1] | Lindberg R H, Wennberg P, Johansson M I, et al. Screening of human antibiotic substances and deter-mination of weekly mass flows in five sewage treatment plants in Sweden[J]. Environmental Science & Technology , 2005, 39(10): 3421-3429. |
| [2] | Glassmeyer S T, Furlong E T, Kolpin D W, et al. Transport of chemical and microbial compounds from known wastewater discharges:Potential for use as indicators of human fecal contamination[J]. Environmental Science & Technology , 2005, 39(14): 5157-5169. |
| [3] | Calisto V, Esteves V I. Psychiatric pharmaceuticals in the environment[J]. Chemosphere , 2009, 77(10): 1257-1274. DOI:10.1016/j.chemosphere.2009.09.021. |
| [4] | Fong P P, Ford A T. The biological effects of antidepressants on the molluscs and crustaceans:A review[J]. Aquatic Toxicology , 2014, 151: 4-13. DOI:10.1016/j.aquatox.2013.12.003. |
| [5] | Styrishave B, Halling-Sorensen B, Ingerslev F. Environmental risk assessment of three selective serotonin reuptake inhibitors in the aquatic environment:a case study including a cocktail scenario[J]. Environmental Toxicology Chemistry , 2011, 30(1): 254-261. DOI:10.1002/etc.372. |
| [6] | Minguez L, Farcy E, Ballandonne C, et al. Acute toxicity of 8 antidepressants:What are their modes of action?[J]. Chemosphere , 2014, 108: 314-319. DOI:10.1016/j.chemosphere.2014.01.057. |
| [7] | Nakamura Y, Yamamoto H, Sekizawa J. The effects of pH in japanese medaka (oryzias latipes):acute toxicity in fish larvae and bioaccumulation in juvenile fish[J]. Chemosphere , 2008, 70(5): 865-873. DOI:10.1016/j.chemosphere.2007.06.089. |
| [8] | YANG Ming, QIU Wen-hui, CHEN Jing-si, et al. Growth inhibition and coordinated physiological regulation of zebrafish (danio rerio) embryos upon sublethal exposure to antidepressant amitriptyline[J]. Aquatic Toxicology , 2014, 151(SI): 68-76. |
| [9] | Segura Y, Martínez F, Melero J A. Effective pharmaceutical wastewater degradation by Fenton oxidation with zero-valent iron[J]. Applied Catalysis B:Environmental , 2013, 136-137: 64-69. DOI:10.1016/j.apcatb.2013.01.036. |
| [10] | Cooper W J, Gehringer P, Pikaev A K, et al. Radiation processes. in:parsons S (ed) advanced oxidation processes for water and wastewater[M]. London, IWA Publishing, 2004. |
| [11] | Silva V H O, Batista A P D, Teixeira A C S C, . Degradation and acute toxicity removal of the antidepressant Fluoxetine (Prozac®) in aqueous systems by electron beam irradiation[J]. Environmental Science & Pollution Research , 2016, 23(12): 11927-11936. |
| [12] | Santoke H, SONG Wei-hua, Cooper W J, et al. Advanced oxidation treatment and photochemical fate of selected antidepressant pharmaceuticals in solutions of Suwannee River humic acid[J]. Journal of Hazardous Materials , 2012, 217-218: 382-390. DOI:10.1016/j.jhazmat.2012.03.049. |
| [13] | LI Xiang, WANG Yu-jue, ZHAO Jian, et al. Electro-peroxone treatment of the antidepressant venlafaxine:operational parameters and mechanism,[J]. Journal of Hazardous Materials , 2015, 300: 298-306. DOI:10.1016/j.jhazmat.2015.07.004. |
| [14] | Lambropoulou D, Evgenidou E, Saliverou V, et al. Degradation of venlafaxine using TiO2/UV process:kinetic studies, RSM optimization, identification of transformation products and toxicity evaluation[J]. Journal of Hazardous Materials , 2017, 323: 513-526. DOI:10.1016/j.jhazmat.2016.04.074. |
| [15] | García-Galán M J, Anfruns A, Rafael Gonzalez-Olmos R, et al. UV/H2O2 degradation of the antidepressants venlafaxine and O-desmethylvenlafaxine:Elucidation of their transformation pathway and environmental fate[J]. Journal of Hazardous Materials , 2016, 311: 70-80. DOI:10.1016/j.jhazmat.2016.02.070. |
| [16] | Salgado R, Marques R, Noronha J P, et al. Assessing the diurnal variability of pharmaceutical and personal care products in a full-scale activated sludge plant[J]. Environmental Pollution , 2011, 159(10): 2359-2367. DOI:10.1016/j.envpol.2011.07.004. |
| [17] | Nagarnaik P, Batt A, Boulanger B. Source characterization of nervous system active pharmaceutical ingredients in healthcare facility wastewaters[J]. Journal of Environmental Management , 2011, 92(3): 872-877. DOI:10.1016/j.jenvman.2010.10.058. |
| [18] | MacLeod S L, Sudhir P. Wong C S stereoisomer analysis of wastewater-derived β-blockers, selective serotonin re-uptake inhibitors, and salbutamol by high-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A , 2007, 1170(1): 23-33. |
| [19] | Vasskog T, Berger U, Samuelsen P J, et al. Selective serotonin reuptake inhibitors in sewage in uents and ef uents from TromsØ, Norway[J]. Journal of Chromatography A , 2006, 1115(1): 187-195. |
| [20] | YUAN Sheng-liu, JIANG Xiao-man, XIA Xing-hui, et al. Detection, occurrence and fate of 22 psychiatric pharmaceuticals in psychiatric hospital and municipal wastewater treatment plants in Beijing, China[J]. Chemosphere , 2013, 90(10): 2520-2525. DOI:10.1016/j.chemosphere.2012.10.089. |
| [21] | Fick J, Söderström H, Lindberg R H, et al. Contamination of surface, ground, and drinking water from pharmaceutical production[J]. Environmental Toxicology Chemistry , 2009, 28(12): 2522-2527. DOI:10.1897/09-073.1. |
| [22] | Lajeunesse A, Gagnon C, Sauve S. Determination of basic antidepressants and their n-desmethyl metabolites in raw sewage and wastewater using solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Analytical Chemistry , 2008, 80(14): 5325-5333. DOI:10.1021/ac800162q. |
| [23] | Lajeunesse A, Smyth S A, Barclay K, et al. Distribution of antidepressant residues in wastewater and biosolids following different treatment processes by municipal wastewater treatment plants in Canada[J]. Water Research , 2012, 46(17): 5600-5612. DOI:10.1016/j.watres.2012.07.042. |
| [24] | Kasprzyk-Hordern B, Dinsdale R M, Guwy A J. The occurrence of pharmaceuticals, personal care products, endocrine disruptors and illicit drugs in surface water in South Wales, UK[J]. Water Research , 2008, 42(13): 3498-3518. DOI:10.1016/j.watres.2008.04.026. |
| [25] | Batt A L, Kostich M S, Lazorchak J M. Analysis of ecologically relevant pharmaceuticals in wastewater and surface water using selective solid-phase extraction and UPLC/MS/MS[J]. Analytical Chemistry , 2008, 80(13): 5021-5030. DOI:10.1021/ac800066n. |
| [26] | Mitchell S Kostich, Angela L Batt, James M Lazorchak. Concentrations of prioritized pharmaceuticals in effluents from 50 large wastewater treatment plants in the US and implications for risk estimation[J]. Environmental Pollution , 2014, 184: 354-359. DOI:10.1016/j.envpol.2013.09.013. |
| [27] | Kasprzyk-Hordern B, Dinsdale R, Guwy A. Multiresidue methods for the analysis of pharmaceuticals, personal care products and illicit drugs in surface water and wastewater by solid-phase extraction and ultra performance liquid chromatography-electrospray tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry , 2008, 391(4): 1293-1308. DOI:10.1007/s00216-008-1854-x. |
| [28] | David R Baker, Barbara Kasprzyk-Hordern. Spatial and temporal occurrence of pharmaceuticals and illicit drugs in the aqueous environment and during wastewater treatment:New developments[J]. Science of the Total Environment , 2013, 454-455: 442-456. DOI:10.1016/j.scitotenv.2013.03.043. |
| [29] | Togola A, Budzinski H. Multi-residue analysis of pharmaceutical compounds in aqueous samples[J]. Journal of Chromatography A , 2008, 1177(1): 150-158. DOI:10.1016/j.chroma.2007.10.105. |
| [30] | Robert Loos, Raquel Carvalho, Diana C Antonio, et al. EU-wide monitoring survey on emerging polar organic contaminants in wastewater treatment plant effluents[J]. Water Research , 2013, 47(17): 6475-6487. DOI:10.1016/j.watres.2013.08.024. |
| [31] | WU Ming-hong, XIANG Jia-jia, QUE Chen-jing, et al. Occurrence and fate of psychiatric pharmaceuticals in the urban water system of Shanghai, China[J]. Chemosphere , 2015, 138: 486-493. DOI:10.1016/j.chemosphere.2015.07.002. |
| [32] | Edson Baltazar Estrada-Arriaga, Juana Enriqueta Cortés-Muñoz, Arturo González-Herrera, et al. Assessment of full-scale biological nutrient removal systems upgraded with physico-chemical processes for the removal of emerging pollutants present in wastewaters from Mexico[J]. Science of the Total Environment , 2016, 1571: 172-1182. |
| [33] | Hummel D, Loeffler D, Fink G, et al. Simultaneous determination of psychoactive drugs and their metabolites in aqueous matrices by liquid chromatography mass spectrometry[J]. Environmental Science & Technology , 2006, 40(23): 7321-7328. |
| [34] | Schultz M M, Furlong E T. Trace analysis of antidepressant pharmaceuticals and their select degradates in aquatic matrixes by LC/ESI/MS/MS[J]. Analytical Chemistry , 2008, 80(5): 1756-1762. DOI:10.1021/ac702154e. |
| [35] | Metcalfe C, Chu S, Judt C, et al. Antidepressants and their metabolites in municipal wastewater, and downstream exposure in an urban watershed[J]. Environmental Toxicology Chemistry , 2010, 29(1): 79-89. DOI:10.1002/etc.v29:1. |
| [36] | Schultz M M, Furlong E T, Kolpin D W, et al. Antidepressant pharmaceuticals in two US effluent-impacted streams:occurrence and fate in water and sediment, and selective uptake in fish neural tissue[J]. Environment Science & Technology , 2010, 44(6): 1918-1925. |
| [37] | Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000:a national reconnaissance[J]. Environmental Science & Technology , 2002, 36(6): 1202-1211. |
| [38] | Benotti M J, Trenholm R A, Vanderford B J, et al. Pharmaceuticals and endocrine disrupting compounds in US drinking water[J]. Environmental Science & Technology , 2009, 43(3): 597-603. |
| [39] | Vasskog T, Anderssen T, Pedersen-Bjergaard S, et al. Occurrence of selective serotonin reuptake inhibitors in sewage and receiving waters at Spitsbergen and in Norway[J]. Journal of Chromatography A , 2008, 1185(2): 194-205. DOI:10.1016/j.chroma.2008.01.063. |
| [40] | Paíga P, Santos L H M L M, Ramos S, et al. Presence of pharmaceuticals in the Lis river (Portugal):sources, fate and seasonal variation[J]. Science of the Total Environment , 2016, 573: 164-177. DOI:10.1016/j.scitotenv.2016.08.089. |
| [41] | Bueno M J M, Aguera A, Gómez M J, et al. Application of liquid chromatography/quadrupole-linear ion trap mass spectrometry and time-of-Flight mass spectrometry to the determf pharmaceuticals and related contaminants in wastewater[J]. Analytical Chemistry , 2007, 79(24): 9372-9384. DOI:10.1021/ac0715672. |
| [42] | YU Ke, LI Bing, ZHANG Tong. Direct rapid analysis of multiple PPCPs in municipal wastewater using ultrahigh performance liquid chromatography-tandem mass spectrometry without SPE pre-concentration[J]. Analytica Chimica Acta , 2012, 738: 59-68. DOI:10.1016/j.aca.2012.05.057. |
| [43] | Silva L J G, Martins M C, Pereira A M P T, et al. Uptake, accumulation and metabolization of the antidepressant fluoxetine by Mytilus galloprovincialis[J]. Environmental Pollution , 2016, 213: 432-437. DOI:10.1016/j.envpol.2016.02.022. |
| [44] | Kallenborn R, Fick J, Lindberg R, et al. Pharmaceutical residues in northern European environments:consequences and perspectives[M]. In:Kümmerer, K. (Ed.), Pharmaceuticals in the environment:sources, fate, effects and risks. Springer Science & Business Media, 2008:61-74. |
| [45] | Sousa M A, Gonçalves C, Cunha E, et al. Cleanup strategies and advantages in the determination of several therapeutic classes of pharmaceuticals in wastewater samples by SPE-LC-MS/MS[J]. Analytical and Bioanalytical Chemistry , 2011, 399(2): 807-822. DOI:10.1007/s00216-010-4297-0. |
| [46] | Rodriguez-Mozaz S, Ricart M, Köck-Schulmeyer M, et al. Pharmaceuticals and pesticides in reclaimed water:Efficiency assessment of a microfiltration-reverse osmosis (MF-RO) pilot plant[J]. Journal of Hazardous Materials , 2015, 282: 165-173. DOI:10.1016/j.jhazmat.2014.09.015. |
| [47] | Bruno J S, Fernando M L, Queiroza M E. determination of fluoxetine and norfluoxetine enantiomers in human plasma by polypyrrole-coated capillary in-tube solid-phase microextraction coupled with liquid chromatography-fluorescence detection[J]. Journal of Chromatography A , 2009, 1216(49): 8590-8597. DOI:10.1016/j.chroma.2009.10.034. |
| [48] | Himmelsbach M, Buchberger W, Klamp C W. Determination of antidepressants in surface and waste water samples by capillary electrophoresis with electrospray ionization mass spectrometric detection after preconcentration using off-line solid-phase extraction[J]. Electrophoresis , 2006, 27(5-6): 1220-1226. DOI:10.1002/(ISSN)1522-2683. |
| [49] | Lamas J P, Salgado-Petinala C, García-Jaresa C, et al. Solid-phase microextraction-gas chromatography-mass spectrometry for the analysis of selective serotonin reuptake inhibitors in environmental water[J]. Journal of Chromatography A , 2004, 1046(1): 241-247. |
| [50] | Snyder S A. Occurrence, treatment and toxicological relevance of EDCs and pharmaceuticals in water[J]. Ozone-Science & Engineering , 2008, 30(1): 65-69. |
| [51] | Zorita S, Martensson L. Occurrence and removal of pharmaceuticals in a municipal sewage treatment system in the south of Sweden[J]. Science of the Total Environment , 2008, 407(8): 2760-2770. |
| [52] | Kinney C A, Furlong E T, Zaugg S D, et al. Survey of organic wastewater contaminants in biosolids destined for land application[J]. Environmental Science & Technology , 2006, 40(23): 7207-7215. |
| [53] | Chu S, Metcalfe C D. Analysis of paroxetine, fluoxetine and norfluoxetine in fish tissues using pressurized liquid extraction, mixed mode solid phase extraction cleanup and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A , 2007, 1163(1-2): 112-118. DOI:10.1016/j.chroma.2007.06.014. |
| [54] | Franzellitti S, Buratti S, Capolupo M, et al. An exploratory investigation of various modes of action and potential adverse outcomes of fluoxetine in marine mussels[J]. Aquatic Toxicology , 2014, 151: 14-26. DOI:10.1016/j.aquatox.2013.11.016. |
| [55] | Meredith-Williams M, Laura J. Carter, Richard Fussell, et al. Uptake and depuration of pharmaceuticals in aquatic invertebrates[J]. Environmental Pollution , 2012, 165: 250-258. DOI:10.1016/j.envpol.2011.11.029. |
| [56] | CHEN Fangfang, GONG Zhiyuan, Kelly B C. Rapid analysis of pharmaceuticals and personal care products in fish plasma micro-aliquots using liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A , 2015, 1383: 104-111. DOI:10.1016/j.chroma.2015.01.033. |
| [57] | Nakamura Y, Yamamoto H, Sekizawa J, et al. The effects of pH on fluoxetine in Japanese medaka (Oryzias latipes):Acute toxicity in fish larvae and bioaccumulation in juvenile fish[J]. Chemosphere , 2008, 70(5): 865-873. DOI:10.1016/j.chemosphere.2007.06.089. |
| [58] | Paterson G, Metcalfe C D. Uptake and depuration of the anti-depressant fluoxetine by the Japanese medaka (Oryzias latipes)[J]. Chemosphere , 2008, 74(1): 125-130. DOI:10.1016/j.chemosphere.2008.08.022. |
| [59] | Brooks B W, Chambliss C K, Stanley J K, et al. Determination of select anti-depressants in fish from an effluent dominated stream[J]. Environmental Toxicology & Chemistry , 2005, 24(2): 464-469. |
| [60] | Schultz M M, Painter M M, Bartell S E, et al. Selective uptake and biological consequences of environmentally relevant antidepressant pharmaceutical exposures on male fathead minnows[J]. Aquatic Toxicology , 2011, 104(1/2): 38-47. |
| [61] | Daouk S, Fleury-Souverain S, Daali Y. Development of an LC-MS/MS method for the assessment of selected active pharmaceuticals and metabolites in wastewaters of Swiss University hospital[J]. Chimia , 2015, 69(11): 684-689. DOI:10.2533/chimia.2015.684. |
| [62] | Gros M, Rodríguez-Mozaz S, Barceló D. Rapid analysis of multiclass antibiotic residues and some of their metabolites in hospital, urban wastewater and river water by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry[J]. Journal of Chromatography A , 2013, 1292: 173-188. DOI:10.1016/j.chroma.2012.12.072. |
| [63] | Englert B. Method 1694:Pharmaceuticals and personal care products in water, soil, sediment, and biosolids by HPLC/MS/MS[J]. US Environmental Protection Agency (EPA) , 2007: 1-72. |
| [64] | Conley J M, Symes S J, Kindelberger S A, et al. Rapid liquid chromatography-tandem masss pectrometry method for the determination of abroad mixture of pharmaceuticals in surface water[J]. Journal of Chromatography A , 2008, 1185(2): 206-215. DOI:10.1016/j.chroma.2008.01.064. |
| [65] | Gómeza M J, Petrovic'M , Fernández-Alba A R, et al. Determination of pharmaceuticals of various therapeutic classes by solid-phase extraction and liquid chromatography-tandem mass spectrometry analysis in hospital effluent wastewaters[J]. Journal of Chromatography A , 2006, 1114(2): 224-233. DOI:10.1016/j.chroma.2006.02.038. |
| [66] | Furlong E T, Burkhardt M R, Kolpin D, et al. Determination of pharmaceutical compounds in surface-and ground-water samples by solid phase extraction and high-performance liquid chromatography-electrospray ionization mass spectrometry[J]. Journal of Chromatography A , 2004, 1041(1/2): 171-180. |
| [67] | Gros M, Petrovic′ M, Barceló D. Development of a multi-residue analytical methodology based on liquid chromatography-tandem mass spectrometry (LC-MS/MS) for screening and trace level determination of pharmaceuticals in surface and wastewaters[J]. Talanta , 2006, 70(4): 678-690. DOI:10.1016/j.talanta.2006.05.024. |
| [68] | Huerta B, Rodriguez-Mozaz S, Nannou C. Determination of a broad spectrum of pharmaceuticals and endocrine disruptors inbiofilm from a waste water treatment plant-impacted river[J]. Science of the Total Environment , 2016, 540: 241-249. DOI:10.1016/j.scitotenv.2015.05.049. |
| [69] | Estevez-Calvar N, Canesi L, Montagna M, et al. Adverse effects of the SSRI antidepressant sertraline on early life stages of marine invertebrates[J]. Marine Environmental Research , 2017, 128: 88-97. DOI:10.1016/j.marenvres.2016.05.021. |
| [70] | Brooks B W, Turner P K, Stanley J K, et al. Waterborne and sediment toxicity of fluoxetine to select organisms[J]. Chemosphere , 2003, 52(1): 135-142. DOI:10.1016/S0045-6535(03)00103-6. |
| [71] | Minguez L, Halm-Lemeille M P, Costil K, et al. Assessment of cytotoxic and immunomodulatory properties of four anti-depressants on primary cultures of abalone hemocytes (Haliotis tuberculata)[J]. Aquatic Toxicology , 2014, 153(SI): 3-11. |
| [72] | QIU Wen-hui, WU Ming-hong, LIU Shuai, et al. Suppressive immunoregulatory effects of three antidepressants via inhibition of the nuclear factor-κB activation assessed using primary macrophages of carp (Cyprinus carpio)[J]. Toxicology and Applied Pharmacology , 2017, 322: 1-8. DOI:10.1016/j.taap.2017.03.002. |
| [73] | Johnson D J, Sanderson H, Brain R A, et al. Toxicity and hazard of selective serotonin reuptake inhibitor antidepressants fluoxetine, fluvoxamine, and sertraline to algae[J]. Ecotoxicology and Environmental Safety , 2007, 67(1): 128-139. DOI:10.1016/j.ecoenv.2006.03.016. |
| [74] | Henry T B, Black M C. Acute and chronic toxicity of fluoxetine (selective serotonin reuptake inhibitor) in Western Mosquitofish[J]. Arch Environ Contam Toxicol , 2008, 54(2): 325-330. DOI:10.1007/s00244-007-9018-0. |
| [75] | Henry T B, Kwon J W, Armbrust K L, et al. Acute and chronic toxicity of five selective serotonin reuptake inhibitors in Ceriodaph-nia dubia[J]. Environmental Toxicology and Chemistry , 2004, 23(9): 2229-2233. DOI:10.1897/03-278. |
| [76] | Chiffre A, Clérandeau C, Dwoinikoff C, et al. Psychotropic drugs in mixture alter swimming behaviour of Japanese medaka (Oryzias latipes) larvae above environmental concentrations[J]. Environmental science and pollution research , 2016, 23(6): 4964-4977. DOI:10.1007/s11356-014-3477-4. |
| [77] | Richards S M, Cole S E. A toxicity and hazard assessment of fourteen pharmaceuticals to Xenopus laevis larvae[J]. Ecotoxicology , 2006, 15(8): 647-656. DOI:10.1007/s10646-006-0102-4. |
| [78] | Christensen A M, Faaborg-Andersen S, Ingerslev F, et al. Mixture and single-substance toxicity of selective serotonin reuptake inhibitors toward algae and crustaceans[J]. Environmental Toxicology and Chemistry , 2007, 26(1): 85-91. DOI:10.1897/06-219R.1. |
| [77] | Cunningham V L, Constable D J, Hannah R E. Environmental risk assessment of paroxetine[J]. Environmental Science & Techonology , 2004, 38(12): 3351-3359. |
| [78] | Minagh E, Hernan R, O'Rourke K, et al. Aquatic ecotoxicity of the selective serotonin reuptake inhibitor sertraline hydrochloride in a battery of freshwater test species[J]. Ecotoxicology and Environmental Safety , 2009, 72(2): 434-440. DOI:10.1016/j.ecoenv.2008.05.002. |
| [79] | Minguez L, Ballandonne C, Rakotomalala C, et al. Transgenerational Effects of Two Antidepressants (Sertraline and Venlafaxine) on Daphnia magna Life History Traits[J]. Environmental Science and Technology , 2015, 49(2): 1148-1155. DOI:10.1021/es504808g. |
| [80] | Newman M C. Fundamentals of ecotoxicology[M]. CRC press, 2009. |
| [81] | Gonzalez-Rey M, Bebianno M J. Does selective serotonin reuptake inhibitor (SSRI) fluoxetine affects mussel Mytilus galloprovincialis?[J]. Environmental Pollution , 2013, 173: 200-209. DOI:10.1016/j.envpol.2012.10.018. |
| [82] | Kreke N, Dietrich D R. Physiological endpoints for potential SSRI interactions in fish[J]. Critical Reviews in Toxicology , 2008, 38(3): 215-247. DOI:10.1080/10408440801891057. |
| [83] | Mennigen J A, Martyniuk C J, Crump K, et al. Effects of fluoxetine on the reproductive axis of female goldfish (Carassius auratus)[J]. Physiological Genomics , 2008, 35(3): 273-282. DOI:10.1152/physiolgenomics.90263.2008. |
| [84] | Foran C M, Weston J, Slattery M, et al. Reproductive assessment of Japanese medaka (Oryzias latipes) following a four-week fluoxetine (SSRI) exposure[J]. Archives Environmental Contamination and Toxicology , 2004, 46(4): 511-517. |
| [85] | Lister A, Regan C, Van Zwol J, et al. Inhibition of egg production in zebrafish by fluoxetine and municipal effluents:a mechanistic evaluation[J]. Aquatic Toxicology , 2009, 95(4): 320-329. DOI:10.1016/j.aquatox.2009.04.011. |
| [86] | Mennigen J A, Lado W E, Zamora J M, et al. Waterborne fluoxetine disrupts the reproductive axis in sexually mature male goldfish, Carassius auratus[J]. Aquatic Toxicology , 2010, 100(4): 354-364. DOI:10.1016/j.aquatox.2010.08.016. |
| [87] | Perreault HAN, Semsar K, Godwin J. Fluoxetine treatment decreases territorial aggression in a coral reef fish[J]. Physiology & Behavior , 2003, 79(4-5): 719-724. |
| [88] | van der Ven K, Keil D, Moens L N, et al. Effects of the antidepressant mianserin in zebrafish:molecular markers of endocrine disruption[J]. Chemosphere , 2006, 65(10): 1836-1845. DOI:10.1016/j.chemosphere.2006.03.079. |
| [89] | De Abreu M S, Koakoski G, Ferreira D, et al. Diazepam and fluoxetine decrease the stress response in zebrafish[J]. Plos One , 2014, 9(7): e103232. DOI:10.1371/journal.pone.0103232. |
| [90] | Park J W, Heah T P, Gouffon J S, et al. Global gene expression in larval zebrafish (Danio rerio) exposed to selective serotonin reuptake inhibitors (fluoxetine and sertraline) reveals unique expression profiles and potential biomarkers of exposure[J]. Environmental Pollution , 2012, 167: 163-170. DOI:10.1016/j.envpol.2012.03.039. |
| [91] | Bossus M C, Guler Y Z, Short S J, et al. Behavioural and transcriptional changes in the amphipod Echinogammarus marinus exposed to two antidepressants, fluoxetine and sertraline[J]. Aquatic Toxicology , 2014, 151(SI): 45-56. |
| [92] | Guler Y, Ford A F. Antidepressants make amphipods see the light[J]. Aquatic Toxicology , 2010, 99(3): 397-404. DOI:10.1016/j.aquatox.2010.05.019. |
| [93] | Fong P P, Molnar N. Antidepressants cause foot detachment from substrate in five species of marine snail[J]. Marine Environmental Research , 2013, 84: 24-30. DOI:10.1016/j.marenvres.2012.11.004. |
| [94] | Di Poi C, Darmaillacq A S, Dickel L, et al. Effects of perinatal exposure to waterborne fluoxetine on memory processing in the cuttlefish Sepia officinalis[J]. Aquatic Toxicology , 2013, 132: 84-91. |
| [95] | Fong P P, Hoy C M. Antidepressants (venlafaxine and citalopram) cause foot detachment from the substrate in freshwater snails at environmentally relevant concentrations[J]. Marine Freshwater Behaviour Physiology , 2012, 45(2): 145-153. DOI:10.1080/10236244.2012.690579. |