焦炉气(coke-oven gas, COG)是炼焦工业的副产气体,主要包括H2 (58%~60%),CH4 (23%~27%),CO (5%~8%),CO2 (≤ 3%)以及一些烃类[1-2]。焦炉气作为炼焦行业的富氢废气有着多种用途,可作为燃料,也可作为生产甲醇、二甲醚和天然气等化工产品的原料。其中我国焦炉气制甲醇(coke-oven gas-to-methanol: CGtM)总产能已达1 100万吨,约占甲醇总产能17%左右[3]。焦炉气富氢少碳的特点使其水蒸汽重整合成气氢碳比4~5,显著高于甲醇合成所需的理想氢碳比2,而焦炉气干重整技术所得合成气氢碳比低于2[2]。焦炉气部分氧化的合成气氢碳比介于蒸汽重整和干重整之间,该技术目前已被广泛应用。但该技术合成甲醇仍面临氢气过剩使大量氢气不能被有效利用的问题[4]。董永波[5]针对焦炉气制甲醇过程中焦炉气利用率低的生产现状,提出了焦炉气制甲醇补充二氧化碳的方法,以及优化焦炉气成分,达到提高焦炉气利用率的目的。YI等[6]进一步建立了焦炉气与二氧化碳重整制甲醇的新流程,并进行分析得到新流程相比焦炉气制甲醇工艺能源节约5%~10%。焦炉气制甲醇中空分单元在生产纯氧的同时副产纯度高达99.99%的氮气,而氮气大多用于冷冻水降温后予以放空[7]。焦炉气制甲醇驰放气中氢气的体积分数在70%以上,可通过变压吸附(pressure swing adsorption: PSA)提氢与空分单元的剩余氮气作为合成氨的原料[8]。因此本研究将建立焦炉气制甲醇联合弛放气合成氨的工艺技术流程,并对整个工艺进行全流程模拟,从技术经济性能方面分析比较新流程与传统焦炉气制甲醇过程的优劣。
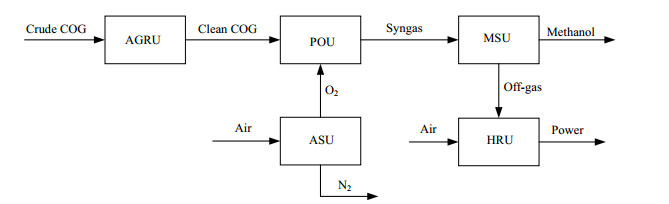
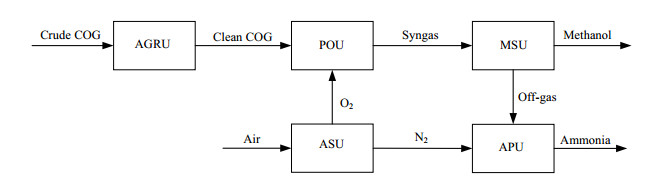
2 焦炉气制甲醇联合驰放气合成氨过程焦炉气制甲醇的工艺流程如图 1所示。焦炉气首先在酸性气体脱除单元(acid gas removal unit: AGRU)除去二氧化碳和硫化物,然后与空分单元(air separation unit: ASU)的氧气一起在部分氧化单元(partial oxidation unit: POU)发生部分氧化反应生成合成气,最后合成气在甲醇合成单元(methanol synthesis unit: MSU)生成甲醇,驰放气再进入热量回收单元(heat recovery unit: HRU)与空气燃烧产生动力。焦炉气制甲醇联合驰放气合成氨(coke-oven gas-to-methanol and ammonia: CGtMA)的工艺流程如图 2所示,焦炉气制甲醇的驰放气先通过变压吸附(PSA)得到99.9%的氢气[8],与空分单元的氮气一起进入氨合成单元(ammonia production unit: APU)先脱氧脱水,再经压缩机压缩到20 MPa后进入3级合成氨反应器。
|
图 1 焦炉气制甲醇流程图 Fig.1 Flow chart of the CGtM process |
|
图 2 焦炉气制甲醇联合驰放气合成氨流程图 Fig.2 Flow chart of the CGtMA process |
本文首先对上述工艺流程进行建模模拟,然后对2条工艺路线进行系统分析。采用低温甲醇洗技术来建立酸性气体二氧化碳和硫化物的脱除过程模型[9-10]。焦炉气首先进入酸性气体吸收塔底部被自上而下的223 K的低温甲醇逆流吸收。脱碳和脱硫均在酸性气体吸收塔中进行。出甲醇再生塔的甲醇贫液经过冷却后进入吸收塔顶部,与吸收塔底部的粗焦炉气逆流吸收得到洁净焦炉气。酸性气体吸收塔釜液经脱吸塔脱除CO2后进入浓缩塔。在浓缩塔底部输入低压氮气与甲醇富液逆流接触,使甲醇中H2S得到富集,使其它杂质气体脱除甲醇液排出系统。从H2S浓缩塔底出的含硫甲醇富液,经过加热后进入甲醇再生塔底部精馏得到塔顶甲醇贫液作为吸收剂循环使用,而塔顶得到的H2S进入硫回收过程。在过程建模和模拟中,酸性气体吸收塔、脱吸塔、浓缩塔和甲醇再生塔均采用RadFrac模型,压缩机选用Compr模型,闪蒸罐采用Flash模型,换热器采用HeaterX模型。
焦炉气部分氧化反应主要包括燃烧反应和重整反应,其中燃烧反应如式(1)~(3)所示,而重整反应如式(4)~(6)所示[11]。由于该反应动力学研究较少,本研究采用RGibbs模型来模拟部分氧化反应,其反应温度和压力分布设定为1 148 K和0.1 MPa [11-12]。
| ${\text{CH}_4} + 2{\text{O}_2} \to {\text{CO}_2} + 2{\text{H}_2}\text{O}$ | (1) |
| $2{\text{CH}_4} + 3{\text{O}_2} \to 2\text{CO} + 4{\text{H}_2}\text{O}$ | (2) |
| $2{\text{H}_2} + {\text{O}_2} \to 2{\text{H}_2}\text{O}$ | (3) |
| ${\text{CH}_4} + {\text{H}_2}\text{O} \leftarrow \to \text{CO} + 3{\text{H}_2}$ | (4) |
| ${\text{CH}_4} + {\text{CO}_2} \leftarrow \to 2\text{CO} + 2{\text{H}_2}$ | (5) |
| ${\text{CO}_2} + {\text{H}_2} \leftarrow \to \text{CO} + {\text{H}_2}\text{O}$ | (6) |
从部分氧化反应器出来的合成气经压缩和换热后,与甲醇合成循环气混合进入甲醇合成反应器反应得到粗甲醇,再经加压精馏和常压精馏获得高纯度甲醇。未反应的合成气一部分作为循环气循环回甲醇合成反应器,另一部分则进入余热回收单元。甲醇合成反应器中发生的主要反应如式(7)~(9)所示[13-14]。在反应中将Cu-Zu-Al作为催化剂,反应温度和压力分别设定为513 K和8.2 MPa [15-16]。
| $\text{CO} + 2{\text{H}_2} \leftarrow \to {\text{CH}_3}\text{OH}$ | (7) |
| ${\text{CO}_2} + 3{\text{H}_2} \leftarrow \to {\text{CH}_3}\text{OH} + {\text{H}_2}\text{O}$ | (8) |
| ${\text{CO}_2} + {\text{H}_2} \leftarrow \to \text{CO} + {\text{H}_2}\text{O}$ | (9) |
选用Lurgi低压合成甲醇工艺建立过程模型[17],甲醇合成反应器选用REquil模型,加压精馏塔和常压精馏塔选用RadFrac模型,压缩机选用Compr模型,闪蒸罐选用Flash模型,换热器选用HeatX模型。未反应合成气则通过FSplit模型分成两股,大部分循环回甲醇合成塔,而少量作为驰放气。
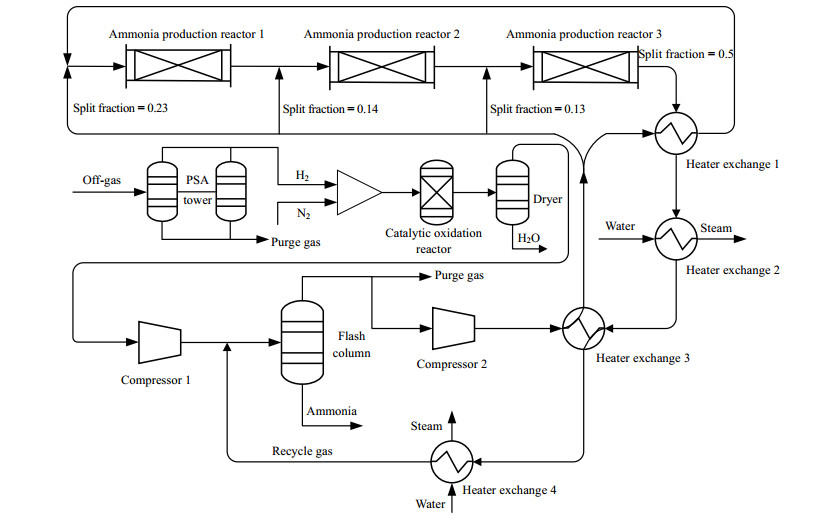
驰放气合成氨工艺模型如图 3所示,其中原料气H2和N2按照3:1的比例混合后,通过催化氧化脱除氧气和通过甲烷化脱除CO和CO2,这两类反应均采用REquil模型[18]。新鲜原料气与循环气一起经过闪蒸,压缩和换热后按照图 3的分配比例进入到3个合成氨反应器[19]。反应压力和温度分别设定为20 MPa和673~773 K,并通过加入冷物料对3个合成反应器进行级间冷却来提高合成氨单程转化率。合成氨反应及其动力学方程分别如式(10)、(11)所示[20]。建模时合成氨反应器采用RPlug模型,然而合成氨产品分离过程采用常压Flash模型。未反应气大部分与新鲜气一起进入反应系统,少量气体作为驰放气排出到系统之外。
| ${\text{N}_2} + 3{\text{H}_2} \leftarrow \to 2\text{N}{\text{H}_3}$ | (10) |
| ${r_{{\rm{N}}{{\rm{H}}_3}}} = \frac{{2f}}{{{\rho _{{\rm{cat}}}}}}\left( {{k_1}\frac{{{p_{{{\rm{N}}_2}}}p_{{{\rm{H}}_2}}^{1.5}}}{{{p_{{\rm{N}}{{\rm{H}}_3}}}}} - {k_{ - 1}}\frac{{{p_{{\rm{N}}{{\rm{H}}_3}}}}}{{p_{{{\rm{H}}_2}}^{1.5}}}} \right)$ | (11) |
|
图 3 焦炉气制甲醇中驰放气合成氨工艺流程图 Fig.3 Flow chart of the off-gas-to-ammonia process in CGtM |
式中p是分压(bar),T是温度(K),ρcat催化剂堆积密度(kg·m-3),f催化剂活性的矫正因子(f = 4.75),正反应:k1 = 1.79×104 e-10 475/T,逆反应:k-1 = 2.75×1016 e-23 871/T。
4 模型验证和系统分析 4.1 模型验证焦炉气制甲醇过程焦炉气消耗和电耗分别为2 145 m3·t-1和673 kWh·t-1与文献[6]中的2 200 m3·t-1和620 kWh·t-1比较接近。新的氨合成单元的结果验证如表 1所示,首先采用文献中的输入数据对其模拟结果进行验证,与文献结果相比误差很小。采用本文的合成氨原料气组成作为输入数据得到的模拟结果与文献中的数据仍比较接近,但误差相对较大,主要是因为本文的合成氨原料气未涉及甲烷和氩气所致。
|
|
表 1 氨合成单元的结果验证 Table 1 Verification results of ammonia production |
氢元素利用率(ε)是衡量焦炉气化工转化性能的一项关键指标,其可通过计算产品的含氢量与原料含氢量的比值来确定。对本研究所涉及的过程来来说,进口有效含氢组分为焦炉气,出口的有效含氢组分为甲醇和氨。㶲是系统所处状态变化到基准态所作出的最大有用功或所消耗的最小有用功。㶲效(η)则是衡量焦炉气化工转化性能的另一重要指标[16],其可用过程的输出㶲Exout与输入㶲Exin的比值η表示,如式(12)所示[21]。
| $\eta = \frac{{E{x_\text{out}}}}{{E{x_\text{in}}}}$ | (12) |
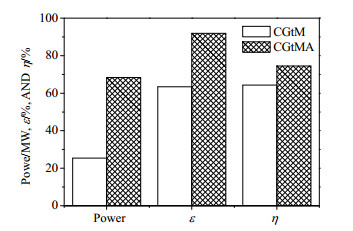
在焦炉气消耗为46.6 t·h-1下,焦炉气制甲醇的甲醇产量为53.2 t·h-1,而新过程在生产53.2 t·h-1的甲醇基础上,由驰放气中的3 t·h-1氢气和空分单元的14 t·h-1氮气反应得到17 t·h-1氨。焦炉气联产甲醇和氨的氢利用率由单产系统的63.4%提高到91.9%,如图 4所示。焦炉气制甲醇和联产过程的动力消耗和㶲效也如图 4所示,联产过程产品的㶲相比单产过程增加95 MW,而其动力消耗同样增加43 MW,综合考虑联产过程的㶲效比单产过程的㶲效提高约10%。
|
图 4 CGtM和CGtMA氢元素利用率(ε)、能耗和㶲效(η) Fig.4 Hydrogen utilization efficiency (ε), energy consumption and exergy efficiency (η) of CGtM and CGtMA |
空分单元,酸性气体净化单元,甲烷部分氧化重整单元和甲醇合成单元的主要设备投资取自文献[22]和[23],而氨合成单元投资取自文献[24]。焦炉气制甲醇投资约2.03亿US$,联产甲醇和氨新流程的投资相比焦炉气制甲醇的投资增加约81.3%,这主要是PSA分离和氨合成单元投资增加所致。
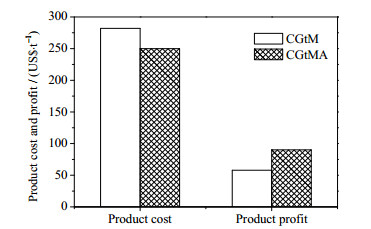
焦炉气制甲醇及新流程的产品成本和利润计算模型参考本文作者之前发表的论文[16-17]。产品成本(PC, product cost)计算如式(13)所示,其为原料成本(CR)、公用工程成本(CU)、操作 & 维修费用(CO & M)、折旧费用(CD)、管理费用(CPOC)、行政费用(CAC)、销售费用(CDSC)和利税(CGET)之和减去副产品氨销售收入(IA)。利润为产品总销售收入与产品成本的差值。原料和公用工程费用以单耗和市场价格计算。价格分别取为焦炉气77 US$·km-3 [6]、电108 US$·(MW·h)-1 [16]、甲醇340 US$·t-1 [25]和氨580 US$·t-1 [24]。折旧费按15年直线折旧,残值为4%。利税根据文献设定为毛利的25%[6]。焦炉气制甲醇及新流程的产品成本和利润如图 5所示。由于大量较高价值氨的合成使新过程的成本比单产甲醇过程低11.2%,而其利润比单产甲醇过程高54.6%。
| $ {\rm{PC = }}{C_{\rm{R}}}{\rm{ + }}{C_{\rm{U}}}{\rm{ + }}{C_{{\rm{O}}\& {\rm{M}}}}{\rm{ + }}{C_{\rm{D}}}{\rm{ + }}{C_{{\rm{POC}}}}{\rm{ + }}{C_{{\rm{AC}}}}{\rm{ + }}{C_{{\rm{DSC}}}}{\rm{ + }}{C_{{\rm{GET}}}}{\rm{ - }}{I_{\rm{A}}}$ | (13) |
|
图 5 CGtM和CGtMA的产品成本和利润 Fig.5 Products cost and profits of CGtM and CGtMA |
本文建立了一个焦炉气制甲醇联合弛放气合成氨的工艺流程。在该流程中,焦炉气制甲醇通过PSA分离得到氢气和其它可燃气体,其中氢气与空分单元的剩余氮气合成氨。焦炉气联产甲醇和氨过程具有以下4个优势:(1)通过驰放气提氢和空分氮气的耦合,实现了对焦炉气资源的有效利用,避免了富氢驰放气直接燃烧发电效率低的问题,将氢利用率由63.4%提高到91.9%。(2)在原料焦炉气消耗为46.6 t·h-1的条件,联产过程生产甲醇53.2 t·h-1,同时副产氨17.0 t·h-1。(3)焦炉气联产过程的㶲效比焦炉气单产甲醇过程提高了约10%。(4)焦炉气联产过程尽管投资比单产甲醇过程高81.3%,但其成本低11.2%,而利润高54.6%。
符号说明:
| APU | —氨生产单元 | r | —反应速率,kmol·(kg cat·h)-1 |
| ASU | —空分单元 | T | —温度,K |
| C | —成本,US$·t-1 | ρ | —密度,kg·m-3 |
| CGtM | —焦炉气制甲醇 | η | — 㶲效,% |
| CGtMA | —焦炉气制甲醇联合驰放气合成氨 | ε | —氢元素利用率,% |
| COG | —焦炉气 | 下标 | |
| Ex | — 㶲,MW | A | —氨 |
| f | —催化剂活性的矫正因子 | AC | —行政 |
| HRU | —余热回收单元 | D | —折旧 |
| I | —营业收入,US$·t-1 | DSC | —销售 |
| MSU | —甲醇合成单元 | GET | —利税 |
| P | —分压,bar | O & M | —操作和维修 |
| PC | —产品成本,US$·t-1 | POC | —管理 |
| POU | —部分氧化单元 | R | —原料 |
| PSA | —变压吸附 | U | —公用工程 |
| [1] |
YI Q, WU G S, GONG M H, et al. A feasibility study for CO2 recycle assistance with coke oven gas to synthetic natural gas[J]. Applied Energy, 2017, 193: 149-161. DOI:10.1016/j.apenergy.2017.02.031 |
| [2] |
BERMUDEZ J M, ARENILLAS A, MENENDEZ J A. Equilibrium prediction of CO2 reforming of coke oven gas:Suitability for methanol production[J]. Chemical Engineering Science, 2012, 82: 95-103. DOI:10.1016/j.ces.2012.07.012 |
| [3] |
陈魁. 我国甲醇产业现状与市场分析[J]. 化学工业, 2015, 33(11): 8-14. CHEN K. Current situation and market analysis of methanol industry in China[J]. Chemical Industry, 2015, 33(11): 8-14. DOI:10.3969/j.issn.1673-9647.2015.11.002 |
| [4] |
崔凤桐, 赵立宁, 李彦坤, 等. 焦炉煤气配转炉和高炉煤气制甲醇探讨[J]. 燃料与化工, 2017, 48(1): 5-7. CUI F T, ZHAO L N, LI Y K, et al. Discussion of methanol synthesis from COG with LDG and BFG[J]. Fuel & Chemical Processes, 2017, 48(1): 5-7. |
| [5] |
董永波. 焦炉气制甲醇补充二氧化碳提高焦炉气利用率[J]. 氮肥技术, 2013, 34(2): 12-19. DONG Y B. Supplement CO2 in COG producing methanol to improve utilization of COG[J]. Nitrogenous Fertilizer Technology, 2013, 34(2): 12-19. |
| [6] |
YI Q, GONG M H, HUANG Y, et al. Process development of coke oven gas to methanol integrated with CO2 recycle for satisfactory techno-economic performance[J]. Energy, 2016, 112: 618-628. DOI:10.1016/j.energy.2016.06.111 |
| [7] |
顾维, 谢全安. 焦炉气制甲醇驰放气合成氨工艺研究[J]. 河北化工, 2011, 34(3): 15-17. GU W, XIE Q A. Study on the synthetic ammonia technology by using coke-oven gas to methanol exhausted gas[J]. Hebei Chemical Industry, 2011, 34(3): 15-17. DOI:10.3969/j.issn.1003-5059.2011.03.006 |
| [8] |
张信凯, 卜令兵. 综合利用焦炉煤气制甲醇尾气生产合成氨[J]. 天然气化工, 2014, 39: 60-61. ZHANG X K, BU L B. Comprehensive utilization of tail gas of coke-oven gas based methanol production for ammonia synthesis[J]. Natural Gas Chemical Industry, 2014, 39: 60-61. |
| [9] |
LIU X, LIANG J N, Xiang D, et al. A proposed coal-to-methanol process with CO2 capture combined organic rankine cycle (ORC) for waste heat recovery[J]. Journal of Cleaner Production, 2016, 129: 53-64. DOI:10.1016/j.jclepro.2016.04.123 |
| [10] |
SHARMA I, HOADLEY A F A, MAHAJANI S M, et al. Multi-objective optimization of a RectisolTM process for carbon capture[J]. Journal of Cleaner Production, 2016, 119: 196-206. DOI:10.1016/j.jclepro.2016.01.078 |
| [11] |
GONG M H, YI Q, HUANG Y, et al. Coke oven gas to methanol process with CO2 recycle for high energy efficiency, economic benefits and low emissions[J]. Energy Conversion and Management, 2017, 133: 318-331. |
| [12] |
RAZZAG R, LI C, ZHANG S. Coke oven gas:Availability, properties, purification, and utilization in China[J]. Fuel, 2013, 113: 287-299. DOI:10.1016/j.fuel.2013.05.070 |
| [13] |
陈鹏, 唐黎华, 张琪, 等. C306催化剂上甲醇合成宏观动力学研究[J]. 高校化学工程学报, 2010, 24(4): 602-607. CHEN P, TANG L H, ZHANG Q, et al. Macro-kinetics of methanol synthesis over C306 catalyst[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 602-607. DOI:10.3969/j.issn.1003-9015.2010.04.010 |
| [14] |
ZHANG C D, JUN K W, GAO R X, et al. Carbon dioxide utilization in a gas-to-methanol process combined with CO2/steam-mixed reforming:Techno-economic analysis[J]. Fuel, 2017, 190: 303-311. DOI:10.1016/j.fuel.2016.11.008 |
| [15] |
柳祥伟, 唐黎华, 吴勇强, 等. 8 MPa条件下甲醇合成的宏观动力学[J]. 高校化学工程学报, 2011, 25(4): 603-608. LIU X W, TANG L H, WU Y Q, et al. Global kinetics of methanol synthesis at 8 MPa[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(4): 603-608. DOI:10.3969/j.issn.1003-9015.2011.04.010 |
| [16] |
XIANG D, QIAN Y, MAN Y, et al. Techno-economic analysis of the coal-to-olefins process in comparison with the oil-to-olefins process[J]. Applied Energy, 2014, 113: 639-647. DOI:10.1016/j.apenergy.2013.08.013 |
| [17] |
XIANG D, LIU X, MAI Z H, et al. Techno-economic performance of the CTO process with CCS[J]. Chemical Engineering Journal, 2014, 240: 45-54. DOI:10.1016/j.cej.2013.11.051 |
| [18] |
PEREZ L E A, CAPIRO O G, KARELOVIC A, et al. A modelling approach to the techno-economics of biomass-to-SNG/methanol systems:standalone VS integrated topologies[J]. Chemical Engineering Journal, 2016, 286: 663-678. DOI:10.1016/j.cej.2015.11.005 |
| [19] |
ORREGO D F, JUNIOR S D O. Modeling and optimization of an industrial ammonia synthesis unit:An exergy approach[J]. Energy, 2017, 137: 234-250. DOI:10.1016/j.energy.2017.06.157 |
| [20] |
ARAUJO A, STOGESTAD S. Control structure design for the ammonia synthesis process[J]. Computer & Chemical Engineering, 2008, 32: 2920-2932. |
| [21] |
FEYZI V, BEHESHTI M, KHARAJJ A G. Exergy analysis:A CO2 removal plant using a-MDEA as the solvent[J]. Energy, 2017, 118: 77-84. DOI:10.1016/j.energy.2016.12.020 |
| [22] |
ZHOU L, HU S Y, LI Y R. Study on co-feed and co-production system based on coal and natural gas for producing DME and electricity[J]. Chemical Engineering Journal, 2008, 136(1): 31-40. |
| [23] |
ZHOU L, HU S Y, CHEN D J, et al. Study on systems based on coal and natural gas for producing dimethyl ether[J]. Industrial Engineering Chemical Research, 2009, 48(8): 4101-4108. DOI:10.1021/ie8006177 |
| [24] |
ANDERSSON J, LUNDGREN J. Techno-economic analysis of ammonia production via integrated biomass gasification[J]. Applied Energy, 2014, 130: 484-490. DOI:10.1016/j.apenergy.2014.02.029 |
| [25] |
杜芳彦, 王朝霞, 杜明明. 甲醇价格项目中原料甲醇来源的选择性分析[J]. 华电技术, 2017, 39(11): 70-72. DU F Y, WANG Z X, DU M M. Selective analysis of source of raw methanol in methanol processing project[J]. Huadian Technology, 2017, 39(11): 70-72. DOI:10.3969/j.issn.1674-1951.2017.11.025 |




