2. 美国俄亥俄大学 化学与生物分子工程系,Athens OH 45701
2. Department of Chemical and Biomolecular Engineering, The Ohio State University, Athens OH 45701, America
随着锂电池产业的迅速发展,废旧锂电池的回收处理问题日益受到关注。生物浸出技术可实现废旧锂电池中钴、锂等金属的回收,并且有安全绿色、反应条件温和等优点,因此备受关注。研究发现,冶金微生物构成的生物被膜结构在生物浸出过程中起到关键作用[1-2]。生物被膜是指细菌黏附于接触表面,分泌多糖基质、纤维蛋白等胞外聚合物(extracellular polymeric substances,EPS),将其自身包裹而形成的三维聚合物网络[3]。EPS介导的细菌对矿物的黏附和生物被膜的形成启动并强化了生物浸出过程[4-6],前人研究表明,生物浸出效率与生物被膜中的黏附菌密切相关[7]。YANG等[8]发现黏附菌对铜提取率的贡献高达50.5%。FENG等[9]证明通过直接增强Acidithiobacillus ferrooxidans的黏附行为能改善黄铜矿的生物浸出。
生物浸出过程中,金属离子的不断溶出会形成金属离子胁迫环境,这会对生物被膜结构和功能产生不利影响,最终影响金属离子的浸出效率。TANG等[10-11]发现高浓度的Mg2+会通过减少IV型菌毛的形成降低A. ferrooxidans黏附能力,抑制生物被膜的形成,导致浸出率降低,而添加感应信号分子酰化高丝氨酸内酯(acyl-homoserine lactones,AHL)能通过促进生物被膜的形成,提高A. ferrooxidans对Mg2+胁迫的抗性。目前,生物浸出废旧锂电池电极材料过程存在“料浆浓度限制”等问题[12],WU等[13]的研究指出,在Li+、Co2+胁迫条件下,冶金微生物胞内ROS含量的迅速升高使细菌生长活性下降,这可能是导致料浆浓度限制的重要原因之一。通过外源添加抗氧化物质如谷胱甘肽(glutathione,GSH)控制细菌胞内ROS水平已被证明是一种有效缓解生物浸出过程受到的氧化胁迫损伤的手段[14]。NAC是一种广谱型抗氧化剂,可中和氧自由基[15],并促进GSH的合成[16],但NAC在生物浸出钴酸锂体系中是否也具有抗氧化功能,同时对生物被膜的结构与功能影响也尚未见公开报道。
本研究针对生物浸出钴酸锂过程中Li+、Co2+胁迫导致的料浆浓度限制问题,探究了Li+、Co2+胁迫对冶金微生物菌群生物被膜的结构、生物量、死活菌分布和黏附菌胞内ROS含量等特征的影响,研究建立Li+、Co2+胁迫体系浓度、胞内ROS含量、生物被膜结构和生物浸出效率间的关系,并考察外源添加抗氧化剂NAC对菌群生物被膜和生物浸出效率的影响。
2 实验材料和方法 2.1 菌种和培养基以Leptospirillum ferriphilum和Sulfobacillus thermosulfidooxidans为主的冶金微生物菌群[13],培养基为9K培养基,组成为(g·L-1):(NH4)2SO4 3.0,KCl 0.1,MgSO4·7H2O 0.5,K2HPO4 0.5,Ca(NO3)2 0.01,用浓硫酸调节pH至1.50左右。
2.2 实验矿样实验所用黄铁矿购自新疆某金矿,其中Au含量(45±5) g·t-1,Ag含量(60±2) g·t-1,其他元素含量分别为Fe (28±1)%,S (28±2)%,基本不含C、Cu、Pb、Zn。黄铁矿破碎研磨后筛分获得粒径在70~90 μm的矿粉。块状黄铁矿切割成片,用砂纸打磨成长、宽约0.5 cm,厚约0.1 cm且表面光滑平整的片状黄铁矿。
2.3 实验材料主要实验试剂:LIVE/DEAD BacLight荧光试剂盒L13152,美国Sigma;硫酸铵、硫酸,分析纯,上海凌峰化学试剂有限公司;钴酸锂、硫酸锂、七水合硫酸钴、N-乙酰-L-半胱氨酸,分析纯,上海阿拉丁生化科技股份有限公司。
主要实验仪器:H2050R湘仪台式高速冷冻离心机,长沙高新技术湘仪离心机仪器有限公司;TQHZ-2002A恒温振荡培养箱,太仓华美生化仪器厂;荧光共聚焦显微镜(ZEISS LSM 700,German);扫描电子显微镜(JEOL JSM-840,Japan)。
2.4 生物浸出钴酸锂实验将10 mL菌液接种到含有10 g黄铁矿粉和90 mL无菌9K培养基的250 mL摇瓶中,在42 ℃、180 r·min-1条件下培养,向培养体系中添加钴酸锂粉末并定时取样检测pH、Eh、Fe2+和Fe3+浓度及Li+、Co2+浸出效率,具体操作参照刘晓翠[14]的方法。
2.5 黄铁矿颗粒表面黏附菌的收集采用添加Li2SO4和CoSO4·7H2O的方法构建不同浓度的金属离子胁迫模拟体系,如无特别指出,本文研究结果均为模拟体系中完成。表 1为不同钴酸锂料浆浓度下钴酸锂完全浸出所对应的理论Li+和Co2+浓度。
|
|
表 1 不同钴酸锂料浆浓度对应的理论Li+和Co2+浓度 Table 1 Li+ and Co2+ concentrations corresponding to different LiCoO2 pulp densities |
向培养2 d的冶金微生物菌群培养液中添加Li2SO4和CoSO4·7H2O构建离子胁迫模拟体系,继续培养5 d后取出矿渣,用无菌9K培养基洗去表面游离菌,加入5 mL含有0.10% Tween-20的无菌9K培养基,在漩涡振荡器上振荡5 min,洗脱矿石表面的黏附菌,1 000 r·min-1离心1 min,收集上清,重复3次上述操作。收集的上清10 000 r·min-1离心10 min,获得黏附菌。
2.6 黄铁矿颗粒单位表面积上黏附菌数量的测定向2.5节中获得的黏附菌中加入5 mL无菌9K培养基重悬,显微镜下用血球计数板计数,得到黏附菌数量n,黄铁矿矿渣重量m为10 g,密度ρ为4.9 g·cm-3,假设黄铁矿颗粒为均匀球体,半径r为45 μm,则黄铁矿颗粒单位表面积上黏附菌数量c计算公式如下:
| $c = \frac{{n\rho r}}{{3m}}$ | (1) |
向2.5节获得的黏附菌中加入5 mL无菌9K培养基重悬,取1 mL重悬液用DCFH[17]法检测ROS,记录荧光值FL,另取3 mL置于玻璃比色皿中测定吸光度OD600,取荧光值与OD值的比值为胞内ROS含量的代表,记FL/OD600。
2.8 扫描电子显微镜(SEM)观察片状黄铁矿表面吸附形貌将2.5节中获得的黏附菌接入放有片状黄铁矿的无菌9K培养基中,42 ℃静置培养7 d后将片状黄铁矿取出,用灭菌生理盐水洗涤(3次)培养形成的生物被膜。参照LI等[18]的方法,使用SEM观察片状黄铁矿表面吸附形貌。
2.9 激光共聚焦显微镜(CLSM)观察片状黄铁矿表面生物被膜样品处理参照LI等[18-19]的方法,将片状黄铁矿浸没在LIVE/DEAD荧光染液中(含有SYTO9和PI两种染料,SYTO9染活菌,发出绿色荧光,而PI染死菌,发出红色荧光),避光静置30 min,随后用灭菌蒸馏水洗涤以除去多余荧光染料,避光自然干燥后使用CLSM观察生物被膜的微观结构。
3 实验结果与讨论 3.1 生物浸出钴酸锂过程的料浆浓度限制问题钴酸锂添加浓度对冶金微生物菌群浸出钴酸锂过程的特征影响见图 1。图 1(a)表明正常条件下由于冶金微生物的产酸性,生物浸出体系pH不断下降,但随着钴酸锂料浆浓度增加,pH下降幅度减小。在5.0% (w·v-1)料浆浓度下,pH有升高趋势,说明生物浸出钴酸锂过程需耗酸,随着钴酸锂料浆浓度增加,冶金微生物菌群产酸能力逐渐受到抑制。
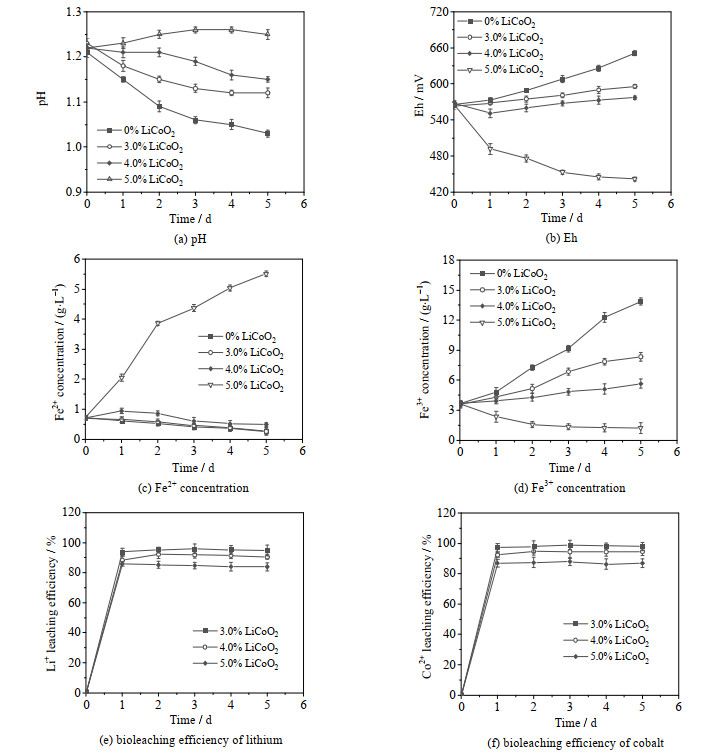
|
图 1 钴酸锂添加浓度对生物浸出钴酸锂过程的特征影响 Fig.1 Effects of lithium cobalt oxide concentration on the characteristics of biological leaching of lithium cobalt oxide |
图 1(b)、1(c)和1(d)分别为体系氧化还原电位Eh、Fe2+和Fe3+浓度,反映了细菌的铁氧化活性。由图可知,随着钴酸锂料浆浓度增加,细菌铁氧化活性受到越来越大的抑制。与对照相比,5.0% (w·v-1)料浆浓度下,Eh在第1 d即迅速下降,此后一直降至442 mV,Fe2+浓度由起始的0.73升高至5.51 g·L-1,Fe3+浓度由起始的3.65降低至1.22 g·L-1,表明此时细菌的铁氧化活性基本丧失。
由图 1(e)和1(f)可知,在3.0% (w·v-1)料浆浓度下,Li+和Co2+的浸出效率在第3 d达到最高,分别为95.85%和98.85%。在4.0% (w·v-1)料浆浓度下,Li+、Co2+浸出效率在第2 d达到最高,分别为92.16%和94.66%,而在5.0% (w·v-1)料浆浓度下,Li+浸出效率在第1 d达到最高,为85.94%,Co2+浸出效率在第3 d达到最高,为87.85%。这表明生物浸出钴酸锂过程中,随着钴酸锂添加浓度增加,冶金微生物的产酸能力、铁氧化活性及Li+、Co2+浸出效率都逐渐降低,且降低幅度随钴酸锂添加浓度增加而增大。
3.2 Li+、Co2+胁迫下黏附菌和生物被膜特征研究前人研究发现Li+和Co2+对冶金微生物产生金属离子胁迫作用,是导致料浆浓度限制问题的重要原因之一[13-14]。生物被膜是冶金微生物抵御金属离子胁迫等不利影响的先天防御机制[20],被膜中的黏附菌活性比游离菌更高,与生物浸出过程的浸出效率密切相关。实验探究了不同浓度Li+、Co2+条件下,生物浸出体系中的黏附菌量,结果如图 2所示,黏附菌数量随Li+、Co2+浓度增加呈现大幅降低趋势。非金属离子胁迫的正常条件下,黄铁矿颗粒单位表面积黏附菌量为8.14 × 106 cells·cm-2,分别为3%、4%、5%的Li+、Co2+胁迫体系的2.48、3.75、10.30倍,说明随着Li+、Co2+胁迫压力的增加,细菌的黏附能力受到极大抑制。细菌在矿物表面的黏附是生物浸出必不可少的步骤[21],TANG等[10-11]发现Mg2+胁迫能通过抑制A. ferrooxidans IV型菌毛的形成降低其黏附能力,进而影响生物被膜的形成,导致浸出率降低。黏附过程的受限会影响浸出效率,因此推断5.0%的Li+、Co2+胁迫下黏附菌的大量减少是5.0% (w·v-1)钴酸锂生物浸出效率受限的重要原因之一。
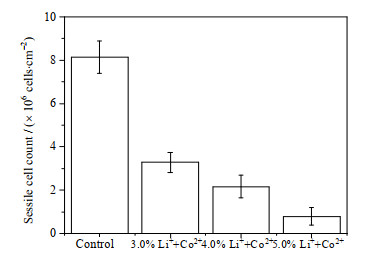
|
图 2 Li+、Co2+胁迫对黄铁矿单位表面积黏附菌数量的影响 Fig.2 Effects of Li+, Co2+ stress on sessile cell count under specific surface area of pyrite |
图 3为冶金微生物菌群在片状黄铁矿表面吸附形貌的SEM图,在非金属离子胁迫的正常条件下(图 3(a)),片状黄铁矿表面呈现出密集的生物被膜,几乎覆盖整个黄铁矿表面,说明此时黏附菌数量较多,分泌出大量EPS包裹自身形成生物被膜。而在5.0% Li+、Co2+胁迫体系下(图 3(b)),黏附菌数量显著减少,生物被膜受到严重破坏,进一步验证了图 2的观点。

|
图 3 片状黄铁矿表面吸附形貌的SEM图 Fig.3 SEM images of pyrite coupons surface |
图 4为表征片状黄铁矿表面生物被膜内黏附菌的死、活菌分布的三维荧光图(图 4(a1)、(b1))和平面荧光图(图 4(a2)、(b2)),其中绿色荧光代表活菌,红色荧光代表死菌,桔黄色一般是死菌和活菌重叠造成。在非金属离子胁迫的情况下(图 4(a1)、(a2)),活菌分布密集,聚集成大片絮团状,死菌量很少。而5.0% Li+、Co2+胁迫体系下(图 4(b1)、(b2)),黏附菌分布很稀疏,并且大多为死菌,活菌不再聚集成团,数量大大减少,说明Li+、Co2+胁迫抑制了冶金微生物的黏附,减少了EPS的产生,生物被膜结构受到破坏。

|
图 4 片状黄铁矿表面的CLSM荧光图 Fig.4 CLSM images of biofilm of pyrite coupons surface |
5.0%的Li+、Co2+胁迫不仅使生物被膜内生物量大幅减少,而且使黏附菌大量死亡,无法形成正常的生物被膜,推断这是5.0% (w·v-1)钴酸锂生物浸出效率受限的直接原因。提高Li+、Co2+胁迫条件下黏附菌的耐受性,促进生物被膜的形成可能是一种有效提高生物浸出效率,解决钴酸锂料浆浓度限制的策略。因此,需要首先探究Li+、Co2+胁迫对黏附菌的影响机制。
前人研究指出,生物浸出体系中金属离子浓度的不断升高会使细菌胞内ROS含量迅速升高[22-24],大量积累的ROS会对细菌造成一系列不利影响[25-26],如灭活细菌胞内必需酶,破坏生物被膜基质内和细菌胞内的蛋白质、脂质和核酸[27],引起氧化胁迫和生长抑制[28],并诱导遗传变异,促进特定生物被膜区域中的细菌死亡,影响生物被膜发育[29]。还有研究表明,非生物胁迫诱导产生的ROS能抑制生物被膜的发育,LI等[30]发现活化水诱导产生的ROS能抑制粪肠球菌生物被膜的发育并减少QS相关致病基因的体外表达。朱雯雯[31]研究发现纳米TiO2光催化诱导产生的ROS通过降解与Escherichia coli K12生物被膜形成有关的感应信号分子阻碍其生物被膜的正常发育。群体感应系统与生物被膜的形成密切相关[32],故ROS可能通过影响感应调节因子的表达来干扰生物被膜的形成和发育[29]。
图 5为不同浓度的Li+、Co2+胁迫下黏附菌胞内ROS含量的变化情况,与对照组相比,Li+和Co2+的加入明显增加了细菌胞内ROS含量,且ROS含量随Li+和Co2+浓度的升高和时间的延长而增多。24 h后,5.0% Li+、Co2+浓度下细菌胞内ROS含量由初始的0.92升高至7.02,是同时刻非金属离子胁迫对照组的3.3倍。这表明黏附菌胞内ROS含量与生物浸出体系中Li+、Co2+含量有直接关系,故推断可能是黏附菌胞内ROS含量的迅速升高抑制了细菌的黏附和生物被膜的形成,进而导致生物浸出效率受限。
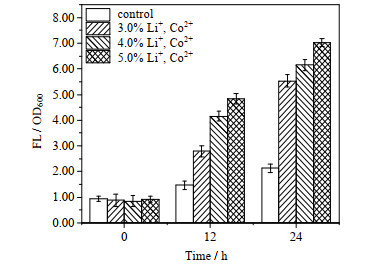
|
图 5 不同浓度Li+和Co2+影响下细菌胞内ROS含量随时间变化情况 Fig.5 ROS profiles as a function of time under different concentrations of both Li+ and Co2+ |
微生物体内往往存在着酶类和非酶类抗氧化系统,使ROS的产生和清除处于动态平衡状态[33],但CÁRDENAS等[34]发现冶金微生物缺乏编码典型氧化应激反应调节因子的基因,且其胞内产生的是非代表性ROS消除酶,当胞内ROS大量累积时,更容易受到氧化胁迫损伤。通过外源添加抗氧化物质来提高微生物抗氧化能力,降低细菌胞内ROS含量已成为一种有效缓解细菌受到的氧化胁迫损伤的手段[13, 35]。GUO等[36]发现ROS参与Listeria monocytogenes的生物被膜形成,其可能充当抑制剂,而NAC可以降低L. monocytogenes的ROS水平,并促进其生物被膜的形成。
考察NAC在生物浸出体系中的抗氧化功能,图 6所示为向5.0% Li+、Co2+胁迫体系中添加0.20 g·L-1 NAC后黏附菌胞内ROS含量变化情况,实验选择在添加Li2SO4和CoSO4·7H2O的同一时间添加NAC。与不添加NAC的对照组相比,添加NAC的实验组黏附菌胞内ROS含量累积速度显著下降,24 h时ROS含量仅为对照组的54.3%,这表明,外源添加NAC的确能消除细菌胞内ROS,缓解ROS迅速累积的趋势,减轻黏附菌受到的氧化胁迫损伤。
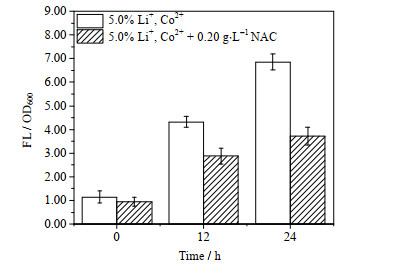
|
图 6 NAC对黏附菌胞内ROS含量的影响 Fig.6 Effects of NAC on intracellular ROS content of sessile cells |
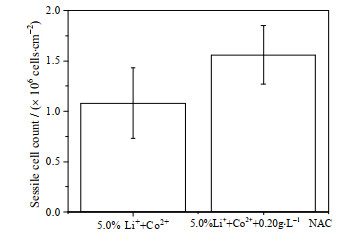
考察外源添加NAC对黄铁矿表面黏附菌和生物被膜的影响,图 7表明5.0% Li+和Co2+胁迫条件下外源添加NAC使黏附菌数量增加,为对照组的1.44倍,图 8(a)所示的SEM观察也表明NAC使片状黄铁矿表面生物量增加。图 8(b1)、(b2)为5.0% Li+和Co2+胁迫下添加0.20 g·L-1 NAC时黏附菌死、活分布的荧光图,对照图 4(b1)、(b2)可知,黏附菌分布较密集,活菌量有增加,表明此时黏附菌大量死亡的现象得到一定缓解。因此,外源加入NAC通过降低黏附菌胞内ROS水平来缓解细菌受到的氧化胁迫损伤,增强了细菌对Li+、Co2+胁迫的耐受性,维持了一定的生物被膜结构。
|
图 7 NAC对黄铁矿单位表面积黏附菌数量的影响 Fig.7 Effects of NAC on sessile cell count under specific surface area of pyrite |

|
图 8 NAC作用下片状黄铁矿表面生物被膜的SEM和CLSM图 Fig.8 SEM and CLSM images of biofilm on pyrite coupons surface treated with NAC |
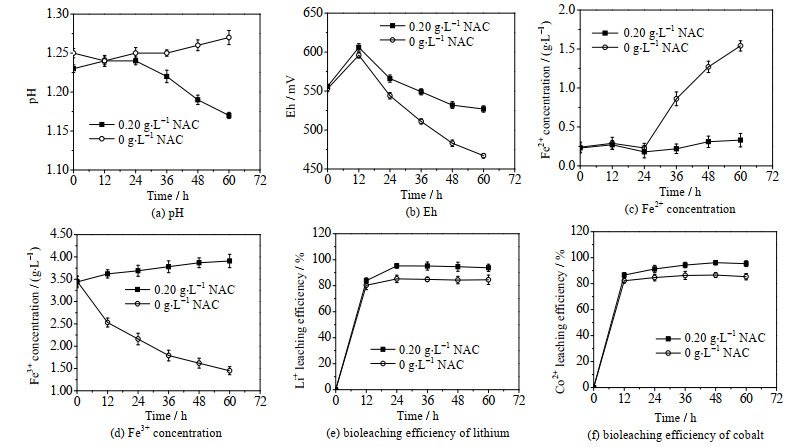
将NAC外源添加策略用于5.0% (w·v-1)钴酸锂的生物浸出实验,NAC添加时间调酸稳定体系pH后,添加量为0.20 g·L-1。由图 9可知,外源NAC的加入实现了5.0% (w·v-1)钴酸锂料浆浓度下生物浸出效率的提高。与对照组细菌活性受到抑制的结果相比,外源添加NAC使体系pH值下降,Eh值、Fe3+浓度和Fe2+浓度维持在相对稳定的值,Li+和Co2+的浸出率分别由原来的85.26%(24 h)和86.59% (48 h)升高至95.13% (24 h)和96.15% (48 h)。
|
图 9 NAC对提高钴酸锂料浆浓度的影响效果研究 Fig.9 Effects of NAC on improving pulp density of LiCoO2 |
综上所述,外源添加的NAC可增强黏附菌对Li+和Co2+的耐受性,提高了5.0% (w·v-1)钴酸锂的浸出效率,原因在于NAC外源添加之后,缓解了由Li+和Co2+胁迫所导致的细菌胞内ROS含量迅速升高的情况,减少了黏附菌和生物被膜受到的氧化胁迫损伤,使生物被膜内的黏附菌能继续保持氧化活性和代谢产酸性能,从而提高生物浸出效率。
4 结论(1) 生物浸出钴酸锂过程中,随着钴酸锂添加浓度的增加,冶金微生物的产酸能力、铁氧化活性及离子浸出效率都逐渐降低,且降低幅度随钴酸锂添加浓度增加而增大。
(2) Li+、Co2+胁迫下黏附菌胞内ROS水平迅速升高,对生物被膜中的黏附菌造成氧化胁迫损伤,导致黏附菌死亡并减少生物被膜形成,这是钴酸锂生物浸出效率受限的重要原因之一。
(3) 通过外源添加抗氧化剂NAC降低了Li+、Co2+胁迫条件下生物被膜中的黏附菌胞内ROS的水平,增强了黏附菌对Li+、Co2+的抗性,维持了黏附菌的活性,最终使5.0% (w·v-1)的钴酸锂生物浸出过程中,Li+和Co2+的浸出效率达到了95.13%和96.15%,分别高出不添加NAC的对照组9.87%和9.56%。
| [1] |
Zhang R Y, Neu T R, Blanchard V, et al. Biofilm dynamics and EPS production of a thermoacidophilic bioleaching archaeon[J]. New Biotechnology, 2019, 51: 21-30. DOI:10.1016/j.nbt.2019.02.002 |
| [2] |
Gonzalez A, Bellenberg S, Mamani S, et al. AHL signaling molecules with a large acyl chain enhance biofilm formation on sulfur and metal sulfides by the bioleaching bacterium Acidithiobacillus ferrooxidans[J]. Applied Microbiology and Biotechnology, 2013, 97(8): 3729-3737. DOI:10.1007/s00253-012-4229-3 |
| [3] |
Balasubramanian S, Aubin-Tam M E, Meyer A S. 3D Printing for the fabrication of biofilm-based functional living materials[J]. Acs Synthetic Biology, 2019, 8(7): 1564-1567. DOI:10.1021/acssynbio.9b00192 |
| [4] |
Li Q, Becker T, Zhang R, et al. Investigation on adhesion of Sulfobacillus thermosulfidooxidans via atomic force microscopy equipped with mineral probes[J]. Colloids and Surfaces B:Biointerfaces, 2019, 173: 639-646. DOI:10.1016/j.colsurfb.2018.10.046 |
| [5] |
Li Q, Sand W. Mechanical and chemical studies on EPS from Sulfobacillus thermosulfidooxidans:from planktonic to biofilm cells[J]. Colloids and Surfaces B-Biointerfaces, 2017, 153: 34-40. DOI:10.1016/j.colsurfb.2017.02.009 |
| [6] |
Diaz M, Castro M, Copaja S, et al. Biofilm formation by the acidophile bacterium Acidithiobacillus thiooxidans Involves c-di-GMP pathway and pel exopolysaccharide[J]. Genes, 2018, 9(2): 113. |
| [7] |
Zhu J, Wang Q, Zhou S, et al. Insights into the relation between adhesion force and chalcopyrite-bioleaching by Acidithiobacillus ferrooxidans[J]. Colloids and Surfaces B:Biointerfaces, 2015, 126: 351-357. DOI:10.1016/j.colsurfb.2014.11.036 |
| [8] |
Yang H, Feng S, Xin Y, et al. Community dynamics of attached and free cells and the effects of attached cells on chalcopyrite bioleaching by Acidithiobacillus sp[J]. Bioresource Technology, 2014, 154: 185-191. DOI:10.1016/j.biortech.2013.12.036 |
| [9] |
Feng S, Yang H, Wang W. Microbial community succession mechanism coupling with adaptive evolution of adsorption performance in chalcopyrite bioleaching[J]. Bioresource Technology, 2015, 191: 37-44. DOI:10.1016/j.biortech.2015.04.122 |
| [10] |
Tang D P, Gao Q Y, Zhao Y, et al. Mg2+ reduces biofilm quantity in Acidithiobacillus ferrooxidans through inhibiting Type IV pili formation[J]. Fems Microbiology Letters, 2018, 365(4): fnx266. |
| [11] |
Tang D, Duan J, Gao Q, et al. Strand-specific RNA-seq analysis of the Acidithiobacillus ferrooxidans transcriptome in response to magnesium stress[J]. Archives of Microbiology, 2018, 200(7): 1025-1035. DOI:10.1007/s00203-018-1503-5 |
| [12] |
Niu Z, Zou Y, Xin B, et al. Process controls for improving bioleaching performance of both Li and Co from spent lithium ion batteries at high pulp density and its thermodynamics and kinetics exploration[J]. Chemosphere, 2014, 109: 92-98. DOI:10.1016/j.chemosphere.2014.02.059 |
| [13] |
WU W, LIU X, ZHANG X, et al. Mechanism underlying the bioleaching process of LiCoO2 by sulfur-oxidizing and iron-oxidizing bacteria[J]. Journal of Bioscience and Bioengineering, 2019, 128(3): 344-354. DOI:10.1016/j.jbiosc.2019.03.007 |
| [14] |
刘晓翠.金属离子对与生物浸出钴酸锂过程的影响机制研究[D].上海: 华东理工大学, 2018. LIU X C. Effect of metal ions on biological leaching of lithium cobaltate[D]. Shanghai: East China University of Science and Technology, 2018. |
| [15] |
Turkmen R, Birdane Y O, Demirel H H, et al. Antioxidant and cytoprotective effects of N-acetylcysteine against subchronic oral glyphosate-based herbicide-induced oxidative stress in rats[J]. Environmental Science and Pollution Research, 2019, 26(11): 11427-11437. DOI:10.1007/s11356-019-04585-5 |
| [16] |
Atkuri K R, Mantovani J J, Herzenberg L A, et al. N-Acetylcysteine-a safe antidote for cysteine/glutathione deficiency[J]. Current Opinion in Pharmacology, 2007, 7(4): 355-359. DOI:10.1016/j.coph.2007.04.005 |
| [17] |
Farrell H, Hayes J, Laffey J, et al. Studies on the relationship between pulsed UV light irradiation and the simultaneous occurrence of molecular and cellular damage in clinically-relevant Candida albicans[J]. Journal of Microbiological Methods, 2011, 84(2): 317-326. DOI:10.1016/j.mimet.2010.12.021 |
| [18] |
Li Y, Jia R, Al-Mahamedh H, et al. Enhanced biocide mitigation of field biofilm consortia by a mixture of D-amino acids[J]. Frontiers in Microbiology, 2016, 7: 896. |
| [19] |
Ma L, Wang H, Wu J, et al. Metatranscriptomics reveals microbial adaptation and resistance to extreme environment coupling with bioleaching performance[J]. Bioresource Technology, 2019, 280: 9-17. DOI:10.1016/j.biortech.2019.01.117 |
| [20] |
Jeremic S, Beškoski V P, Djokic L, et al. Interactions of the metal tolerant heterotrophic microorganisms and iron oxidizing autotrophic bacteria from sulphidic mine environment during bioleaching experiments[J]. Journal of Environmental Management, 2016, 172: 151-161. DOI:10.1016/j.jenvman.2016.02.041 |
| [21] |
Sand W, Gehrke T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(1): 49-56. DOI:10.1016/j.resmic.2005.07.012 |
| [22] |
Sharma R, Bhardwaj R, Thukral A K, et al. Oxidative stress mitigation and initiation of antioxidant and osmoprotectant responses mediated by ascorbic acid in Brassica juncea L. subjected to copper (Ⅱ) stress[J]. Ecotoxicology and Environmental Safety, 2019, 182: UNSP 109436. DOI:10.1016/j.ecoenv.2019.109436 |
| [23] |
Ferrer A, Rivera J, Zapata C, et al. Cobalamin protection against oxidative stress in the acidophilic iron-oxidizing bacterium Leptospirillum group Ⅱ CF-1[J]. Frontiers in Microbiology, 2016, 7: 746. |
| [24] |
Contreras M, Mascayano C, Chavez R, et al. Dyp-type peroxidase (DypA) from the bioleaching acidophilic bacterium Leptospirillum ferriphilum DSM 14647[J]. Advanced Materials Research, 2015, 1130: 23-27. DOI:10.4028/www.scientific.net/AMR.1130.23 |
| [25] |
Dat J, Vandenabeele S, Vranova E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Sciences, 2000, 57(5): 779-795. DOI:10.1007/s000180050041 |
| [26] |
王红, 王兆印, 张旭, 等. 富氧条件下活性氧和初始Fe2+浓度对难处理金精矿生物氧化过程的影响[J]. 高校化学工程学报, 2016, 30(1): 104-111. WANG H, WANG Z Y, ZHANG X, et al. Effects of reactive oxygen and Fe2+ concentration on biooxidation of refractory gold concentrates under oxygen-rich conditions[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(1): 104-111. |
| [27] |
Hu X, Huang Y-Y, Wang Y, et al. Antimicrobial photodynamic therapy to control clinically relevant biofilm infections[J]. Frontiers in Microbiology, 2018, 9: 1299. DOI:10.3389/fmicb.2018.01299 |
| [28] |
Bellenberg S, Dieu H, Poetsch A, et al. Proteomics reveal enhanced oxidative stress responses and metabolic adaptation in Acidithiobacillus ferrooxidans biofilm cells on pyrite[J]. Frontiers in Microbiology, 2019, 10: 592. DOI:10.3389/fmicb.2019.00592 |
| [29] |
Cáp M, Váchová L, Palková Z. Reactive oxygen species in the signaling and adaptation of multicellular microbial communities[J]. Oxidative Medicine and Cellular longevity, 2012, 2012: 976753. |
| [30] |
Li Y L, Pan J, Wu D, et al. Regulation of Enterococcus faecalis biofilm formation and quorum sensing related virulence factors with ultra-low dose reactive species produced by plasma activated water[J]. Plasma Chemistry and Plasma Processing, 2019, 39(1): 35-49. DOI:10.1007/s11090-018-9930-2 |
| [31] |
朱雯雯.纳米TiO2光淬灭群体感应信号分子AI-2调控Escherichia coli K12生物膜发育的研究[D].镇江: 江苏大学, 2016. ZHU W W. Study on the regulation of Escherichia coli K12 biofilm development by photoquenching of nano TiO2 quorum sensing signal molecule AI-2[D]. Zhenjiang: Jiangsu University, 2016. |
| [32] |
Yi L, Li J P, Liu B B, et al. Advances in research on signal molecules regulating biofilms[J]. World Journal of Microbiology & Biotechnology, 2019, 35(8): 8. |
| [33] |
常君, 曹建民, 曹卉, 等. 天然抗氧化剂对抗氧化应激的作用[J]. 运动, 2018(10): 149-150. CHANG J, CAO J M, CAO H, et al. The role of natural antioxidants in combating oxidative stress[J]. Exercise, 2018(10): 149-150. |
| [34] |
Cárdenas J P, Moya F, Covarrubias P, et al. Comparative genomics of the oxidative stress response in bioleaching microorganisms[J]. Hydrometallurgy, 2012, 127: 162-167. |
| [35] |
邱永秋, 吴炜进, 刘浩, 等. Lysinibacillus sp.Re Cr-13还原Cr(Ⅵ)特性及对Cr(Ⅵ)诱导的氧化胁迫响应[J]. 高校化学工程学报, 2019, 33(4): 856-863. QIU Y Q, WU W J, LIU H, et al. The performance of Cr(VI) reduction by Lysinibacillus sp. ReCr-13 and its response of Cr(VI)-induced oxidative stress[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 856-863. |
| [36] |
Guo L, Zhang C, Chen G, et al. Reactive oxygen species inhibit biofilm formation of Listeria monocytogenes[J]. Microbial Pathogenesis, 2019, 127: 183-189. DOI:10.1016/j.micpath.2018.11.023 |




