低品位热能种类繁多、体量巨大[1]。课题组将逆电渗析法盐差能发电技术[2]与低温多效蒸馏技术相结合,提出一种新的由低品位热能(可低至80 ℃)驱动的闭式热-电转换技术[3]。工作原理为:首先在发生器内利用热能驱动工作溶液组分分离,产生化学势差。再将分离出的两股溶液分别导入逆向电渗析电堆内交替分布的浓、稀溶液流道中。经阴、阳离子跨膜迁移和电堆两端电极的氧化还原反应过程,溶液浓差能被转化为电能。流出电堆的废液被导回发生器中进行再生。如此反复,实现热能→浓差能→电能的持续转换。该系统匹配工作溶液应兼具良好的热力学性质(热能输入尽可能少)和电化学性质(电能输出尽可能多)[4]。常见电解质水溶液热分离能耗大、沸点温度高、能量转换效率低,不适用于上述闭式热-电转换系统。一些由一价无机盐和低气化潜热有机溶剂所组成的溶液具有潜在可行性,而其电化学性质亟待被探明[3-4]。为此,研究电解质-有机溶剂体系的电导性是该领域重要基础工作。
目前已有文献报道了部分电解质-有机溶剂体系电导性研究成果。姜波等[5]测定了25~50 ℃下,以NaBr为溶质,甲醇、乙醇、正丙醇和异丙醇(IPA)分别为溶剂的溶液体系的电导率,以及NaCl和KBr分别在乙醇和甲醇中的电导率。郭磊等[6]测定了25~29 ℃下的NaCl–二甲基乙酰胺(DMAC)–水体系,NaBr–DMAC–水体系,及NaI–DMAC–水体系的电导率,并分析了溶液电导率的影响因素。MAEDA等[7]在0.1~400 MPa测量了NH4Cl与NH4NO3在不同浓度的乙醇-水溶液中的电导率。王卫东[8]在15~35 ℃下内测试了LiCl在异丙醇中的电导率。REHMAN等[9]测量了5~50 ℃的LiCl-乙醇-水体系的电导率值。笔者曾测试20~60 ℃时乙酸钾在乙醇和三氟乙醇(TFE)中的电导率[10]。当前的溶液电导率研究成果虽重要,但在种类范围、强化机理、拟合方程等方面仍有进一步研究的必要。
本文参照前人研究方法,测试并拟合3种一价强电解质(LiCl、LiBr和LiI)分别在乙醇、IPA和TFE 3种低沸点有机溶剂中的电导率,并探讨分别向溶液中添加N-甲基吡咯烷酮(NMP)、二氯甲烷、DMAC和少量水时的溶液电导率强化特性。所获结果可为发展闭式热-电转换系统工作溶液提供参考。
2 实验方法 2.1 试剂与实验过程所用试剂及药品包括:LiCl(分析纯,天津大茂化学)、LiBr(分析纯,天津大茂化学)、LiI(分析纯,北京百灵威科技)、无水乙醇(分析纯,天津光复科技)、TFE(分析纯,上海阿拉丁生化科技)、IPA(分析纯,天津大茂化学)、NMP(分析纯,上海阿拉丁生化科技)、二氯甲烷(分析纯,天津大茂化学)以及去离子水(实验室自产,反渗透方法)。
溶液电导率测量装置如图 1所示。使用电子分析天平(美国OHAUS,精度0.001 g)称量待测样品,配制一定质量摩尔浓度的待测溶液。将精密恒温槽(德国JULABO,±0.03 ℃)中的恒温水通过保温良好的管路导入隔层溶解釜(大连理工大学,定制)的夹套中,循环流动以保持恒温。溶解釜置于超薄磁力搅拌器(日本ASONE)上,通过转子的转动加速溶质的溶解并使得溶液成分均匀。电导率工作站及所配置的耐腐蚀电极(瑞士METTLER TOLEDO,±0.5%)在使用前经标准溶液校准。待溶解釜内溶质完全溶解并且溶液恒定在实验需求温度(热电阻,天津中环仪表,±0.15 ℃)时,开始测量溶解釜内多个空间位置上的电解质溶液电导率,确保浓度均匀,记录数据。每个测点至少进行3次重复性实验。调整溶液浓度或温度,进行下一个测点的实验,直至完成全部实验。基于本实验系统对LiCl–IPA和LiCl–ethanol溶液体系的电导率测试结果与文献[8]和[9]的报告值的对比情况如图 2所示。
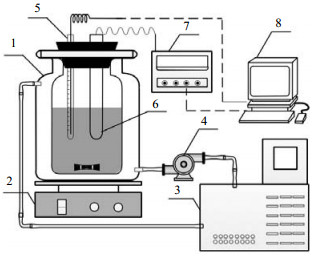
|
图 1 溶液电导率测量实验系统示意图[10] Fig.1 Schematic diagram of the experimental setup for conductivity measurements[10] 1. reaction vessel 2.stirrer 3. thermostatic bath 4. water pump 5. T sensor 6.electrode 7. conductivity meter 8. data acquisiter |
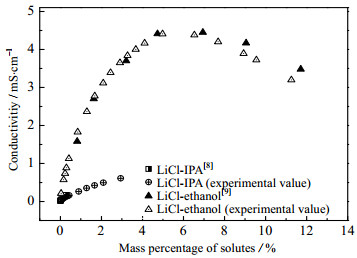
|
图 2 LiCl–IPA、LiCl–ethanol电导率的文献[8-9]值与测试值对比 Fig.2 Comparison of conductivities of LiCl–IPA and LiCl–ethanol solutions |
电导率测试误差主要由电导率仪重复测量误差(XE)、系统温度误差(XT)、标准液标定误差(XC)、系统固有误差(XI)组成,具体计算方法已在文献[10]中详述,本文中溶液体系电导率的不确定度数据都以误差棒的形式连同电导率数据一起在后面的图 3至图 7中表示出来。几乎所有溶液体系电导率实验值的相对扩展不确定度都小于3%。
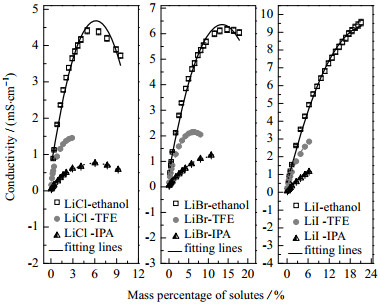
|
图 3 20 ℃时LiX(X=Cl, Br, I)在3种溶剂中的电导率 Fig.3 Conductivities of LiX(X=Cl, Br, I) in three solvents at 20 ℃ |
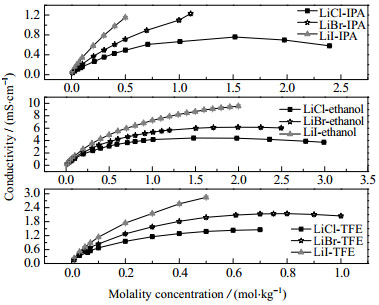
|
图 4 20 ℃时3种溶质在乙醇、TFE和IPA中的电导率 Fig.4 Conductivities of three solutes in ethanol, TFE and IPA at 20 ℃ |
|
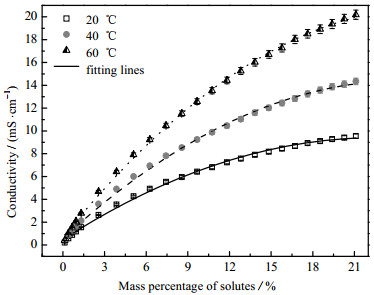
图 5 变温度条件下LiI在乙醇中的电导率 Fig.5 Conductivity profiles of LiI in ethanol under different temperatures |
|
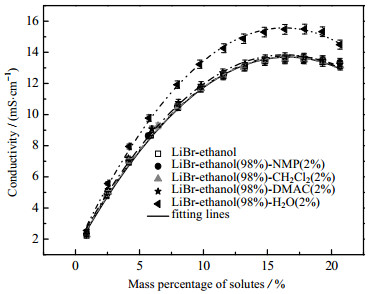
图 6 60 ℃时LiBr–乙醇(98%)–添加剂(2%)体系的电导率 Fig.6 Conductivity profiles of LiBr–ethanol–additives systems at 60 ℃ |
|
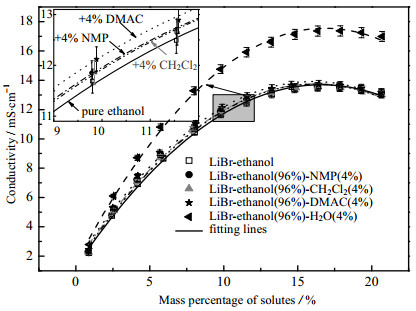
图 7 60 ℃时LiBr–乙醇(96%)–添加剂(4%)体系的电导率 Fig.7 Conductivity profiles of LiBr–ethanol–additives systems at 60 ℃ |
图 3和图 4示出了LiCl, LiBr和LiI分别与有机溶剂乙醇、TFE和IPA两两组合而成的9组二元溶液在20 ℃时的电导率测试结果,图 5为变温度条件下LiI在乙醇中的电导率测试结果,图 6和图 7为加入不同比例添加剂(NMP、二氯甲烷、DMAC和H2O)对LiBr-乙醇溶液电导率的影响测试结果。共性规律在于:随着溶质质量分数的增加,溶液的电导率呈现先迅速增大,而后增速减缓,当达到峰值后,会转而逐渐减小的现象。电解质溶液的电导特性由溶液中自由离子数量与迁移速度共同决定。自由离子数量受到离子缔合和溶剂化作用影响。根据卜耶隆离子缔合理论,阴、阳离子彼此接近到某一临界距离时因库仑力的吸引作用大于热运动能而形成离子对。缔合而成的离子对对溶液的导电能力没有积极贡献。离子溶剂化是指溶剂中的极化分子附着在溶质分子或离子周围的过程,这一过程使得离子体积增大,离子运动空间减少,离子迁移受到影响;而且会导致自由正、负离子间距缩小,缔结离子对数目增加[11-12]。低浓度溶液中,自由离子间距离较大,库仑力较弱,不易缔合,而且离子溶剂化的影响可以忽略,所以随着浓度升高,溶液中自由离子的数目增多,电导率迅速增大。但随着浓度持续升高,溶液中阴、阳离子数目逐渐增多,缔结离子对的数目也随之增加,导致溶液电导率的增加幅度逐渐趋缓。随着溶质质量分数的进一步增大,离子缔合与离子溶剂化愈发显著,弛豫效应增大,溶液中自由离子数量及其迁移能力下滑严重,促使溶液电导率下降。
3.1 溶剂组分的影响图 3还示出相同的溶质质量分数下,同一种溶质与3种不同溶剂所分别组成的溶液的电导率值相差很大。按照溶液体系电导率由高到低排序,依次是最大的LiX–乙醇体系,居中的LiX–TFE体系和最小的LiX–IPA体系。强极性溶剂能大大降低离子晶体中正、负离子间的静电吸引力,使其更容易溶解和解离。无机盐在有机溶剂中的溶解度受溶剂的物理化学性质、溶质溶剂分子间作用力等因素影响[13]。而溶质在溶剂中的解离度越大,溶液中自由离子数目就越多[14],表现为溶液电导率就越大。3种溶剂中,乙醇的极性相对较大(相对介电常数25.15[15]),而IPA的极性最弱(相对介电常数20.31[15]),实验测得的LiX–乙醇体系的最大电导率约为LiX–IPA体系的8.3倍。
3.2 溶质组分的影响图 4还示出相同的质量摩尔浓度下,同一种溶剂与3种不同溶质分别组成的溶液的电导率对比关系,其中LiI–乙醇体系的电导率最高可达9.55 mS·cm-1,而LiCl–乙醇体系最大值仅4.41 ms·cm-1。对于具有相同溶剂和阳离子的溶液体系,卤素阴离子的溶剂化过程同样值得重视[16]。乙醇、TFE及IPA皆为质子性溶剂,既是氢键给体,也是氢键受体,与阴、阳离子间均有相互作用。一方面质子溶剂会通过氢键与阴离子发生作用。另一方面O-H键中的“O”有孤对电子,能够与Li+形成供体-受体键[17-18],此外阴离子(Cl-,Br-,I-)与具有极性的Li+的溶剂化外壳发生反应,形成局部溶剂化离子对[16]。同时,当空间距离足够接近时,未溶剂化的阴、阳离子也可能缔合成电中性离子对,从而降低溶液导电能力。碘、溴、氯是同族卤素,离子半径从大到小依次为I- > Br- > Cl-,所形成的局部溶剂化离子对体积也由大到小,对自由阴、阳离子的空间阻隔和迁移影响也依次减弱。而且在同种溶剂中,LiI的溶解度最大。因而LiI–有机溶剂体系的自由离子的数量相对最多、表现为电导率最大。
3.3 温度的影响以前述电导性最优的LiI–乙醇体系为研究对象,测试其在更高温度下的电导率,结果如图 5所示。可以看出温度对于浓溶液电导率的影响程度要比稀溶液更为显著。而在相同质量分数时,溶液温度越高时,体系的电导率就越大,即温度对于溶液电导率起到正相关影响性。
溶液温度对LiI–乙醇体系电导率的影响机理可解释为[11-12, 19]:随着溶液温度的升高,其一,溶液黏度降低,使得离子迁移过程中的摩擦力和不可逆损失降低;其二,离子热运动增强,导致离子的平均动能增加;其三,外部环境中的干扰物质在溶液中的溶解度降低,削弱外部不利的影响;其四,电泳效应变弱,减少离子输运阻碍;其五,溶剂分解作用增强,阻滞作用弱化。因此溶液温度是一个影响电解质溶液电导能力的重要因素。但提升温度对于溶液电导率的强化效果也并非是无限增大的, 会随温度升高而逐渐减弱。
3.4 添加剂的影响在LiBr-乙醇体系溶液中分别加入少量有机溶剂NMP、二氯甲烷、DMAC及H2O,探索添加剂对溶液电导率的影响。图 6和图 7分别是60 ℃时LiBr–98%乙醇–2%添加剂和LiBr–96%乙醇–4%添加剂溶液体系的电导率。除了添加H2O会使体系电导率有明显的增强(添加2%和4%H2O,电导率平均分别增大了约14%和27%)之外,3种有机添加剂(NMP,二氯甲烷和DMAC)对体系电导率的强化效果都较弱。对比可见,极性较强的DMAC (相对介电常数38.85[20])的强化效果相对较好,体系电导率平均增大约3%,而极性较弱的NMP和极性最小的二氯甲烷对体系电导率的影响非常微小(仅约1%)。
4种添加剂中,水的极性最强(相对介电常数80.1[20]),能够最大程度上削弱离子间的相互作用,而且具有最好的定向及序化程度[11],从而显著地促进溶质的溶解和电离。此外,在水作为添加剂的溶液体系中,除了自由阴、阳离子和溶剂化离子外,还有由于离子–偶极作用而形成的水合离子。离子在水中的迁移阻力相对较小,有效迁移数量较多,电泳效应较弱,因而离子迁移效率高,溶液电导能力强。
4 无机盐在有机溶剂中的电导率关联文献[21]分段建立了NaCl及岩盐水溶液电导率与浓度的关联关系,在低浓度范围内溶液电导率与浓度的平方根呈线性关系,而在较高浓度时,电导率与浓度关系类似于Langmuir吸附等温方程[21]。本文采用修正的高斯振幅方程(GuassAmp Equation)来关联所测试的溶液电导率数据,如式(1)示。该方法已被成功用于描述醋酸钾溶液体系的电导率随浓度变化规律[10]。
| $ {\kappa _{\rm{T}}} = {A_1} \cdot T + {A_2} \cdot T \times {\exp _{}}( - \frac{1}{2}{(\frac{{{C_{\rm{x}}} - {C_{\rm{m}}}}}{{{A_{\rm{3}}} \cdot T}})^2}) $ | (1) |
式中:κT为当前温度对应的溶液电导率,mS·cm-1;A1,A2和A3偏移系数,振幅系数和宽度系数;Cx为当前溶质质量分数,%;Cm为所测溶液的最大电导率对应的溶质质量分数,%;T为溶液温度,K。
其拟合结果如图 3和图 5~7中的线条所示,与实验结果之间具有较好的一致性。拟合后的理论数据与实际测得值之间的平均相对误差相差不大(第一测点除外),总体平均的相对误差值为2.87%。式(1)中系数及各溶液体系的拟合误差详见表 1所示。
|
|
表 1 拟合溶液电导率的方程系数 Table 1 Coefficients of equation for estimating conductivity of solutions |
(1) 随着溶质质量分数的增加,溶液的电导率会先迅速增大,而后增速逐渐减缓,当达到峰值后,会转而逐渐减小。因此逆电渗析法闭式热-电转换系统的工作溶液不应选用饱和液。
(2) 实测温度范围内,LiI在乙醇中的电导率随溶液温度升高而增大。相关文献调研可知,乙酸钾-TFE等其他多种溶液也呈现与此相同的规律。
(3) 温度、溶质相同时,溶液电导率从大到小依次为LiX–乙醇 > LiX–TFE > LiX–IPA;而温度、溶剂相同时,溶液电导率排序为LiI–有机溶剂 > LiBr–有机溶剂 > LiCl–有机溶剂。
(4) 60 ℃时,向LiBr-乙醇溶液添加2%和4%的H2O会使体系电导率平均分别增大约14%和27%,添加DMAC的强化效果次之(平均约3%),而NMP和二氯甲烷几乎无效果(仅1%)。多方面综合考虑,LiBr-乙醇- H2O体系是下一步深化研究的重点。
(5) 修正的高斯振幅方程可用来关联本研究所涉及到的20组溶液的电导率,其拟合值与实测值间的总平均相对误差2.87%。该方程也具有关联其他1-1型电解质溶液的电导率的价值。
| [1] |
姚志敏, 薛冰, 盛遵荣, 等. 开式高温吸附热泵生成蒸汽系统的耐久性能研究[J]. 高校化学工程学报, 2016, 30(4): 791-799. YAO Z M, XU B, SHENG Z R, et al. Cyclic durability of a high temperature open adsorption heat pump for steam generation[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(4): 791-799. DOI:10.3969/j.issn.1003-9015.2016.04.008 |
| [2] |
CIPOLLINA A, MICALE G. Sustainable energy from salinity gradients[M]. Duxford: Woodhead Publishing, 2016.
|
| [3] |
徐士鸣, 吴曦, 吴德兵.一种新型低品位热能发电方法及装置: CN, 105261808 A[P]. 2017-07-11. XU S M, WU X, WU D B. A novel low-grade heat energy generation method and device: CN, 105261808 A[P]. 2017-07-11. |
| [4] |
吴曦, 徐士鸣, 吴德兵, 等. 逆电渗析法热-电转换系统循环工质匹配准则[J]. 化工学报, 2016, 67(S2): 326-332. WU X, XU S M, WU D B, et al. Methodology of assessing working mediums availability for a novel heat-power conversion system with reverse electrodialysis technology[J]. CIESC Journal, 2016, 67(S2): 326-332. |
| [5] |
姜波, 王利生, 李弥异. NaBr, NaCl和KBr在几种有机溶剂中活度系数的测定[J]. 化学工业与工程, 2011, 28(3): 25-32. JIANG B, WANG L S, LI M Y. Activity coefficient measurement of NaBr, NaCl and KBr in selected organic solvents[J]. Chemical Industry and Engineering, 2011, 28(3): 25-32. |
| [6] |
郭磊, 刘亚文, 刘春丽, 等. NaCl、NaBr、NaI在DMA水溶液中的电导率[J]. 全面腐蚀控制, 2013, 27(12): 63-66. GUO L, LIU Y W, LIU C L, et al. Study of the conductivity of NaCl, NaBr and NaI in DMA aqueous solution[J]. Total Corrosion Control, 2013, 27(12): 63-66. DOI:10.3969/j.issn.1008-7818.2013.12.029 |
| [7] |
MAEDA K, MAENO K, FUKUI K, et al. Electrical conductivity of aqueous ethanol solutions containing ammonium salts under high pressure at 298 K[J]. Journal of Chemical and Engineering Data, 2013, 58(2): 264-270. DOI:10.1021/je3008233 |
| [8] |
王卫东. LiCl在异丙醇中热力学性质的研究[J]. 盐湖研究, 2007(3): 28-32. WANG W D. Study on thermodynamic properties of LiCl in 2-propanol solvent[J]. Journal of Salt Lake Research, 2007(3): 28-32. DOI:10.3969/j.issn.1008-858X.2007.03.006 |
| [9] |
REHMAN H, ANSARI M S. Density, Viscosity, and electrical conductivity measurements on the ternary system H2O + C2H5OH + LiCl over the entire ranges of solvent composition and LiCl solubility from (-5 to +50)℃[J]. Joural of Chemical and Engineering Data, 2008, 53(9): 2072-2088. DOI:10.1021/je800150h |
| [10] |
WU X, XU S M, WU D B, et al. Electric conductivity and electric convertibility of potassium acetate in water, ethanol, 2, 2, 2-trifluoroethanol, 2-propanol and their binary blends[J]. Chinese Journal of Chemical Engineering, 2018, 26(12): 2581-2591. DOI:10.1016/j.cjche.2018.06.004 |
| [11] |
HAMANN C H, HAMNETT A, VIELSTICH W. Electrochemistry[M]. Weinheim: Wiley-VCH, 2007.
|
| [12] |
李以圭, 陆九芳. 电解质溶液理论[M]. 北京: 清华大学出版社, 2005. LI Y G, LU J F. The theory of electrolyte solutions[M]. Beijing: Tsinghua University Press, 2005. |
| [13] |
刘丹, 毛丽莉, 王海增. 六水氯化镁在醇类溶剂中溶解度的测定与关联[J]. 高校化学工程学报, 2018, 32(1): 24-29. LIU D, MAO L L, WANG H Z. Determination and correlation of magnesium chloride hexahydrate solubility in alcohol solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 24-29. |
| [14] |
靳朝辉, 张凤宝, 张国亮. 电导法确定离子交换树脂中反离子的解离度[J]. 高校化学工程学报, 2004, 18(6): 671-675. JIN Z H, ZHANG F B, ZHANG G L. Determining the dissociation degree of counter ions in ion-exchange resin by conductivity measurement[J]. Journal of Chemical Engineering of Chinese Universities, 2004, 18(6): 671-675. DOI:10.3321/j.issn:1003-9015.2004.06.001 |
| [15] |
CHMIELEWSKA A, ZURADA M, KLIMASZEWSKI K, et al. Dielectric properties of methanol mixtures with ethanol, isomers of propanol, and butanol[J]. Journal of Chemical and Engineering Data, 2009, 54(3): 801-806. DOI:10.1021/je800593p |
| [16] |
KRUMGALE B S. Ion-sovent interaction and ionic association in ethanol solutions[J]. Journal of Solution Chemistry, 1982, 11(4): 283-292. DOI:10.1007/BF00657319 |
| [17] |
STOCKTON G W, MARTIN J S. Proton nuclear magnetic resonance study of diamagnetic cation association with hydroxylic substates. Interpretation of ionic molal shifts in methanol and water[J]. Journal of the American Chemical Society, 1972, 94(20): 6921-6930. DOI:10.1021/ja00775a010 |
| [18] |
凌锦龙, 余成芸, 姜垚, 等. 甲酰胺+乙醇/丙醇/异丙醇/乙酸乙酯二元混合物的体积及黏度性质[J]. 高校化学工程学报, 2017, 31(6): 1267-1275. LING J L, YU C Y, JIANG Y, et al. Volumetric and viscous properties for binary mixtures of formamide and ethanol/propanol/isopropanol/ethyl acetate[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(6): 1267-1275. |
| [19] |
黄子卿. 电解质溶液理论导论[M]. 北京: 科学出版社, 1983. HUANG Z Q. Introduction to the theory of electrolyte solution[M]. Beijing: Science China Press, 1983. |
| [20] |
HAYNES W M. CRC Handbook of Chemistry and Physics 2014-2015[M]. Florida: CRC Press, 2014.
|
| [21] |
刘成伦, 徐龙君, 鲜学福. 水溶液中盐的浓度与其电导率的关系研究[J]. 中国环境监测, 1999, 15(4): 21-24. LIU C L, XU L J, XIAN X F. Study on the relationship between concentration of salt solution and its conductivity[J]. Environmental Monitoring in China, 1999, 15(4): 21-24. |




