2. 浙江众成包装材料股份有限公司,浙江 嘉善 314100;
3. 浙江众立合成材料科技股份有限公司 浙江 平湖 314200
2. Zhejiang Zhongcheng Packing Material Co. Ltd., Jiashan 314100, China;
3. Zhejiang Zhongli Synethtic Material Technology Co. Ltd., Pinghu 314200, China
奈妥吡坦(Netupitant)由Helsinn公司研制,与帕洛诺司琼(Palonosetron)组成复方药Akynzeo于2014年在美国上市。奈妥吡坦为P物质/神经激肽NK1受体拮抗剂,可有效预防癌症化疗急性期和延迟期产生的恶心和呕吐等不良反应[1-3]。(6-(4-甲基哌嗪-1-基)-4-(邻甲苯)吡啶-3-基)氨基甲酸甲酯(化合物 1)是合成奈妥吡坦的重要中间体。根据合成化合物 1 的起始物料不同,其合成方法主要有以下4种。
(1) 2-氯-5-硝基吡啶为起始物,依次经过氨基取代、钯催化还原、酰氯保护、丁基锂拔氢碘化、Suzuki偶联等反应生成化合物 1[4],此法因合成路线冗长、原材料成本高等因素限制了其在工业上的应用。
(2) 以4-甲氧基-3-硝基吡啶为起始物,经过吡啶环羟基化、取代、缩合、脱甲基、羟基取代、Suzuki偶联、硝基还原、氨基缩合等反应得到与化合物 1 类似的乙酯化合物[5],此合成路线较长,用昂贵的Pd催化Suzuki反应,并用毒性较大的POCl3进行取代反应,会对环保带来不利的影响。
(3) 以6-氯烟酸为原料,经过与叔丁胺缩合、格式试剂1, 4-加成、DDQ或Mn(OAc)3氧化、缩合、氨基去烷基化、NBS溴化后的Hofmann重排等反应制备得到化合物 1[6],此合成路线也存在一定的问题,比如格式试剂1, 4-加成的效果较差,需要3 ~ 5个当量配比在1.0 mol·L-1的THF溶液中[7],且1, 4-加成产物二氢吡啶的氧化用到DDQ、Mn(OAc)3、MnO2、KMnO4等强氧化剂会产生副产物,纯化工艺繁冗[7],氧化剂重金属的引入也会为环保带来压力,此外,NBS价格较高,不利于成本控制。
(4) 以2-氯乙酰胺为原料,与吡啶生成吡啶盐,然后加入至邻甲基苯甲醛与氰基乙酸甲酯中,依次发生Knoevenagel缩合与Michael加成反应,再环化形成Shestopalov吡啶内盐,采用POCl3对此内盐转化成二氯吡啶中间体,再与N-甲基哌嗪缩合,钯催化氢化、硫酸水解氰基转化成酰胺,最后通过NBS溴化后发生Hofmann重排反应生成化合物 1[7],此法步骤较多,要用到毒性较大的POCl3与昂贵的钯催化剂,也制约其在工业上的应用。
在参考方法3的基础上,以N-叔丁基-6-氯烟酰胺为原料,采用叠缩工艺,通过优化反应条件,开发出收率高、操作简便、成本低、适合工业化生产的工艺,合成路线见图 1。
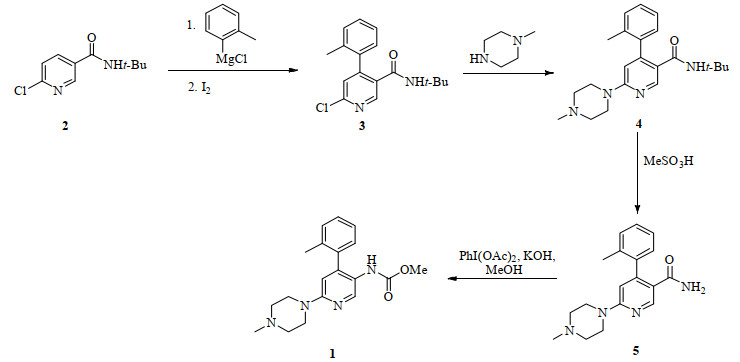
|
图 1 (6-(4-甲基哌嗪-1-基)-4-(邻甲苯基)吡啶-3-基)氨基甲酸甲酯的合成路线 Fig.1 Synthesis route of methyl (6-(4-methylpiperazin-1-yl)-4-(o-tolyl)pyridin-3-yl)carbamate |
Avance Ⅲ 400核磁共振仪测定(CDCl3为溶剂,TMS为内标), Micromass LCT TOF-MS测定分子量。化学品均是市售分析纯试剂,反应溶剂均为无水试剂,水份≤ 0.1%,瑞士万通水分测试仪,未经精制直接使用。循环水真空泵,型号SHZ-DIII, 巩义予华仪器有限公司。化合物 1纯度用高效液相色谱法(HPLC)检测,检测条件:高效液相色谱法(HPLC),仪器型号:Agilent 1200;色谱柱:YMC-Pack Pro C18,150 mm × 4.6 mm,5 μm;检测波长:UV 225 ± 4 nm;流速:1.3 mL·min-1;柱温:30 ℃;进样量:10 µL。流动相:水、甲醇、缓冲液(取磷酸氢二钠二水合物1.78 g和四丁基硫酸氢铵3.34 g,加1 000 mL水溶解)梯度洗脱。
2.2 方法与步骤在装备有机械搅拌、温度计、恒压滴液漏斗和回流冷凝器的2 000 mL四口瓶A 中,氮气保护下加入THF 85.0 mL、化合物 2 (50.0 g,0.24 mol),搅拌至固体完全溶解,N2保护下冷却至15 ~ 18 ℃。恒压滴液漏斗中加入20% 370.3 g邻甲苯基氯化镁(74.1 g,0.48 mol) THF溶液,控制内温 < 25 ℃。滴毕升温至70 ~ 75 ℃反应2 h。然后冷却至-30 ~ -20 ℃,将配制好的THF 195.6 mL,I2 (45.7 g,0.36 mol)溶液滴入,再加热至50 ℃反应1 h。向体系中加H2O 50.0 g,搅拌1 h。然后将此体系中的物料缓慢滴入另一个装有3%浓度稀硫酸150.0 g的2000 mL四口反应烧瓶 B 中,并保持温度 < 30 ℃。反应烧瓶 B 进行减压蒸馏(温度50 ℃,真空度-0.09 ~ -0.10 MPa)所得馏分重183.0 g。此馏分主要含有THF与H2O,经过脱水处理THF可以套用于下一批次反应。冷却至20 ~ 25 ℃,向反应瓶 B 中加入甲苯272.4 mL,转至分液漏斗分离水相,加H2O 171.5 g,40% NaHSO3溶液25.3 g洗涤,再分离水相。有机相减压蒸馏(先温度60 ~ 80 ℃,后温度85 ~ 90 ℃,真空度-0.09 ~ -0.10 MPa)至无馏分(馏分中主要含有甲苯及少量的THF,经过常压蒸馏除去THF,回收到的甲苯可以直接套用于下一批次反应),蒸馏剩余物为化合物 3。
冷却体系至70 ~ 75 ℃,滴加N-甲基哌嗪(76.2 g,0.72 mol),滴毕升温至105 ~ 110 ℃,并维持该温度反应3 h,进行减压蒸馏至无馏分(真空度-0.09 ~ -0.10 MPa)(回收N-甲基哌嗪可直接套用于下一批)。冷却至90~100 ℃,加入甲苯456.0 mL,然后再冷却至20 ~ 30 ℃,加入H2O 43.6 g,用18%硫酸调节pH至7.0 ~ 8.0,静置分层,分离水相。有机相常压蒸馏(温度110 ℃)所得馏分甲苯375.3 g。蒸馏剩余物即为化合物 4 的溶液。
向体系中滴加MeSO3H (69.2 g,0.72 mol),维持温度90 ~ 100 ℃,保持反应4 h后再冷却至80 ~ 85 ℃,真空/N2来回3次交换,除去异丁烯。冷却至20 ~ 25 ℃,加入H2O 170.0 g,搅拌后转至分液漏斗,分离有机相,加入i-PrOAc 950.0 mL,H2O 155.0 g,用30% NaOH溶液调节pH至10 ~ 11,停止搅拌,转至分液漏斗分离水相,有机相转入反应烧瓶中,常压蒸馏至无馏分(馏分i-PrOAc可直接套用于下一批)。残留物即为化合物 5。
将KOH (60.5 g, 1.08 mol)与MeOH 748.5 mL的溶液加入至烧瓶中,控温在20 ~ 25 ℃,滴加PhI(OAc)2 (81.2 g, 0.25 mol)。在25 ~ 30 ℃反应1 h, 加入水800.0 g, 用20%盐酸水溶液调节pH至12,再进行减压蒸馏(温度35 ~ 40 ℃,真空度-0.09 ~ -0.1 MPa)。当反应烧瓶中物料体积达到约945.0 ~ 1036.0 mL时, 停止蒸馏并冷却至35 ℃。加入i-PrOAc 792.7 mL后搅拌30 min,分液,有机相加入H2O 127.3 g,搅拌后分离水相,有机相进行蒸馏至无馏分(i-PrOAc可直接回收套用于下一批),并升高温度至120~125 ℃进行减压蒸馏(真空度-0.09 ~ -0.1 MPa)至无馏分,降温至40 ℃补加i-PrOAc 218.2 mL后加热至80 ℃,加入正己烷138.5 mL,再缓慢冷却至0 ℃,过滤,55 ℃真空干燥得到米色固体化合物 1 (55.1 g, 收率67.4%)。
化合物 3 核磁与质谱数据:1H NMR (400 MHz,CDCl3) δ 8.90 (s, 1 H), 7.30~7.42 (m, 3 H), 7.16 (m, 2 H), 5.07 (s, br, 1 H), 2.11 (s, 3 H), 1.03 (s, 9 H); 13C NMR (100 MHz,CDCl3) δ 19.76, 27.94, 51.39, 124.45, 126.65, 128.14, 129.58, 129.97, 130.85, 135.74, 136.48, 149.64, 151.13, 152.88, 163.93. TOF-MS ES+:303.126 6,理论值:303.126 4.
化合物 4 核磁与质谱数据:1H NMR (400 MHz,CDCl3) δ 8.80 (s, 1 H), 7.27~7.37 (m, 3 H), 7.17~7.19 (m, 1 H), 6.30 (s, 1 H), 4.98 (s, br, 1 H), 3.65 (m, 4 H), 2.50 (t, J = 4.0 Hz, 4 H),2.33 (s, 3 H), 2.12 (s, 3 H), 1.01 (s, 9 H); 13C NMR (100 MHz,CDCl3) δ 19.76, 28.17, 44.72, 46.15, 50.61, 54.71, 106.03, 119.90, 126.43, 128.79, 130.53, 136.07, 139.29, 148.47, 150.81, 159.71, 165.38. TOF-MS ES+:367.250 6,理论值:367.249 8.
化合物 5 核磁与质谱数据:1H NMR (400 MHz,CDCl3) δ 8.92 (s, 1 H), 7.28~7.35 (m, 4 H), 7.19~7.21 (m, 1 H), 6.30 (s, 1 H), 5.23 (s, br, 1 H), 5.06 (s, br, 1 H), 3.69(t, J = 4.0 Hz, 4 H), 2.53 (t, J = 4.0 Hz, 4 H),2.36 (s, 3 H), 2.14 (s, 3 H); 13C NMR (100 MHz,CDCl3) δ 19.76, 44.51, 46.07, 54.66, 106.20, 116.70, 126.49, 128.18, 128.96, 130.68, 139.10, 151.90, 159.95, 167. 78. TOF-MS ES+:311.407 8,理论值:311.192 9.
化合物 1 核磁与质谱数据:1H NMR (400 MHz,CDCl3) δ 8.80 (s, 1 H), 7.22~7.33 (m, 3H), 7.09~7.11 (m, 1 H), 6.44 (s, 1 H), 5.92 (s, br, 1 H), 3.64~3.50 (m, 7 H), 2.52~2.50(m, 4 H), 2.32 (s, 1 H),2.10 (s, 3 H), 2.00 (s, 3 H); 13C NMR (100 MHz,CDCl3) δ 19.59, 45.61, 46.23, 52.41, 54.90, 107.53, 126.49, 123.46, 126.32, 128.80, 129.10, 135.90, 140.99, 154.29, 156.33. TOF-MS ES+:341.199 0,理论值:341.197 8.
3 结果与讨论 3.1 1, 4-加成反应与氧化反应格氏试剂易对吡啶环上发生1, 4-加成反应,生成1, 4-二氢吡啶类化合物[8-10]。化合物 2在与邻甲苯基氯化镁反应过程中,应保持体系无水份进入。因H2O与二氢吡啶反应产生二氢吡啶酮(图 2),其结构得到了质谱TOF-MS [M+Na]+:309.156 5,理论值:309.157 9的确认。
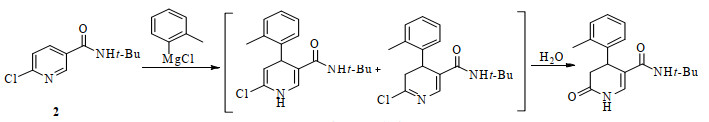
|
图 2 二氢吡啶酮的生成 Fig.2 Process of dihydropyridone synthesis |
文献[7]列举了二氢吡啶类化合物转化成吡啶环的氧化剂,但它们应用在生产上存在诸多的缺点。实验发现采用碘单质作为氧化剂可避免存在的不足。单质碘在常用溶剂中的溶解度都比较小,为了兼顾碘的溶解性与格式试剂1, 4-加成反应溶剂的单一性,选择THF作为反应溶剂,有利于简化后处理溶剂回收套用。另一方面,格式试剂的用量偏大[7],会引起生产成本偏高。通过对反应TLC跟踪检测,在溶剂THF中,对1, 4-加成反应温度、氧化温度、格式试剂的用量、碘的用量进行考察。在探索实验结果的基础上,设计了4因素3水平正交试验,具体见表 1与表 2。
|
|
表 1 L9(34)正交实验的因素和水平 Table 1 Factors and levels of the L9(34) orthogonal experiment |
|
|
表 2 L9(34)正交实验结果 Table 2 Results of the L9(34) orthogonal experiment |
实验发现,1, 4-加成反应温度低会导致反应活性相对较小,温度过高则会引起副产物增多。文献[7]中1, 4-加成反应在0 ℃,本工艺通过适当提高反应温度,可有效降低格式试剂的用量。采用碘氧化1, 4-二氢吡啶化合物,可有效抑制副产物的产生,稍过量的碘可用NaHSO3溶液还原,工艺绿色环保。通过4因素3水平正交试验,从表 1和表 2中数据可以看出,此工艺最佳的合成条件为:1, 4-加成反应温度70 ~ 75 ℃,碘氧化温度-30 ~ -20 ℃,n(化合物 2):n(格式试剂):n(碘)=1:2:1.2,收率达到88.4%。
3.2 缩合反应N-甲基哌嗪与化合物 3 发生缩合反应,有副产物HCl产生。通过考察溶剂与用量、反应温度、时间等条件,研究不同因素对缩合反应化合物 3 转化率的影响,具体见表 3。
|
|
表 3 缩合反应的工艺条件 Table 3 Condensation reaction parameters under different conditions |
此反应理论上N-甲基哌嗪的用量为1.0 eq,当以2.0 eq当量参与反应、溶剂分别采用EA、DMF、CH3CN、甲苯、THF时,从表 3可以看出,化合物 3 的转化率在溶剂DMF、甲苯中比乙酸乙酯、CH3CN、THF中高(Entries 1 ~ 5)。为了达到化学反应原子经济性的原则,实验研究了直接以N-甲基哌嗪为溶剂的反应体系,其反应结果见(Entries 6 ~ 11)。结果发现n (N-甲基哌嗪):n (化合物 3) = 6:1,3:1,温度在110 ~ 115 ℃、105 ~ 110 ℃时,化合物 3 均可以完全转化(Entries 6 ~ 8),但缩短反应时间到2 h时,转化率却下降至92.7% (Entry 9)。而温度在100~105 ℃时,反应物料对应的摩尔比为2:1或者3:1时,转化率仅有87.3%与91.4% (Entries 10 ~ 11)。故选择工艺条件105 ~ 110 ℃,n (N-甲基哌嗪): n(化合物 3) = 3:1,反应时间3 h较好,收率达到82.7%。经实验验证,过量的N-甲基哌嗪通过蒸馏方式回收,可直接套用于下一批次。
3.3 N-去烷基化反应N-去烷基化反应选用MeSO3H作为去叔丁基反应试剂。MeSO3H具有腐蚀性小、反应活性高、可生物降解,对环境友好等特点[11]。为了研究此工序合适的工艺,对N-去烷基化反应进行了工艺条件探索,具体见表 4。
|
|
表 4 N-去烷基化反应的工艺条件 Table 4 N-dealkylation reaction parameters under different conditions |
实验发现,当温度在90 ~ 100 ℃反应4 h,n (MeSO3H):n (化合物 4)在6:1或3:1时均可转化完全(Entries 1 ~ 2)。当两者的摩尔比降至2 : 1时则转化率略降至95.4 % (Entry 3),但反应体系的比较黏稠,搅拌阻力较大。当控制两者反应摩尔比为3 : 1,温度降至80 ~ 85 ℃时,转化率降至83.6 % (Entry 4),可见降低温度减缓了反应进行。在温度90 ~ 100 ℃,缩短反应时间至3 h,转化率降低至92.1% (Entry 5)。为了避免体系太过粘稠而引起生产中烧坏搅拌电机,综合考虑工艺条件选择90 ~ 100 ℃反应4 h,n (MeSO3H):n (化合物 4) = 3:1较合适。反应完毕,化合物 5 与MeSO3H生成的盐在水相,经过NaOH溶液调节pH值至10 ~ 11可游离出来,最终收率达到87.4%。
3.4 Hofmann重排反应Hofmann重排在碱性条件下,传统的卤素或次卤酸盐体系存在副反应多、收率低等缺点[12]。文献[6]中用价格较高的NBS作为溴代试剂,不利于控制生产成本。以高价碘[13-16]作为重排试剂,因其反应条件温和、过程操作简便、转化效率高、副产物少等优点而被广泛使用于Hofmann反应中。为了得到较优的生产工艺,在以MeOH为溶剂、反应温度20 ~ 30 ℃、反应时间1 h的条件下,研究了PhI(OAc)2、碱对收率的影响,结果见表 5。
|
|
表 5 Hofmann重排反应的工艺条件 Table 5 Hofmann rearrangement reaction parameters under different conditions |
从表 5可以看出,以NaOH为碱(Entries 1 ~ 3),当n(NaOH) : n(Compound 5)分别为6:1、5:1及4.5 : 1时,NaOH、PhI(OAc)2用量大则反应收率相对较好,而在反应条件KOH为4.5 eq、PhI(OAc)2 1.5 eq (Entry 4)比相同条件的NaOH (Entry 2)的收率较好,达到85.8%。实验发现,当KOH的用量为3.5 eq,PhI(OAc)2 1.05 eq,以MeOH的用量为变量,发现溶剂MeOH的使用量变少,收率略有增加(Entries 5 ~ 6)。当提高KOH的用量至4.5 eq时,n (PhI(OAc)2):n (compound 5) = 1.05:1.0,质量比m(compound 5):m(MeOH)=1.0:3.5,产品收率可达到86.2% (Entry 7),此工艺条件较佳。
3.5 叠缩工艺近些年来,在医药中间体的合成过程中,叠缩工艺因可提高收率、减少操作步骤与缩短操作时间,节省生产成本而被广泛采用[17-18]。在合成化合物 1 的过程中,采用i-PrOAc与正己烷混合溶剂对每一步产物进行重结晶分离纯化,具体见表 6,计算总收率约为55.1%。当采用叠缩工艺对化合物 1 进行制备(具体见实验部分),化合物 1 的总收率达到67.4%,纯度≥ 98.0%。由此可见,叠缩工艺有效地避免了中间体的流失,降低原料单耗,更有利于产品的工业放大。
|
|
表 6 每步重结晶收率 Table 6 Recrytallization yields of each reaction step |
以N-叔丁基-6-氯烟酰胺为原料,经过1, 4-加成与氧化、缩合、N-去烷基化、Hofmann重排反应,采用叠缩工艺合成了(6-(4-甲基哌嗪-1-基)-4-(邻甲苯基)吡啶-3-基)氨基甲酸甲酯。1, 4-加成与氧化反应采用无水体系,碘作为氧化试剂,探索出了1, 4-加成反应温度70 ~ 75 ℃,碘氧化温度-30 ~ -20 ℃,n (化合物 3):n (格式试剂):n (碘)=1:2:1.2为最佳工艺;缩合反应中确定了反应温度105 ~ 110 ℃,n (N-甲基哌嗪):n (化合物 3) = 3: 1,反应时间3 h为较优的反应工艺条件;N-去烷基化反应中,利用MeSO3H为去烷基化试剂,研究出了反应温度90 ~ 100 ℃、反应时间4 h,n (MeSO3H):n (化合物 4) = 3:1为较佳的反应工艺参数;在Hofmann重排反应中,PhI(OAc)2为氧化剂,KOH/MeOH体系中、反应温度20 ~ 30 ℃、反应时间1 h,确立了n (KOH):n (PhI(OAc)2): n (compound 5) = 4.5:1.05:1.0,m(compound 5):m(MeOH)=1.0:3.5为较佳的反应条件比。各中间体与化合物 1 结构均得到1H NMR,13C NMR与TOF-MS确认。通过叠缩工艺制备化合物 1 的总收率为67.4%,相关溶剂可回收套用,此工艺提高了收率、降低了生产成本、缩短了生产周期,可适用于工业化生产。
| [1] |
KEATING G M. Netupitant /palonosetron: a review in the prevention of chemotherapy-induced nausea and vomiting[J]. Drugs, 2015, 75(18): 2131-2141. DOI:10.1007/s40265-015-0512-9 |
| [2] |
SCHWARTZBERG L, ROELAND E, ANDRIC Z, et al. Phase 3 safety study of intravenous nepa, a novel fixed antiemetic combination of fosnetupitant and palonosetron in patients receiving highly emetogenic chemotherapy[J]. Annals of Oncology, 2018, 29(7): 1535-1540. |
| [3] |
丘岳, 张宏亮, 黄振光, 等. 肿瘤化疗致胃肠不适或恶心呕吐的预防用药临床指南系统评价[J]. 医药导报, 2018, 37(12): 1518-1523. QIU Y, ZHANG H L, HUANG Z G, et al. Systematic review of clinical guidelines for prevention of cancer chemotherapy-induced gastrointestinal adverse reactions[J]. Herald of Medicine, 2018, 37(12): 1518-1523. |
| [4] |
HOFFMANN T, BOS M, STADLER H, et al. Design and synthesis of a novel, achiral class of highly potent and selective, orally active neurokinin-1 receptor antagonists[J]. Bioorganic & Medical Chemistry Letters, 2006, 16(5): 1362-1365. |
| [5] |
KOVI R, KANNAPAN J, THANKOR S F, et al. Methods of making netupitant and intermediates thereof: US, 20150315149[P], 2015-11-05.
|
| [6] |
HOFMANN-EMERY F, HILPERT H, SCALONE M, et al. Efficient synthesis of novel NK1 receptor antagonists: Selective 1, 4-addition of grignard reagents to 6-chloronicotinic acid derivatives[J]. The Journal of Organic Chemistry, 2006, 71(5): 2000-2008. DOI:10.1021/jo0523666 |
| [7] |
HARRINGTON P J, JOHNSTON D, MOORLAG H, et al. Research and development of an efficient process for the construction of the 2, 4, 5-substituted pyridines of NK-1 receptor antagonists[J]. Organic Process Research & Development, 2006, 10(6): 1157-1166. |
| [8] |
COMINS D L, O'CONNOR S. Regioselective substitution in aromatic six-membered nitrogen heterocycles[J]. Advances In Heterocyclic Chemistry, 1988, 44: 199-267. DOI:10.1016/S0065-2725(08)60263-9 |
| [9] |
MEYERS A I, GABEL R A. Oxazolines as activating groups in aromatic substitution, selective metalation or addition to the 4-position of pyridine, a new synthesis of 1, 4-dihydropyridines[J]. Heterocycles, 1978, 11: 133-138. DOI:10.3987/S(N)-1978-01-0133 |
| [10] |
MEYER A I, GABEL R A. Substitutions of pyridines activated by oxazolines via nucleophilic additions for metalation-alkylation[J]. The Journal of Organic Chemistry, 1982, 47(13): 2633-2637. DOI:10.1021/jo00134a024 |
| [11] |
李敢. 甲基磺酸的应用研究进展[J]. 化工中间体, 2015, 3: 11-12. LI G. Research Progress of Methylsulfonic acid[J]. Chemical Intermediate, 2015, 3: 11-12. |
| [12] |
叶盼盼, 郑土才, 李静观, 等. Hofmann重排反应的应用进展[J]. 化工生产与技术, 2013, 20(3): 22-27. YE P P, ZHENG T C, LI J G, et al. Application advances of hofmann rearrangement reactions[J]. Chemical Production and Technology, 2013, 20(3): 22-27. DOI:10.3969/j.issn.1006-6829.2013.03.007 |
| [13] |
LOUDON G M, RADHAKRISHNA A S, ALMOND M R, et al. Conversion of aliphatic amides into amines with[1, 1-bis(trifluoroacetoxy)iodo] benzene.1.Scope of the reaction[J]. The Journal of Organic Chemistry, 1984, 49(22): 4272-4276. DOI:10.1021/jo00196a031 |
| [14] |
PRAKASH O, BATRA H, MORIARTY R M, et al. Hypervalent iodine oxidative rearrangement of anthranilamides, salicylamides and some β-substituted amides: A new and convenient synthesis of 2-benzimidazolones, 2-benzoxazolones and related compounds[J]. Synthesis, 2001, 4: 541-543. |
| [15] |
SONG H, CHEN W, QIN Y, et al. Preparation of alkyl carbamate of 1-protectedindole-3- methylamine as a precursor of indole-3-methylamine[J]. Synthetic Communications, 2005, 35(21): 2735-2748. DOI:10.1080/00397910500287967 |
| [16] |
LANDSBERG D, KALESSE M. Synthesis of symmetrical ureas by (diacetoxyiodo)benzene-induced hofmann rearrangement[J]. Synlett, 2010, 7: 1104-1106. |
| [17] |
张霁, 张福利. 叠缩工艺在制药工艺优化中的应用[J]. 中国医药工业杂志, 2013, 44(12): 1281-1291. ZHANG J, ZHANG F L. Application of telescoping approach to pharmaceutical process optimization[J]. Chinese Journal of Pharmaceuticals, 2013, 44(12): 1281-1291. |
| [18] |
张福利. 工艺改进与绿色制药[J]. 药学进展, 2016, 40(7): 505-517. ZHANG F L. Process improvement and green chemistry in pharmaceutical industry[J]. Progress In Pharmaceutical Sciences, 2016, 40(7): 505-517. |




