2. 复旦大学 药学院,上海 201203
2. School of Pharmacy, Fudan University, Shanghai 201203, China
木质纤维素生物质作为一种可再生资源,在生物化学和生物能源工业有着广泛的应用前景。虽然木质纤维素具有含量丰富、低价易得、可再生等优势,但它的商业应用仍存在问题[1]。木质纤维原料成分比较复杂,含有半纤维素和纤维素等,水解后主要为戊糖和己糖。在多种碳源共存的发酵过程中,细菌优先选择利用葡萄糖,这个现象被称为分解代谢阻遏(CCR)[2],被阻遏的碳源不能得到利用,产率较低。因此实现木质纤维素生物质的工业应用,首先需要解除分解代谢阻遏,实现多种碳源共同利用。Liang等[3]通过敲除pflB、ldhA、ppc和ptsG构建得到E. coli BA305,该菌株过表达磷酸烯醇丙酮酸羧基酶(PEPCK),可以同时消耗葡萄糖和木糖,利用木质纤维素生产琥珀酸,且产量到达83 g×L-1。Yao等[4]探讨了E. coli BW25113crp+以葡萄糖和木糖为混合碳源的发酵特性,发现增强crp基因能够使大肠杆菌同时消耗葡萄糖和木糖。Xia等[5]探讨了大肠杆菌C(ATCC8739)在葡萄糖、木糖、阿拉伯糖为碳源,生长抑制剂乙酸存在下的发酵特性,发现大肠杆菌C(ATCC8739)能够同时消耗葡萄糖、木糖、阿拉伯糖,乙酸的存在不影响碳源利用。
大肠杆菌分解代谢物阻遏效应主要是葡萄糖的磷酸转移酶系统(PTS)产生[6](图 1),关键组分包括环腺苷酸(cAMP),cAMP受体蛋白(Crp),腺苷酸环化酶(Cya)等。大肠杆菌的PTS系统,特异性地转运活化葡萄糖、果糖等PTS糖类;而对于木糖等无PTS转运系统的糖类,则通过糖特异性的透性酶运输。在PTS糖类和非PTS糖类共存的环境中,大肠杆菌优先利用PTS糖类作为碳源,PTS糖类耗尽时才能利用非PTS糖类生长。葡萄糖PTS转运系统中EIIAGlc-P不断将磷酸基团转移出去,得到以去磷酸化形式存在的EIIAGlc。未磷酸化的EIIAGlc会抑制非PTS糖类的摄取,EIIAGlc无法激活Cya的活性,导致胞内cAMP含量的下降,cAMP-Crp复合体的含量随之下降,最终导致分解代谢物阻遏。因此提高cAMP-Crp复合体的含量是解除分解代谢物阻遏的一种行之有效的方法。
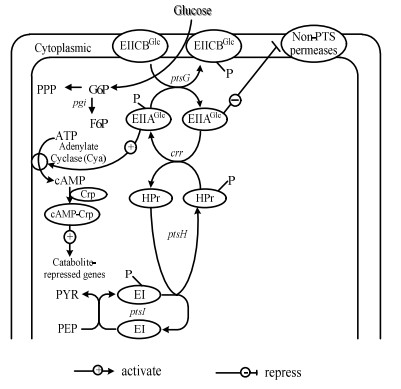
|
图 1 大肠杆菌的分解代谢物阻遏机制 Fig.1 Mechanisms of carbon catabolite repression in E.coli. |
pgi基因编码磷酸葡糖异构酶,催化葡萄糖-6-磷酸转化为果糖-6-磷酸。Toya等[7]的研究表明pgi敲除会导致ptsG转录水平的下降。有研究表明ptsG基因转录水平的下降可以显著减弱葡萄糖PTS系统,减少胞内EIIAGlc的含量[8]。敲除pgi基因可以解除分解代谢阻遏[9],还能够使葡萄糖代谢进入磷酸戊糖途径以提供NADPH[10]。因此,此策略在生产生物产品方面有着广泛的应用。Lee等[11]在E. coli BLdtug24的基础上,敲除pgi,增加了NADPH和胸腺嘧啶的产量。Shiue等[9]在大肠杆菌中同时敲除pgi和zwf,解除了分解代谢阻遏,D-葡萄糖二酸对葡萄糖的得率显著增加。Sekar等[12]在E. coli ΔhycAΔhyaABΔhybBCΔldhAΔfrdAB的基础上敲除pgi,过表达zwf和gnd;重组菌的乙醇和氢气对葡萄糖的得率接近最大理论得率。本文通过敲除大肠杆菌pgi基因,探究其在PTS糖类和非PTS糖类共存的环境下的碳源利用情况。
2 材料与方法 2.1 菌株和培养基实验涉及菌株E. coli BW25113(CGSC#:7636, Keio Collection)和E. coli BW25113△pgi(CGSC#:10867, Keio Collection)如表 1所示。
| 表 1 实验涉及的大肠杆菌菌株 Table 1 Escherichia coli strains used in this study |
实验中使用的培养基为LB培养基和M9培养基,其中M9培养基成分见文献[13]。M9中添加葡萄糖、果糖和木糖,初始浓度均为是5 g·L-1。为了探究不同比例对混合糖利用的情况,设置混合糖浓度为:葡萄糖5 g·L-1,果糖2.5 g·L-1,木糖2.5 g·L-1;葡萄糖2.5 g·L-1,果糖5 g·L-1,木糖5 g·L-1;葡萄糖5 g·L-1,果糖2.5 g·L-1,木糖5 g·L-1。
2.2 培养条件从保种甘油管中取0.1 mL菌液至含10 mL LB培养基的L管中进行一级前培养。8 h后,取1 mL一级种子液至100 mL M9培养基中进行二级前培养。分批培养和连续培养在3 L发酵罐(BLBIO-3GJ)中进行,发酵体积为1 L,使用M9培养基。培养条件为pH 7.0,温度37℃,好氧发酵时空气流量1 vvm (air volume·(working volume×min)-1),搅拌转速400 r×min-1,溶氧量35%~40%(V·V-1)。厌氧发酵时,不通入空气,搅拌转速100 r×min-1。连续培养时,稀释率为0.1 h-1。
2.3 分析方法菌株的生长通过单光束紫外-可见分光光度计(UV-7504)测定。发酵结束后取200 mL菌液,离心收集细胞并干燥,计算每升培养液的细胞干重。同时测定菌液在600 nm波长处的吸光值,建立OD600与细胞干重的关系曲线。最后通过测定菌液在600 nm波长处的吸光值来计算当时的细胞浓度。葡萄糖、果糖、木糖、乳酸、乙酸、甲酸、乙醇和木糖醇的浓度通过高效液相色谱仪(Agilent-1260)测定。使用的色谱柱为HPX-87H柱(Bio-Rad, Hercules,CA),流动相为5 mmol·L-1硫酸,流速为0.5 mL· min-1,进样量20 μL。使用RID检测器,RID的温度设置为55℃。柱子柱温为60℃。
2.4 大肠杆菌总RNA提取大肠杆菌总RNA的提取利用Qiagen RNeasy Mini试剂盒(QIAGEN K.K., Japan)完成。RNA的浓度和纯度通过260和280 nm的光密度比例来鉴定;RNA的质量通过1%甲醛琼脂糖凝胶电泳来测定。在此研究中使用的引物序列和基因特异性引物对的设计准则依照文献报告[13]。
2.5 cDNA合成和PCR扩增RT-PCR的反应利用Qiagen One-step RT-PCR试剂盒(QIAGEN K.K.,Japan)在PCR热循环仪(Takara TP240, Japan)中进行。以步骤2.4节获得的mRNA为模板制备反应混合液,先在95℃中孵育15 min进行初始PCR激活,再置于30℃中孵育30 min进行反转录用于cDNA的合成,之后进行30个循环的PCR扩增。PCR循环参数:94℃ 1 min的变性;50℃ 1 min的退火;72℃ 1 min的延伸。30个循环结束后,72℃延伸10 min。反应结束后取5 μL PCR产物进行琼脂糖凝胶电泳。
2.6 代谢流量分析由于测定数据的数量多于系统的自由度,产生了超定系统。在该系统中,利用冗余的数据不仅能计算未测流量的估计值,也能计算已测量流量的估计值。本次研究中在厌氧连续培养条件下使用了超定系统代谢流量分析的方法。计算代谢流量使用的质量平衡方程依照文献报告[13]。使I表示化学计量系数矩阵,i表示胞内代谢流量矢量,v表示胞外测定的底物代谢速率和产物的生成速率,则质量平衡方程如式(1)所示:
| $I\mathit{\boldsymbol{i}} = v$ | (1) |
将式(1)进行变换:
| $\left[\begin{array}{l} {v_{\rm{m}}}\\ {v_{\rm{c}}} \end{array} \right] = \left[{\begin{array}{*{20}{c}} {{\mathit{\boldsymbol{I}}_{11}}}&{{\mathit{\boldsymbol{I}}_{12}}}\\ {{\mathit{\boldsymbol{I}}_{21}}}&{{\mathit{\boldsymbol{I}}_{22}}} \end{array}} \right]\left[\begin{array}{l} {\mathit{\boldsymbol{i}}_1}\\ {\mathit{\boldsymbol{i}}_2} \end{array} \right]$ | (2) |
其中vm表示已测量的速率,vc表示胞内代谢物的累积速率。假定I22是一个满秩的方阵,同时根据稳态代谢物平衡,设定vc为零向量,则式(2)变为:
| ${v_{\rm{m}}} = {\mathit{\boldsymbol{I}}_{11}}{\mathit{\boldsymbol{i}}_1} + {\mathit{\boldsymbol{I}}_{12}}{\mathit{\boldsymbol{i}}_2}$ | (3.1) |
| $0 = {\mathit{\boldsymbol{I}}_{21}}{\mathit{\boldsymbol{i}}_1} + {\mathit{\boldsymbol{I}}_{22}}{\mathit{\boldsymbol{i}}_2}$ | (3.2) |
变换式(3.2)得
| ${\mathit{\boldsymbol{i}}_2} = - \mathit{\boldsymbol{I}}_{22}^{ - 1}{\mathit{\boldsymbol{I}}_{21}}{\mathit{\boldsymbol{i}}_1}$ | (4) |
将式(4)带入式(3.1)得到
| ${v_{\rm{m}}} = H{\mathit{\boldsymbol{i}}_1}$ | (5) |
其中
| $H = {\mathit{\boldsymbol{I}}_{11}} - {\mathit{\boldsymbol{I}}_{12}}\mathit{\boldsymbol{I}}_{22}^{ - 1}{\mathit{\boldsymbol{I}}_{21}}$ | (6) |
根据式(5)和式(6)可以解得r的最小二乘估计为:
| $\mathop {{\mathit{\boldsymbol{i}}_1}}\limits^ \wedge = {({H^{\rm{T}}}H)^{ - 1}}{H^{\rm{T}}}{v_{\rm{m}}}$ | (7) |
| $\mathop {{\mathit{\boldsymbol{i}}_2}}\limits^ \wedge = - \mathit{\boldsymbol{I}}_{22}^{ - 1}{\mathit{\boldsymbol{I}}_{21}}\mathop {{\mathit{\boldsymbol{i}}_1}}\limits^ \wedge $ | (8) |
使用上述的等式计算代谢流量。
3 结果与讨论 3.1 好氧条件下分批发酵结果图 2(a)和图 3(a)所示为野生型菌株和pgi突变株以葡萄糖、果糖和木糖作为混合碳源在好氧条件下分批发酵培养的结果。野生型菌株优先消耗葡萄糖,在葡萄糖消耗殆尽后果糖和木糖才同时被消耗(图 2(a))。菌株E. coli BW25113 △pgi同时消耗葡萄糖、果糖和木糖,分解代谢阻遏完全被解除;生物量和碳源消耗速率与野生型菌株相比有所下降,乙酸的生成略高于野生型(图 3(a))。敲除pgi基因,使葡萄糖从糖酵解途径流向磷酸戊糖途径,同时产生过量的NADPH,影响菌体生长和葡萄糖的消耗速率[14]。菌株E. coli BW25113 crp+在葡萄糖耗尽后实现果糖和木糖的同时消耗[13],说明crp基因的增强未到完全解除分解代谢阻遏的程度,直接降低葡萄糖消耗的策略更为有效。为检验不同比例对混合糖利用的影响,对菌株做了在不同比例下的好氧分批发酵培养(图 2(b),2(c),2(d),3(b),3(c),3(d))结果表明,不同比例的糖对混合糖的利用没有影响。
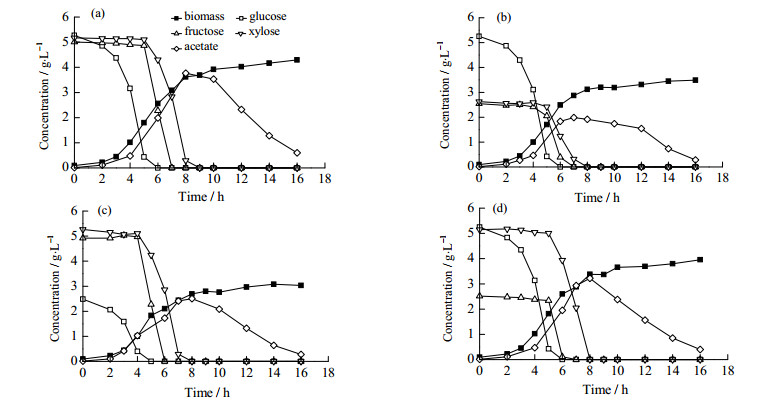
|
图 2 E. coli BW25113以不同比例葡萄糖、果糖和木糖为混合碳源在好氧条件下分批发酵结果 Fig.2 Results of batch aerobic cultivation of E. coli BW25113 using a mixture of glucose, fructose, and xylose as the carbon source (a) glucose 5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (b) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 2.5 g·L-1 (c) glucose 2.5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (d) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 5 g·L-1 |
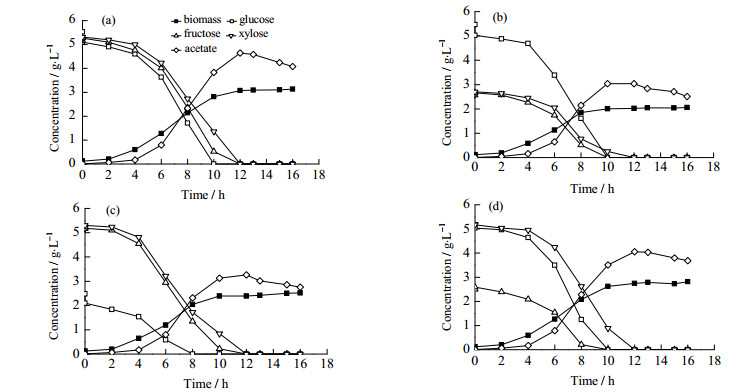
|
图 3 E. coli BW25113 △pgi以不同比例葡萄糖、果糖和木糖为混合碳源在好氧条件下分批发酵结果 Fig.3 Results of batch aerobic cultivation of E. coli BW25113 △pgi using a mixture of glucose, fructose, and xylose as the carbon source (a) glucose 5g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (b) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 2.5 g·L-1 (c) glucose 2.5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (d) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 5 g·L-1 |
图 4(a)和图 5(a)所示为野生型菌株和pgi突变株以葡萄糖、果糖和木糖作为混合碳源在厌氧条件下进行分批发酵培养的结果。野生型菌株优先消耗葡萄糖,在葡萄糖耗尽后果糖和木糖才开始同时被消耗,与好氧条件下发酵结果相似;木糖消耗量明显下降,与好氧条件下情况不同。厌氧发酵产物浓度依次为乙酸、甲酸、乙醇以及少量乳酸。其中菌体生物量主要在以葡萄糖和果糖作为碳源时积累。菌株E. coli BW25113 △pgi同时消耗葡萄糖、果糖和木糖,消耗速率与野生型相比降低,与好氧条件下情况相似;生物量的产生略低于野生型;发酵产物中几乎不产乳酸,其它胞外代谢物与野生型相似。同好氧条件类似,在厌氧条件下不同比例的糖对混合糖的利用没有影响(图 4(b),4(c),4(d),5(b),5(c),5(d))。
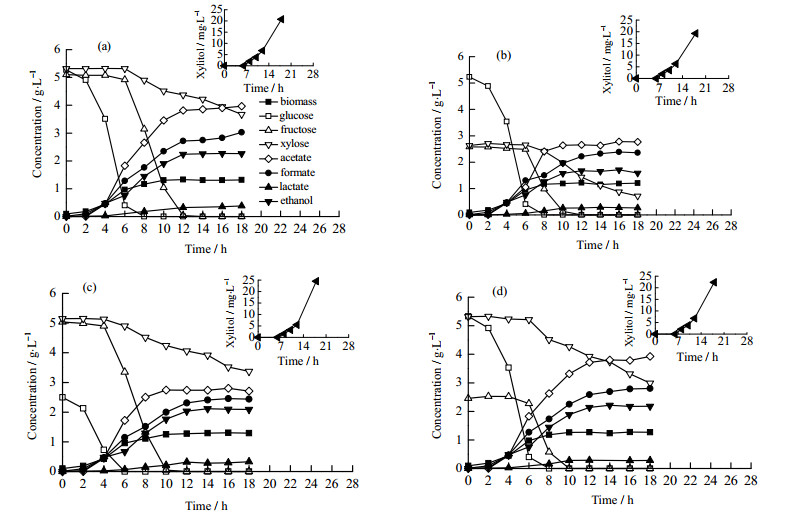
|
图 4 E.coli BW25113以不同比例葡萄糖、果糖和木糖为混合碳源在厌氧条件下分批发酵结果 Fig.4 Results of batch anaerobic cultivation of E. coli BW25113 using a mixture of glucose, fructose, and xylose as the carbon source (a) glucose 5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (b) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 2.5 g·L-1 (c) glucose 2.5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (d) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 5 g·L-1 |
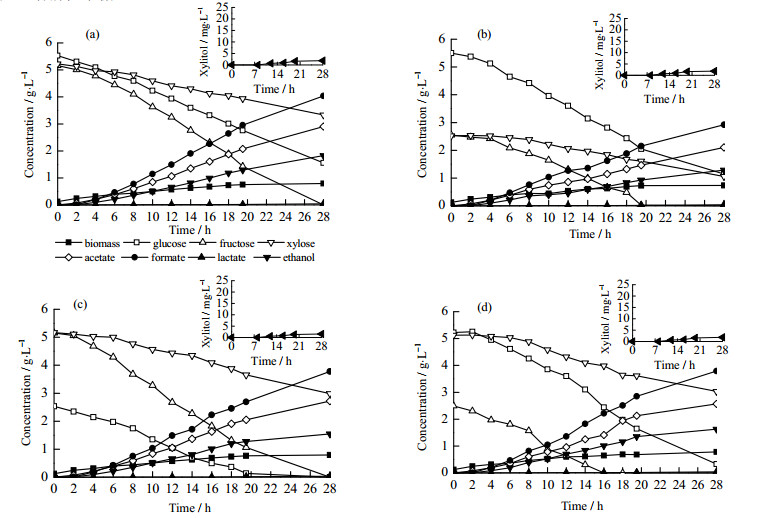
|
图 5 E. coli BW25113 Δpgi以不同比例葡萄糖、果糖和木糖为混合碳源在厌氧条件下分批发酵结果 Fig.5 Results of batch anaerobic cultivation of E. coli BW25113 Δpgiusing a mixture of glucose, fructose, and xylose as the carbon source (a) glucose 5g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (b) glucose 5 g·L-1, fructose 2.5 g·L-1, xylose 2.5 g·L-1 (c) glucose 2.5 g·L-1, fructose 5 g·L-1, xylose 5 g·L-1 (d) glucose 5g·L-1, fructose 2.5 g·L-1, xylose 5 g·L-1 |
菌株在厌氧条件和好氧条件下培养结果差异主要体现在碳源利用和代谢副产物的生成。厌氧条件下,氧化磷酸化无法进行,NADH过量,碳源流向多种代谢副产物,如甲酸、乙酸、乳酸和乙醇。此外木糖的利用情况也不同,如图 2(a)和图 4(a)所示,在好氧条件下,当葡萄糖耗尽后木糖全部耗尽;而在厌氧条件下,葡萄糖和果糖全都耗尽,野生型的木糖消耗量依旧很低。有研究表明,在厌氧条件下,小部分木糖会被还原成木糖醇,而木糖醇对细胞生长有抑制作用[15]。图 4和图 5的小图为胞外的木糖醇浓度随时间的变化曲线图。厌氧条件下,E. coli BW25113△pgi生成的木糖醇明显低于野生型生成的木糖醇,与E. coli BW25113 crp+相似[13]。由此可以解释野生型菌株只消耗少量木糖的原因,而E. coli BW25113 △pgi在逐渐消耗木糖。
3.3 厌氧条件下连续发酵结果表 2所示为E. coli BW25113和E. coli BW25113△pgi以葡萄糖、果糖和木糖作为混合碳源在厌氧条件下以0.1 h-1的稀释率进行连续发酵培养的结果。E. coli BW25113连续培养发酵液中未检测到葡萄糖,剩余的木糖浓度高于果糖的浓度,同厌氧分批发酵结果一致。E. coli BW25113 △pgi同时消耗葡萄糖、果糖和木糖,发酵液中未检测到乳酸,同厌氧分批发酵结果一致。与野生型菌株相比,E. coli BW25113 △pgi菌株的葡萄糖摄取速率下降,果糖和木糖摄取速率上升,连续培养发酵液中剩余果糖的浓度低于葡萄糖浓度、木糖浓度。说明E. coli BW25113 △pgi不再优先消耗葡萄糖,葡萄糖PTS系统可能被抑制。与E. coli BW25113 crp+相比,E. coli BW25113 △pgi葡萄糖的摄取速率降低,果糖摄取速率增加,木糖摄取速率稍微降低[13]。
| 表 2 E. coli BW25113和E. coli BW25113 △pgi以葡萄糖、果糖和木糖作为混合碳源在厌氧条件下以0.1 h-1的稀释率进行连续培养的结果 Table 2 Continuous anaerobic fermentation of E. coli BW25113 and its △pgi mutant using a mixture of glucose, fructose, and xylose as the carbon source under dilution rate of 0.1 h-1 |
如图 6所示为厌氧条件下连续发酵的E. coli BW25113与E. coli BW25113 △pgi部分基因转录水平的比较。pgi基因表达水平与菌体生长相关[16],可以解释E. coli BW25113 △pgi的生物量低于野生型。与野生型菌株相比,菌株E. coli BW25113 △pgi中全局调节子crp的表达水平增加(P < 0.01),cyaA的转录水平增加(P < 0.01),说明分解代谢阻遏被解除[6],此现象也在E. coli BW25113 crp+中发现[13]。尽管Crp能激活ptsG[8],但pgi敲除会导致ptsG转录水平的下降[7],最终ptsG转录水平显著下降(P < 0.01),与降低的葡萄糖摄取速率一致。由于crp的表达水平增加,引起cAMP-Crp浓度增加,激活木糖调节子xylR[17],xylR及其调控的xylA,xylB转录水平增加(P < 0.01),引起木糖摄取速率增加。磷酸戊糖途径的第一个基因zwf转录水平显著增加(P < 0.01),与葡萄糖代谢被迫从糖酵解途径进入磷酸戊糖途径相关[10]。除此之外,E. coli BW25113 △pgi菌株的rpoS的转录水平上升,可能是因为rpoS的转录不再被EIIAGlc所抑制,这与cAMP-Crp浓度增加,EIIAGlc含量减少效果一致。此外,和野生型相比,pflA,ldhA和adhE基因转录水平下降(P < 0.01),这与表 2所得结果甲酸、乳酸和乙醇的产量降低一致。而在E. coli BW25113 crp+中,ldhA基因转录水平增加(P < 0.01),乳酸生成增加。
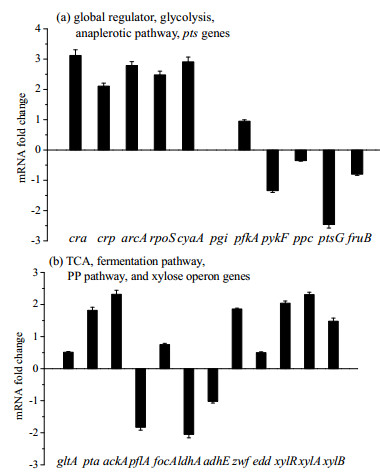
|
图 6 E. coli BW25113 △pgi以葡萄糖、果糖和木糖为混合碳源在厌氧条件下以0.1 h-1为稀释率进行连续培养的部分基因转录水平的比较 Fig.6 Gene transcript levels of △pgi mutant in continuous anaerobic culture using a mixture of glucose, fructose, and xylose as the carbon source under dilution rate of 0.1 h-1 |
如图 7所示为E. coli BW25113和E. coli BW25113 △pgi以葡萄糖、果糖和木糖为混合碳源在厌氧条件下以0.1 h-1为稀释率进行连续发酵培养的代谢流量分布结果图。与野生型菌株比较,可发现E. coli BW25113 △pgi的葡萄糖利用途径流量降低,流量从糖酵解途径进入磷酸戊糖途径,不再生成果糖-6-磷酸造成葡萄糖-6-磷酸的积累,与Toya,Canonaco和Usui的结果一致[7, 14, 16]。果糖和木糖摄取途径流量增加,乙醇、甲酸和乳酸合成途径流量降低。代谢流量分布与基因转录水平数据(图 6)和发酵结果(表 2)相符。与E. coli BW25113 crp+相比,葡萄糖摄取途径的流量降低,果糖摄取途径的流量增加,木糖摄取途径的流量略微增加,乙酸、乙醇和乳酸生成途径的流量降低,甲酸生成途径的流量未见变化。
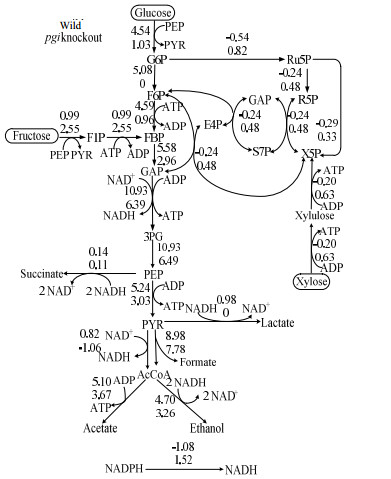
|
图 7 E. coli BW25113和E. coli BW25113 △pgi以葡萄糖、果糖和木糖为混合碳源在厌氧条件下以0.1 h-1为稀释率进行连续培养的代谢流量分布 Fig.7 Metabolic flux distributions of wild type E. coli BW25113 and △pgi mutant in continuous anaerobic culture using a mixture of glucose, fructose, and xylose as the carbon source under dilution rate of 0.1 h-1 |
由图 5和表 2可得,在厌氧分批发酵培养和厌氧连续发酵培养中,E. coli BW25113 △pgi果糖的摄取速率皆比葡萄糖的摄取速率快。可能原因如下:pgi基因敲除后,葡萄糖-6-磷酸无法转化为果糖-6-磷酸,葡萄糖的糖酵解途径被切断,葡萄糖的摄取速率下降。而果糖则通过磷酸化进入糖酵解途径,摄取速率升高。这与代谢流量分布结果(图 7)一致。根据基因转录水平数据(图 6)可以发现,E. coli BW25113 △pgi的fruB转录水平下降,这可能是因为果糖-1-磷酸含量升高间接抑制了fruB的转录。大肠杆菌中果糖PTS系统包含两个胞质蛋白EI和FPr[18]。其中由fruB编码的FPr负责从磷酸化的EI中获得磷酸基因传递给EIIAFru[19]。fruB转录水平的下降一定程度上抑制了果糖的利用,因此果糖摄取速率增大的幅度有限。
课题组前期的研究结果发现,在E. coli BW25113在厌氧培养条件下,小部分木糖被还原成木糖醇,木糖醇会被果糖PTS系统磷酸化形成木糖醇-5-磷酸(高于阈值15.2 mg·L-1),抑制菌体生长;在E. coli BW25113crp+在厌氧培养条件下产生少量木糖醇,不足以抑制菌体生长[13]。本研究中,E. coli BW25113 △pgi在厌氧条件下,葡萄糖、果糖和木糖同时开始被消耗,但只产生了低浓度的木糖醇,抑制菌体生长的效果不显著。上述结果可能是由于E. coli BW25113 △pgi在单位时间内消耗的果糖量低于野生型,不足以诱导木糖醇形成抑制菌体生长的木糖醇-5-磷酸。此外,与野生型相比,E. coli BW25113 △pgi的cyaA和crp转录水平增加,分解代谢阻遏一定程度上被解除,木糖以木酮糖-5-磷酸的形式进入磷酸戊糖途径的流量增加,由此减少了由木糖还原产生的木糖醇的量。在基因转录水平(图 6),xylR及其调控编码木酮糖异构酶的xylA和编码木酮糖激酶的xylB的转录水平增加也证明这一点。
4 结论在本研究中发现大肠杆菌pgi基因敲除能在一定程度上解除分解代谢阻遏。在pgi基因敲除的情况下,葡萄糖、果糖和木糖三种碳源被同时消耗。pgi基因的敲除,使得葡萄糖代谢只能够进入磷酸戊糖途径,继而导致G6P的积累,ptsG转录水平的下降,最终使cAMP-Crp含量增加,EIIAGlc含量减少。EIIAGlc含量的下降,对non-PTS糖类的特异性透性酶的抑制减弱,使大肠杆菌能够同时消耗non-PTS糖类碳源。因此,菌株E. coli BW25113 △pgi能同时消耗混合碳源但消耗速率降低。研究成功构建出一株能够同时利用葡萄糖、果糖和木糖三种碳源的菌株E. coli BW25113 △pgi,在生物化学和生物能源领域上具有广阔的应用前景。
| [1] | Guerriero G, Hausman J F, Strauss J, et al. Lignocellulosic biomass:biosynthesis, degradation, and industrial utilization[J]. Engineering in Life Sciences , 2016, 16(1): 1-16. DOI:10.1002/elsc.v16.1. |
| [2] | Luo Y, Zhang T, Wu H. The transport and mediation mechanisms of the common sugars in Escherichia coli[J]. Biotechnology Advances , 2014, 32(5): 905-919. DOI:10.1016/j.biotechadv.2014.04.009. |
| [3] | Liang L, Liu R, Li F, et al. Repetitive succinic acid production from lignocellulose hydrolysates by enhancement of ATP supply in metabolically engineered Escherichia coli[J]. Bioresource Technology , 2013, 143(6): 405-412. |
| [4] | Yao R, Hirose Y, Sarkar D, et al. Catabolic regulation analysis of Escherichia coli and its crp, mlc, mgsA, pgi and ptsGmutants[J]. Microbial Cell Factories , 2011, 10: 67. DOI:10.1186/1475-2859-10-67. |
| [5] | Xia T, Eiteman M A, Altman E. Simultaneous utilization of glucose, xylose and arabinose in the presence of acetate by a consortium of Escherichia coli strains[J]. Microbial Cell Factories , 2012, 11: 77. DOI:10.1186/1475-2859-11-77. |
| [6] | Deutscher J, Francke C, Postma P W. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J]. Microbiology & Molecular Biology Reviews , 2006, 70(4): 939-1031. |
| [7] | Mannan A A, Toya Y, Shimizu K, et al. Integrating kinetic model of E. coli with genome scale metabolic fluxes overcomes its open system problem and reveals bistability in central metabolism[J]. PloS One , 2015, 10(10): e0139507. DOI:10.1371/journal.pone.0139507. |
| [8] | Kim S M, Choi B Y, Ryu Y S, et al. Simultaneous utilization of glucose and xylose via novel mechanisms in engineered Escherichia coli[J]. Metabolic Engineering , 2015, 30: 141-148. DOI:10.1016/j.ymben.2015.05.002. |
| [9] | Shiue E, Brockman I M, Prather K L. Improving product yields on D-glucose in Escherichia coli via knockout of pgi andzwf and feeding of supplemental carbon sources[J]. Biotechnology and Bioengineering , 2015, 112(3): 579-587. DOI:10.1002/bit.v112.3. |
| [10] | Fong S S, Nanchen A, Palsson B O, et al. Latent pathway activation and increased pathway capacity enable Escherichia coli adaptation to loss of key metabolic enzymes[J]. Journal of Biological Chemistry , 2006, 281(12): 8024-8033. DOI:10.1074/jbc.M510016200. |
| [11] | Lee H C, Kim J S, Jang W, et al. High NADPH/NADP+ ratio improves thymidine production by a metabolically engineered Escherichia coli strain[J]. Journal of Biotechnology , 2014, 149(1-2): 24-32. |
| [12] | SundaraSekar B, Seol E, Park S. Co-production of hydrogen and ethanol from glucose in Escherichia coli by activation of pentose-phosphate pathway through deletion of phosphoglucose isomerase (pgi) and overexpression of glucose-6-phosphate dehydrogenase (zwf) and 6-phosphogluconate dehydrogenase (gnd)[J]. Biotechnology for Biofuels , 2017, 10: 85. DOI:10.1186/s13068-017-0768-2. |
| [13] | XIONG De-wang(熊得王), LIU Qing(刘晴), YAO Rui-lian(姚瑞莲), et al. Effect of crp gene mutation on the utilization mechanism of Escherichia coli for a mixture of multiple carbon sources(Crp基因突变对大肠杆菌利用混合碳源的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(6): 1390-1398. |
| [14] | Canonaco F, Hess T A, Heri S, et al. Metabolic flux response to phosphoglucose isomerase knock-out in Escherichia coli and impact of overexpression of the soluble transhydrogenase UdhA[J]. FEMS Microbiology Letters , 2001, 204(2): 247-252. DOI:10.1111/fml.2001.204.issue-2. |
| [15] | Reiner A M. Xylitol and D-arabitol toxicities due to derepressed fructose, galactitol, and sorbitol phosphotransferases of Escherichia coli[J]. Journal of Bacteriology , 1977, 132(1): 166-173. |
| [16] | Usui Y, Hirasawa T, Furusawa C, et al. Investigating the effects of perturbations topgi and eno gene expression on central carbon metabolism in Escherichia coli using 13C metabolic flux analysis[J]. Microbial Cell Factories , 2012, 11: 87. DOI:10.1186/1475-2859-11-87. |
| [17] | Park Y H, Lee B R, Seok Y J, et al. In vitro reconstitution of catabolite repression in Escherichia coli[J]. Journal of Biological Chemistry , 2006, 281(10): 6448-6454. DOI:10.1074/jbc.M512672200. |
| [18] | Saier M H Jr, Ramseier T M, Reizer J. Regulation of carbon utilization[C]//Escherichia coli and Salmonella: cellular and molecular biology, 2nd ed. Washington DC: ASM Press, 1996: 1325-1343. |
| [19] | Saier M H Jr, Ramseier T M. The catabolite repressor/activator (Cra) protein of enteric bacteria[J]. Journal of Bacteriology , 1996, 178(12): 3411-3417. DOI:10.1128/jb.178.12.3411-3417.1996. |




