2. 广西大学 环境学院,广西 南宁 530004;
3. 广西碳酸钙产业化工程院,广西 南宁 530004
2. School of Environment, Guangxi University, Nanning 530004, China;
3. Guangxi Engineering Academy of Calcium Carbonate Industrialization, Nanning 530004, China
随着工业的发展,被称为“重金属五毒”之一的Cr(Ⅵ)在电镀、冶金、印染、制革等工业中被大量使用,产生的废水和废渣不仅对生态环境造成极大破坏,而且对人类健康产生严重威胁。重金属Cr(Ⅵ)已被国际抗癌研究中心和美国毒理学会公认为致癌物,被列为对人体损害最为严重的8种化学物质之一,国际环保组织指出居民使用含Cr(Ⅵ)的污染水是造成癌症发生的主要原因[1]。目前,含Cr(Ⅵ)废水的传统处理方法主要有生物法[2]、离子交换法[3]、膜分离法[4]和吸附法[5, 6]等。其中吸附法因其操作简单而被普遍使用,膨润土矿物材料因具有比表面积大、资源丰富且价格低廉等优点而被广泛应用于吸附领域[7, 8],但未改性的膨润土吸附能力较差,且存在固液分离困难、易产生二次污染等问题。磁分离技术虽然常用于解决固液分离和材料的高效回收利用[9],但是未经修饰的Fe3O4在空气中容易被氧化,从而导致磁性降低甚至消失。本课题组曾用柠檬酸对膨润土进行活化改性,改性后不仅吸附性能有所提高[10],而且其表面的‒COOH和‒OH有助于其与Fe3O4微粒结合,因此柠檬酸膨润土可作为磁性Fe3O4的理想载体。壳聚糖作为一种来源广、无污染的天然高分子,不仅可用于修饰Fe3O4微粒防止其被氧化,而且其分子中的功能基团(‒NH2、‒OH)对Cr(Ⅵ)也有很好的富集作用[11]。本研究构筑了一种壳聚糖修饰的磁性柠檬酸膨润土(MCAB),其制备方法简单,绿色环保,在外加磁场条件下能够快速实现固液分离,同时研究了MCAB对Cr(Ⅵ)的吸附性能。本论文的研究可为含Cr(Ⅵ)废水的处理提供参考。
2 实验部分 2.1 试剂和仪器原料和试剂:天然膨润土,天津市光复精细化工研究所,化学纯,使用前经120℃干燥处理并过200目筛。壳聚糖(脱乙酰度大于95%,黏度:100~200 mPa.s),阿拉丁试剂(上海)有限公司。一水合柠檬酸、冰醋酸、六水合三氯化铁、四水合氯化亚铁、一水合氨等试剂均为分析纯。
设备:JY992‒IIDN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;XH‒200A电脑微波固液相合成/萃取仪,北京祥鹄科技发展有限公司;DZF‒6050型真空干燥箱,上海和呈仪器制造有限公司;UV‒2550紫外分光光度计,日本岛津公司;傅立叶变换红外光谱仪Nicolet Nexus 470,美国尼采公司。
2.2 MCAB的制备称取5.0 g天然膨润土于250 mL三口烧瓶中,加入50 mL去离子水配成膨润土悬浮液,配制一定浓度的柠檬酸溶液[10]并将其倒入膨润土悬浮液中,在60℃恒温下搅拌2 h,洗涤至中性,烘干、研磨并过200目筛,得到CAB样品。
取2.0 g的CAB于100 mL去离子水中,超声分散5 min,再缓慢加入1.47 g的FeCl3·6H2O和0.685 g的FeCl2·4H2O,继续超声10 min。将超声后的混合悬浮液倒入三口烧瓶中,微波加热到60℃后,迅速加入10 mL25%(wt)的氨水,恒温搅拌30 min,再加入20 mL壳聚糖溶液(0.1 g溶于20 mL 1%(wt)的冰醋酸),并逐滴加入2 mL 5%(wt)的戊二醛,继续搅拌30 min。反应结束后,在外加磁场的作用下固液分离出磁性复合物,并用无水乙醇、去离子水洗涤若干次,60℃下真空干燥12 h,研磨并过200目筛,制得MCAB样品。
2.3 静态吸附实验配制1000 mg·L‒1的Cr(Ⅵ)标准储备液,实验采用的不同浓度Cr(Ⅵ)溶液均由上述标准储备液稀释所得。量取一定体积的含Cr(Ⅵ)溶液于50 mL锥形瓶中,加入一定量所制备的吸附剂,不同温度下以150 r·min‒1振荡吸附处理一定时间,用带有0.45 μm滤头的注释器取样,采用二苯碳酰二肼分光光度法[5]测定水样中Cr(Ⅵ)的浓度,平衡吸附量和去除率计算公式见(1) 和(2):
| ${{q}_{\text{e}}}=({{C}_{\text{0}}}-{{C}_{\text{t}}})\times {V}/{M}\;$ | (1) |
| ${{R}_{\text{d}}}={({{C}_{\text{0}}}-{{C}_{\text{t}}})}/{{{C}_{\text{0}}}}\;$ | (2) |
式中qe为平衡吸附量,mg·g–1;C0为吸附前Cr(Ⅵ)的浓度,mg·L–1;Ct为吸附后Cr(Ⅵ)的浓度,mg·L‒1;V为移取的溶液的体积,L;Rd为Cr(Ⅵ)的去除率,%;M为吸附剂的投加量,g。
2.3.1 吸附剂用量的影响移取20 mL浓度为10 mg·L‒1的Cr(Ⅵ)溶液于若干50 mL锥形瓶中,调节pH为3,吸附剂投加量为0.4~1.8 g·L‒1,在30℃的条件下,振荡吸附2.5 h,考察CAB和MCAB的投加量对吸附效果的影响。
2.3.2 Cr(Ⅵ)初始pH值的影响向若干50 mL的锥形瓶中加入20 mL浓度为10 mg·L‒1的Cr(Ⅵ)溶液,调节pH(2~8),分别加入0.032 g的MCAB,在30℃下振荡吸附2.5 h,并通过(1) 式计算其平衡吸附量。
2.3.3 吸附等温模型与吸附动力学模型研究向一系列20 mL不同浓度的Cr(Ⅵ)溶液(10~80 mg·L‒1)加入1.6 g·L‒1的MCAB,调节pH = 3,在30℃的条件下,振荡至吸附平衡,采用Langmuir和Freundlich吸附等温模型对吸附平衡数据进行拟合。公式见(3) 和(4):
| ${{{C}_{\text{e}}}}/{{{q}_{\text{e}}}}\;\text{=}{\text{1}}/{{{q}_{\text{max}}}{{K}_{\text{L}}}}\;\text{+}{{{C}_{\text{e}}}}/{{{q}_{\text{max}}}}\;$ | (3) |
| $\ln {{q}_{\text{e}}}\text{=}\ln {{K}_{\text{f}}}\text{+}{\ln {{C}_{\text{e}}}}/{n}\;$ | (4) |
式中Ce为平衡时浓度,mg·L‒1;qe为平衡吸附量,mg·g‒1;qmax为最大吸附量,mg·g‒1;KL是Langmuir吸附常数,L·mg‒1;Kf和n是Freundlich常数。
取20 mL 10 mg·L‒1的Cr(Ⅵ)溶液于若干锥形瓶中,加入1.6 g·L‒1的MCAB,pH值调节为3,在30℃的条件下振荡吸附,在0~150 min不同时间间隔取样,测定Cr(Ⅵ)残留浓度,实验数据采用准一级、准二级动力学模型拟合,公式见(5)、(6):
| $\ln \left( {{q}_{\text{e}}}-{{q}_{\text{t}}} \right)\text{=}\ln {{q}_{\text{e}}}-{{k}_{\text{1}}}t$ | (5) |
| ${t}/{{{q}_{\text{t}}}}\;\text{=}{\text{1}}/{{{k}_{\text{2}}}q_{\text{e}}^{\text{2}}}\;\text{+}{1}/{{{q}_{\text{e}}}}\;$ | (6) |
式中qe为平衡吸附量,mg·g‒1;qt是t时刻的吸附量,mg·g‒1;k1是准一级动力学常数,min‒1;k2是准二级动力学常数,g·mg‒1·min‒1。
3 结果与讨论 3.1 MCAB复合吸附剂的表征图 1中(a)、(b)分别为CAB和MCAB的SEM照片。对比可知,CAB表面有片层卷曲现象,且较为光滑,而复合后的MCAB表面明显粗糙,片层上长有很多微小颗粒,由XRD结果可知微小颗粒为磁性Fe3O4微粒,对比发现复合吸附剂的比表面积有所增大,有利于提高吸附能力。

|
图 1 CAB(a)和MCAB(b)的SEM图 Fig.1 SEM micrographs of CAB (a) and MCAB (b) |
CAB和MCAB的XRD图谱如图 2所示。对比可知,在MCAB的图谱上,2θ= 30.08°、35.43°、43.05°、56.94°、62.52°处的衍射峰,分别归属于Fe3O4的(220)、(311)、(400)、(511)、(440) 晶面的衍射,与Fe3O4粉末的标准卡片(JCPDS NO.88-0315) 结果一致。说明MCAB上负载有Fe3O4微粒。由布拉格方程2dsinθ= nλ可知CAB的层间距为1.55 nm,与前人实验结果基本一致[10]。由于MCAB的制备过程是采用微波加热的方式,导致其d(001)特征峰强度降低且向右偏移,膨润土层间距缩小为1.26 nm[12]。此外,改性后的膨润土仍具有良好的d(001)特征峰,且晶型较为完整,因此MCAB的内部结构没有被破坏。
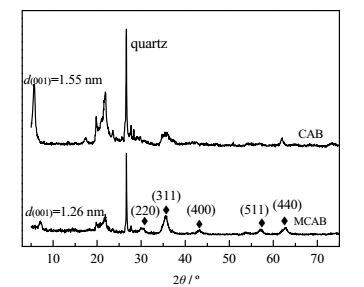
|
图 2 CAB和MCAB的XRD图谱 Fig.2 XRD patterns of CAB and MCAB |
室温条件下,利用VSM得到了图 3中Fe3O4和MCAB的磁滞回线。纯Fe3O4粒子的饱和磁化强度达到75.35 emu·g‒1,而由于MCAB中含有一些非磁性物质(CAB、壳聚糖),导致MCAB的饱和磁化强度减小为19.46 emu·g‒1。同时,可以看出Fe3O4粒子和MCAB没有磁滞现象,说明两者都具有超顺磁性[13]。此外,从图 3右下角的固液分离示意图可以看出,在外加磁场条件下,MCAB有很好的磁响应能力。
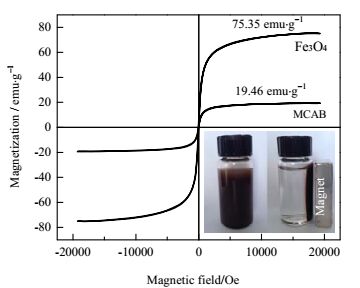
|
图 3 Fe3O4和MCAB的磁滞回线 Fig.3 Hysteresis loops of Fe3O4 and MCAB |
图 4为CAB和MCAB的FTIR图谱。CAB在1384 cm‒1出现的特征吸收峰为‒COOM所产生(M代表金属离子),说明柠檬酸改性膨润土成功[10]。MCAB在2928 cm‒1处为壳聚糖中‒CH和‒CH2的伸缩振动峰,1654 cm‒1处是壳聚糖‒NH2的弯曲振动吸收峰。577 cm‒1处是Fe‒O键伸缩振动吸收峰[11, 14],说明壳聚糖和Fe3O4均已负载到CAB上。此外,CAB和MCAB在3620、3423 cm‒1附近均出现膨润土层间水的‒OH伸缩振动特征峰,1042 cm‒1处为Si‒O‒Si的振动吸收峰,比较可知改性复合前后膨润土的基本骨架没有改变。
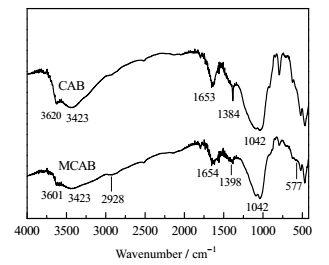
|
图 4 CAB和MCAB的FT-IR图谱 Fig.4 FT-IR spectra of CAB and MCAB |
图 5为MCAB和CAB的投加量对Cr(Ⅵ)的吸附影响曲线,可以看出MCAB和CAB对Cr(Ⅵ)的去除率虽然都随其投加量的增加而升高,并最终趋于平衡,但经壳聚糖修饰后的MCAB的去除率明显高于CAB,当MCAB的投加量为1.6 g·L‒1时吸附达到平衡,去除率高达99%,主要是由于MCAB中的功能基团‒NH2在溶液中质子化后对Cr(Ⅵ)有一定的静电吸引作用,并且随着投加量的增加功能基团数量增多,因此去除率呈上升趋势。
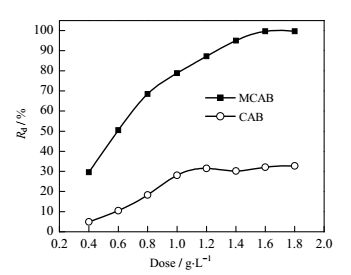
|
图 5 MCAB、CAB的投加量对Cr(Ⅵ)的吸附影响 Fig.5 Effects of MCAB and CAB dosages on Cr(Ⅵ) adsorption |
pH值是影响MCAB对溶液中Cr(Ⅵ)吸附的重要因素。图 6分析了溶液初始pH对Cr(Ⅵ)的吸附影响,pH值较低时MCAB的吸附能力较强,在pH为3时吸附量达到最大值6.24 mg·g‒1,而当pH大于3时,吸附量显著降低。由于不同pH值下Cr(Ⅵ)会以HCrO4‒、CrO42‒等阴离子形式存在,当pH ˂ 4时,主要是以HCrO4‒的形式存在(99.1%),且在低pH值下,MCAB上的‒NH2易质子化成‒NH3+,两者发生静电吸引作用,因此吸附能力得到提高[10]。但随着pH的增大,‒NH2质子化率降低,静电吸引作用减弱,Cr(Ⅵ)的存在形式也发生改变,当pH ˃ 6时,溶液中Cr(Ⅵ)主要以CrO42‒形式存在,OH‒浓度的增大会与HCrO4‒、CrO42‒产生竞争吸附[15]。同时,由于柠檬酸的一级电离常数pK1 = 3.13,当pH>3.13时,柠檬酸逐渐以HCit2‒、H2Cit‒的形式存在,也会与HCrO4‒、CrO42‒形成竞争吸附,从而导致pH值在3~4之间吸附量骤减。
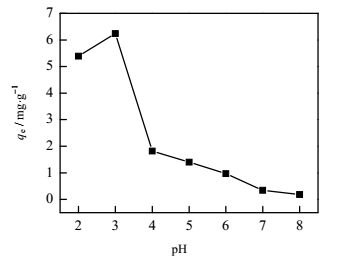
|
图 6 溶液初始pH对MCAB吸附Cr(Ⅵ)的影响 Fig.6 Effects of initial pH of Cr(Ⅵ) solution on Cr(Ⅵ) adsorption of MCAB |
吸附等温模型的拟合结果如表 1所示,Langmuir吸附等温方程的拟合度R12为0.991,高于Freundlich方程的拟合度(R22) 0.973,表明MCAB对Cr(Ⅵ)的吸附更符合Langmuir吸附模型,为单分子层吸附,拟合所得的Langmuir吸附容量为16.67 mg·g‒1。另外,由Freundlich的吸附指数1/n小于0.6可以看出吸附反应易于进行。
| 表 1 MCAB对Cr(Ⅵ)吸附等温模型的拟合参数 Table 1 Fitting results of Cr(Ⅵ) adsorption isotherms of MCAB |
吸附材料的Langmuir吸附容量是评估吸附剂优劣的重要指标,表 2是MCAB与其它吸附剂对Cr(Ⅵ)吸附能力的比较,相比于改性后的活性炭、沸石、海泡石等吸附剂,MCAB在投加量相对较小的情况下对Cr(Ⅵ)仍具有较高的吸附容量,说明MCAB在处理Cr(Ⅵ)废水方面有良好的应用潜力。
| 表 2 MCAB和其它吸附剂对Cr(Ⅵ)吸附能力的比较 Table 2 Comparison of Langmuir monolayer adsorption capacities of various adsorbents for Cr(Ⅵ) removal |
从表 3的动力学模型拟合参数可知准一级动力学模型的相关系数较低,通过该模型计算得到的平衡吸附量跟实验值相差较大。而准二级动力学模型拟合的相关系数均大于0.99,且模型计算的平衡吸附量与实验值相当接近,明显可以看出吸附过程更符合准二级动力学模型,说明MCAB对Cr(Ⅵ)的吸附主要是化学吸附[15]。
| 表 3 Cr(Ⅵ)在MCAB上的吸附动力学拟合参数 Table 3 Fitting results of Cr(Ⅵ) adsorption kinetics of MCAB |
图 7为MCAB的吸附机理示意图,经过柠檬酸和壳聚糖改性后,MCAB上含有大量‒NH2、‒OH和‒COOH等功能基团,而Cr(Ⅵ)在不同pH值下会以不同的阴离子形式(HCrO4‒、CrO42‒)出现,这种特殊性质导致Cr(Ⅵ)在MCAB上的吸附机理变得复杂,而不是简单的完全由质子化后的‒NH3+与HCrO4‒间的静电吸引作用。在pH为2~6的酸性环境中,HCrO4‒可发生图 7中(a)所示的氧化还原反应,反应中的电子可由MCAB上柠檬酸及壳聚糖分子中的含碳官能团(‒CxOH/‒COOH/‒CO)提供[21]。同时,还可能发生图 7中(b)所示的配体交换反应,式中≡M‒OH代表MCAB上存在的少量配合物,在低pH值下易质子化成≡M‒(H2O)+,然后与HCrO4‒发生配体交换反应[22]。因此,推测MCAB对Cr(Ⅵ)吸附性能增强的原因不仅是由于静电吸引作用,同时还伴随少量的氧化还原反应及配体交换反应,这三者间的协同作用。
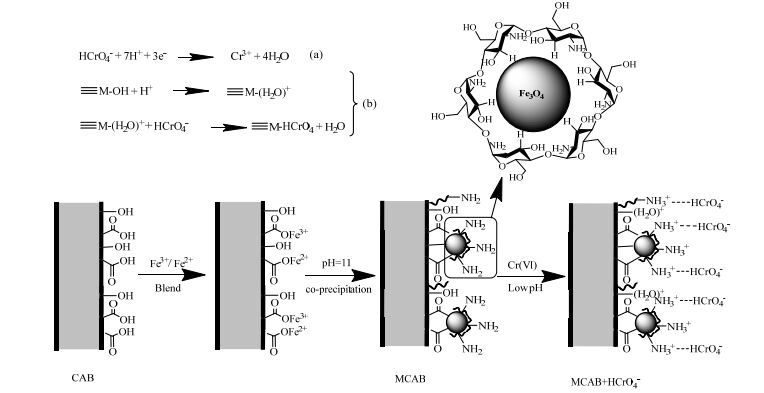
|
图 7 MCAB的吸附机理示意图 Fig.7 Schematic diagram of Cr(Ⅵ) removal mechanism of MCAB |
以柠檬酸膨润土为载体、壳聚糖分子为修饰剂,采用微波共沉淀法制备出功能基团修饰的磁性柠檬酸膨润土(MCAB),并研究其对Cr(Ⅵ)的吸附性能。
(1) SEM、XRD、VSM、FT-IR等表征结果表明磁性Fe3O4微粒及壳聚糖均已负载到柠檬酸膨润土上,具有了在外加磁场条件下能快速固液分离的能力。
(2) 相比于CAB,复合改性后的MCAB对Cr(Ⅵ)的吸附能力有明显提高。随着吸附剂用量的增加去除率明显上升并趋于平缓;pH值对Cr(Ⅵ)的去除影响较大,在低pH条件下有助于MCAB吸附Cr(Ⅵ),去除率可达99%;吸附等温方程符合Langmuir吸附模型,单分子层最大吸附量为16.67 mg·g‒1;MCAB对Cr(Ⅵ)的吸附动力学符合准二级动力学模型,吸附过程以化学吸附为主。
(3) MCAB对Cr(Ⅵ)吸附性能增强的原因可归纳为由质子化后的‒NH3+与HCrO4‒间的静电吸引作用、HCrO4‒自身的氧化还原反应以及配体交换反应,这三者之间的协同作用。
本研究MCAB的制备工艺简单,所使用的原料经济环保,且吸附效果相较于同类型其它吸附剂有明显优势。结果表明MCAB在含Cr(Ⅵ)废水处理方面有一定的应用潜力。
符号说明:
| C0 | -吸附前的浓度,mg·L-1 | n | -Freundlich吸附常数 |
| Ce | -平衡时的浓度,mg·L-1 | qe | -平衡吸附量,mg·g-1 |
| Ct | -吸附后的浓度,mg·L-1 | qmax | -最大吸附量,mg·g-1 |
| k1 | -准一级动力学常数,min‒1 | qt | -t时刻的吸附量,mg·g-1 |
| k2 | -准二级动力学常数,g·mg-1·min-1 | Rd | -去除率,% |
| Kf | -Freundlich吸附常数,mg·g-1 | t | -吸附时间,min |
| KL | -Langmuir吸附常数,L·mg-1 | V | -溶液的体积,L |
| M | -吸附剂投加量,g |
| [1] | Beaumont J J, Sedman R M, Reynolds S D, et al. Cancer mortality in a Chinese population exposed tohexavalent chromium in drinking water[J]. Epidemiology, 2008, 19(1): 12-23.DOI:10.1097/EDE.0b013e31815cea4c. |
| [2] | Shekhawat A, Kahu S, Saravanan D, et al. Synergistic behaviour of ionic liquid impregnated sulphate-crosslinked chitosan towards adsorption of Cr[J]. International Journal of Biological Macromolecules, 2015, 80(9): 615-626. |
| [3] | Alvaradoa L, Torresb I R, Chen AC. Integration of ionexchange and electrodeionization as a new approach for thecontinuous treatment of hexavalent chromium wastewater[J]. Separation and Purification Technology, 2013, 105(105): 55-62. |
| [4] | Xu H M, Wei J F, Wang X L. Nanofiltration hollow fiber membranes with high charge density prepared by simultaneous electron beam radiation-induced graft polymerization for removal of Cr[J]. Desalination, 2014, 346: 122-130.DOI:10.1016/j.desal.2014.05.017. |
| [5] | Wang G, Hua Y, Su X, et al. Cr(Ⅵ) adsorption by montmorillonite nanocomposites[J]. Applied Clay Science, 2016, 124: 111-118. |
| [6] | DAI Li-bo(代立波), ZHOU Cong-zhang(周从章), YUAN Si-guo(原思国). Cr(Ⅵ) Adsorption properties of weak alkaline ion exchange fiber(弱碱性离子交换纤维对六价铬吸附性能的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2012, 26(4): 674-678. |
| [7] | ZHANG Han-bing(张寒冰), HU Xue-ling(胡雪玲), WEI Teng-you(韦藤幼), et al. Progress of preparation and applications of alkaline Ca-bentonite(碱性钙基膨润土的制备及其应用研究进展)[J]. Chemical Industry and Engineering Progress(化工进展), 2012, 31(7): 1395-1401. |
| [8] | WU Lian(吴炼), WEI Teng-you(韦藤幼), TANG Yan-xiu(唐艳秀), et al. Process study on crude biodiesel purification by bentonite adsorption(膨润土吸附精制粗生物柴油的工艺过程研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2015, 29(4): 932-938. |
| [9] | Muliwa A M, Leswifi T Y, Onyango M S, et al. Magnetic adsorption separation (MAS) process: an alternative method of extracting Cr(Ⅵ) from aqueous solution using polypyrrole coated Fe3O4 nanocomposites[J]. Separation and Purification Technology, 2016, 158: 250-258.DOI:10.1016/j.seppur.2015.12.021. |
| [10] | ZHOU Juan(周娟), ZHANG Han-bing(张寒冰), TONG Zhang-fa(童张法), et al. Adsorption behavior of methylene blue on citric acid bentonite(亚甲基蓝在有机酸膨润土上的吸附行为)[J]. Chinese Journal of Environmental Engineering(环境工程学报), 2015, 9(3): 1057-1061. |
| [11] | Kousalya G N, Gandhi M R, Meenakshi S. Sorption of chromium(Ⅵ) using modified forms ofchitosan beads[J]. International Journal of Biological Macromolecule, 2010, 47(2): 308-315.DOI:10.1016/j.ijbiomac.2010.03.010. |
| [12] | WEI Teng-you(韦藤幼), CAO Yu-hong(曹玉红), TONG Zhang-fa(童张法). Modification of bentonite by microwave irradiation and its mechanism(微波强化膨润土的改性及其作用机理)[J]. The Chinese Journal of Process Engineering(过程工程学报), 2005, 5(4): 411-413. |
| [13] | Lian L L, Cao X L, Wu Y Q, et al. A green synthesis of magnetic bentonite material and its applicationfor removal of microcystin-LR in water[J]. Applied Surface Science, 2014, 289(8): 245-251. |
| [14] | Wang D, Li W B, Wang G H, et al. Adsorption and heterogeneous degradation of rhodamine B on thesurface of magnetic bentonite material[J]. Applied Surface Science, 2015, 349: 988-996.DOI:10.1016/j.apsusc.2015.05.004. |
| [15] | Jin X Y, Jiang M Q, Du J H, et al. Removal of Cr(Ⅵ) from aqueous solution by surfactant-modifiedkaolinite[J]. Journal of Industrial and Engineering Chemistry, 2014, 20(5): 3025-3032.DOI:10.1016/j.jiec.2013.11.038. |
| [16] | Dakiky M, Khamis M, Manassra A, et al. Selective adsorption of chromium (Ⅵ) in industrialwastewater using low-cost abundantly available adsorbents[J]. Advances in Environmental Research, 2002, 6(4): 533-540.DOI:10.1016/S1093-0191(01)00079-X. |
| [17] | Lach J, Okoniewska E, Neczaj E, et al. Removal of Cr(Ⅲ) cations and Cr(Ⅵ) anions onactivated carbons oxidized by CO2[J]. Desalination, 2007, 206(1-3): 259-269.DOI:10.1016/j.desal.2006.04.056. |
| [18] | LeyvaR R, JacoboA A, DiazFPE , et al. Adsorption of chromium(Ⅵ) from an aqueous solution on a surfactantmodified zeolite[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 330: 35-41. |
| [19] | Marjanovic V, Lazarevic S, JankovicC I, et al. Chromium(Ⅵ) removal from aqueous solutions using mercaptosilanefunctionalized sepiolites[J]. Chemical Engineering Science, 2011, 166(1): 198-206.DOI:10.1016/j.cej.2010.10.062. |
| [20] | Zhang S, Yang J, Xin X D, et al. Adsorptive removal of Cr(Ⅵ) from aqueous solution onto different kinds of modified bentonites[J]. Environmental Progress & Sustainable Energy, 2015, 34(1): 39-46. |
| [21] | Li T, Shen J F, Huang S T, et al. Hydrothermal carbonization synthesis of a novel montmorillonitesupported carbon nanosphere adsorbent for removal of Cr (Ⅵ) fromwaste water[J]. Applied Clay Science, 2014, 93-94(3): 48-55. |
| [22] | Ji M, Su X, Zhao Y X, et al. Effective adsorption of Cr(Ⅵ) on mesoporous Fe-functionalized Akadama clay: optimization, selectivity, and mechanism[J]. Applied Surface Science, 2015, 344: 128-136.DOI:10.1016/j.apsusc.2015.03.006. |




