2. 广州科技职业技术学院,广东 广州 510450
2. Guangzhou Vocational College of Science and Technology, Guangzhou 510450, China
过度暴露于紫外线辐射会导致皮肤晒伤、光老化、光致癌和免疫抑制[1~3]。然而,目前的防晒产品中的化学防晒剂也有很大的毒副作用,例如会导致接触性皮炎、过敏、光毒性[4, 5]和抑制雌激素活性[6, 7]。因此,开发基于新的更安全的运载系统的防晒产品为人类使用,以消除传统的防晒配方的缺点具有实际意义。
固体脂质纳米粒(SLN)是20世纪90年代初新开发的一种活性组分载体,主要是利用无毒、生物相容性好的固体油脂在冷却或相分离过程中固化、结晶形成的固态结构作为赋形剂将活性组分包覆在脂质结构中[8]。与SLN不同的是,“第二代脂质载体”NLC采用的是用液体脂质取代部分固态脂质作为赋形剂[9]。液体油脂的加入可以提供更多的缺陷结构,液态分子随机取代晶格中的固态分子,降低固体脂质的结晶度,提高载药量[10, 11];此外,使药物有更好的溶解度,使药物均匀地分散在纳米球中[12]。近十年,这种新型的纳米给药系统从药学领域的研究扩展到了化妆品领域,一方面活性组分嵌于纳米结构脂质载体的微孔结构中后,可改善活性成分的光稳定性[13],另一方面可实现活性成分的控制性释放,从而解决了在化妆品使用初期,活性成分在皮肤表面浓度偏高、作用时间短等问题[14~16]。最近研究表明[17],固体颗粒本身就具有对紫外线的散射作用,包覆防晒剂的配方会显示出防晒效果的协同效应,同时还可以降低防晒剂及其衍生物在皮肤的渗透,提高防晒配方的安全性,因此NLC是一种极具推广意义的包覆载体。
目前,国外已经有应用NLC技术的化妆品上市,包括Amore Pacific和La Prairie等国际高端化妆品公司。但是就NLC技术层面而言,在配方架构上仍有较大的开发空间,其产业化也处于起步阶段。Mestres等[18]研究了BP-3包覆于固体脂质微粒中,与含等量BP-3的普通溶液相比,释放和在皮肤内的渗透量都有所下降。Gabriela等[19]采用共包覆的方法,研究了以Tween20为乳化剂制备作为UVA和UVB的载体脂质纳米粒,采用防晒指数和红斑UVA指数评估了纳米粒子的防晒性能,研究取得了一些让人满意的结果,但是防晒剂的包封率不高。本研究的目的是采用高压均质法开发以纳米载体为基础的载体配方技术,解决OMC和BP-3配伍性和光化学稳定性差的问题,值得一提的是,目前没有同时包覆两种防晒剂NLC配方,利用差示扫描量热法对防晒剂和赋形剂的相互作用的研究还鲜有报道。此外,笔者对脂质纳米粒的理化性质,如颗粒的大小、形态、ζ电位、包封率等进行了详细研究,并对优化配方的紫外吸收性能和光稳定性进行了评估。
2 实验方法 2.1 实验材料BP-3,分析纯,麦克林;OMC,分析纯,阿拉丁;辛酸癸酸甘油三酯(GTCC),实验室自制,合成方法参照文献[20];鲸蜡醇棕榈酸酯(CP),分析纯,艾比克;蜂蜡,分析纯,麦克林;棕榈蜡,分析纯,麦克林;A165乳化剂,分析纯,禾大;泊洛沙姆188,巴斯夫公司;大豆卵磷脂,分析纯,巴斯夫公司;卡伯姆940,分析纯,禾大;三乙醇胺,分析纯,阿拉丁。
2.2 实验方法采用高压均质法制备包覆防晒剂的NLC:将固体脂质(CP、棕榈蜡或蜂蜡)和GTCC混合脂质升温至某一均质温度,然后将防晒剂BP-3、OMC(OMC、BP-3质量比为4:1)加入其中,作为油相,且防晒剂含量占油相10%。接着,把油相加入到同样温度的表面活性剂水溶液当中,用Ultra-Turrax T25在8000 r·min-1的转速下剪切1 min,快速混匀得到初乳,通过高压均质后室温冷却得到包覆防晒剂的NLC。
此外,普通纳米乳液的配方为正交所得的最优配方,其制备方法与上述基本一致,只是制备普通乳液的油脂全部采用液体脂质GTCC。
2.3 分析方法 2.3.1 粒径和ζ电位的测定马尔文激光粒度仪Zetasizer Nano-ZS90测量NLC的颗粒大小、分布系数(PDI)和ζ电位。测量前样品用水稀释1000倍,在25℃条件下测粒径、分布系数(PDI)和ζ电位3次,取平均值。
2.3.2 包封率的测定色谱条件:色谱柱为Waters BEH C18色谱柱(4.6 mm×250 mm,18.5 μm),流动相为甲醇:水=78:22(V:V),流率为1 mL·min-1,紫外灯检测波长为300 nm,进样20 μL。
配制一定浓度范围的标准溶液,以峰面积为纵坐标
测样:移液枪移取1000 μL样品于离心管,加入10 mL乙醇。然后震荡2 min,再用高速离心机离心10 min,转速为8000 r·min-1,使膏体和清液分层,上清液用乙醇稀释到合适浓度后通过高效液相色谱分析游离的防晒剂浓度。最后通过式(1)计算防晒剂的包封率。
| $ EE(\% ) = \frac{{{c_{{\rm{initial}}}}-{c_{{\rm{free}}}}}}{{{c_{{\rm{initial}}}}}} \times 100 $ | (1) |
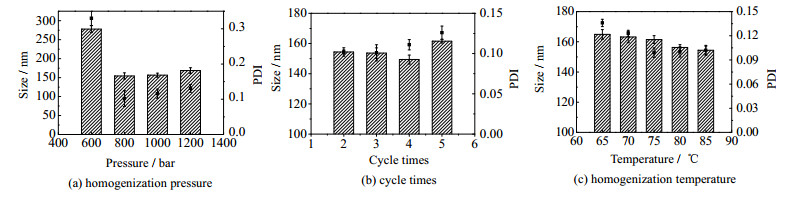
影响NLC粒径的主要因素有均质压力、循环次数和均质温度等。如图 1所示,NLC粒径在一定范围内,随压力的增大而减小,在压力为800 bar时颗粒粒径最小,而800 bar以后粒径略微增大,原因可能是在适当的压力作用下,能量的加入有利于形成小粒径的纳米粒,而压力过大时,外部剪切力的作用使NLC颗粒剧烈运动而阻碍或破坏形成粒径更小的颗粒。此外,均质压力为过低会导致PDI较大,粒径分布不均匀。因此,均质压力选择800 bar是较合适的。同理,纳米粒粒径随均质循环次数的增加也呈现先减小后增大的趋势,在循环4次时有最小值,粒径达到149.4 nm,各组样品PDI较低,均符合要求。NLC粒径随均质温度的升高而减小,但80℃到85℃变化缓慢,PDI的变化趋势与粒径相近。均质温度越高,体系黏度越小,有利于均质形成更小粒径的纳米颗粒,但是温度过高不利于活性组分的稳定,从而导致包封率下降,所以乳化温度的选择80℃。
|
图 1 均质条件对粒径、PDI的影响 Fig.1 Effects of homogenization parameters on particle size and PDI |
在配方筛选方面,前期做了大量的单因素实验(此处不详述),发现乳化剂浓度过低形成的界面膜强度过小,不能很好地乳化油相和水相,纳米粒容易发生聚集和团聚现象,导致粒径的增大,但是浓度过高会导致防晒剂的包封率下降,原因可能是乳化剂对防晒剂的增溶作用,使液体脂质溶解的防晒剂在乳化剂作用下容易在水相中形成胶束。若液态脂质过多,一部分GTCC可能会转移到水相当中,表面活性剂及液态油形成胶束、脂质体和其他聚合水溶液[21],从而使部分防晒剂可能吸附在纳米粒表层,而不存在于NLC的内核,导致骤释现象的发生。此外,脂质浓度越高,包封率也越高,但是同样的条件下,OMC的包封率高于BP-3,原因是防晒剂包封率的高低还取决于其在脂质中的溶解性。因此,按L9 (33)正交设计进行实验,考察总油相含量(A),液态脂质占总脂质百分比(B)以及乳化剂含量(C)对包封率的交互影响,以期得到较优的制备条件。正交实验设计方案和实验结果见表 1。
|
|
表 1 正交实验结果表 Table 1 Results of the orthogonal experiment |
由表 1数据可知,影响防晒剂包封率大小的排列顺序为:乳化剂含量(C) > 总油相含量(A) > 液态油脂占总油脂百分比(B),影响最大的是乳化剂含量。由此可知,制备NLC的最优工艺条件是A1B1C3,即总油相占6%,液态脂质占总脂质25%,乳化剂含量为4%。在优化条件下进行三次平行试验,其OMC包封率分别为98.3%,99.2%,98.9%,其平均值为98.8%;BP-3包封率分别为93.5%,93%,93.1%,其平均值为93.2%。从表 2可见各样品粒径在121.4~171.3 nm,仅6号样品的PDI高于0.2,说明所有样品粒径较小,而且粒径分布都较为均匀。正交实验样品的ζ电位在(-23.60 ± 1.04) mV到(-31.60 ± 1.93) mV之间。一般来说,ζ电位可以预测胶体粒子的物理稳定性。具有高ζ电位的体系,由于粒子间存在较高的静电斥力而不容易发生聚集,电位绝对值越高,体系稳定性越好,一般要求在30 mV以上。但是对于含有空间稳定型非离子型表面活性剂的粒子,表面活性剂在粒子剪切面的转移会降低表面电势,其通过范德华力的相互作用在纳米粒表面周围形成单分子层来维持NLC的稳定性,因此即使ζ电位低于|20| mV也可以在长时间提供足够的稳定性[22]。按最优处方制备得到的NLC粒径为(138.7 ± 0.5) nm,PDI为0.142 ± 0.02,电位为(-28.30 ± 0.98) mV。
|
|
表 2 正交实验各样品的理化性质 Table 2 Physical and chemical properties of the samples for orthogonal tests |
取少量稀释1000倍后的NLC乳液于铜网上,采用磷钨酸溶液(质量分数为2%)对其进行染色处理,待铜网晾干后,采用透射电镜(JEM 2100F)观察NLC纳米颗粒的微观形貌。
由图 2可知,脂质纳米粒的外观呈类球形,表面光滑,粒径大多在130~145 nm,粒径分布窄,与DLS测得的粒径基本一致,属于单分散的乳液。值得注意的是,大多数观察得到是球形的粒子,说明脂质的结晶形态基本为亚稳态的α 晶型,更为有序的针状晶体β 晶型含量极少,这正是所希望得到的结果,因为α晶型在形成更为稳定的β晶型的过程中可能会导致药物的泄露[23, 24]。单一的脂质的结晶形态在后面的DSC分析中得到证实。

|
图 2 稀释1000倍的NLC悬浮液的TEM图 Fig.2 Transmission electron micrographs of NLC dispersion diluted by 1000 times |
将待测样品与溴化钾混合均匀,压片,利用Bruker(Tensor27)红外光谱仪在450~4000 cm-1对样品进行扫描,空气为扫描背景。
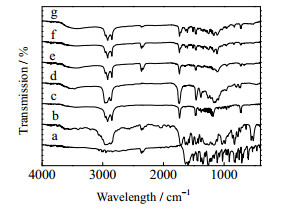
红外光谱研究了固体脂质纳米粒和各个组分之间可能存在的相互作用。实际上,固体脂质CP主要由一个酯基和长的碳氢链组成。如图 3所示,1735 cm-1是酯基C=O的伸缩振动吸收峰,酯基中C-O的对称伸缩振动吸收峰在1200 cm-1处附近。2919和2848 cm-1是亚甲基的C-H键不对称伸缩振动和对称伸缩振动吸收峰,1464和725 cm-1分别是是其弯曲振动和骨架振动吸收峰。同理,液体脂质也存在酯基和碳氢链的红外特征峰,但是由于液体脂质GTCC是甘油单酯、二酯和三酯的混合物,因此在3500 cm-1附近还会出现羟基的吸收峰。OMC不仅有酯基,还有苯环、芳基醚和双键。因此,在图中1250 cm-1处有明显的醚基的伸缩振动吸收峰,与苯环共轭的C=C吸收峰在1634 cm-1处。BP-3的芳基酮基在1640 cm-1出也有明显的红外吸收。通过谱图的比较可以发现,BP-3-OMC-NLC的谱图与未负载的NLC并无明显差异,不存在BP-3和OMC的几个明显的特征峰,而且其谱图与固体脂质的谱图基本一致,这说明紫外线吸收剂被包覆于在固体脂质中。因为没有新的特征峰出现,证实了药物与赋形剂之间并没有明显的作用关系。与预期结果一致,不加入液体脂质制备的脂质纳米粒SLN与NLC相比,谱图也没有显著的差异,液体脂质的羟基峰没有体现出来,这说明液体脂质也是在固体脂质内部分散均匀,而且可以为固体脂质提供更多的缺陷结构,从而容纳更多的防晒剂,大大提高防晒剂的包封率。
|
图 3 红外光谱图 Fig.3 Fourier transformed spectra for (a) BP-3, (b) OMC, (c)CP, (d) GTCC, (e) unloaded-NLC, (f) BP-3-OMC-NLC, (g) BP-3-OMC-SLN |
将样品进行压片,采用PANalytical(PW3040/60)X射线粉末衍射仪对其晶体结构进行分析,电流30 mA,电压40 kV,连续扫描范围5~80°,扫描步长0.26°。
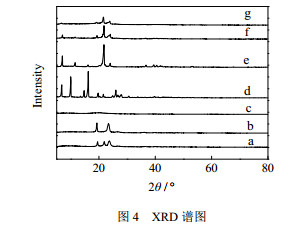
X射线衍射是探究脂质在结晶过程中结晶行为的一种常用方法,可以推测NLC的内部晶体结构和结晶状态。如图 4可知,固体紫外线吸收剂BP-3在2θ角为6.8、9.9、14.7、16.1、19.8、21.5以及26.0°处有尖锐的峰,可以表征其自然的结晶状态。然而,在NLC配方冻干样品的谱图中在这些位置则无信号峰的出现,这表明BP-3在NLC中以非晶态或者无定形状态的形式存在,是以分子的形式分散在赋形剂的基质当中或者包覆在脂质内核当中。更重要的是,NLC与固体脂质CP在峰位置上基本一致,但是相比于后者,其特征峰的强度大大降低,这很有可能是因为包覆的紫外吸收剂以及液态油的存在,固体脂质结晶度降低导致的结果。
|
图 4 XRD谱图 Fig.4 X-ray diffraction patterns of (a) A165 emulsifier, (b) poloxamer188, (c) soybean lecithin, (d)BP-3, (e) CP, (f) physical mixtures and (g) BP-3-OMC-NLC |
准确称取2~10 mg固体样品于铝制密封坩埚内,采用空的坩埚作为对照品。使用PerkinElmer(DSC8000)差示扫描量热仪,在0~100℃以10 K·min-1的速率进行扫描测量,氮气流率为50 mL·min-1。
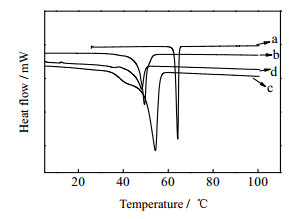
脂质的结晶行为对研究NLC载体的性能起着非常重要的作用,是表征脂质纳米粒的重要手段。文献研究表明[12, 25],NLC的物理稳定性与脂质的晶型及转变速率有关。由图 5可知,NLC样品的相变温度低于固体物质物理混合物,当固体脂质被融化均质冷却制备成NLC的纳米粒子后其熔化焓也大大降低,这是由于无序性的晶体熔化时无需克服完美晶体中的晶格力作用导致的结果。此外,在BP-3-OMC-NLC的曲线图中不存在固体防晒剂BP-3对应的特征峰,这显然证实了在NLC体系中BP-3没有结晶,而是以无定形状态存在,其分子在固体基质中均匀分散。NLC中也不存在乳化剂的两个特征峰。这可能是由于乳化剂吸附于固体脂质纳米粒表面,从而导致结晶度降低使其吸热峰丢失,表明单分子膜的形成使表面活性剂的天然构象发生了变化[26]。
|
图 5 各组分的DSC升温谱图 Fig.5 Thermal behaviour of (a) BP-3, (b) CP, (c) physical mixtures, (d) BP-3-OMC-NLC |
|
|
表 3 不同脂质及其对应的NLC样品的熔化温度和熔化焓数据 Table 3 Fusion enthalpy, melting points and onset of melting endotherm of bulk solid lipids and corresponding lipid nanoparticles |
不同的固体脂质有不同的熔化温度和熔化焓,图 6展示了纯药物、不同脂质以及其对应的NLC冻干样品的DSC谱图。药物BP-3在64.2℃有一个尖锐的吸热峰,熔化焓为99.7 J·g-1。固体脂质CP、蜂蜡、棕榈蜡分别在54.2、57.9、78.2℃处有明显特征峰,其中CP的吸热峰较为尖锐,而棕榈蜡和蜂蜡的吸热峰较宽,这可能是由于棕榈蜡和蜂蜡成分复杂,容易导致多种熔点相近物质吸热峰叠加从而使峰型变宽。与前面得出的结果一致,棕榈蜡和蜂蜡制备的NLC,也不存在BP-3的熔化峰。与纯的固体脂质相比,NLC对应的熔点都降低了5~12℃,熔化焓也有不同程度地降低,而且各固体脂质熔化峰的峰型均有不同程度地变宽。这是由于乳化剂的存在,降低了固体脂质颗粒与表面活性剂水溶液的界面张力和表面自由能,粒子粒径变小形成Kelvin效应导致的结果[27]。另一方面,添加的液态油脂和被包覆的药物分散在基质中会给固体脂质的晶格提供更多的缺陷结构,使晶格的有序性降低,从而导致固体脂质的结晶度下降和熔点的降低。有序性降低的晶格结构能提供更多的空间给无定形状态或者以非晶簇形态的药物,从而使药物的包封率显著提高。
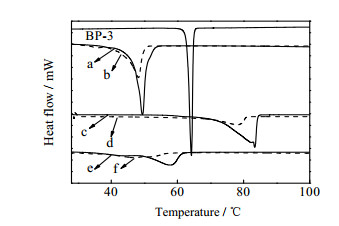
|
图 6 不同脂质及其对应的NLC冻干样品的升温谱图 Fig.6 Differential scanning calorimetry curves: (a) CP, (b) NLC-CP, (c) carnauba wax, (d) NLC-carnauba wax, (e) bees wax, (f) NLC-bees wax |
当低熔点脂质加到配方当中制备NLC,除了会改变熔点和熔化焓,其结晶行为也会发生显著变化。从图 7(b)中可以看出,制备成NLC后,样品的起始结晶温度由49.7℃下降到43.7℃,结晶焓也大幅降低,由原来的274.2降低到167.6 J·g-1。在降温过程中,没有任何吸热事件,此过冷现象可以推断为产生了共晶熔化。过冷度是指实际样品的开始结晶温度与纯固体脂质的结晶温度的差值,产生这种过冷现象的原因可能是的纳米脂质粒胶体尺寸大小,导致结晶迟缓以及过冷现象的发生。
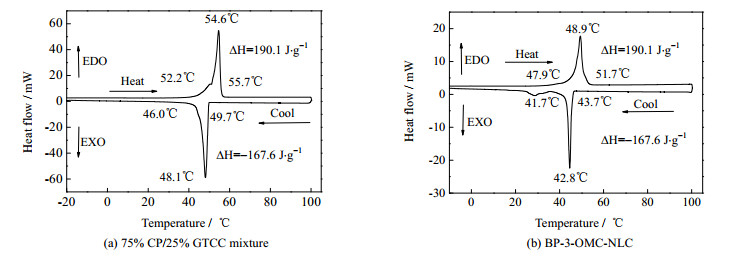
|
图 7 含25%GTCC的二元脂质混合物与NLC最优正交配方的DSC图 Fig.7 DSC endotherms (up) and exotherms (down) of (a) 75% CP/25% GTCC mixture and (b) BP-3-OMC-NLC during a heat-cool cycle |
将原NLC悬浮液稀释2500倍后采用Hitachi(U-2910)紫外可见分光光度计测定样品的紫外吸收,测试其紫外吸收性能[8]。
如图 8所示,未负载防晒剂的NLC在波长260~400 nm有一定的吸光度,并且吸光度随着波长的增加而减小。这是因为NLC是纳米颗粒对在粒径范围的紫外线有散射的作用,类似于物理防晒剂的作用。而包覆率两种防晒剂防晒剂的NLC在波长260~360 nm有较好的吸光度,而且出现两个极值点。这是由于两种防晒剂都会存在一个最大吸收峰。此外,可发现在相同的波长下,包覆防晒剂NLC比普通乳液的吸光度性能高,包覆紫外线吸收剂的固体脂质颗粒的防晒效果大于单一化学防晒剂和固体脂质颗粒的加和,说明NLC对防晒起到了协同增效的效果。

|
图 8 包覆及未包覆防晒剂的NLC与普通乳液的紫外吸收对比
Fig.8 UV adsorption of unloaded-NLC, BP-3-OMC-NLC, and conventional nanoemulsion
—▲— BP-3-OMC-NLC —□— conventional nanoemulsion —◆— unloaded -NLC |
由于NLC黏度太低,不适宜直接使用。为了有优良的铺展性和肤感,加少量的增稠剂卡伯姆制备成凝胶配方以增加产品在皮肤上的滞留性和生物相容性。将凝胶样品均匀涂在3M胶带上(2 mg·cm-2),然后把胶带贴在石英板上,放暗处自然干燥15 min后,用紫外分光光度计测量经紫外灯照射0、0.5、1、2、5 h后的样品在整个紫外光谱(290 ~400 nm)的紫外吸收,比较样品的光稳定性,结果如图 9所示。
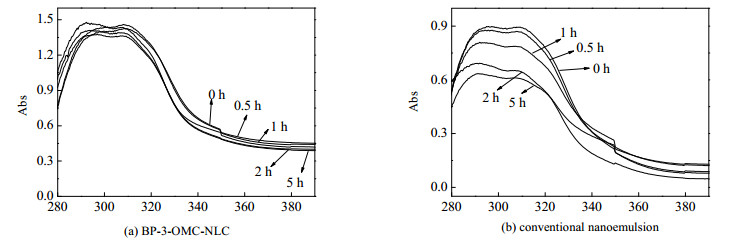
|
图 9 BP-3-OMC-NLC和普通乳状液的光稳定性研究 Fig.9 Effects of irradiation on UV absorbance of (a) BP-3-OMC-NLC and (b) conventional nanoemulsion |
样品在290~320 nm波长范围内都有很强的紫外吸收,比较各个样品照射前的吸收带,BP-3-OMC-NLC凝胶的最大吸收是最高的,其吸光度是显著高于普通乳液,表明包覆紫外吸收剂的固体脂质运载系统的防晒性能要明显优于普通乳液。这是因为BP-3-OMC-NLC悬浮液中存在大量的固体颗粒,这些颗粒通过散射的作用,与防晒剂的化学吸收相结合达到协同增效的效果,显著提高了其防晒性能。从分子结构上看,因为OMC具有与酯基C=O共轭的双键,暴露在阳光下会不稳定,容易发生异构化转化为酮-烯醇式结构,而且化学防晒剂可能渗透进入皮肤角质层,而产生氧自由基,对人体造成危害[28]。为了探究其光照稳定性,对比各个样品照射不同时间后的紫外吸收,可看出照射5 h后的BP-3-OMC-NLC的吸光度仍没有显著的降低,比普通乳液显示出较高的稳定性,这可能是由于在脂质纳米粒的制备过程中,固体脂质会集中在颗粒的外层,避免紫外吸收剂与太阳光的相互作用,从而提高其光照稳定性,通过包覆可以防止其降解和在皮肤上的积累,减少副作用。
3.4.3 储存稳定性将最优条件下制备的NLC放在4、25、40℃的环境中储存3个月,定期测量NLC粒径和包封率的变化。
由表 4可知,在4、25℃环境下储存,NLC颗粒粒径和防晒剂的包封率并没有明显的变化。在40℃条件下经过3个月的储存,粒径由138.7增大到343.8 nm,包封率也大大降低。原因可能是在较高温度下,加剧了纳米粒的布朗运动,经过碰撞的作用纳米粒容易发生聚集,从而使粒径增大。此外,温度的升高有利于防晒剂在纳米粒的扩散,另一方面也有可能加快了固体脂质的晶型转变,形成更稳定有序的晶型,从而导致了防晒剂的泄露,这种现象在40℃时尤为明显。所以在4℃和25℃存放时,比在40℃存放时要更稳定,包封率的变化也明显减弱。因此在室温下可以保证NLC的储存稳定性。
|
|
表 4 BP-3-OMC-NLC储存稳定性测试结果 Table 4 Storage stability of BP-3-OMC-NLC |
(1) 确定均质条件为均质压力800 bar,循环次数4次,乳化温度80℃。在此均质条件下,利用正交实验优化了NLC配方参数,确定了最优配方为防晒剂(OMC:BP-3=4:1)占总油相10%,总油相占配方6%,液体脂质占总脂质25%,乳化剂(A165:泊洛沙姆188:大豆卵磷脂=3:3:1)占配方4%,制备得到的NLC中BP-3和OMC包封率的分别为93.2%、98.8%,粒径为(138.7 ± 0.5) nm,PDI为0.142 ± 0.02,电位为(-28.30 ± 0.98) mV。
(2) 脂质纳米粒的外观呈类球形,表面光滑,粒子大多在130~145 nm,与DLS测得的粒径基本一致。
(3) 通过FTIR、XRD、DSC等表征手段,证实BP-3在NLC中以非结晶状态或者无定形状态的形式存在,分散在赋形剂的基质当中或者包覆在脂质内核当中。因为包覆的紫外吸收剂以及液态油脂的存在,导致固体脂质熔点、熔化焓、结晶度降低以及过冷现象的发生。
(4) 包覆防晒剂的NLC比普通乳状液的紫外吸收能力好,且被包覆的防晒剂光异构化程度降低,光稳定性更好。这项研究为紫外吸收剂提供了一个合适的胶体脂质载运系统,该载体成为一个成功的光保护纳米制剂。
| [1] | Chen L, Hu J Y, Wang S Q. The role of antioxidants in photoprotection:a critical review[J]. Journal of the American Academy of Dermatology , 2012, 67(5): 1013-1024. DOI:10.1016/j.jaad.2012.02.009. |
| [2] | González S, Fernández-Lorente M, Gilaberte-Calzada Y. The latest on skin photoprotection[J]. Clinics in Dermatology , 2008, 26(6): 614-626. DOI:10.1016/j.clindermatol.2007.09.010. |
| [3] | Teeranachaideekul V, Müller R H, Junyaprasert V B. Encapsulation of ascorbyl palmitate in nanostructured lipid carriers (NLC)-effects of formulation parameters on physicochemical stability[J]. International Journal of Pharmaceutics , 2007, 340(1): 198-206. |
| [4] | Ou-Yang H, Stanfield J, Cole C, et al. High-SPF sunscreens (SPF ≥ 70) may provide ultraviolet protection above minimal recommended levels by adequately compensating for lower sunscreen user application amounts[J]. Journal of the American Academy of Dermatology , 2012, 67(6): 1220-1227. DOI:10.1016/j.jaad.2012.02.029. |
| [5] | Vilela F M P, Fonseca Y M, Jabor J R, et al. Effect of ultraviolet filters on skin superoxide dismutase activity in hairless mice after a single dose of ultraviolet radiation[J]. European Journal of Pharmaceutics and Biopharmaceutics , 2012, 80(2): 387-392. DOI:10.1016/j.ejpb.2011.10.005. |
| [6] | Díaz-Cruz M S, Llorca M, Barceló D. Organic UV filters and their photodegradates, metabolites and disinfection by-products in the aquatic environment[J]. Trends in Analytical Chemistry , 2008, 27(10): 873-887. DOI:10.1016/j.trac.2008.08.012. |
| [7] | Giokas D L, Salvador A, Chisvert A. UV filters:from sunscreens to human body and the environment[J]. Trends in Analytical Chemistry , 2007, 26(5): 360-374. DOI:10.1016/j.trac.2007.02.012. |
| [8] | TIAN Yong-hong(田永红), ZHANG Wan-ping(张婉萍). Preparation and properties of sunscreening agent made of solid lipid nanoparticles loaded with butyl methoxybenzophenone(包覆丁基甲氧基二苯甲酮固体脂质防晒粒的制备及性能研究)[J]. China Surfactant Detergent & Cosmetics(日用化学工业) , 2013, 43(1): 55-58. |
| [9] | Kovačević A B, Müller R H, Savić S D, et al. Solid lipid nanoparticles (SLN) stabilized with polyhydroxy surfactants:preparation, characterization and physical stability investigation[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects , 2014, 444: 15-25. |
| [10] | Das S, Ng W K, Tan R B H. Are nanostructured lipid carriers (NLCs) better than solid lipid nanoparticles (SLNs):development, characterizations and comparative evaluations of clotrimazole-loaded SLNs and NLCs?[J]. European Journal of Pharmaceutical Sciences , 2012, 47(1): 139-151. DOI:10.1016/j.ejps.2012.05.010. |
| [11] | Chen C C, Tsai T H, Huang Z R, et al. Effects of lipophilic emulsifiers on the oral administration of lovastatin from nanostructured lipid carriers:physicochemical characterization and pharmacokinetics[J]. European Journal of Pharmaceutics and Biopharmaceutics , 2010, 74(3): 474-482. DOI:10.1016/j.ejpb.2009.12.008. |
| [12] | Sütő B, Weber S, Zimmer A, et al. Optimization and design of an ibuprofen-loaded nanostructured lipid carrier with a 23 full factorial design[J]. Chemical Engineering Research and Design , 2015, 104: 488-496. DOI:10.1016/j.cherd.2015.09.010. |
| [13] | LIANG Rong(梁蓉), WU Li-na(吴丽娜), YANG Cheng(杨成), et al. Application of co-enzyme Q10-loaded nanostructured lipid carriers in cosmetics(运载辅酶Q10的纳米结构脂质载体在化妆品中的应用)[J]. China Surfactant Detergent & Cosmetics(日用化学工业) , 2016, 46(9): 524-529. |
| [14] | LI Xin-wei(李欣玮), SUN Li-xin(孙立新), LIN Xiao-hong(林晓宏), et al. Solid lipid nanoparticles as drug delivery system(固体脂质纳米粒作为药物载体)[J]. Progress in Chemistry(化学进展) , 2007, 19(1): 87-92. |
| [15] | Puglia C, Bonina F. Lipid nanoparticles as novel delivery systems for cosmetics and dermal pharmaceuticals[J]. Expert Opinion on Drug Delivery , 2012, 9(4): 429-441. DOI:10.1517/17425247.2012.666967. |
| [16] | LIU Xiao-hui (刘晓慧). Preparation and characterization of the nano solid lipid particles loaded UVA/UVB sunscreen (包覆UVA/UAB防晒剂的纳米固体脂质载体的制备和性能表征) [D]. Shanghai (上海): Shanghai Institute of Technology (上海应用技术学院), 2015. http://cdmd.cnki.com.cn/Article/CDMD-10259-1015725963.htm |
| [17] | Nikolić S, Keck C M, Anselmi C, et al. Skin photoprotection improvement:synergistic interaction between lipid nanoparticles and organic UV filters[J]. International Journal of Pharmaceutics , 2011, 414(1): 276-284. |
| [18] | Mestres J P, Duracher L, Baux C, et al. Benzophenone-3 entrapped in solid lipid microspheres:formulation and in vitro skin evaluation[J]. International Journal of Pharmaceutics , 2010, 400(1): 1-7. |
| [19] | Niculae G, Badea N, Meghea A, et al. Coencapsulation of butyl-methoxydibenzoylmethane and octocrylene into lipid nanocarriers:UV performance, photostability and in vitro release[J]. Photochemistry and Photobiology , 2013, 89(5): 1085-1094. DOI:10.1111/php.2013.89.issue-5. |
| [20] | Montenegro L, Sarpietro M G, Ottimo S, et al. Differential scanning calorimetry studies on sunscreen loaded solid lipid nanoparticles prepared by the phase inversion temperature method[J]. International Journal of Pharmaceutics , 2011, 415(1): 301-306. |
| [21] | Chen Y, Yang X, Zhao L, et al. Preparation and characterization of a nanostructured lipid carrier for a poorly soluble drug[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects , 2014, 455: 36-43. |
| [22] | Soheyla H, Foruhe Z. Effect of zeta potential on the properties of nano-drug delivery systems-a review (Part 2)[J]. Tropical Journal of Pharmaceutical Research , 2013, 12(2): 265-273. |
| [23] | Li H L, Zhao X B, Ma Y K, et al. Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[J]. Journal of Controlled Release , 2009, 133(3): 238-244. DOI:10.1016/j.jconrel.2008.10.002. |
| [24] | Weiss J, Decker E A, McClements D J, et al. Solid lipid nanoparticles as delivery systems for bioactive food components[J]. Food Biophysics , 2008, 3(2): 146-154. DOI:10.1007/s11483-008-9065-8. |
| [25] | Islan G A, Tornello P C, Abraham G A, et al. Smart lipid nanoparticles containing levofloxacin and DNase for lung delivery. Design and characterization[J]. Colloids and Surfaces B:Biointerfaces , 2016, 143: 168-176. DOI:10.1016/j.colsurfb.2016.03.040. |
| [26] | Kumar S, Randhawa J K. Solid lipid nanoparticles of stearic acid for the drug delivery of paliperidone[J]. RSC Advances , 2015, 5(84): 68743-68750. DOI:10.1039/C5RA10642G. |
| [27] | Ali H, El-Sayed K, Sylvester P W, et al. Molecular interaction and localization of tocotrienol-rich fraction (TRF) within the matrices of lipid nanoparticles:evidence studies by Differential Scanning Calorimetry (DSC) and proton nuclear magnetic resonance spectroscopy (1H NMR)[J]. Colloids and Surfaces B:Biointerfaces , 2010, 77(2): 286-297. DOI:10.1016/j.colsurfb.2010.02.003. |
| [28] | Lacatusu I, Badea N, Murariu A, et al. The encapsulation effect of UV molecular absorbers into biocompatible lipid nanoparticles[J]. Nanoscale Research Letters , 2011, 6(1): 73. DOI:10.1186/1556-276X-6-73. |




