土霉素(oxytetracycline,OTC)是在禽、畜养殖业中最常用的四环素类抗生素[1],可通过抑制蛋白质合成对立克次氏体、支原体、衣原体等多种病原菌产生抑制作用[2-3]。许多抗生素在动物肠道内吸收较差,通常会有30%~90%的母体化合物随动物粪便进入到自然环境的水体和土壤中[4]。LI等[5]通过研究发现渭河流域的四环素类抗生素残留量处于中等水平,其中土霉素的残留量最高(1.56~87.89 ng·L-1)。JIANG等[6]研究了河北省海河流域中16种抗生素的含量,发现水体中土霉素含量高达3.6×105 ng·L-1。目前食品中检出的抗生素含量常常远超食品药品监督管理局规定的标准[7],而长期食用抗生素含量超标的食物会严重危害人体健康。
漆酶(Laccase,EC 1.10.3.2)是一类多酚氧化酶[8],由于其作用底物广泛,可用于多种有机污染物(包括农药、抗生素等)的降解[9-10],在环境治理方面具有重要的应用价值。由于漆酶不能直接氧化具有相对较高氧化还原电势(> 1.3 V)的非酚类底物[11],通常需要有小分子介体物质参与反应,如人工合成介体2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)、1-羟基苯丙三唑(HBT)、N-羟基-N-乙酰基苯胺(NHA)等[12],但人工介体价格较高且有可能对环境造成二次污染,在实际应用中具有局限性[13]。已发现木质素降解过程中产生的小分子酚类衍生物如丁香醛、香草醛、香草酮、乙酰丁香酮等可以提高漆酶的催化活性[14],采用此类天然介体替代人工合成介体,不仅可以大幅度降低成本、而且使用更加安全,在漆酶的规模化应用方面具有重要意义。
本文以土霉素为漆酶的作用底物,研究多种介体对漆酶催化反应的影响,并通过不同介体间的适当组合,构建漆酶-天然介体系统以实现对土霉素的高效降解。
2 材料与方法 2.1 试剂盐酸土霉素(CAS 2058-46-0,≥98%)购自上海吉至生化科技有限公司;香草醛(Van)、丁香醛(Syr)、阿魏酸(FA)、对香豆酸(PCA)、香草酮(Vanillone)、1-羟基苯并三唑(HBT)、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)购自生工生物工程(上海)股份有限公司;其他试剂均为分析纯以上。
2.2 粗酶液的制备以水稻秸秆为基质,接入彩绒革盖菌(Trametes versicolor)固态发酵培养10 d[15],取酶曲后以1:5的固液比加入pH 4.8的柠檬酸缓冲液浸泡过夜,过滤离心后取上清液即为粗酶液。
2.3 漆酶对土霉素的降解实验在漆酶降解土霉素反应体系中,5 mL反应体系内含20 mg·L-1的土霉素,0~0.5 mmol·L-1的介体(丁香醛、香草醛、阿魏酸、对香豆酸、香草酮、ABTS、HBT),200 mmol·L-1 pH 2.5~7.0的柠檬酸缓冲液以及0~0.2 IU·mL-1的粗制漆酶液,于25~70 ℃水浴摇床中120 r·min-1条件下反应0~5 h。
2.4 分析测定方法 2.4.1 漆酶活力的测定采用ABTS法,以2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)为底物,取适当稀释的酶液50 μL,加入950 μL pH 4.0的柠檬酸缓冲液,30 ℃下加入2 mmol·L-1ABTS溶液1 mL混匀,于420 nm处测定2 min内吸光值变化,每分钟消耗1 µmol ABTS所需的酶量定义为一个漆酶活力单位(IU·mL-1)[15]。
2.4.2 高效液相色谱法检测土霉素取反应结束的样品1 mL过0.45 μm水膜,利用高效液相色谱仪(Agilent 1200, USA)进行检测,流动相为0.01 mol·L-1草酸水溶液:乙腈:甲醇= 7:2:1,Eclipse XDB-C18(150 mm×4.6 mm×5 μm)色谱柱,流速0.8 mL·min-1,柱温30 ℃,检测波长355 nm,进样体积20 μL,外标法定量。土霉素降解率计算如下:
| $ 降解率=(C_0-C_1)/C_0×100 \% $ |
式中:C0为反应前土霉素的浓度,C1为降解反应后土霉素的浓度。
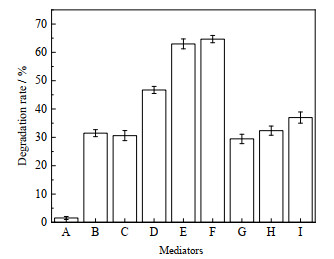
3 结果与讨论 3.1 不同介体对漆酶降解土霉素的影响以土霉素为作用底物,介体添加量为0.3 mmol·L-1,研究多种介体(ABTS、HBT、丁香醛、香草醛、阿魏酸、对香豆酸、香草酮)对漆酶降解土霉素的影响,从图 1可以看出:天然介体丁香醛和香草醛对漆酶降解土霉素具有明显的促进作用,其效果比常用的人工合成介体ABTS、HBT更好。丁香醛和香草醛都是木质素降解过程中产生的中间产物,利用此类天然介体在降解土霉素过程中替代人工合成介体,不仅可大大降低成本,而且对环境更加友好,具有良好的实际应用价值。
|
图 1 不同介体对漆酶降解土霉素的影响 Fig.1 Effects of different mediators on oxytetracycline degradation by laccase A. control B. without mediator C. HBT D. ABTS E. syringaldehyde F. vanillina G. ferulic acid H. p-coumaric acid I. vanillone |
选取ABTS、丁香醛和香草醛3种介体,考察介体浓度(0.1~0.5 mmol·L-1)对漆酶降解土霉素的影响,结果如表 1所示,ABTS的适宜浓度为0.4 mmol·L-1,而对于丁香醛和香草醛,在浓度0.1~0.3 mmol·L-1,土霉素降解率随着介体用量的增加而提高,在0.3 mmol·L-1时达到最大,分别为62.98%和64.68%,是漆酶-ABTS系统的1.35和1.38倍。
|
|
表 1 介体浓度对土霉素降解率的影响 Table 1 Effects of mediator concentrations on oxytetracycline degradation |
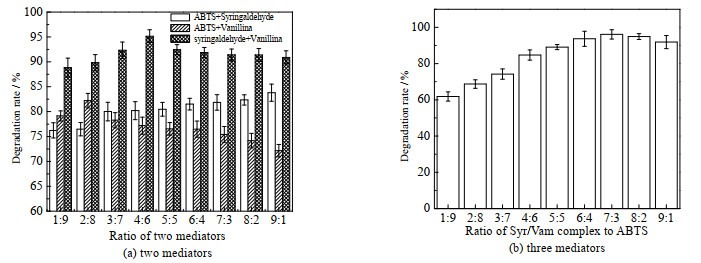
以介体ABTS、丁香醛、香草醛为基础,控制反应体系内介体总添加量为0.3 mmol·L-1,通过介体复配考察漆酶对土霉素的降解效果。如图 2(a)所示,在反应体系内添加复合天然介体丁香醛/香草醛(4:6)(记为Syr/Van)时,土霉素降解率可达95.14%,与漆酶-丁香醛和漆酶-香草醛介体系统比较时,漆酶-Syr/Van系统对土霉素的降解效果分别提高了51.06%和47.09%,表明介体复配可有效提高漆酶对土霉素的降解,其中漆酶-Syr/Van双天然介体系统的效果最好。
|
图 2 漆酶-复合介体系统对土霉素的降解作用 Fig.2 Oxytetracycline degradation catalyzed by the laccase-complex mediator system |
图 2(b)显示了漆酶-Syr/Van-ABTS系统对土霉素的降解效果,在Syr/Van复合物与ABTS的比值为7:3时,土霉素降解率最高可达96.12 %。虽然加入ABTS后的3介体系统可以提高漆酶对土霉素的降解率,但ABTS属于人工合成介体,在实际推广应用中成本较高且可能对环境造成2次污染。相比之下,采用漆酶-Syr/Van双介体系统在实际应用中更为经济可行。
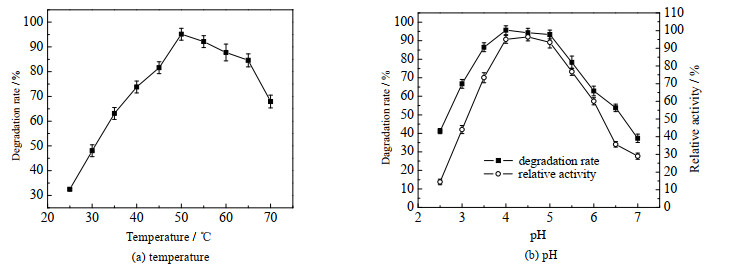
3.4 漆酶-Syr/Van系统降解土霉素条件优化 3.4.1 最适温度和pH在反应体系内Syr/Van复合物(4:6)添加量0.3 mmol·L-1,漆酶用量0.1 IU·mL-1,25~70 ℃,120 r·min-1,pH 2.5~7.0,反应4 h,考察漆酶-Syr/Van系统降解土霉素的最适温度和pH,结果如图 3所示。在25~50 ℃,土霉素降解率随着温度升高而增加,在50 ℃时降解率达到最高(图 3(a)),由于彩绒革盖菌所产漆酶具有较好的耐热性[16],漆酶-Syr/Van系统可在宽泛的温度范围内实现对土霉素的有效降解。
|
图 3 温度和pH对漆酶-Syr/Van系统降解土霉素的影响 Fig.3 Effects of temperature and pH on oxytetracycline degradation catalyzed by the laccase-Syr/Van system |
漆酶-Syr/Van系统对pH适应范围较广,在pH 3.0~6.0,土霉素降解率及反应结束后的剩余漆酶活力均可保持在60%以上。在pH 4.0~5.0,漆酶对土霉素的降解率可达到90%以上,其中在pH 4.0时,土霉素降解率最高(图 3(b))。
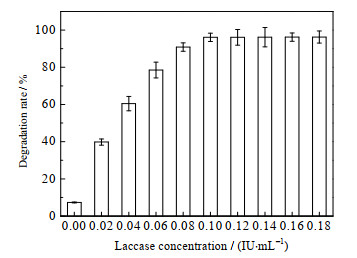
3.4.2 漆酶用量在反应体系内Syr/Van复合物(4:6)添加量0.3 mmol·L-1,漆酶用量0~0.2 IU·mL-1,50 ℃,120 r·min-1,pH 4.0,反应4 h,考察不同漆酶用量对土霉素降解的影响,结果如图 4所示:在0~0.1 IU·mL-1漆酶用量,土霉素的降解率随着漆酶用量的增加而提高;在漆酶用量达到0.1 IU·mL-1之后,继续增加漆酶用量不能进一步提高土霉素的降解率。
|
图 4 漆酶用量对漆酶-Syr/Van系统降解土霉素的影响 Fig.4 Effects of laccase dosage on oxytetracycline degradation catalyzed by the laccase-Syr/Van system |
在反应体系内Syr/Van复合物(4:6)添加量0.3 mmol·L-1,漆酶用量0.1 IU·mL-1,50 ℃,120 r·min-1,pH 4.0条件下,反应0~5 h。定时取样测定土霉素降解率,结果如图 5所示:漆酶-Syr/Van系统对土霉素的降解率1 h内可达53%,反应4 h后土霉素的降解率高达95.14%,与漆酶-ABTS介体系统相比较,优势十分明显。
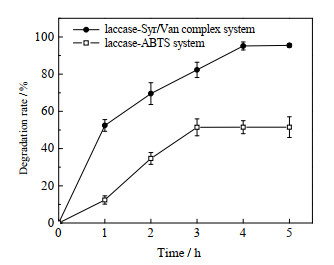
|
图 5 漆酶-Syr/Van系统降解土霉素的时间进程 Fig.5 Profiles of oxytetracycline degradation processes catalyzed by the laccase-Syr/Van system |
土霉素在土壤和水体中的检出率很高,其具有并四苯结构,在自然环境中不易分解、残留期较长[17]。WANG等[18]利用微生物燃料电池研究土霉素在其中的降解和毒性变化,结果发现7天内土霉素降解率可达78%,斑马鱼毒理实验证明土霉素经降解后毒性明显降低。本文采用漆酶-Syr/Van系统,成功实现了对土霉素的高效降解,有望在环境污染治理领域发挥出重要作用。
4 结论利用漆酶介体系统可实现对土霉素的有效降解,发现木质素降解中间产物丁香醛(Syr)、香草醛(Van)在土霉素降解中可以作为天然介体替代常用的人工合成介体ABTS和HBT,此类天然介体价格低廉、使用安全。发现复合介体的效果优于单一介体,构建了Syr/Van双介体复合物,采用漆酶-Syr/Van系统4 h内对土霉素的降解率高达95.14 %。本研究结果具有重要的实际应用价值。
| [1] |
MA J, ZHU D, SHENG G D, et al. Soil oxytetracycline exposure alters the microbial community and enhances the abundance of antibiotic resistance genes in the gut of Enchytraeus crypticus[J]. Science of the Total Environment, 2019, 673: 357-366. DOI:10.1016/j.scitotenv.2019.04.103 |
| [2] |
张憬, 唐煜, 梁斌. 饲料中金霉素使用现状分析[J]. 饲料研究, 2016, 8: 45-47. ZHANG J, TANG Y, LIANG B. Analysis of the current status of chlortetracycline use in feed[J]. Feed Research, 2016, 8: 45-47. |
| [3] |
CHEN H, ZHOU Y, HU X, et al. Effects of chlortetracycline on biological nutrient removal from wastewater[J]. Science of the Total Environment, 2019, 647: 268-274. DOI:10.1016/j.scitotenv.2018.07.436 |
| [4] |
SARMAH A K, MEYER M T, BOXALL A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [5] |
LI Y, FANG J, YUAN X, et al. Distribution characteristics and ecological risk assessment of tetracyclines pollution in the Weihe River, China[J]. International Journal of Environmental Research and Public Health, 2018, 15(9): 1803-1813. DOI:10.3390/ijerph15091803 |
| [6] |
JIANG Y, LI M, GUO C, et al. Distribution and ecological risk of antibiotics in a typical effluent-receiving river (Wangyang River) in north China[J]. Chemosphere, 2014, 112: 267-274. DOI:10.1016/j.chemosphere.2014.04.075 |
| [7] |
WEI R, HE T, ZHANG S, et al. Occurrence of seventeen veterinary antibiotics and resistant bacterias in manure-fertilized vegetable farm soil in four provinces of China[J]. Chemosphere, 2019, 215: 234-240. DOI:10.1016/j.chemosphere.2018.09.152 |
| [8] |
SOLOMON E I, SUNDARAM U M, MACHONKIN T E. Multicopper oxidases and oxygenases[J]. Chemical Reviews, 1996, 96(7): 2563-2606. DOI:10.1021/cr950046o |
| [9] |
MATE D M, ALCALDE M. Laccase:a multi-purpose biocatalyst at the forefront of biotechnology[J]. Microbial Biotechnology, 2016, 10(6): 1457-1467. |
| [10] |
TAHERAN M, NAGHDI M, BRAR S K, et al. Biodegradation of chlortetracycline by Trametes versicolor-produced laccase:By-product identification[J]. Journal of Environmental Engineering, 2018, 144(4): 04018018. DOI:10.1061/(ASCE)EE.1943-7870.0001362 |
| [11] |
CANAS A I, CAMARERO S. Laccases and their natural mediators:biotechnological tools for sustainable eco-friendly processes[J]. Biotechnology Advances, 2010, 28(6): 694-705. DOI:10.1016/j.biotechadv.2010.05.002 |
| [12] |
CALL H P, MUCKE I. History, overview and applications of mediated lignolytic systems, especially laccase-mediator-systems (Lignozym(R)-process)[J]. Journal of Biotechnology, 1997, 53(2/3): 163-202. |
| [13] |
邱卫华, 陈洪章. 木质纤维素原料中漆酶天然介体的研究进展[J]. 生物工程学报, 2014, 30(5): 726-733. QIU W H, CHEN H Z. Progress in natural laccase mediators from lignocelluloses[J]. Chinese Journal of Biotechnology, 2014, 30(5): 726-733. |
| [14] |
BUGG T D, AHMAD M, HARDIMAN E M, et al. Pathways for degradation of lignin in bacteria and fungi[J]. Natural Product Reports, 2011, 28(12): 1883-1896. DOI:10.1039/c1np00042j |
| [15] |
ZENG S Q, ZHAO J, XIA L M. Simultaneous production of laccase and degradation of bisphenol A with Trametes versicolor cultivated on agricultural wastes[J]. Bioprocess Biosystems Engineering, 2017, 40(8): 1237-1245. DOI:10.1007/s00449-017-1783-1 |
| [16] |
曾盛泉. Trametes versicolor产漆酶及其在有机污染物降解中的应用基础研究[D].杭州: 浙江大学, 2017. ZENG S Q. Basic research on laccase production with Trametes versicolor and its application in the degradation of organic pollutants[D]. Hangzhou: Zhejiang University, 2017. |
| [17] |
郑茂佳, 张恩栋, 孙静茹, 等. 四环素类抗生素生物降解研究进展[J]. 天津农业科学, 2018, 24(6): 72-76, 85. ZHENG M J, ZHANG E D, SUN J R, et al. Biodegradation research progress of tetracyclines antibiotics[J]. Tianjin Agricultural Sciences, 2018, 24(6): 72-76, 85. DOI:10.3969/j.issn.1006-6500.2018.06.018 |
| [18] |
WANG J, ZHOU B, GE R, et al. Degradation characterization and pathway analysis of chlortetracycline and oxytetracycline in a microbial fuel cell[J]. RSC Advances, 2018, 8(50): 28613-28624. DOI:10.1039/C8RA04904A |




