2. 东华理工大学 核资源与环境省部共建国家重点实验室,江西 南昌 330013;
3. 东华理工大学 核科学与工程学院,江西 南昌 330013
2. State Key Laboratory of Nuclear Resources and Environment, East China University of Technology, Nanchang 330013, China;
3. School of Nuclear Science and Engineering, East China University of Technology, Nanchang 330013, China
伴随着核能的快速发展,放射性废物的处理迫在眉睫,其中放射性废水又因含铀矿物的大量开采而日渐增多。众所周知,铀作为一种放射性元素,它的危害不仅在于它具有的化学毒性,更是它的放射性污染。因此,对含铀放射性废水的有效处理显得尤其重要[1]。
自20世纪以来,碳材料因其特异物理及化学性能受到广泛关注。其中石墨烯拥有高比表面积、突出的导热性能和力学性能及其优良电子传递性能,引起了一波研究狂潮[2]。理论上石墨烯是一种无限大的二位材料,但这种结构不稳定,易产生褶皱,起伏等结构缺陷,限制了很多实际应用[3]。石墨烯纳米带(GNRs),一种经横向剪切石墨烯得到的纳米材料,解决了石墨烯的结构不稳定问题,同时又增大了石墨烯的比表面积。2010年至今,诸多学者研究了氧化石墨烯纳米材料的吸附吸能[4],发现氧化石墨烯纳米材料因其纳米结构,能够很好地作为载体复合官能团进行吸附。王云等采用化学法打开碳纳米管,制备的氧化石墨烯纳米带对铀的吸附容量可达到394 mg∙g-1,远超普通碳材料。杨熙[5]及邹文雅等[6]采用改性Hummers法合成的氧化石墨烯纳米材料及其复合材料表现出很好的吸附性能。二氧化锰因其具有成本低、表面积大、氧化性温和以及在酸性条件下稳定性好等优点,近年来在吸附领域亦受到人们广泛关注。另外,MnO2表面还存在大量的羟基活性基团,易于质子化以及脱质子化,能够为金属离子提供结合位点,能更有效地去除废水中的金属离子[7-11]。
鉴于此,若在GONRs表面适当地引入锰氧化物,一方面GONRs表面存在含氧官能团可作为锰氧化物复合位点,另一方面MnO2在水中的低溶解度可弥补GONRs在水中难以分离的缺点,从而形成一种性能更加优异的新型复合吸附剂[12-15]。因此,研究采用横向切割碳纳米管制备的GONRs为基体,将MnO2复合到其表面,制备出复合吸附剂氧化石墨烯纳米带/二氧化锰(GONRs/MnO2),并将其应用于吸附含铀废水。
2 实验 2.1 仪器与试剂设备:可见分光光度计(北京科仪有限公司,721型);离心机(湖南湘仪离心机仪器有限公司,H1650型);超声波清洗器(昆山禾创超声仪器有限公司,KH2200型);扫描电子显微镜(FEI捷克有限公司,Nova NanoSEM450);红外光谱仪(美国Perkin Elmer,IR-843型);比表面积测定仪(北京精微高博科学技术有限公司,JW-BK100A型)。
原料与试剂:多壁碳纳米管(MWCNTs)的纯度为95%,另含2%的金属催化剂颗粒和3%的无定型碳,购自中国科学院成都有机化学研究所、高锰酸钾、98%浓硫酸、30%过氧化氢、无水乙醇、氢氧化钠、硝酸、氯乙酸、乙酸钠、偶氮胂(Ⅲ)等试剂均购自国药集团化学试剂有限公司。实验用水为自制去离子水,实验所需含铀废水使用硝酸铀酰配制而成(该模拟废水中仅含有铀酰离子及硝酸根离子,而常见核工业含铀废水除以上离子外,往往还含一些重金属离子或镧系、锕系金属离子)。
2.2 GONRs的制备采用改性的Tour方法轴向打开MWCNTs制备氧化石墨烯纳米带[16]。该方法涉及到H2SO4预氧化、KMnO4氧化、透析和纯化4个步骤。首先,称取1 g MWCNTs于装有150 mL浓H2SO4溶液的三口烧瓶中,在室温下搅拌6 h,然后称量500% (相对于碳管的质量)的KMnO4于混合液中,室温下搅拌1 h。将混合物加热到55 ℃,反应30 min。再将温度升至70 ℃,稳定几分钟,反应停止,冷却到室温。混合物倒入至400 mL含有5 mL过氧化氢(H2O2)的冰中,并用5.0 μm的聚四氟乙烯(PTFE)膜过滤。固体物溶解在120 mL去离子水中,超声30 min,在透析袋(3.5 K,MWCO,pierce)中透析一周以上。最后,混合液经真空过滤后,固体物在60 ℃真空干燥24 h,备用。所得产物被标记为GONRs。
2.3 GONRs/MnO2复合材料的合成将200 mL 0.1 mol∙L-1的高锰酸钾加热至75 ℃,回流3 h。用0.01 mol∙L-1的HCl将上述溶液pH调至5.0,之后将0.5 g的GONRs加入到上述溶液中,在75 ℃下合成3 h。悬浮液经过滤后,用去离子水、乙醇反复洗涤,在80 ℃真空干燥12 h,所得产物为GONRs/MnO2复合材料。
2.4 吸附实验称取一定量的GONRs于50 mL锥形瓶中,加入25 mL已调好pH (用NaOH和HNO3调节)的已知浓度铀溶液,在一定温度下进行震荡一定时间,用注射器和滤筛过滤后,取滤液进行铀的测定,铀的分析采用偶氮胂(Ⅲ)分光光度法。GONRs对铀的吸附量qe (mg∙g−1)及去除率通过下式计算:
| $ {q_{\rm{e}}} = \frac{{\left( {{C_0} - {C_{\rm{e}}}} \right) \times V}}{w} $ | (1) |
| $ p = \frac{{{C_0} - {C_{\rm{e}}}}}{{{C_0}}} \times 100\% $ | (2) |
其中,qe为对铀的平衡吸附量,mg∙g-1;C0为铀的初始浓度,mg∙L-1;Ce为吸附平衡时溶液中的铀浓度,mg∙L-1;V为溶液体积,L;w为吸附剂用量,g。
3 结果与讨论 3.1 表征 3.1.1 SEM对GONRs和GONRs/MnO2进行SEM表征,结果如图 1所示。GONRs呈带状结构,长度在10~300 nm,长宽比大于10 (图 1(a))[17-18]。MnO2为小球状固体(图 1(b)),GONRs经MnO2复合后,两者团聚成簇状,证明MnO2被成功复合在GONRs上(图 1(c)和(d))。

|
图 1 GONRs、MnO2和GONRs/MnO2的SEM图 Fig.1 SEM micrographs of GONRs, MnO2 and GONRs/MnO2 |
GONRs和GONRs/MnO2的FT-IR如图 2所示。在GONRs的谱图中,位于1 558 cm−1处的峰为石墨结构特征峰,在1 397 cm−1处为碳材料的无序结构特征峰,而在3 440 cm−1处的宽峰为碳纳米管表面羟基或者物理吸附水中的羟基的振动峰,在2 920及2 850 cm−1处的峰分别为CH和CH2的伸缩振动峰,位于1 731和1 095 cm−1处的峰分别为–C=O及C–O振动峰[19]。而在GONRs/MnO2谱图中,在582 cm-1处出现了Mn–O键的特征伸缩振动峰,说明MnO2被复合到GONRs上[20]。
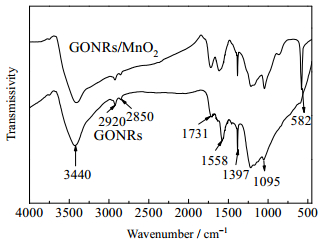
|
图 2 GONRs和GONRs/MnO2的红外光谱图 Fig.2 FT-IR spectra of GONRs and GONRs/MnO2 |
GONRs和GONRs/MnO2的XRD如图 3所示。GONRs有两个特征峰,位于2θ = 10.2°的石墨烯特征峰(001)和2θ = 25.4°的石墨碳特征峰(002)。而复合MnO2后的GONRs却出现了3个特征峰,图中可以看出,原来的GONRs的特征峰强度大幅度降低甚至接近消失,同时又出现了2θ = 37.5°的α-MnO2特征峰(400),说明GONRs上的部分含氧官能团充当了MnO2的结合位点,这又符合了FT-IR的解释。XRD图的结果进一步表明MnO2已被复合到GONRs上了[21-22]。
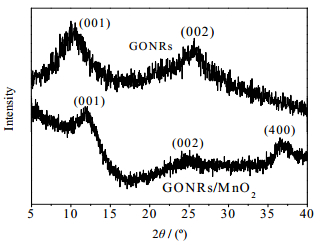
|
图 3 GONRs和GONRs/MnO2的XRD图 Fig.3 XRD patterns of GONRs and GONRs/MnO2 |
图 4为GONRs (a)和GONRs/MnO2 (b)的N2吸附/脱附等温曲线。由图 4可知,GONRs和GONRs/MnO2均符合第Ⅳ类N2吸附/脱附等温曲线模型。通过计算得到GONRs和GONRs/MnO2的比表面积分别为203.8和158.6 m2∙g-1。GONRs/MnO2的比表面积更小,这可能是因为GONRs的部分空隙被MnO2填满,使得具有丰富孔结构的GONRs比表面积进一步减小。
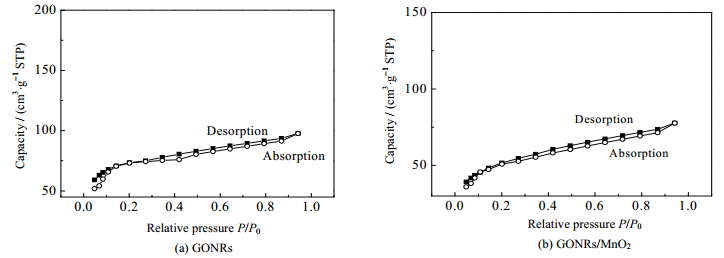
|
图 4 GONRs和GONRs/MnO2的N2吸附/脱附等温曲线 Fig.4 N2 absorption/desorption isotherms of GONRs and GONRs/MnO2 |
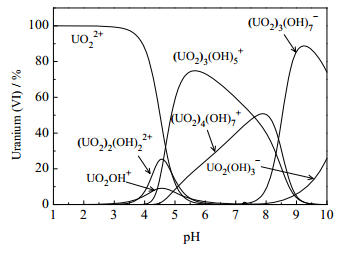
pH对GONRs/MnO2吸附U(Ⅵ)的影响如图 5所示。由图 5可知,在pH较低时,GONRs/MnO2对铀的吸附量较低,这是因为H+的竞争作用结果较强,使得铀酰离子与吸附剂表面络合的几率减小。当pH在3.5~5.0时,GONRs/MnO2吸附U(Ⅵ)的吸附量急剧上升,这是因为随着pH增大,H+浓度减小,H+的竞争效果降低,吸附剂更多地开始与铀酰离子进行络合作用。在pH > 5.0时,GONRs/MnO2对铀的吸附量明显降低,这可能是因为铀酰离子开始水解,形成一些不易于吸附剂络合的配合物。根据U(Ⅵ)的种态分析计算(图 6)结果,实验将初始溶液的pH限制在4.5以下。铀酰离子在pH值过高的溶液中会因水解而转变为其他不易溶的种态[19]。因此,为避免水解或沉淀的形成,后续实验溶液pH选为4.5。
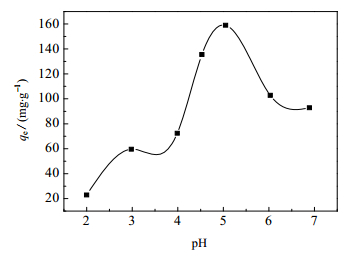
|
图 5 初始溶液pH对GONRs/MnO2吸附U(Ⅵ)的影响 Fig.5 Effects of initial pH on U(Ⅵ) adsorption by GONRs/MnO2 |
|
图 6 pH值对铀溶液中铀(Ⅵ)的种态分布影响 Fig.6 Effects of pH on distribution of uranium(Ⅵ) species |
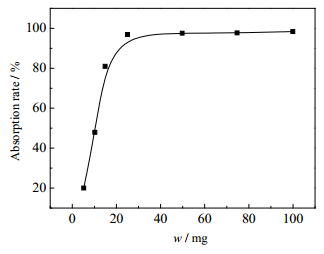
吸附剂质量对GONRs/MnO2吸附铀的影响如图 7所示。从图 7可以看出,随着GONRs/MnO2质量的增加,GONRs/MnO2对U(Ⅵ)的吸附率不断增加,当GONRs/MnO2质量超过15 mg时,吸附率的增大变得比较平缓。因此,在后续实验中,选择15 mg GONRs/MnO2作为后续实验的吸附剂用量。
|
图 7 吸附剂用量对GONRs/MnO2吸附铀的影响 Fig.7 Effects of composite dosage on U(Ⅵ) adsorption by GONRs/MnO2 |
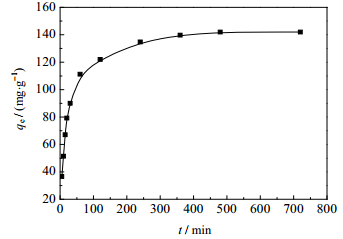
吸附时间对GONRs/MnO2吸附铀的影响如图 8所示。由图 8可知,在开始的前2 h内,GONRs/MnO2对U(Ⅵ)的吸附量随吸附时间的增加而增加,2 h后基本达到吸附平衡。为了探究时间对吸附性能的控制机理,采用拟一级动力学和拟二级动力学模型进行模拟[23],两种模型的直线方程分别如下:
| $ \lg \left( {{q_{\rm{e}}} - {q_{\rm{t}}}} \right) = \lg {q_{\rm{e}}} - \frac{{{k_1}t}}{{2.303}} $ | (3) |
| $ \frac{t}{{{q_{\rm{t}}}}} = \frac{1}{{{k_2}q_{\rm{e}}^2}} + \frac{t}{{{q_{\rm{e}}}}} $ | (4) |
|
图 8 吸附时间对GONRs/MnO2吸附U(Ⅵ)的影响 Fig.8 Effects of contact time on U(Ⅵ) adsorption by GONRs/MnO2 |
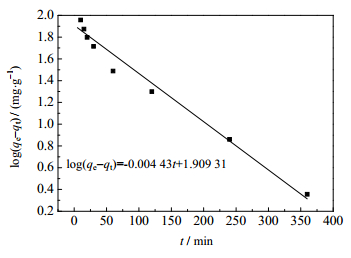
式中,k1和k2分别为准一级和准二级吸附动力学模型中的吸附速率常数,单位分别为min-1和g·(mg∙min)-1,可通过图 9和图 10中的直线的斜率和截距得到,结果列于表 1。
|
图 9 拟一级动力学模型 Fig.9 Quasi-first-order dynamic model |
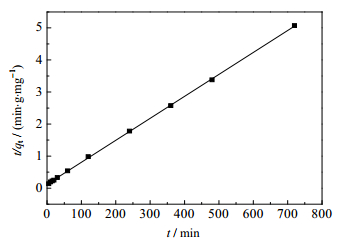
|
图 10 拟二级动力学模型 Fig.10 Quasi-secondary dynamic model |
|
|
表 1 GONRs/MnO2吸附铀的动力学参数 Table 1 Kinetic parameters of U(Ⅵ) adsorption by GONRs/MnO2 |
由表 1可以看出,拟二级动力学的相关系数更大,且理论吸附值qe, cal与实际吸附值qe, exp更接近。因此推测GONRs/MnO2对U(Ⅵ)的吸附过程更符合拟二级动力学模型。该模型是假设吸附剂与被吸附物质之间的吸附作用为化学过程,过程涉及吸附剂与吸附质之间存在共价键和电子交换作用。由此可得GONRs/MnO2与对U(Ⅵ)的吸附过程应为化学吸附。
3.5 铀初始浓度对GONRs/MnO2吸附U(Ⅵ)的影响及吸附等温线研究图 11为不同铀初始浓度对GONRs和GONRs/MnO2吸附U(Ⅵ)的影响。图 11表明随着平衡浓度的增加,吸附量增加,并且吸附最终可达平衡,GONRs和GONRs/MnO2对铀的最大吸附量分别为296和345 mg∙g-1。经MnO2功能化后,GONRs/MnO2对铀的吸附量有明显提高。
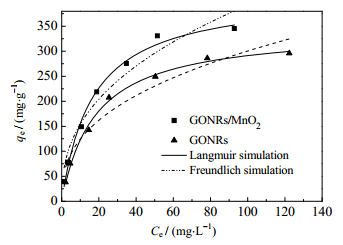
|
图 11 初始浓度对GONRs和GONRs/MnO2吸附U(Ⅵ)的影响 Fig.11 Equilibrium isotherm for U(Ⅵ) adsorption by GONRs and GONRs/MnO2 |
对于GONRs/MnO2对U(Ⅵ)的吸附过程,分别用Langmuir和Freundlich模型进行模拟。其中,Langmuir吸附等方程假设吸附为单层均一吸附,且每个吸附位点只能容纳一个吸附质分子,其线性表达式为:
| $ \frac{{{C_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{1}{{{q_{\rm{m}}}{K_{\rm{L}}}}} + \frac{{{C_{\rm{e}}}}}{{{q_{\rm{m}}}}} $ | (5) |
式中,KL为与吸附能量相关的参数,其值越大表示吸附的亲和力越大;qm为单层吸附能量,mg∙g-1。
Freundlich吸附模型假设吸附剂表面不是单一的,且吸附位点不是均一的。其等温线模型的线性表达式为:
| $ {\rm{lg}}{q_{\rm{e}}} = \lg {K_{\rm{F}}} + \frac{1}{n}\lg {C_{\rm{e}}} $ | (6) |
式中,KF、n为与吸附容量与吸附强度相关的参数。
通过计算得到的有关GONRs和GONRs/MnO2吸附铀的实验吸附容量和相关的参数详见表 2。由表 2可见,Langmuir的相关系数更大,GONRs/MnO2对U(Ⅵ)的吸附过程更符合Langmuir等温模型。这表明铀在GONRs/MnO2的吸附很有可能是由单层吸附主导的。
|
|
表 2 GONRs和GONRs/MnO2吸附铀的Langmuir和Freundlich模型参数 Table 2 Parameters of the Langmuir, Freundlich isotherm models for U(Ⅵ) adsorption by GONRs and GONRs/MnO2 |
温度对GONRs/MnO2吸附U(Ⅵ)的影响如图 12所示。由图可知,GONRs/MnO2对U(Ⅵ)的吸附量随着温度的提高而逐渐增加,表明温度有利于GONRs/MnO2对U(Ⅵ)的吸附。
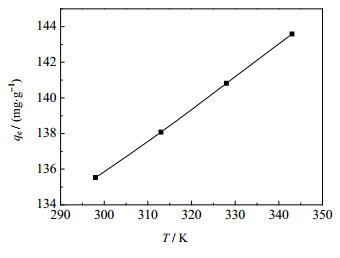
|
图 12 温度对GONRs/MnO2吸附U(Ⅵ)的影响 Fig.12 Effects of temperature on U(Ⅵ) adsorption by GONRs/MnO2 |
研究吉布斯自由能变(ΔG,kJ∙mol-1)、焓变(ΔH,kJ∙mol-1)和熵变ΔS(J∙K-1∙mol-1)等热力学参数,焓变和熵变的计算式如下:
| $ \ln {K_{\rm{d}}} = \frac{{\Delta S}}{R} - \frac{{\Delta H}}{{RT}} $ | (7) |
| $ \Delta G = \Delta H - T\Delta S $ | (8) |
式中,Kd为吸附分配系数,T与R分别为绝对温度和气体常数。
实验数据均列于图 13和表 3中。从热力学参数可知,ΔH > 0,说明GONRs/MnO2吸附U(Ⅵ)是一个吸热过程,ΔS > 0说明吸附剂表面的自由度增加了。同时不同温度下的ΔG < 0,说明该吸附过程是一个自发的吸附过程。
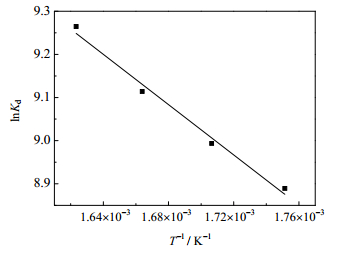
|
图 13 lnKd with T-1的变化关系 Fig.13 Profile of lnKd against T-1 |
|
|
表 3 GONRs/MnO2吸附U(Ⅵ)的热力学参数 Table 3 Thermodynamic parameters of U(Ⅵ) adsorption by GONRs/MnO2 |
使用含有多种竞争阳离子的废水研究了GONRs和GONRs/MnO2对U(Ⅵ)的选择性[17],结果如图 14所示。可以很明显地发现,与GONRs相比,GONRs/MnO2对铀吸附能力和选择性得到了显著提高。GONRs/MnO2对铀的吸附量从GONRs的9.7上升至69.5 mg∙g-1 (约是GONRs的7倍),占了对所有金属离子总吸附容量的79.4%,相比原始GONRs (31.2%)对铀的选择性提高了近2.5倍。
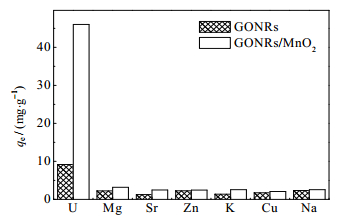
|
图 14 GONRs和GONRs/MnO2对铀的选择吸附 Fig.14 Selective uranium adsorption by GONRs and GONRs/MnO2 CUO22+ = 50 mg·L-1, Cmp = 0.01 mmol·L-1, m = 15 mg, pH = 5, T = 25 ℃ |
在对含铀废水的处理中,吸附材料的重复利用性至关重要。利用0.1 M的盐酸进行洗脱再生利用,GONRs/MnO2对铀的循环利用性能如图 15所示。由图 15可知,在经过5次循环利用之后,复合材料对铀的去除率依然保持在80%以上,说明其具有良好的重复使用性能。
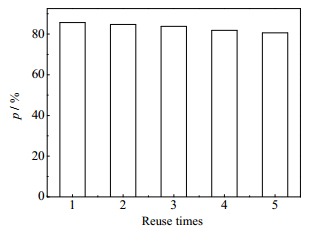
|
图 15 GONRs/MnO2对铀的循环利用 Fig.15 Reusability of GONRs/MnO2 for uranium adsorption |
(1) SEM、XRD和FT-IR分析表明,制备的GONRs/MnO2复合材料呈簇状,表面含有丰富的含氧官能团。
(2) GONRs/MnO2对U(Ⅵ)的吸附过程是与受pH影响的,自发、吸热的化学吸附过程。吸附动力学符合拟二级动力学模型,表明为反应控制。吸附等温线符合Langmuir模型,最大吸附量达345 mg∙g-1。
(3) GONRs/MnO2对U(Ⅵ)的吸附选择性能和重复使用性能较好,可用于吸附分离废水中的铀。
| [1] |
黄扬帆, 刘会娥, 王振有, 等. 软模板法石墨烯气凝胶的制备及其对水中油品的吸附机理[J]. 高校化学工程学报, 2018, 32(4): 208-216. HUANG Y F, LIU H E, WANG Z Y, et al. Preparation of graphene aerogels with soft templates and their oil adsorption mechanism from water[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(4): 208-216. |
| [2] |
马文石, 周俊文, 程顺喜. 石墨烯的制备与表征[J]. 高校化学工程学报, 2010, 24(4): 719-722. MA W S, ZHOU J W, CHENG S X. Preparation and characterization of graphene[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 719-722. DOI:10.3969/j.issn.1003-9015.2010.04.030 |
| [3] |
郑小青, 冯苗, 詹红兵. 石墨烯纳米带[J]. 化学进展, 2012, 24(12): 2320-2329. ZHENG X Q, FENG M, ZHAN H B. Graphene nanoribbons[J]. Progress in Chemistry, 2012, 24(12): 2320-2329. |
| [4] |
张蓉, 付婧, 罗田, 等. 氧化石墨烯纳米材料的制备及其对Eu(Ⅲ)吸附性能[J]. 环境化学, 2018, 37(4): 798-806. ZHANG R, FU J, LUO T, et al. Preparation of graphene oxide nanomaterials and the Eu(Ⅲ) adsorption performance[J]. Journal of Environmental Chemistry, 2018, 37(4): 798-806. |
| [5] |
杨熙.氧化石墨烯和石墨烯纳米材料制备及其重金属吸附性能研究[D].武汉: 华中师范大学, 2012. YANG X. Preparation and heavy metal adsorption of GO and graphene nanomaterials[D]. Wuhan: Central China Normal University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10511-1012385131.htm |
| [6] |
邹文雅.氧化石墨烯改性材料的制备及其对重金属离子的吸附应用研究[D].广州: 华南理工大学, 2016. ZOU W Y. Preparation of GO modified materials and its adsorption of heavy metal ions[D]. Guangzhou: South China University of Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10561-1016737768.htm |
| [7] |
XIE X, GAO L. Characterization of a manganese dioxide/carbon nanotube composite fabricated using an in situ coating method[J]. Carbon, 2007, 45(12): 2365-2373. DOI:10.1016/j.carbon.2007.07.014 |
| [8] |
LI H, LI X, XIAO T, et al. Efficient removal of thallium(Ⅰ) from wastewater using flower-like manganese dioxide coated magnetic pyrite cinder[J]. Chemical Engineering Journal, 2018, 353: 867-877. DOI:10.1016/j.cej.2018.07.169 |
| [9] |
LI Y, CAO D, WANG Y, et al. Hydrothermal deposition of manganese dioxide nanosheets on electrodeposited graphene covered nickel foam as a high-performance electrode for supercapacitors[J]. Journal of Power Sources, 2015, 279(279): 138-145. |
| [10] |
WANG Y, ZHANG X, HE X, et al. In situ synthesis of MnO2 coated cellulose nanofibers hybrid for effective removal of methylene blue[J]. Carbohydrate Polymers, 2014, 110(18): 302-308. |
| [11] |
HAWASH H B I, CHMIELEWSKA E, NETRIOVA Z, et al. Innovative comparable study for application of iron oxyhydroxide and manganese dioxide modified clinoptilolite in removal of Zn(Ⅱ) from aqueous medium[J]. Journal of Environmental Chemical Engineering, 2018, 6(5): 6489-6503. DOI:10.1016/j.jece.2018.09.024 |
| [12] |
LI Y, WANG G, YE K, et al. Facile preparation of three-dimensional multilayer porous MnO2/reduced graphene oxide composite and its supercapacitive performance[J]. Journal of Power Sources, 2014, 271: 582-588. DOI:10.1016/j.jpowsour.2014.08.048 |
| [13] |
SEREDYCH M, BANDOSZ T J. Manganese oxide and graphite oxide/MnO2 composites as reactive adsorbents of ammonia at ambient conditions[J]. Microporous & Mesoporous Materials, 2012, 150(1): 55-63. |
| [14] |
WEN Q, WANG S, YAN J, et al. MnO2-graphene hybrid as an alternative cathodic catalyst to platinum in microbial fuel cells[J]. Journal of Power Sources, 2012, 216(216): 187-191. |
| [15] |
YANG W, GAO Z, WANG J, et al. Synthesis of reduced graphene nanosheet/urchin-like manganese dioxide composite and high performance as supercapacitor electrode[J]. ElectrochimicaActa, 2012, 69(5): 112-119. |
| [16] |
JIAO L, ZHANG L, WANG X, et al. Narrow graphene nanoribbons from carbon nanotubes[J]. Nature, 2009, 458(7240): 877-880. DOI:10.1038/nature07919 |
| [17] |
PAN N, LI L, DING J, et al. Preparation of graphene oxide-manganese dioxide for highly efficient adsorption and separation of Th(Ⅳ)/U(Ⅵ)[J]. Journal of Hazardous Materials, 2016, 309: 107-115. DOI:10.1016/j.jhazmat.2016.02.012 |
| [18] |
WU Z L, LI C K, YU J G, et al. MnO2/reduced graphene oxide nanoribbons:Facile hydrothermal preparation and their application in amperometric detection of hydrogen peroxide[J]. Sensors and Actuators B:Chemical, 2017, 239: 544-552. DOI:10.1016/j.snb.2016.08.062 |
| [19] |
GU Z, WANG Y, TANG J, et al. The removal of uranium(Ⅵ) from aqueous solution by graphene oxide-carbon nanotubes hybrid aerogels[J]. Journal of Radioanalytical and Nuclear Chemistry, 2014, 303: 1835-1842. |
| [20] |
SANDIPAN M, ATIN P, SOURINDRA M, et al. Interconnected network of MnO2 nanowires with a 'cocoon' like morphology:Redox couple mediated performance enhancement in symmetric aqueous supercapacitor[J]. ACS Applied Materials & Interfaces, 2014, 6: 10754-10762. |
| [21] |
ZHOU L, YA NG, Z, YA NG, J, et al. Facile syntheses of 3-dimension graphene aerogel and nanowalls with high specific surface areas[J]. Chemical Physics Letters, 2017, 677: 7-12. DOI:10.1016/j.cplett.2017.03.076 |
| [22] |
REN H, SHI X., ZHU J, et al. Facile synthesis of N-doped graphene aerogel and its application for organic solvent adsorption[J]. Journal of Materials Science, 2016, 51(13): 6419-6427. DOI:10.1007/s10853-016-9939-y |
| [23] |
李传宝, 刘海辉, 苗锦雷, 等. 还原氧化石墨烯/MnO2气凝胶对甲醛的去除[J]. 复合材料学报, 2016, 33(12): 2831-2839. LI C B, LIU H H, MIAO J L, et al. In removal of formaldehyde with reduced graphene oxide/MnO2 aerogel[J]. Acta Materiae Compositae Sinica, 2016, 33(12): 2831-2839. |




