苦卤中含有大量的钠、镁、钾等无机盐,是极具价值的资源宝库。我国苦卤的利用率不足20%,大量的苦卤资源排入大海,既造成了资源的浪费又影响了近海海域的生态平衡。所以苦卤资源的高效综合利用一直是值得探讨和研究的课题。
苦卤镁盐转化为氢氧化镁[1]、碱式碳酸镁[2]、碱式硫酸镁[3]等无机材料产品是苦卤高效综合利用的新途径。目前以Mg(NO3)2、MgSO4、MgCl2等化学试剂为原料,通过与Na2CO3、NaHCO3、NH3·H2O等碱性物质反应制备碱式碳酸镁已经有不少文献报道[4-6],但是这些研究多关注的是产品形貌结构,而对原料转化率和反应后母液组成及如何再利用等问题研究较少。以苦卤为原料,Na2CO3作为沉淀剂制备碱式碳酸镁晶须,近年来张士航[7]、吴建松等[8]、祁洪波等[9]分别进行了研究,这些文献虽然讨论了原料中镁离子的转化率,但是没有考察Na2CO3的转化率,所用卤水为稀释后的苦卤,原料碳酸钠浓度较低,而且没有研究卤水制备碱式碳酸镁后,剩余母液组成及其如何利用,研究工作用于指导实际生产还有一定的距离。
鉴此,考虑到苦卤或海水空气吹出法提溴技术[10]已经成熟并工业化,本文以不含溴的实际苦卤为模拟苦卤,围绕提高原料Mg2+及CO32-转化率,简化合成碱式碳酸镁后母液组成及其后续钠盐与钾盐的分离设计为目的,进行苦卤与Na2CO3及Na2CO3和NaOH混合液反应制备碱式碳酸镁及其剩余母液钠盐与钾盐分离工艺的研究。
2 实验 2.1 原料及试剂实验原料为我国晒盐场晒盐后留下的卤水,其主要成分[11]为:质量浓度ρ(MgCl2):165 g·L-1,ρ(NaCl):85 g·L-1,ρ(KCl):20 g·L-1,ρ(MgSO4):67.5 g·L-1,ρ(Br):7.25 g·L-1。实验所用试剂均为分析纯,Na2CO3(天津市风船化学试剂科技有限公司),NaOH(天津赢达稀贵化工试剂厂),KCl(天津恒山化工科技有限公司),MgSO4·7H2O(天津市风船化学试剂科技有限公司),MgCl2·6H2O(天津恒山化工科技有限公司),NaCl(天津恒山化工科技有限公司)。
2.2 实验方法考虑到空气吹出法提溴技术已经成熟且工业化,本文以不含溴的实际苦卤为模拟苦卤,用化学试剂配制卤水作为制备碱式碳酸镁的原料。
碱式碳酸镁制备:
(1) 以Na2CO3为沉淀剂
取模拟卤水25 mL加入250 mL三口烧瓶,然后将其放置恒温水浴锅中,在搅拌状态下加入一定浓度的2.5 mol·L-1碳酸钠溶液,在搅拌转速120 r·min-1下搅拌120 s,停止搅拌,恒温静置沉化反应一定时间后即生成碱式碳酸镁晶体,并释放二氧化碳气体。化学反应式[12]如下:
| $ 5 \mathrm{Mg}^{2+}+5 \mathrm{CO}_{3}^{2-}+5 \mathrm{H}_{2} \mathrm{O}==4 \mathrm{MgCO}_{3} \cdot \mathrm{Mg}(\mathrm{OH})_{2} \cdot 4 \mathrm{H}_{2} \mathrm{O} \downarrow+\mathrm{CO}_{2} \uparrow $ | (1) |
(2) 以Na2CO3和NaOH为沉淀剂
由式(1)可知,生成的碱式碳酸镁可以看作是MgCO3和Mg(OH)2 2种物质组成的复盐,理论分析,如果由这2种物质直接合成碱式碳酸镁,则可不产生二氧化碳气体,避免CO2与水反应产生HCO3-,有利于后续母液的分离。目前还未见Na2CO3和NaOH混合沉淀剂与Mg2+反应制备碱式碳酸镁的文献报道,为此本文对此进行了研究。
取模拟卤水25 mL加入250 mL 三口烧瓶,然后将其放置恒温水浴锅中,在搅拌状态下加入一定量浓度的2.5 mol·L-1 Na2CO3和3 mol·L-1 NaOH混合碱液,在搅拌转速为120 r·min-1搅拌120 s,停止搅拌,恒温静置沉化反应一定时间后即生成碱式碳酸镁晶体。化学反应式如下:
| $ 5 \mathrm{Mg}^{2+}+4 \mathrm{CO}_{3}^{2-}+2 \mathrm{OH}^{-}+4 \mathrm{H}_{2} \mathrm{O}==4 \mathrm{MgCO}_{3} \cdot \mathrm{Mg}(\mathrm{OH})_{2} \cdot 4 \mathrm{H}_{2} \mathrm{O} \downarrow $ | (2) |
X射线衍射(XRD)分析:用德国Bruker射线衍射仪分析粉体的物相组成,Cu Kα辐射,管电压40 kV,管电流200 mA,分辨率0.02°,扫描速度为12 °·min-1,扫描范围为5° ~ 90°。
扫描电镜(SEM)分析:样品经真空镀铂金处理后,用JSM6700F型冷场发射扫描电镜观察样品表观的形貌。仪器的分辨率为3.5 nm,放大倍数为2×105~15×105倍。
母液中离子含量分析:Mg2+采用EDTA络合滴定法测定,CO32-、HCO3-、OH-含量采用HCl标准溶液滴定法测定,SO42-利用重量方法测定,Cl-用硝酸银滴定法测定,Na+用差减法计算。
| $ 钱离子的转化率 =\frac{\text { 反应镁离子的物质的量 }}{\text { 原料中镁离子的物质的量 }} \times 100 \% $ |
在反应温度80 ℃,反应时间3.5 h,Mg2+:CO32-摩尔比为1:0.9,1:1,1:1.1,1:1.2,1:1.3时,反应后母液化学组成及反应物Mg2+和CO32-转化率见表 1所示,产品的XRD和SEM分别如图 1和2所示。
|
|
表 1 不同反应物摩尔比对母液内各物质质量分数的影响 Table 1 Effects of reactant molar ratios on product mass fractions in the solution |
|
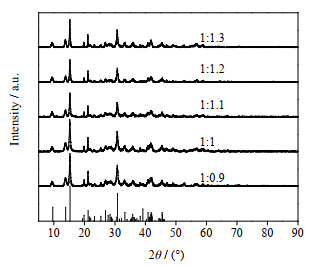
图 1 不同原料摩尔比下产品XRD谱图 Fig.1 XRD patterns of products from different molar ratios of raw materials |

|
图 2 不同原料摩尔比下产品SEM照片 Fig.2 SEM micrographs of products from different molar ratios of raw materials (a) 1:0.9 (b)1:1 (c) 1:1.1 (d) 1:1.2 (e) 1:1.3 |
由表 1可以看出当Mg2+:CO32-摩尔比为1:1.2时,Mg2+转化率为98%,此时的CO32-转化率也较高。
从图 1的XRD谱图可以看出,Mg2+:CO32-摩尔比分别为1:0.9,1:1,1:1.1,1:1.2,1:1.3时反应产物均为碱式碳酸镁。图 2的SEM图说明所有产物均为片层叠加成的直径为20 μm左右球体结构。可见原料Mg2+与CO32-摩尔比对反应产物形貌影响不大。
3.1.2 反应时间在反应温度为80 ℃,Mg2+:CO32-摩尔比为1:1.2条件下,反应时间分别为0.5、1.5、2.5、3.5、4.5 h时,反应后母液化学组成及反应物Mg2+和CO32-转化率如表 2所示,产品的XRD和SEM分别如图 3和4所示。
|
|
表 2 不同反应时间对母液内各物质质量分数的影响 Table 2 Effects of reaction times on product mass fractions in the solution |
|
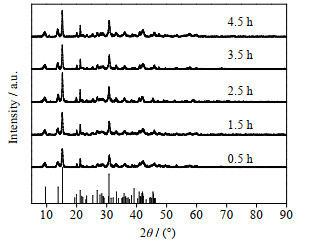
图 3 不同时间下产品的XRD谱图 Fig.3 XRD patterns of products obtained at different reaction times |

|
图 4 不同时间下产品的SEM照片 Fig.4 SEM micrographs of products obtained at different reaction times (a) 0.5 h (b) 1.5 h (c) 2.5 h (d) 3.5 h (e) 4.5 h |
由表 2可以看出,当反应时间为3.5 h时,Mg2+转化率99%,此时CO32-转化率最高。
图 3表明,当反应时间为2.5 h时,XRD峰高较高,2.5 h以后峰高没有明显变化,这说明2.5 h产物结晶度较好。从图 4产物的SEM图也可以看出,当反应时间为2.5 h时,产物表面轮廓线较之前清晰,且球体片层致密。分析原因为Mg2+和CO32-反应先生成无定形物[13],随着反应时间延长无定形物转变成为片层结构,由于交叉片状结构的极化作用[14],无定形物优先生长在其中一对凹面处,形成两面凹的沙漏,随着时间的延长,凹陷处会生长完全,形成表面清晰的球型碱式碳酸镁。
3.1.3 反应温度在反应时间为3.5 h,Mg2+:CO32-摩尔比为1:1.2条件下,反应温度分别为50、60、70、80、90 ℃时,反应后母液化学组成及反应物Mg2+和CO32-转化率见表 3所示,产品的XRD和SEM分别如图 5和6所示。
|
|
表 3 不同温度对母液内各物质质量分数的影响 Table 3 Effects of temperatures on product mass fractions in the solution |
|
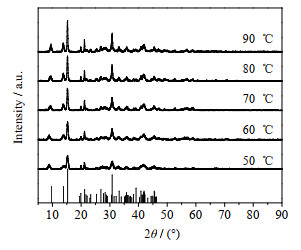
图 5 不同温度下产品的XRD谱图 Fig.5 XRD patterns of products obtained at different temperatures |

|
图 6 不同温度下产品的SEM照片 Fig.6 SEM micrographs of products obtained at different temperatures (a) 50 ℃ (b) 60 ℃ (c) 70 ℃ (d) 80 ℃ (e) 90 ℃ |
由表 3可以看出,当反应温度为80 ℃时,Mg2+转化率99%,此时的CO32-转化率最高。
由图 5可知,当反应温度为60 ℃时,XRD峰高较高,60 ℃以后峰高没有明显变化,这说明60 ℃产物结晶度较好。从图 6产物的SEM图也可以看出,反应温度为60 ℃时,产物表面轮廓线较之前清晰,且球体片层致密。
3.2 苦卤混合碱法制备碱式碳酸镁由3.1节研究可知,单独用CO32-与Mg2+反应制备碱式碳酸镁,不可能将镁离子完全转化,而且反应后的母液中还含有HCO3-,这不利于后续母液中钠盐、钾盐的分离。因此对碱式碳酸镁的化学式进行分析,是否可以通过直接加入OH-的方法来合成碱式碳酸镁,而不产生HCO3-,按照化学式(2),Mg2+:CO32-:OH-摩尔比为5:4:2,由3.1节结果可知Mg2+:CO32-摩尔比为1:1.2时效果最佳,于是将Mg2+:CO32-摩尔比定为5:4.8。为此在3.1节合成碱式碳酸镁优化条件基础上,探索浓度为2.5 mol·L-1 Na2CO3和浓度为3 mol·L-1 NaOH混合碱液制备碱式碳酸镁的适宜条件。
3.2.1 Mg2+、CO32-与OH-的摩尔比rB1在反应时间为3.5 h,反应温度为60 ℃条件下,Mg2+:CO32-:OH-摩尔比为5:4.8:1.4、5:4.8:1.6、5:4.8:1.8和5:4.8:2时,反应后母液化学组成及反应物Mg2+和CO32-转化率如表 4所示,产品的XRD和SEM分别见图 7和8所示。
|
|
表 4 不同摩尔比对母液中各物质质量分数的影响 Table 4 Effects of molar ratios on chemical mass fractions in the solution |
|
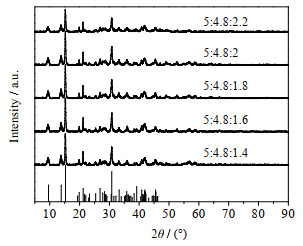
图 7 不同摩尔比下产品的XRD谱图 Fig.7 XRD patterns of products obtained at different molar ratios |

|
图 8 不同摩尔比下产品的SEM照片 Fig.8 SEM micrographs of products obtained at different molar ratios (a) 5:4.8:1.4 (b) 5:4.8:1.6 (c) 5:4.8:1.8 (d) 5:4.8:2 (e) 5:4.8:2.2 |
由表 4可以看出,当Mg2+:CO32-:OH摩尔比-为5:4.8:2时,Mg2+和CO32-转化率最高,溶液中不含OH-、HCO3-。
由图 7可知,当Mg2+:CO32-:OH-摩尔比为5:4.8:2时,产物峰高较高,再增加比例峰高没有明显变化,这说明Mg2+:CO32-:OH-摩尔比为5:4.8:2时产物结晶度较好。图 8为产物的SEM图,当Mg2+:CO32-:OH-摩尔比为5:4.8:2时,产物表面轮廓线较之前清晰,且球体片层致密。
3.2.2 反应温度在Mg2+:CO32-:OH-摩尔比为5:4.8:2,反应时间为2.5 h条件下,反应温度分别为50、60、70、80 ℃时,反应后母液化学组成及反应物Mg2+和CO32-转化率如表 5所示,产品的XRD和SEM分别如图 9和10所示。
|
|
表 5 不同温度对母液内各物质质量分数的影响 Table 5 Effects of temperatures on chemical mass fractions in the solution |
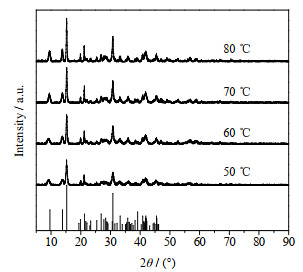
|
图 9 2.5 h下不同温度产物的XRD谱图 Fig.9 XRD patterns of products obtained under different temperatures at 2.5 h |

|
图 10 2.5 h不同温度下产品的SEM照片 Fig.10 SEM micrographs of products obtained under different temperatures at 2.5 h (a) 50 ℃ (b) 60 ℃ (c) 70 ℃ (d) 80 ℃ |
由表 5中可以看出,当反应温度为60 ℃时,Mg2+转化率为100%,此时的CO32-转化率较高,溶液中不含OH-、HCO3-。
图 9表明,当反应温度为60 ℃时,产物峰高较高,再增加比例峰高没有明显变化,这说明60 ℃时产物结晶度较好。图 10为产物的SEM图,当反应温度为60 ℃时,产物表面轮廓线较之前清晰。
3.2.3 反应时间在Mg2+:CO32-:OH-摩尔比为5:4.8:2,反应温度为60 ℃条件下,反应时间分别为0.5、1.5、2.5、3.5、4.5 h时,反应后母液化学组成及反应物Mg2+和CO32-转化率如表 6所示,产品的XRD和SEM分别如图 11和12所示。
|
|
表 6 不同反应时间对母液内各物质质量分数的影响 Table 6 Effects of reaction times on chemical mass fractions in the solution |
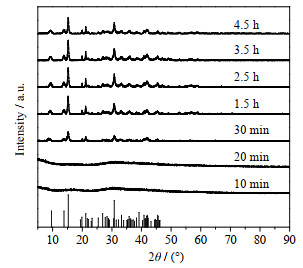
|
图 11 60 ℃下不同时间产物的XRD谱图 Fig.11 XRD patterns of products obtained under different times at 60 ℃ |
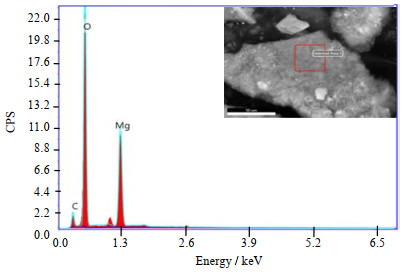
|
图 12 反应10 min后产物的形貌及能谱图 Fig.12 Morphology and EDAX spectrum of the product after 10 min reaction |
从表 6中可以看到,当反应时间为2.5 h时,Mg2+转化率为100%,此时CO32-转化率为90%,溶液中不含OH-、HCO3-。
由图 11中可以看出,当反应时间10和20 min时,反应产物没有特征峰为无定形物,由图 12中可以看出该无定形物由C、O、Mg 3种元素构成不含H元素,所以加入OH-和CO32-混合碱也是先生成无定形物,再转变生成碱式碳酸镁,而并非生成Mg(OH)2和MgCO3再转化生成碱式碳酸镁。当反应时间为2.5 h时,产物峰高较高,再增加比例峰高没有明显变化,这说明2.5 h时产物结晶度较好。图 13为产物的SEM图,当反应温度为2.5 h时,产物表面轮廓线较之前清晰,且球体片层致密。

|
图 13 60 ℃不同时间下产品的SEM照片 Fig.13 SEM micrographs of products obtained under different times at 60 ℃ (a) 0.5 h (b) 1.5 h (c) 2.5 h (d) 3.5 h (e) 4.5 h |
综合考虑原料Mg2+与CO32-的转化率,剩余母液中Mg2+、CO32-与HCO3-含量,及碱式碳酸镁产品形貌结构,确定苦卤混合碱法制备碱式碳酸镁的适宜条件:Mg2+:CO32-:OH-摩尔比为5:4.8:2,反应温度60 ℃,反应时间2.5 h。
3.3 制备碱式碳酸镁后母液加工分离苦卤经最佳条件沉镁后剩余母液中Mg2+含量极少,组成为0.01%,近似认为母液不含Mg2+,剩余母液中各物质的组成如表 7所示:
|
|
表 7 剩余母液中各物质的组成 Table 7 Composition of substances in remaining mother liquor |
由表 7中可以看出,适宜条件下苦卤制备碱式碳酸镁后,剩余母液组成为Na+, K+//Cl-, SO42-, CO32- -H2O五元体系,但该五元体系不好直接分离各盐,故可以通过添加等当量0.5 mol·L-1的CaCl2溶液,除去母液中的CO32-,使剩余母液简化为易于加工分离的Na+, K+ //Cl-, SO42- -H2O四元体系,然后在对其中各盐进行分离。除钙后的母液组成:Na+:5.48%,K+:0.41%,Cl-:7.35%,SO42-:2.05%,H2O:84.71%。
3.3.1 除钙后K+, Na+//Cl-, SO42- -H2O体系母液分离工艺依据数据[16]绘制0和25 ℃时K+, Na+//Cl-, SO42- -H2O四元体系干盐图如图 14所示。图中xB为干盐的摩尔分数,在25 ℃相图中,EFGHB为NaCl的结晶区,EFPN为Na2SO4·10H2O的结晶区,OPFGRQ为GLa(NaSO4·3K2SO4)的结晶区。在0 ℃相图中,AMLKJSI为Na2SO4·10H2O的结晶区,ISUB为NaCl的结晶区,LKJWV为3K2SO4·Na2SO4的结晶区。
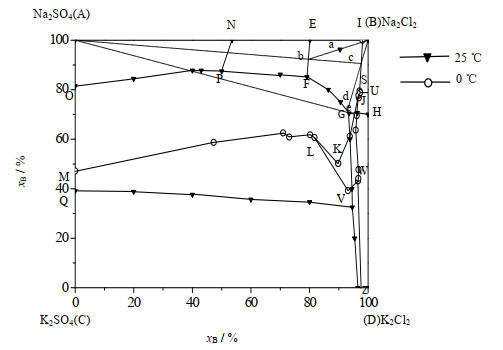
|
图 14 25 ℃、0 ℃时K+, Na+//Cl-, SO42-- H2O稳定体系相图 Fig.14 Phase diagram of the K+, Na+//Cl-, SO42--H2O stable system at 25 ℃ and 0 ℃ |
图 14中点a为除钙后的母液组成点,a点落在了25 ℃相图的NaCl结晶区内,a点25 ℃等温蒸发析出NaCl,液相点将沿着Ba延长线方向移动,当液相点到达Ba延长线与EF线的交点b时,Na2SO4达到饱和,继续蒸发水分,Na2SO4与NaCl共析,此时停止蒸发。分离析出固相NaCl后,b点落在0 ℃相图Na2SO4·10H2O结晶区内,通过挥发调整母液b水分并降温到0 ℃,可使Na2SO4·10H2O结晶析出,液相点恰好到Ab延长线与IS线的交点c点,分离析出Na2SO4·10H2O固相后,母液点又在落在了25 ℃时K+, Na+//Cl-, SO42- -H2O四元体系干盐图的NaCl结晶区内。对母液c再进行25 ℃等温蒸发失水,将会有NaCl析出,析出NaCl后的液相点到达Bc延长线与FG线的交点d点,分离析出NaCl后,母液d点又落在了0 ℃ K+, Na+//Cl-, SO42- -H2O相图的Na2SO4·10H2O结晶区内,在此温度等温挥发水分,有Na2SO4·10H2O固相析出,液相点恰好达到AG延长线与JK线的交点e点,由于e点接近25 ℃时NaCl和KCl的共饱线GH,因此停止蒸发。
表 8为生产流程的相图计算,经过上步分离计算后,母液中剩余各离子的质量分数:w (Na+):7.74%,w (K+):5.50%,,w (Cl-):15.00%,w (SO42-):2.09%,w (H2O):84.71%。经计算可知SO42-质量分数较低,因此可以加入等浓度的0.3 mol·L-1 BaCl2除去SO42-,使剩余母液简化为NaCl-KCl-H2O三元体系相图,然后再对其中各盐进行分离。除SO42-后剩余母液组成为:w(Na+):5.48%,w(K+):0.41%,w(Cl-):7.35%,w(H2O):84.71%。
|
|
表 8 K+, Na+//Cl-, SO42--H2O四元相图生产工艺流程计算 Table 8 Process calculation of the phase diagram of the K,+ Na+//Cl,- SO42--H2O quaternary system |
依据数据[15]绘制100和25 ℃时NaCl-KCl-H2O三元体系干盐图如图 15所示。25 ℃相图中BMO为NaCl的结晶区,AMN为KCl结晶区,ABM为NaCl和KCl结晶区。100 ℃相图中BEI为NaCl的结晶区,AEK为KCl结晶区,ABE为NaCl和KCl结晶区。
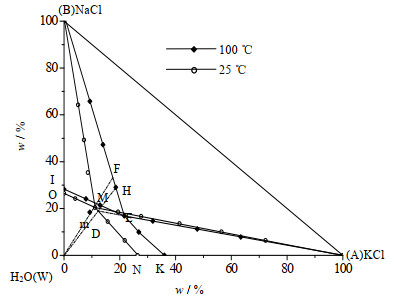
|
图 15 25 ℃、100 ℃时NaCl-KCl-H2O稳定体系相图 Fig.15 Phase diagram of the NaCl-KCl-H2O stable system at 25 ℃ and 100 ℃ |
图 15中的点m为组成点,在相图中点m落在了100 ℃IEKW区域内,表示点m为未饱和点。第1步100 ℃等温蒸发,析出NaCl,系统点由m移动到BE与Wm的交点F上,液相点为E,共饱点E同时落在了25 ℃ KCl结晶区内,第2步将点E降温到25 ℃,此时E点为系统点,析出KCl,液相点为点D。由图中可以看出这对于100 ℃ NaCl-KCl-H2O三元体系相图来说,D点为未饱和点,第3步100 ℃等温蒸发,析出NaCl,系统点由点D移动到点BE与WD的交点H上,液相点为点E。第4部多次重复2,3步,直到将NaCl和KCl完全分开为止。表 9为对应的相图工艺计算。
|
|
表 9 NaCl-KCl-H2O三元相图生产工艺流程计算 Table 9 Process calculation of the NaCl-KCl-H2O Ternary system |
苦卤综合利用制备碱式硫酸镁和分离钾、钠盐的工艺流程如图 16所示。该工艺实现了苦卤资源的全部高效利用,不产生废液和废渣,碱式碳酸镁附加值高,具有绿色环保和经济效益良好的优势。
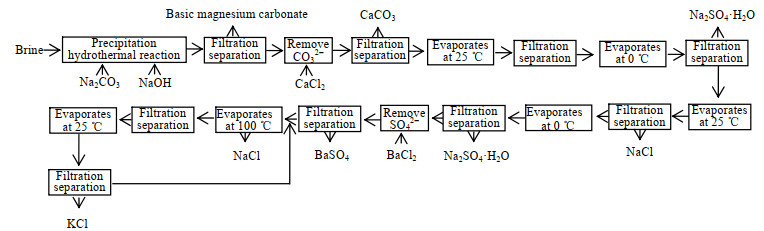
|
图 16 苦卤循环利用的工艺流程 Fig.16 Process flowchart of bitter brine recycling |
(1) 苦卤与纯碱反应不能全部将其中的镁离子转为碱式碳酸镁,反应后母液中含有碳酸根和碳酸氢根,不利于后续母液分离加工。该反应的适宜条件:Mg2+与CO32-摩尔比为1:1.2,反应温度80 ℃,反应时间3.5 h,生成直径10~30 μm的球型碱式碳酸镁晶体。此时Mg2+转化率为98%,CO32-转化率为77%。
(2) 苦卤与碳酸钠和氢氧化钠混合碱反应能实现镁离子全部转化为碱式碳酸镁,而且母液中不产生碳酸氢离子,该反应的适宜条件:Mg2+:CO32-:OH-摩尔比为5:4.8:2,反应温度为60 ℃,反应时间为2.5 h,生成直径10~30 μm的球型碱式碳酸镁晶体,CO32-转化率为90%,OH-转化率为100%。
设计了苦卤制备碱式氯化镁后剩余母液加工分离工艺,剩余母液先经氯化钙反应将其中少量碳酸根离子转变为碳酸钙副产品,然后依据K+, Na+//Cl-, SO42- -H2O体系相图指导对母液进行处理。最后,浓缩剩余母液经氯化钡反应将其中少量硫酸根离子转变为硫酸钙副产品后,采用NaCl-KCl-H2O三元相图分离氯化钠和氯化钾。
| [1] |
TAI C Y, TAI C T, MINGHUI CHANG A, et al. Synthesis of magnesium hydroxide and oxide nanoparticles using a spinning disk reactor[J]. Industrial & Engineering Chemistry Research, 2007, 46(17): 5536-5541. |
| [2] |
OHKUBO T, SUZUKI S, MITSUHASHI K, et al. Preparation of petaloid microspheres of basic magnesium carbonate[J]. Langmuir, 2007, 23(11): 5872-5874. DOI:10.1021/la7002782 |
| [3] |
Mi Y, Chen J, SONG Y. Research on the preparation of basic magnesium sulfate whisker with organic acid by hydrothermal method[J]. Inorganic Chemicals Inoustry, 2007(1): 23-24+43. |
| [4] |
SUN B, ZHOU H, AROWO M, et al. Preparation of basic magnesium carbonate by simultaneous absorption of NH3 and CO2 into MgCl2 solution in an RPB[J]. Powder Technology, 2015, 284: 57-62. DOI:10.1016/j.powtec.2015.06.043 |
| [5] |
CHOUDHARY V R, PATASKAR S G, GUNJIKAR V G, et al. Influence of preparation conditions of basic magnesium carbonate on its thermal analysis[J]. Thermochimica Acta, 1994, 232(1): 95-110. DOI:10.1016/0040-6031(94)80049-9 |
| [6] |
MA X, NING G, CHEN B, et al. Self-assembly with varying hydrophobic centers:Synthesis of red blood cell-like basic magnesium carbonate microspheres[J]. Particuology, 2015, 22(5): 145-150. |
| [7] |
张士航. 由制盐母液制取碱式碳酸镁和氧化镁[J]. 山东化工, 2017, 46(15): 23-24+27. ZHANG S H. Preparation of basic magnesium carbonate and magnesium oxide from mother liquor of salt production[J]. Shandong Chemical Industry, 2017, 46(15): 23-24+27. DOI:10.3969/j.issn.1008-021X.2017.15.009 |
| [8] |
吴健松, 梁海群, 黄雪清. 徐闻盐场苦卤制备Mg2(OH)2CO3·3H2O晶须[J]. 人工晶体学报, 2015, 44(6): 1713-1717. WU J S, LIANG H Q, HUANG X Q, et al. Preparation of Mg2(OH)2CO3·3H2O whiskers by bitter brine of Xuwen salt field[J]. Journal of Synthetic Crystals, 2015, 44(6): 1713-1717. DOI:10.3969/j.issn.1000-985X.2015.06.050 |
| [9] |
祁洪波, 杨维强. 轻质透明碱式碳酸镁生产工艺研究[J]. 无机盐工业, 2008, 40(10): 36-38. QI H B, YANG W Q. Production process of light transparent basic magnesium carbonate[J]. Inorganic Chemicals Industry, 2008, 40(10): 36-38. DOI:10.3969/j.issn.1006-4990.2008.10.012 |
| [10] |
GUO-HUA H E, CHEN Q R. Effect of bromine production in brine by air blowing method on seasalt production[J]. Journal of Salt & Chemical Industry, 2016. |
| [11] |
袁俊生, 吴举, 邓会宁, 等. 中国海盐苦卤综合利用技术的开发进展[J]. 盐科学与化工, 2006, 35(4): 33-37. YUAN J S, WU J, DENG H N, et al. Development of china sea salt bitter brine comprehensive utilization technology[J]. Salt Science and Chemical Industry, 2006, 35(4): 33-37. DOI:10.3969/j.issn.1673-6850.2006.04.012 |
| [12] |
袁春华, 李海民. 碱式碳酸镁的应用及合成方法[J]. 盐湖研究, 2005, 13(2): 40-44. YUAN C H, LI H M. Application and synthesis method of basic magnesium carbonate[J]. Salt Lake Research, 2005, 13(2): 40-44. DOI:10.3969/j.issn.1008-858X.2005.02.008 |
| [13] |
ZHANG Z P, ZHENG Y J, ZHANG J X, et al. Synthesis and shape evolution of monodisperse basic magnesium carbonate microspheres[J]. Crystal Growth & Design, 2007, 7(2): 337-342. |
| [14] |
杨晨, 宋兴福, 汪瑾, 等. 碱式碳酸镁微球的反应结晶过程[J]. 化工学报, 2013, 64(2): 718-724. YANG C, SONG X F, WANG J, et al. Reaction crystallization process of basic magnesium carbonate microspheres[J]. CIESC Journal, 2013, 64(2): 718-724. DOI:10.3969/j.issn.0438-1157.2013.02.042 |
| [15] |
STEPHEN H, STEPHEN T. Solubilities of inorganic and organic compounds[M]. Oxford: Pergamon Press, 1963.
|




