溶菌酶是从动植物组织或分泌物中分离的蛋白质,具有抑菌、消炎、抗病毒和抗肿瘤等多种作用,因而在食品、医药和畜牧养殖中应用广泛[1~3]。其耐热性强,偏酸性条件下稳定,但在碱性环境中易破坏[4],不适合口服给药。同时作为外源蛋白,进入人体后易引起免疫反应[5],因此需要研制一种稳定和组织相容性好的制剂。
采用纳米包覆可以提高药物稳定性、组织相容性和被动靶向性,但不能实现主动靶向释放[6, 7]。pH响应、酶响应、热响应制剂虽然有一定作用,但不能进行体外调控[8]。只有光响应制剂具备体外调控的优势。目前采用的光响应材料系偶氮苯类化合物,它们在光照下可发生结构翻转,从而改变材料的通透性[9]。但是偶氮苯类响应材料需要在紫外光照射下才发生结构变化[10],由于紫外光对人体有害,不适合人体使用。
脱镁叶绿酸,属于叶绿素的降解产物,低毒且具有较强的光敏性,其激发光为红光(650 nm)[11]。脱镁叶绿酸在红光照射下可产生单线态氧,而单线态氧活性高,可以利用来破坏纳米囊的完整性,以促进药物释放[12]。由于红光对人体无害,且穿透力较强。因此本文计划以脱镁叶绿酸作为光敏剂构建一种红光响应的溶菌酶纳米囊制剂。
本研究用组织相容性好的高分子材料聚乳酸-羟基乙酸共聚物(PLGA)制备包载溶菌酶的纳米囊,提高其在碱性环境中的稳定性,并结合脱镁叶绿酸光敏剂的作用,实现红光调控溶菌酶的靶向释放。
2 材料和方法 2.1 试剂和仪器PLGA (分子量20000 Da)购自济南岱罡生物工程有限公司;脱镁叶绿酸(本实验室自制,由中药蚕砂中获取[13]);溶菌酶(分子量14000 Da)购自武汉江民华泰医药化工有限公司;其他试剂为分析纯,购自东营汇宝化工有限公司。
UV-2450紫外可见分光光度计(日本日立有限公司);650 nm红外点状激光器(50~100 mW)(东莞市三鼎光电技术有限公司);Nano ZS马尔文粒度仪(马尔文仪器公司, 英国);XSP-63XD荧光显微镜(上海光学仪器一厂)。
2.2 光响应纳米囊的制备采用复乳法制备光响应纳米囊[14]。分别称取溶菌酶5、7.5、10、12.5、15 mg溶于0.2 mL 5%(wt)的PEG2000水溶液中,作为内水相;分别称取PLGA 20、30、40、50、60 mg和脱镁叶绿酸0.5、1、1.5、2、3 mg,超声溶解于2 mL二氯甲烷/丙酮混合溶剂(V/V =1:1) 为油相;在10000 r·min-1搅拌下,将内水相滴加到油相中混合形成初乳,再将初乳滴加到20 mL 0.5%(wt) PVA水溶液(外水相)形成复乳。再加入60 mL 0.1%(wt) PVA水溶液(分散相),置入透析袋(截留分子量18000 Da)中透析8 h后冷冻干燥。
2.3 正交设计优化囊材配比以纳米囊包封率为指标,对PLGA、溶菌酶和脱镁叶绿酸用量进行优化。采用L9(34)正交设计表,各因素设置为3个水平,分别为因素A(PLGA用量:45、50、55 mg)、因素B(溶菌酶用量:9、10、11 mg)和因素C(脱镁叶绿酸用量:0.8、1、1.2 mg)。按照2.2节方法制备纳米囊,测定其包封率。
2.4 光响应纳米囊的表征 2.4.1 粒径和电位测定取5 mg PLGA纳米囊,用2 mL 0.9%(wt) NaCl水溶液分散。用马尔文纳米粒度仪测定各纳米囊的粒径和电位,折光系数为1.33[15],每个样品重复测定3次。
2.4.2 包封率和载药量测定溶菌酶的含量采用Bradford法测定其蛋白含量[16]。称取纳米囊50 mg,用1 mL二氯甲烷震荡破乳,再用0.9%(wt) NaCl水溶液分3次提取药物,每次2~3 mL,合并水层溶液,定容至10 mL。根据Bradford法测定包封药物总量,计算药物的包封率和载药量[17]。
| $包封率 = {W_{\rm{i}}}/{W_{\rm{o}}} \times 100\% $ | (1) |
式中,Wo为加入药物总量,Wi为实测的包封药物总量。
载药量的计算公式如下:
| $载药量 = {W_{\rm{i}}}/{W_{\rm{a}}} \times 100\% $ | (2) |
式中,Wi为包封药物总量,Wa为纳米囊的总重量。
2.4.3 形态观察取5 mg PLGA纳米囊,用1 mL乙醇分散,取适量滴于载玻片上,待乙醇挥发,用荧光显微镜观察形貌。
2.4.4 差示扫描量热分析取100 mg PLGA纳米囊进行差示量热扫描,参数设置为:升温速率5℃·min-1,升温范围30~180℃,载气N2,流速100 mL·min-1。
2.5 累积释药量测定参照文献方法[17],取PLGA纳米囊50 mg,用0.1 mol·L-1 pH 8.0磷酸缓冲液稀释到10 mL,在100 r·min-1 37℃恒温水浴槽中,分别进行不光照、650 nm (50 mW)光照15 min和30 min,每隔12 h取0.5 mL用Bradford法测定溶菌酶含量,并补加0.5 mL pH 7.4磷酸缓冲液,持续3 d。计算累积释药量。
2.6 单线态氧含量测定利用9, 10-二苯基蒽(DPA)对单线态氧的捕获后引起吸光值的变化对单线态氧含量进行间接测定[18]。取10 mL 0.5 mg·mL-1脱镁叶绿酸乙醇溶液2份,其中一份加入5 mL 5%(wt) PLGA乙醇溶液,分别与5 mL 2×10-5 mol·L-1 DPA乙醇溶液混合均匀,650 nm (50 mW)光照5、10、15、20、30、40、50、60 min,测定355 nm处的吸光值,比较光照后与无光照的吸光度值差异(ΔA)。
3 结果和讨论 3.1 纳米囊材配比的优化PLGA属于生物可降解的高分子材料,具有良好的组织相容性、无毒无残留及化学稳定性高等特点[19]。根据分子量的不同,在体内降解的时间为1~2月。用于缓释制剂的囊材,可以提高生物药物的稳定性。
以纳米囊的包封率、载药量和粒径为指标,采用单因素法优化PLGA、溶菌酶及光敏剂脱镁叶绿酸用量。分别固定PLGA 50 mg、溶菌酶10 mg和脱镁叶绿酸1 mg中的2个变量,考察另一个变量,其结果见图 1。
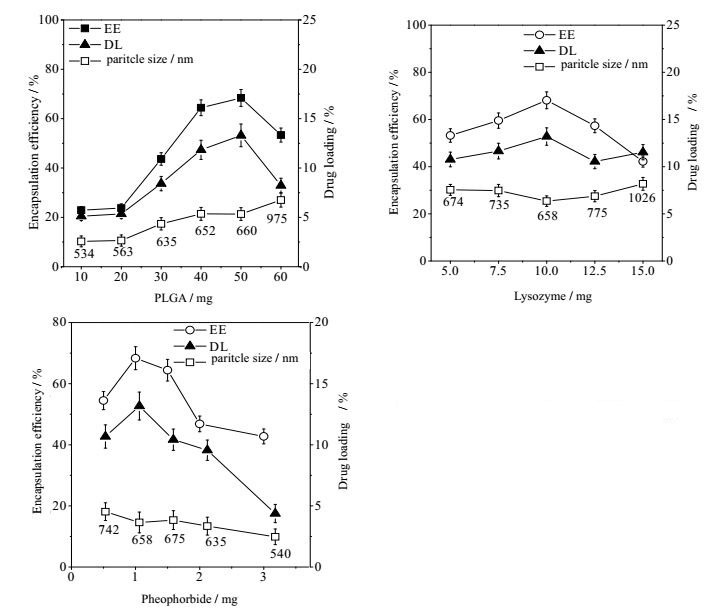
|
图 1 PLGA、溶菌酶、脱镁叶绿酸用量对纳米囊包封率、载药量和粒径的影响 Fig.1 Effects of PLGA, lysozyme and pheophorbide contents on encapsulation efficiency, drug loading and particle size (x±s, n = 3) |
随PLGA用量增大,包封率、载药量和粒径逐渐增大,但在高于50 mg用量时,包封率和载药量开始下降,而粒径继续增加。说明PLGA用量过多,导致团聚,致使粒径过大,成囊性降低。随着溶菌酶添加量的增加,包封率和载药量缓慢增加,但在10 mg以后开始下降,粒径增大,表明纳米囊对药物的承载有限,药物过多没有包覆反而相互团聚。脱镁叶绿酸在1 mg以上,包封率和载药量下降明显,但粒径也有所减小。说明脱镁叶绿酸用量加大,可导致囊的破裂。为了得到更佳的制备条件,以单因素实验结果为依据,采用了正交试验对配方进一步优化,其结果见表 1和表 2。
| 表 1 正交试验设计与结果 Table 1 Design and results of the orthogonal experiment |
| 表 2 方差分析表 Table 2 Analysis of variance |
PLGA用量对纳米囊包封率影响较大,达到显著水平(p<0.05),最优水平组合为A3B2C2。以优化的PLGA、溶菌酶及光敏剂脱镁叶绿酸用量配比(55:10:1) 放大制备3批样品,得到132 g、135 g、130 g纳米囊。测得其包封率为81.3%±4.5%,载药量为13.1%±1.6%。由于溶菌酶为蛋白质,一般制备的蛋白纳米粒的载药量较低为5%左右[20],而采用本方法可同时获得较高的载药量和包封率。制备过程虽然采用了有机溶剂,但该溶剂用量少且易挥发,通过干燥后已除去,不会导致残留。
3.2 纳米囊的形态和粒径将纳米囊分散在载玻片上,用荧光显微镜下观察,结果见图 2。在自然光下观察,其形态为圆形(图 2(a)),呈明显的囊状,囊心不透光为溶菌酶,囊壁呈白色半透明状,为PLGA。将纳米囊放大后,改用荧光观察(图 2(b)),可见囊壁有明显的红色荧光,内部荧光弱,表明光敏剂脱镁叶绿酸主要分布在囊壁层。纳米囊粒径分布范围450~900 nm (图 3),平均粒径为(667±35) nm,电位(-39.6±4.6) mV。其电位呈负值,表明该条件下制备的纳米囊具有较好的分散性和一致性。虽然平均粒径较大,但仍小于1 µm,易被细胞和组织吸收发挥作用。该尺寸的粒子一般可被肝脾巨噬细胞吞噬,但可以通过病变部位注射给药或粘膜给药方式,避开肝脏的首过效应,直接在病变部位发挥作用。

|
图 2 光响应溶菌酶PLGA纳米囊的荧光显微照片 Fig.2 Fluorescence microscopic images of photo responsive PLGA nanocapsules containing lysozyme |
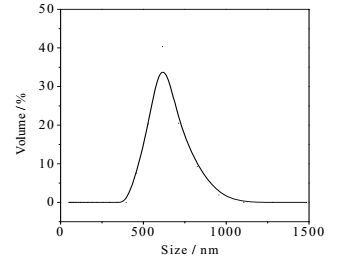
|
图 3 溶菌酶纳米囊的粒径分布 Fig.3 Size distribution of lysozyme nanocapsules |
纳米囊的差示扫描量热结果见图 4,热流速变化曲线在45~50℃有明显的拐点,表明PLGA在该温度下可发生相变。但由于人体温度在37℃左右,此温度下纳米囊没有显著变化,因此体内稳定性较好。空囊的热流速相比于其他均有显著的提高,说明空囊内外相区分明显,结合不紧密;但加入溶菌酶和脱镁叶绿酸后,其热流速明显降低,表明后两者与PLGA结合紧密,有助于纳米囊的稳定。
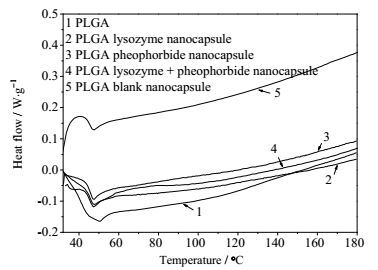
|
图 4 PLGA纳米囊差示扫描量热曲线 Fig.4 DSC curves of PLGA nanocapsules |
光响应PLGA纳米囊在光照前后,其释药速率有明显差异,结果见图 5。未光照时,12 h的释药量不到20%,3d的累计释药量为55%,而光照后释药速度明显加快,且随光照时间延长而增大,光照30 min,3d的累计释药量可达80%以上,表明光响应PLGA纳米囊具有光控释药性能。
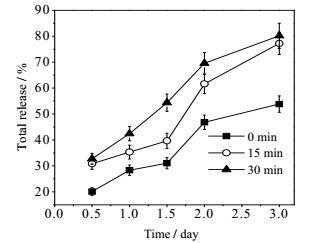
|
图 5 不同光照时间PLGA纳米囊的累积释放曲线 Fig.5 Cumulative release curves of PLGA nanocapsules at different illumination times (x±s, n = 3) |
脱镁叶绿酸在光照下可产生单线态氧,ΔA反映了单线态氧捕获剂DPA作用的单线态氧量。图 6显示脱镁叶绿酸的ΔA随光照时间增加而增大,在30 min时达到稳态,表明30 min为合适的光照时间。而加入PLGA后单线态氧大幅下降,表明脱镁叶绿酸产生的单线态氧与PLGA发生了作用而消耗。由此可见在该纳米囊制剂中,因光照产生的单线态氧被PLGA阻挡,不会引起溶菌酶的变性。
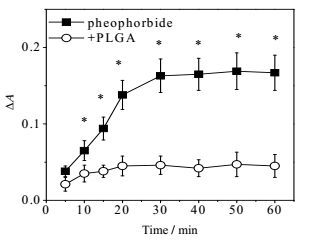
|
图 6 不同光照时间脱镁叶绿酸及添加PLGA后单线态氧产量 Fig.6 Yields of singlet oxygen produced by pheophorbide and pheophorbide+PLGA at different illuminating times (x±s, n = 3) |
光敏剂促进释药的机理与其在光照下产生单线态氧相关[21]。其机制可以用图 7表示。当650 nm激光照射纳米囊时,激活脱镁叶绿酸产生单线态氧,由于其活性强,作用于邻近的PLGA分子中的羟基,使相邻PLGA分子作用键裂开,膜层出现缝隙而致内在药物释放。
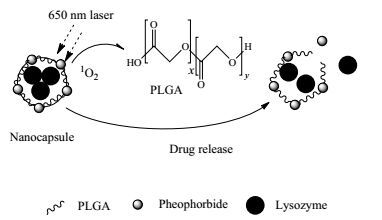
|
图 7 红光作用光响应PLGA纳米囊的释药机制 Fig.7 Mechanism of drug release of photo responsive PLGA nanocapsules triggered by red light |
以PLGA为成囊材料,同时添加光敏剂脱镁叶绿酸,通过条件优化,制备出包封率和载药量较高、粒径在纳米尺度的光响应溶菌酶纳米囊。该制剂可望成为新型靶向控释药物用于体内抗菌、抗病毒、抗肿瘤等方面的治疗。
(1) 优化的工艺条件为:PLGA用量:溶菌酶添加量:光敏剂脱镁叶绿酸添加量为55:10:1。获得纳米囊的包封率为81.3%±4.5%,载药量为13.1%±1.6%,平均粒径为(667±35) nm,电位(-39.6±4.6) mV。
(2) 该纳米囊呈球形,包被良好,光敏剂处于囊壳层,光敏剂和溶菌酶与PLGA结合紧密,稳定性较好。
(3) 该纳米囊在不光照时可起到缓释和增强药物稳定性作用,而在红光照射下可促进药物释放,从而可达到红光靶向释药的效果。
| [1] | Aminlari L, Hashemi M M, Aminlari M. Modified lysozymes as novel broad spectrum natural antimicrobial agents in foods[J]. Journal of Food Sciences , 2014, 79(6): R1077-R1077. DOI:10.1111/jfds.2014.79.issue-6. |
| [2] | Rubio C A. The natural antimicrobial enzyme lysozyme is up-regulated in gastrointestinal inflammatory conditions[J]. Pathogens , 2014, 3(1): 73-92. DOI:10.3390/pathogens3010073. |
| [3] | Oliver W T, Wells J E. Lysozyme as an alternative to growth promoting antibiotics in swine production[J]. Journal of Animal Science and Biotechnology , 2015, 6(1): 35. DOI:10.1186/s40104-015-0034-z. |
| [4] | Wu H, Cao D, Liu T, et al. Purification and characterization of recombinant human lysozyme from eggs of transgenic chickens[J]. PLoS One , 2015, 10(12): e0146032. DOI:10.1371/journal.pone.0146032. |
| [5] | Infante S, López-Matas M Á, Carnés J, et al. Allergy reaction mediated by Gal d 4(lysozyme) after the induction of tolerance with egg[J]. Annals of Allergy, Asthma & Immunology , 2014, 113(4): 491-492. |
| [6] | Gaudana R, Gokulgandhi M, Khurana V, et al. Design and evaluation of a novel nanoparticulate-based formulation encapsulating a HIP complex of lysozyme[J]. Pharmaceutical Development and Technology , 2013, 18(3): 752-759. DOI:10.3109/10837450.2012.737806. |
| [7] | Siafaka PI, Üstündağ Okur N, Karavas E, et al. Surface modified multifunctional and stimuli responsive nanoparticles for drug targeting:current status and uses[J]. International Journal of Molecular Sciences , 2016, 17(9): E1440. DOI:10.3390/ijms17091440. |
| [8] | Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nature Materals , 2013, 12(11): 991-1003. DOI:10.1038/nmat3776. |
| [9] | Lau Y A, Henderson B L, Lu J, et al. Continuous spectroscopic measurements of photo-stimulated release of molecules by nanomachines in a single living cell[J]. Nanoscale , 2012, 4(11): 3482-3489. DOI:10.1039/c2nr30524k. |
| [10] | Yang Y, Yang Y, Xie X, et al. Preparation and characterization of photo-responsive cell-penetrating peptide-mediated nanostructured lipid carrier[J]. Journal of Drug Targeting , 2014, 22(10): 891-900. DOI:10.3109/1061186X.2014.940589. |
| [11] | GAO He-gang(高何刚), YE Yong(叶勇), HU Ai-xi(胡艾希). Studies on fluorescence properties of pheophorbide A(脱镁叶绿酸A的荧光特性研究)[J]. Chinese Journal of New Drugs(中国新药杂志) , 2007, 16(23): 1965-1967. DOI:10.3321/j.issn:1003-3734.2007.23.014. |
| [12] | Ye Y, Li Y, Fang F. Opening of brain blood barrier induced by red light and central analgesic improvement of cobra neurotoxin[J]. Journal of Photochemistry and Photobiology:B-Biology , 2014(134): 16-22. |
| [13] | YE Yong(叶勇), ZHANG Yong-bo(张永波), ZHU Quan-hong(朱全红). Separation of phaeophorbide and preparation of its conjugation to Naproxe(脱镁叶绿酸的分离及与萘普生交联物的制备)[J]. Lishizhen Medicine and Materia Medica Research(时珍国医国药) , 2009, 20(4): 939-940. |
| [14] | ZHAO Xin-yi(赵心怡), SHEN Qi(沈琦), LI Ming-li(李明丽), et al. Preparation of saussurea nanoparticles by a double emulsion method(复乳法制备雪莲纳米粒的研究)[J]. Lishizhen Medicine and Materia Medica Research(时珍国医国药) , 2010, 21(7): 1726-1727. |
| [15] | Ye Y, Li Y, Fang F. Upconversion nanoparticles conjugated with curcumin as a photosensitizer to inhibit methicillin-resistant Staphylococcus aureus in lung under near infrared light[J]. International Journal of Nanomedicine , 2014, 9: 5157-5165. |
| [16] | Bourseau-Guilmain E, Béjaud J, Griveau A, et al. Development and characterization of immuno-nanocarriers targeting the cancer stem cell marker AC133[J]. International Journal of Pharmacy , 2012, 423(1): 93-101. DOI:10.1016/j.ijpharm.2011.06.001. |
| [17] | Zhang J, Tao W, Chen Y, et al. Doxorubicin-loaded star-shaped copolymer PLGA-vitamin E TPGS nanoparticles for lung cancer therapy[J]. Journal of Materials Science:Material in Medicine , 2015, 26(4): 165. DOI:10.1007/s10856-015-5498-z. |
| [18] | Cui S, Chen H, Zhu H, et al. Amphiphilic chitosan modified upconversion nanoparticles for in vivo photodynamic therapy induced by near-infrared light[J]. Journal of Materials Chemistry , 2012, 22(11): 4861-4867. DOI:10.1039/c2jm16112e. |
| [19] | Han F Y, Thurecht K J, Whittaker A K, et al. Bioerodable PLGA-based microparticles for producing sustained-release drug formulations and strategies for improving drug loading[J]. Frontiers in Pharmacology , 2016, 7: 185. |
| [20] | LIANG Huan(梁欢), WANG Qian(王倩), WANG Kang(王康), et al. Preparation of PLGA-calcium phosphate complex drug loading nanoparticles(PLGA-磷酸钙复合载药纳米粒的制备)[J]. Journal of Polymer Science(高分子学报) , 2016(10): 1383-1389. |
| [21] | Ye Y, Xing H, Li Y. Nanoencapsulation of the sasanquasaponin from Camellia oleifera, its photo responsiveness and neuroprotective effects[J]. International Journal of Nanomedicine , 2014, 9: 4475-4484. |




