2. 昆明理工大学 云南省高校磷化工重点实验室,云南 昆明 650500
2. The Higher Educational Key Laboratory for Phosphorous Chemical Engineering of Yunnan Province, Kunming University of Science and Technology, Kunming 650500, China
磷酸作为一种重要的化工原料,广泛应用于农业、食品、医药等行业[1, 2]。现阶段磷酸的主要生产方法有湿法和热法两种,湿法磷酸生产成本较低,但对磷矿品味要求过高,且磷酸纯度低,只能用于磷肥的生产,无法满足高品质磷酸的需要[3];热法磷酸生产磷酸品质高,但能耗高,经济性差[4, 5];而窑法磷酸生产对磷矿品味要求低、耗能少、成本低,是一种具有广阔前景的高品质磷酸的生产方法[6~8],但其存在窑内结圈、炭损耗高和磷转化率低等问题[8]致使其不能连续化生产。因此,开发能降低磷矿碳热反应温度,提高磷矿碳热反应速率的外加剂,是解决目前窑法磷酸面临困境的一种新思路。
国内外学者对窑法磷酸生产进行了深入的研究,但大多集中在尾气的处理、窑体设计以及助熔剂的选择等方面。例如,宁平等[9, 10]利用活性炭吸附窑法磷酸生产过程产生的PH3和H2S等气体;Megy等[11]提出将窑体原料粒度降低,可以降低所需的床层温度,降低反应温度;Jaocb等[12~14]研究窑法磷酸生产过程,提出SiO2比Al2O3的助熔效果更佳,且渣相同样适合水泥的生产;Jiang等[15]在标况下对窑法磷酸生产进行热力学计算,提出SiO2的存在可以大幅降低磷矿反应温度;Geng等[16]对比了钾长石和硅石的助熔效果,提出钾长石的起始反应温度低于硅石,可以达到节能的目的。而关于提高磷矿碳热还原反应物活性,实现相对低温下达到高转化率的研究还未见报道。
K2CO3和Na2CO3作为一种碱金属催化剂广泛应用于煤气化、冶金等多个领域[17]。例如,Ma等[18]研究水煤气变换得出掺杂K2CO3的催化活性远大于掺杂KOH和KOAc;Kopyscinski等[19]人研究发现在750℃时,与20%(wt) K2CO3水溶液混合的无灰煤的气化速度分别比不含催化剂的原煤和无灰煤快3~60倍,催化剂用量从无灰煤质量的20%提高到45%时,气化率提高了3倍;Bai等[20]研究发现加入Na2CO3可以促进焦炭气化,进而加速菱铁矿的还原。K2CO3和Na2CO3作为催化剂在提高煤炭活性方面具有显著效果。
综上所述,本研究拟通过添加碱金属碳酸盐来提高炭活性,借用XRD、SEM方法研究磷矿的碳热还原机理,结合动力学分析添加物与动力学特征参数的关联性,为窑法磷酸生产提供理论依据。
2 实验部分 2.1 实验原料实验采用分析纯磷酸钙、分析纯K2CO3、分析纯Na2CO3,高纯石墨C(C > 99.98%),无定形碳C(A)(无烟煤)。为消除无烟煤中灰分对实验研究的影响,无烟煤经混酸脱灰分后过滤、洗涤、干燥后备用。实验所用磷矿、硅石均产自云南某地,经分析,磷矿其主要矿物成分为Ca5(PO4)3F,其次是SiO2,并含有少量的Ca、Mg碳酸盐等杂质,其化学组成根据标准GB/T 1871.1-1995进行分析,结果如表 1所示。焦炭取自云南富源焦化厂,其工业分析采用HKGF-3000工业分析仪分析,如表 2所示。
|
|
表 1 原料化学成分 Table 1 Chemical compositions of raw materials |
|
|
表 2 焦炭和无烟煤工业分析 Table 2 Industrial analysis of coke and anthracite |
根据实验要求,先将碱金属碳酸盐溶于水后加入焦炭中,搅拌均匀并保持糊状,干燥后与磷矿石、硅石按比例混合均匀后制成球,再次干燥后待用。将TCGC-1700管式炉中按程序进行升温,并通入氩气作保护气体,当温度升至指定温度并恒温30 min后,取适量球状物于石墨坩埚中,分两次推至恒温区,待反应结束后,取出坩埚放入于干燥器中冷却至室温,残渣经计量后研磨过180目筛筛余量小于5%,用于分析表征。
2.3 分析方法采用GB/T 1871.1-1995中磷钼酸喹啉重量法分析残渣中P2O5的含量,磷转化率按式(1)计算:
| $ X = \frac{{{M_0}{w_0} - {M_1}{w_1}}}{{{M_0}{w_0}}} $ | (1) |
其中M0、M1分别为反应前后球团的质量,w0、w1分别为反应前后球团中P2O5的质量分数。
3 实验结果与讨论 3.1 炭活性与Ca3(PO4)2还原反应研究炭的结构、相组成与反应性密切相关[19],结合邱礼有等[20]提出Ca5(PO4)3F首先脱氟生成Ca3(PO4)2和SiF4(g),然后Ca3(PO4)2与炭发生还原反应的作用机理,故本实验通过热力学分析和实验证明Ca3(PO4)2与炭的反应性。
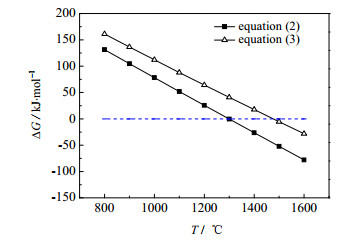
3.1.1 Ca3(PO4)2与C、C(A)体系热力学分析采用HSC Chemistry 5.0软件分别计算Ca3(PO4)2和C、C(A)反应的吉布斯自由能(ΔG)随温度(T)的变化关系,结果如图 1所示。
| $ {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 5C}}\left( {\rm{A}} \right){\rm{ = 3CaO + }}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 5CO}}\left( {\rm{g}} \right) $ | (2) |
| $ {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 5C = 3CaO + }}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 5CO}}\left( {\rm{g}} \right) $ | (3) |
|
图 1 吉布斯自由能变与温度的关系 Fig.1 Profiles of ΔG as a function of temperature |
由图 1可知,石墨和磷酸钙在1477℃以上才能反应,而无定形碳和磷酸钙在1300℃就可以反应,相差177℃,由此可知石墨和无定形碳的反应活性不同,进而影响氟磷灰石碳热还原反应的发生。因此,提高炭反应活性,促进反应进行,是解决窑法磷酸碳热还原反应磷转化率低的重要途径。
3.1.2 Ca3(PO4)2与C、C(A)碳热反应实验研究在碳过量系数为1.05,反应时间30 min的条件下,分别针对Ca3(PO4)2与C、C(A)两个体系在1250~1400℃下研究其磷转化率与温度的关系,结果如图 2所示。

|
图 2 温度对磷转化率的影响 Fig.2 Effects of temperature on P2O5 conversion |
由图 2可知,在整个温度区间内,磷酸钙与石墨的转化率均接近零,即无反应发生,与热力学计算结果基本一致,而磷酸钙与无烟煤体系中,在1300℃时磷酸钙和无烟煤反应的转化率达到10.75%且随着温度的升高急剧增大,与热力学计算结果相符合。通过热力学计算和实验证明,石墨和无烟煤活性不同,达到磷酸钙碳热还原反应的温度也不同,故添加外加剂提高炭活性,降低反应活化能,降低体系反应温度,进而实现窑法磷酸的可持续化生产。
3.2 添加物对焦炭活性的影响根据SiO2-CaO二元体系相图[21]可知,二者在1436℃左右形成低共融体,由于实际矿物中存在Al2O3、MgO等多种杂质,会降低共融温度[22],因此,窑法磷酸生产温度通常控制在1300℃左右[23, 24],酸度值M[(SiO2+Al2O3)/(CaO+MgO)]一般控制在0.85~0.95,焦炭的过剩系数为1.05~1.10 [25]。本实验拟在温度1300℃,反应时间50 min,碳过量系数δ = 1.05,酸度值M = 1.02的情况下,分别添加焦炭量0.5%~2.0%的K2CO3、Na2CO3,以磷转化率为指标,结果如图 3所示。

|
图 3 添加量对磷转化率的影响 Fig.3 Effects of alkali metal amount on P2O5 conversion |
由图 3可知,具有添加物的体系,磷转化率明显升高。无添加体系其转化率为46.7%,添加量为2.0%时,K2CO3和Na2CO3体系的磷转化率分别为64.45%、59.69%,增幅分别为38.01%、27.82%。由此可知,添加K2CO3和Na2CO3可以明显增加炭活性,提升磷转化率。但添加量在0~1.5%之间变化较大,K2CO3和Na2CO3体系增幅分别为37.52%、26.63%。相比1.5%,添加量为2%时,K2CO3和Na2CO3体系磷转化率仅增长0.23%、0.55%,增加其添加量对磷转化率的影响并不显著。所以,综合考虑后续试验中选取掺杂量为1.5%。
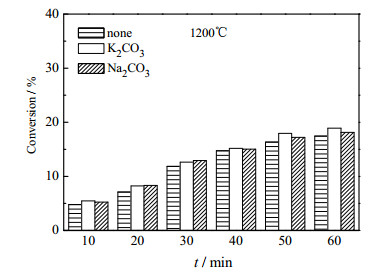
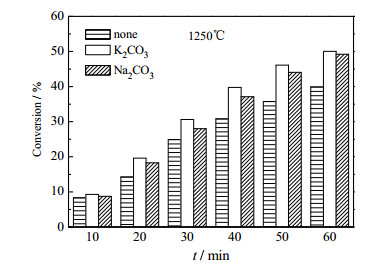
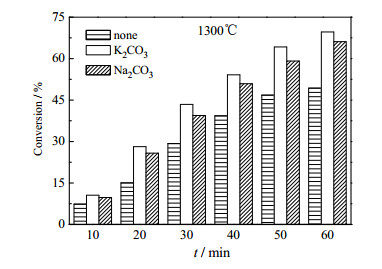
4 碳热还原反应动力学过程研究根据以上实验结果,在碳过量系数δ = 1.05,酸度值M = 1.03,碱金属添加量为1.5%的条件下研究了无添加体系和分别添加K2CO3,Na2CO3的体系在1200、1250、1300和1350℃下磷转化率随时间的变化关系,分别如图 4、5、6、7所示。
|
图 4 1200℃时转化率与时间的关系 Fig.4 Effects of time on P2O5 conversion at 1200℃ |
|
图 5 1250℃时转化率与时间的关系 Fig.5 Effects of time on P2O5 conversion at 1250℃ |
|
图 6 1300℃时转化率与时间的关系 Fig.6 Effects of time on P2O5 conversion at 1300℃ |
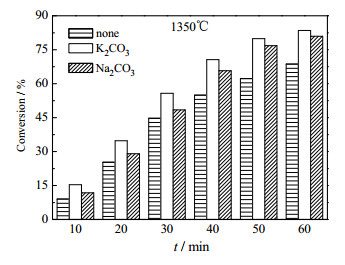
|
图 7 1350℃时转化率与时间的关系 Fig.7 Effects of time on P2O5 conversion at 1350℃ |
如图所示,在1200℃时,不论何种体系,磷转化率均较低,无添加体系10 min时仅为4.8%,且随着时间的增长,磷转化率增幅不明显,60 min时仅17.45%。添加K2CO3和Na2CO3的效果也并不明显,这是由于磷矿的碳热还原反应是一个强吸热反应,受温度影响较为显著,温度增加时磷转化率逐渐增大,添加K2CO3和Na2CO3的效果也逐步显现。
由于1200℃时反应发生较难,磷转化率低,添加剂效果不明显。故选择在1250、1300和1350℃下研究其反应动力学。众多学者均提出磷矿的碳热还原反应为一级反应[26~28],所以拟计算ln[1/(1-X)]与时间的关系,分析结果如表 3所示。
|
|
表 3 不同温度下反应速率常数k与相关系数R2 Table 3 Reaction rate constant k and R2 at different temperatures |
由表 3可知,在同一温度下
由Arrhenius公式可求出其反应的活化能。
| $ k = A\text{exp} ( - \frac{E}{{RT}}) $ | (4) |
| $ \text{ln} k = \text{ln} A - \frac{E}{{RT}} $ | (5) |
其中:A为指前因子,min-1;E为活化能,kJ·mol-1;R为摩尔气体常数,kJ·mol-1·K-1;T为温度,K。
一般认为活化能E为常数,所以lnk与1/T呈线性关系。根据表 3数据作图,见图 8。其拟合结果见表 4。
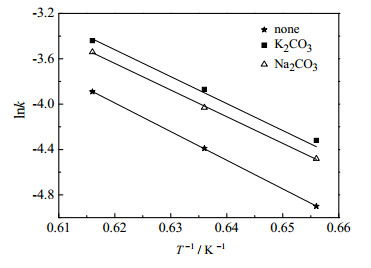
|
图 8 lnk与1/T的关系 Fig.8 Relationship between lnk and 1/T |
|
|
表 4 线性拟合结果 Table 4 Linear fitting results |
由表 4可知,
在扫描电压36 kV,电流40 mA,扫描步长为2°·min-1,利用D/max-3B型X射线衍射仪对渣相进行检测。对不同温度下、60 min时三种体系渣相进行XRD分析,结果如图 9、10、11所示。
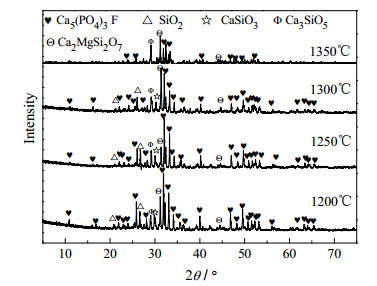
|
图 9 不同温度下磷矿-焦炭-硅石体系渣相XRD Fig.9 XRD patterns of phosphate rock-coke-silica slag at different temperatures |
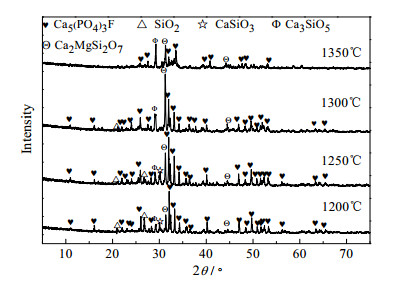
|
图 10 不同温度下磷矿-焦炭(K2CO3)-硅石体系渣相XRD Fig.10 XRD patterns of phosphate rock-coke(K2CO3)-silica slag at different temperatures |
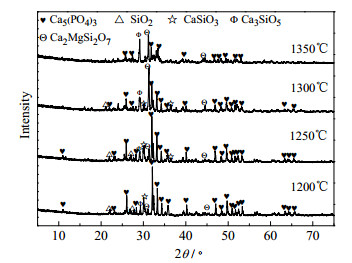
|
图 11 不同温度下磷矿-焦炭(Na2CO3)-硅石体系渣相XRD Fig.11 XRD patterns of phosphate rock-coke(Na2CO3)-silica slag at different temperatures |
由图 9可知,磷矿-焦炭-硅石体系的渣相中主要是Ca5(PO4)3F和SiO2,还有少量的CaSiO3和Ca3SiO5,而体系中并未出现CaF2,说明氟主要以SiF4(g)的形式排出。由于体系中含有少量的MgO,而热力学上CaO、SiO2和MgO极易结合生成镁黄长石(Ca2MgSi2O7),故体系中出现了少量Ca2MgSi2O7。根据李茜等[28],江礼平等[29]提出的氟磷灰石固态还原反应过程及Jacob等[12]提出的磷酸钙碳热还原机理:
| $ {\rm{2C}}{{\rm{a}}_{{\rm{10}}}}{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)6}}{{\rm{F}}_{\rm{2}}}{\rm{ + 3Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 6C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 2CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right) $ | (6) |
| $ {\rm{2C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 10C = 6CaO + 10CO}}\left( {\rm{g}} \right){\rm{ + }}{{\rm{P}}_{\rm{4}}}\left( {\rm{g}} \right) $ | (7) |
| $ n{\rm{CaO}} + m{\rm{Si}}{{\rm{O}}_2} = {\rm{C}}{{\rm{a}}_n}{\rm{S}}{{\rm{i}}_m}{{\rm{O}}_n}_{ + 2m} $ | (8) |
可对图 9做以下解释:随着温度的升高,Ca5(PO4)3F和SiO2的特征峰逐渐减弱,主要是由于温度升高导致Ca5(PO4)3F脱氟速率增加,氟磷灰石转变为α-磷酸钙,同时磷酸钙被碳还原生成CaO并与SiO2结合生成硅酸盐;由于体系硅钙摩尔比小于1,体系中CaO富足,其与CaSiO3进一步反应,生成Ca3SiO5,故随温度升高,XRD图谱中CaSiO3的特征峰减弱而Ca3SiO5的特征峰增强,直至1350℃时,CaSiO3的特征峰几乎全部消失。1350℃时体系的衍射峰强度较低温时弱,一是此时反应速度加快,Ca5(PO4)3F还原反应较彻底,二是1350℃时,体系中形成低共熔物,这是SiO2消失,其它峰减弱的主要原因;体系中MgO与SiO2、CaO生成Ca2MgSi2O7复盐,而Ca2MgSi2O7的特征峰在实验温度下均稳定存在,由此可知,体系中MgO的存在,间接的增加了体系的碱度,消耗体系的SiO2,因此,MgO的存在不利于磷矿的碳热还原,这与结果相一致[27]。
图 10、11对比图 9可知,添加不同的碱金属后,Ca5(PO4)3F和SiO2的衍射峰进一步被弱化,硅酸盐的衍射峰增强,说明碱金属可以促进反应的进行,使更多的Ca5(PO4)3F转化为硅酸盐;但无新物相的生成,说明加入K2CO3和Na2CO3并不改变磷矿碳热还原的反应历程,仅具有类似“催化剂”功能。此外,加入K2CO3的体系,Ca5(PO4)3F的衍射峰弱化的程度相比Na2CO3体系的弱化程度稍大,由此推断K2CO3助反应效果好于Na2CO3,此结论与添加K2CO3、Na2CO3时磷转化率实验结果相吻合。
为了准确分析三种体系1300℃的反应情况,故将其XRD进行对比分析,如图 12所示。从图 12可知,无添加剂和添加Na2CO3体系的仍有明显的CaSiO3特征峰,而添加K2CO3体系的CaSiO3特征峰几乎消失,而Ca3SiO5衍射峰明显增强,说明添加K2CO3体系催化效果最好,能促进更多的磷酸钙还原产生CaO,其与CaSiO3进一步反应生成Ca3SiO5。除此之外,对比图 9、10、11,当温度升至1350℃时,添加碱金属碳酸盐体系的XRD有“鼓泡”现象,说明此时体系有液相产生,反应已从原来的固固反应转变为固-固和液-固反应共存,此温度下物料烧结明显,这也是前述实验选择1300℃作为反应温度的重要因素。

|
图 12 1300℃下,三种体系的渣相XRD Fig.12 XRD patterns of three slag at 1300℃ |
为使磷转化率达到工业要求,电炉法黄磷生产反应物停留时间一般为4 h,现有窑法磷酸工业化生产,物料停留时间也在4 h以上[7]。因此,在1300℃下,分别对上述三个体系延长反应时间至4 h,其实验结果见图 13。从图 13可知,当反应时间达到4 h时,添加K2CO3,Na2CO3的体系磷转化率分别为91.32%,87.24%,而无添加体系仅为66.41%。由此可见,添加碱金属碳酸盐能够大幅度的增加磷转化率,添加K2CO3和Na2CO3的体系磷转化率均在85%以上,满足窑法磷酸磷转化率85%以上的生产要求[7]。
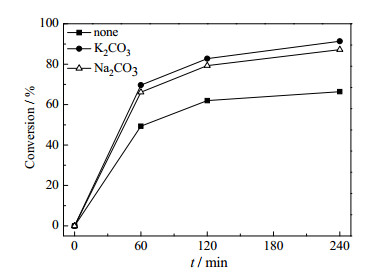
|
图 13 转化率与时间的关系 Fig.13 Effects of time on P2O5 conversion at 1300℃ |
同时,窑法磷酸生产中采用固态排渣,一般情况下,有碱金属参与的高温体系易形成低共融体,不利于窑法磷酸生产,故通过1300℃下4 h的SEM图来判断其是否出现熔融,结果如图 14所示。

|
图 14 1300℃下添加K2CO3 (左)、Na2CO3(中)、无添加(右)体系渣相SEM图 Fig.14 SEM micrographs of slag from K2CO3 system (left), Na2CO3 system (middle) and control system(right) at 1300℃ |
对比图 14可知,1300℃三个体系反应残渣外观一致,呈独立不规则体,单个颗粒相对较密实,即有烧结,而并未熔融,说明添加焦炭量1.5% K2CO3和Na2CO3渣相仍以固态形式存在,不会导致窑内结圈。能满足窑法磷酸生产的要求,这为碱金属添加剂应用于窑法磷酸的生产奠定了基础。
7 结论(1) 通过热力学分析和实验证明可知,在1400℃时,磷酸钙不与石墨反应,但可与无烟煤反应,因此,炭结构不同,活性不同,提高炭活性可以作为解决窑法磷酸磷转化率低的一种途径。
(2) 加入一定量的碱金属可以增强炭的活性,提高磷的转化率,助反应效果K2CO3 > Na2CO3。
(3) 结合XRD分析可知,添加碱金属碳酸盐后,磷矿碳热反应均得到了强化,但添加物不改变磷矿碳反应历程,仅起类似“催化剂”的作用。
(4) 其它条件不变,添加焦炭量1.5%的K2CO3和Na2CO3,其活化能分别为182.91和195.38 kJ·mol-1,与无添加体系209.93 kJ·mol-1相比,分别下降27.02和14.55 kJ·mol-1。
(5) 延长时间至4 h,添加碱金属碳酸盐体系的残渣在1300℃时与无添加剂的外观形貌类似,仅存在烧结而未见熔化现象。
符号说明:
|
|
| [1] | Rashid M, Jahan M, Islam K S. Impact of nitrogen, phosphorus and potassium on brown planthopper and tolerance of its host rice plants[J]. Rice science , 2016, 23(3): 119-131. DOI:10.1016/j.rsci.2016.04.001. |
| [2] | MaL P, Ning P, Zhang Y, et al. Experimental and modeling of fixed-bed reactor for yellow phosphorous tail gas purification over impregnated activated carbon[J]. Chemical Engineering Journal , 2008, 137(3): 471-479. DOI:10.1016/j.cej.2007.04.032. |
| [3] | Kijkowska R, Kowalski Z, Wzorek Z, et al. Tripolyphosphate made from wet-process phosphoric acid with the use of a rotary kiln[J]. Industrial & Engineering Chemistry Research , 2008, 47(18): 6821-6827. |
| [4] | Wang X J, Tang L, Jiang Z. Numerical simulation of venturi ejector reactor in yellow phosphorus purification system[J]. Nuclear Engineering & Design , 2014, 268(3): 18-23. |
| [5] | CHEN Shan-ji(陈善继). Summary of comprehensive utilization of by-products from phosphorus by electric furnace in China(我国电炉制磷副产物综合利用概要)[J]. Sulphur Phosphorus & Bulk Materials Handling Related Engineering(硫磷设计与粉体工程) , 2004(4): 7-12. |
| [6] | LIU Ming-li(刘明理). Study of producing industrial phosphoric acid with middle-low grade phosphate rock by vertical kiln method(窑法利用中低品位磷矿石生产工业磷酸的研究)[J]. Chemical Research and Application(化学研究与应用) , 2009, 21(1): 131-134. |
| [7] | DENG Shu-yuan(邓淑元), LIANG Bin(梁斌), LI Chun(李春), et al. Research progress of kiln phosphoric acid process(窑法磷酸技研究进展)[J]. Chemical Industry & Engineering Progress(化工进展) , 2012, 31(7): 402-406. |
| [8] | LÜ Li(吕莉), LIANG Bin(梁斌), LIU Qiang(刘强), et al. Reactions between P2O5 and calcium phosphate in kiln phosphoric acid(窑法磷酸中磷酸钙对P2O5反吸过程)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2016, 67(10): 4399-4405. |
| [9] | REN Zhan-dong(任占东), CHEN Liang(陈樑), NING Ping(宁平). Removal of hydrogen phosphide and hydrogen sulfide from yellow phosphorus tail gas by catalytic oxidation process(催化氧化法脱除黄磷尾气中的磷化氢和硫化氢)[J]. Environmental Protection of Chemical Industry(化工环保) , 2005, 25(3): 221-224. |
| [10] | ZHANG Yong(张永), NING Ping(宁平), XU Hao-dong(徐浩东), et al. Adsorptive removal of PH3 in off-gas of yellow phosphorus by modified activated carbon(改性活性炭吸附净化黄磷尾气中的PH3)[J]. Chinese Journal of Environmental Engineering(中国环境学报) , 2007, 1(5): 75-80. |
| [11] | Megy J A. Rotary kiln process for phosphoric acid manufacture: US, WOUS2005019598[P]. 2005-06-03. |
| [12] | Jacob K D, Reynolds D S. Reduction of tricalcium phosphate by carbon[J]. Industrial and Engineering Chemical Research , 2002, 20(1): 1204-1210. |
| [13] | Jacob M U, Frederic L, Park W C, et al. Reduction of phosphate ores by carbon:Part Ⅰ. Process variables for design of rotary kiln system[J]. Metallurgical Transactions B , 1986, 17(4): 861-868. DOI:10.1007/BF02657149. |
| [14] | Frederic L, Howard R, Jacob M U, et al. Reduction of phosphate ore by carbon:Part Ⅱ. Rate limiting steps[J]. Metallurgical Transactions B , 1986, 17(4): 869-877. DOI:10.1007/BF02657150. |
| [15] | JIANG Shan-xiang(江善襄). Discussion on improving reduction rate of kiln phosphoric acid(提高窑法磷酸还原率的探讨)[J]. Phosphate & Compound Fertilizer(磷肥与复肥) , 1995, 10(1): 13-17, 56. |
| [16] | Geng R X, Xia J P, Chen Z J, et al. Effects of potassium feldspar on slagging and fluxing in phosphorus produced via electric furnace[J]. Phosphorus Sulfur & Silicon & the Related Elements , 2016, 192(4): 475-480. |
| [17] | Belyaev A A. Effect of alkali metal carbonate additives on the rate of oxidation of the organic matter of anthracite[J]. Solid Fuel Chemistry , 2013, 47(4): 226-230. DOI:10.3103/S0361521913040046. |
| [18] | Ma Y, Liu B, Jing M M, et al. Promoted potassium salts based Ru/AC catalysts for water gas shift reaction[J]. Chemical Engineering Journal , 2016, 287: 155-161. DOI:10.1016/j.cej.2015.10.119. |
| [19] | Kopyscinski J, Habibi R, Mims C A, et al. K2CO3-catalyzed CO2 gasification of ash-free coal:kinetic study[J]. Energy Fuels , 2013, 27(8): 4875-4883. DOI:10.1021/ef400552q. |
| [20] | QIU Li-you(邱礼有), LIANG Bin(梁斌), JIANG Li-ke(江礼科). Investigation on the solid state reduction of fluorapatite(氟磷灰石固态还原过程实验研究)[J]. Journal of Chemical Industry & Engineering(化工学报) , 1996, 47(1): 65-71. |
| [21] | Bai S, Wen S, Liu D, et al. Effects of sodium carbonate on the carbothermic reduction of siderite ore with high phosphorus content[J]. Minerals & Metallurgical Processing , 2013, 30(2): 100-107. |
| [22] | Safarian J, Tangstad M. Wettability of silicon carbide by CaO-SiO2 Slags[J]. Metallurgical & Materials Transactions , 2009, 40(6): 920-925. |
| [23] | NING Pei-dong(宁培栋), YING Xian-guo(殷宪国). Evaluation and discussion on two technological routes for production of kiln phosphoric acid(我国窑法磷酸两条技术路线评估与探讨)[J]. Phosphate & Compound Fertilizer(磷肥与复肥) , 2006, 21(1): 30-32. |
| [24] | QIU Lin-you(邱礼有), JIANG Li-ke(江礼科). Investigation on operation temperature range of the rotary kiln in KPA process(窑法磷酸生产的旋窑制气实验研究)[J]. Chemical Reaction Engineering And Technology(化学反应工程与工艺) , 1993, 9(1): 90-97. |
| [25] | QIN Yang-song(覃扬颂), WANG Chong-hua(王重华), HUANG Xiao-feng(黄小凤), et al. Utilization of melting yellow phosphor furnace slag(熔融态黄磷炉渣的综合利用)[J]. Chemical Industry and Engineering Progress(化工进展) , 2012, 31(10): 2319-2323. |
| [26] | LI Qian(李茜), HU Biao(胡彪), WU Yuan-xin(吴元欣), et al. Process parameters and kinetics of smelting reduction technology for low-phosphate ore reduction(熔融法还原中低品位磷矿的工艺及动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(4): 905-910. |
| [27] | YANG Jun(杨军), CHEN Jian-jun(陈建钧), LIU Hai-yan(刘海燕), et al. Enhanced effect of aluminum impurity on solid state carbothermal reduction of fluorapatite(铝杂质强化固相碳热还原氟磷灰石过程分析)[J]. Journal of Sichuan University Engineering (Science Edition)(四川大学学报(工程科学版)) , 2015, 47(1): 186-191. |
| [28] | LI Qian(李茜), HU Biao(胡彪), WU Yuan-xin(吴元欣), et al. Reaction kinetics of phosphate ore with carbonby smelting reduction technology(固态碳熔融还原磷矿反应动力学)[J]. Chemical Engineering of China(化学工程) , 2013, 41(4): 53-56. |
| [29] | JIANG Li-ke(江礼科), QIU Li-you(邱礼有), LIANG Bin(梁斌). Solid reaction mechanism for the thermal reduction of fluorapatite by carbon(氟磷灰石热炭固态还原反应机理)[J]. Journal of Chengdu University of Science and Technology(成都科技大学学报) , 1995(1): 1-5. |




