沼气是微生物在厌氧条件下分解麦秸、垃圾等有机物产生的一种可燃性气体,其主要成分包括45%~70%(V) CH4、30%~45%(V) CO2及少量N2、H2S和H2[1, 2]。沼气作为一种清洁能源,可以用作燃料、燃料电池、发电及车用燃料等。其中,将其用作车用燃料不仅可以缓解能源紧张的问题,还可以实现废物的循环再利用,有效地解决环境污染问题[3]。但天然沼气中CH4的含量较低,需要将CH4提纯至95%才可达到车用燃料的标准[2]。我国车用燃气主要性能指标如表 1所示[4]:
| 表 1 车用燃气主要特定参数 Table 1 Typical parameters of vehicle gas |
沼气提纯常用的方法有溶剂吸收法、变压吸附法(PSA)、膜分离法和低温精馏法[5, 6]。其中变压吸附法因能耗低、自动化程度高及产品纯度高等优点受到广泛关注[7]。Cavenati等[8, 9]以碳分子筛(CMS)为吸附剂,采用不同的PSA循环从CH4/CO2(55/45)混合气提纯CH4,可得CH4纯度为96%,回收率大于76%。随后以13X和CMS为吸附剂,采用复合床层法从CH4、CO2和N2 (70/20/10)混合气中将CH4提纯至92%,回收率为43.5%。银纯彪等[10]以沸石分子筛为吸附剂,采用3床12步真空变压吸附法(VPSA)富集CH4,可得CH4纯度为98%,回收率为92%。李克兵等[11]采用变温吸附和变压吸附结合的方式将CH4提纯至80%~90%,回收率为80%~95%。
本文测定CH4、CO2和N2在13X和CMS上的吸附分离性能。在此基础上,采用两段VPSA工艺以提纯沼气中的CH4。选择合适的数学模型,并验证其可靠性。对两段VPSA工艺计算,同时对过程的操作压力和分离特性进行分析,为实际工业过程提供一定的理论指导。
2 实验部分13X分子筛由上海环球分子筛有限公司提供;CMS由浙江长兴山立化工材料科技有限公司提供。H2、Ar、CH4、CO2和N2均由南京瑞尔特种气体有限公司提供,纯度均大于99.9%。
2.1 CH4、CO2和N2纯组分吸附等温线测定采用高精度智能重量分析仪(IGA-100,HIDEN)分别测定CH4、CO2和N2在13X和CMS上的吸附等温线。测试温度为25、35和45℃,压力范围为0~3 bar。并记录三组分气体在t时刻的吸附量Mt,计算出Mt与平衡吸附量M∞的比值,将计算所得比值对时间作图,可得气体在吸附剂上的吸附速率曲线。
为保证测量结果的准确性,测量前对装置进行气密性检查和管路清洗,并对吸附剂采用加热和抽真空的方式进行预处理,以脱除水分和杂质气体。其中,13X加热温度为300℃,CMS加热温度为180℃,在真空度为10-4 pa条件下处理4 h。
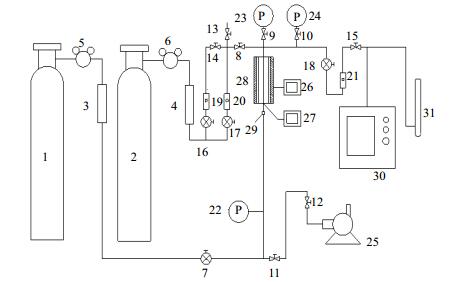
2.2 CH4、CO2和N2混合气穿透曲线测定利用固定床装置分别测定吸附压力6 bar、不同原料气流量下CH4/CO2/N2(60/37/3%)混合气在13X和CMS上的穿透曲线。实验装置如图 1所示,该装置主要由钢瓶气、固定床吸附柱、色谱分析系统和抽真空系统等组成。
|
图 1 固定床装置图 Fig.1 Schematic diagram of the fixed bed setup 1. feed cylinder 2. helium cylinder 3, 4. dried column 5, 6. compression release valve 8~15. cut-off valve 7, 16~18. regulating valve 19~21. rotameter 22~24. pressure gage 25. vacuum pump 26. temperature controller 27. temperature indicator 28. furnace 29. pressure indicator 30. gas chromatography 31. soap film flowmeter |
实验测定前首先用氩气对吸附床充压,使床内压力达到6 bar。然后调节尾部微量调节阀至设定流量,关闭氩气进气阀,开启原料阀,使原料气恒压进入吸附床,开始计时。尾气组成由气相色谱仪(GC-9790Ⅱ,浙江福立有限公司)分析。采用热导分析,固定相为Porapak-Q,桥电流为80 mA,载气为H2,载气流量为30 mL·min-1,柱箱温度为60℃,检测室温度为80℃。当尾气浓度达到混合气浓度的98%并恒定时,停止实验。每2 min采集一个数据点,整理数据可得穿透曲线。
3 数学模型选用数学模型对实验测定N2、CH4和CO2混合气在13X和CMS上的穿透曲线进行计算,计算过程基于以下假设:
(1) 气体遵循理想气体定律;
(2) 质量、动量及热量传递只考虑吸附床轴向;
(3) 吸附动力学采用线性推动力(LDF)方程;
(4) 吸附床内空隙率和吸附剂颗粒孔隙率均为常数;
(5) 气相和固相之间存在热平衡。
选择数学模型,对气体在吸附床内吸附过程计算。其中,总质量平衡方程如下[12]:
| $ \frac{\partial }{{\partial z}}\left( {{E_{\rm{b}}}-{D_{{\rm{ax}}}}c\frac{{\partial y}}{{\partial z}}} \right) + \frac{{\partial \left( {vc} \right)}}{{\partial z}} + \left( {{E_{\rm{b}}} + \left( {1-{E_{\rm{b}}}} \right){E_{\rm{p}}}} \right)\frac{{\partial q}}{{\partial t}} + {\rho _{\rm{p}}}\left( {1-{E_{\rm{b}}}} \right)\frac{{\partial q}}{{\partial t}} = 0 $ | (1) |
其中轴向吸附系数用下列公式估算[13]:
| $ {D_{{\rm{ax}}}} = 0.73{D_{\rm{m}}} + \frac{{{v_{\rm{g}}}{R_{\rm{p}}}}}{{{E_{\rm{b}}}\left( {1 + 9.49\frac{{{E_{\rm{b}}}{D_{\rm{m}}}}}{{2{v_{\rm{g}}}{R_{\rm{p}}}}}} \right)}} $ | (2a) |
| $ {D_{\rm{m}}} = \frac{{0.01013{T^{1.75}}\sqrt {\left( {\frac{1}{{{M_{\rm{A}}}}} + \frac{1}{{{M_{\rm{B}}}}}} \right)} }}{{P\left( {{D^{1/3}}_{{\rm{v, A}}} + {D^{1/3}}_{{\rm{v, B}}}} \right)}} $ | (2b) |
LDF方程如下[14]:
| $ \frac{{{\rm{d}}{q_i}}}{{{\rm{d}}t}} = {K_i}\left( {q_i^*-{q_i}} \right) $ | (3) |
吸附床层压降用Ergun方程计算[15]:
| $ - \frac{{\partial P}}{{\partial z}} = \left[{\frac{{150 \times {{\left( {1-{E_{\rm{b}}}} \right)}^2}}}{{{{\left( {2{R_{\rm{p}}}} \right)}^2}E_{\rm{b}}^3}}\mu {v_{\rm{g}}} + 1.75M{\rho _{\rm{g}}}\frac{{\left( {1-{E_{\rm{b}}}} \right)}}{{2{R_{\rm{p}}}{E_{\rm{b}}}^3}}\left| {{v_{\rm{g}}}} \right|} \right]{v_{\rm{g}}} $ | (4) |
热量平衡方程如下[16]:
| $ \begin{gathered} \left[{{E_{\rm{b}}} + (1-{E_{\rm{b}}}){E_{\rm{p}}}\sum\limits_{i = 1}^N {{c_i}({c_{{\rm{pg}}, i}}-R) + (1-{E_{\rm{b}}})\rho \sum\limits_{i - 1}^N {{q_i}({C_{{\rm{pq}}, i}} - R)} } } \right]\frac{{\partial T}}{{\partial t}} + {v_{\rm{g}}}{\rho _{\rm{g}}}\sum\limits_{i = 1}^N {{C_{{\rm{pg}}, i}}\frac{{\partial T}}{{\partial Z}}} \hfill \\ + (1 -{E_{\rm{b}}}){\rho _{\rm{g}}}\sum\limits_{I = 1}^N {\frac{{\partial {q_i}}}{{\partial z}}\Delta {H_i}} + 2h\frac{{T -{T_{\rm{w}}}}}{{{R_{\rm{b}}}}}({E_{\rm{b}}} + (1 -{E_{\rm{b}}}){E_{\rm{p}}}) - {k_{\rm{g}}}\frac{{{\partial ^2}T}}{{\partial {z^2}}} = 0 \hfill \\ \end{gathered} $ | (5) |
吸附平衡模型采用扩展的Langmuir方程,吸附热用Clausius-Clayperion方程[12, 17]来计算:
扩展Langmuir方程:
| $ q_i^* = \frac{{I{P_1}{P_i}}}{{1 + \sum\limits_k {I{P_{2k}}{P_{ik}}} }} $ | (6) |
Clausius-Clayperion方程:
| $ {\rm{-}}\Delta {H_i} = RT{\left( {\frac{{\partial \ln {P_i}}}{{\partial T}}} \right)_{{q_i}}} $ | (7) |
计算采用的离散化方法为一阶上风差分法(UDS1),该方法运算速度快、过程稳定、误差合理,UDS1对模型中的一阶微分导数是采用后项差分法,对二阶微分导数运用的是中心差分法,表达式如下,
一阶导数:
| $ \frac{{\partial {\mathit{\Gamma} _i}}}{{\partial z}} = \frac{{\partial {\mathit{\Gamma} _i}-{\mathit{\Gamma} _{i-1}}}}{{\Delta z}} $ | (8) |
二阶导数:
| $ \frac{{{\partial ^2}{\mathit{\Gamma} _i}}}{{\partial {z^2}}} = \frac{{{\mathit{\Gamma} _{i + 1}}-2{\mathit{\Gamma} _i} + {\mathit{\Gamma} _{i-1}}}}{{\Delta z}} $ | (9) |
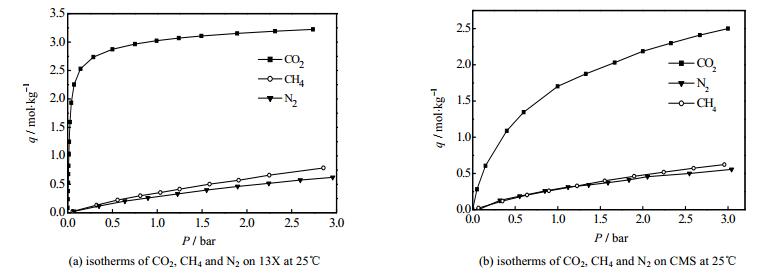
图 2为25℃下CH4、CO2和N2在13X和CMS上的吸附等温线(35℃和45℃下的等温线见附件)。由图 2可知,压力为3 bar时,CO2在13X上的吸附量为3.32 mol·kg-1,在CMS上的吸附量为2.51 mol·kg-1;N2的吸附量分别为0.62和0.55 mol·kg-1;CH4的吸附量分别为0.78和0.62 mol·kg-1。13X和CMS对CO2的吸附量远大于N2和CH4的吸附量,N2和CH4的吸附量相差较小,且吸附量较低。测定结果表明,13X和CMS对CO2有较大的吸附选择性,可以利用吸附量的不同实现CO2的脱除;但对N2和CH4吸附选择性较差。
|
图 2 25℃下CO2、CH4和N2在13X和CMS上的吸附等温线 Fig.2 Adsorption isotherms of CO2, CH4 and N2 on 13X and CMS at 25℃ |
采用扩展的Langmuir方程对CH4、CO2和N2的吸附平衡数据进行拟合,结果如表 2所示。由表可知,N2和CH4的吸附平衡参数大致相近,且明显小于CO2的吸附平衡参数,说明扩展的Langmuir方程可以较好地描述CO2、N2和CH4在13X和CMS上的吸附特性。
| 表 2 CH4、N2和CO2在13X和CMS上吸附平衡参数 Table 2 Adsorption equilibrium parameters of CH4, N2 and CO2 on 13X and CMS |
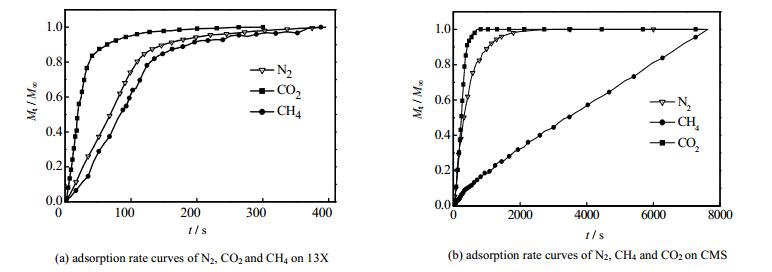
图 3为25℃下N2、CH4和CO2在13X和CMS上的吸附速率曲线。
|
图 3 25℃下N2、CH4和CO2在13X和CMS上的吸附速率曲线 Fig.3 Adsorption rate profiles of N2, CH4 and CO2 on 13X and CMS at 25℃ |
从图 3(a)可知,CO2、N2和CH4在13X上的吸附速率较快,在200 s左右达到吸附平衡;该结果可为PSA过程吸附时间的确定提供一定的指导,即吸附时间控制在200 s以内较为合理;CO2的吸附速率高于N2和CH4,且N2和CH4的吸附速率大致相近。该结果表明,利用13X很难实现从N2和CH4混合气中分离出高纯度的CH4。但由图 3(b)可知,CH4和N2在CMS上的吸附速率相差较大,且N2的吸附速率高于CH4,可利用CH4和N2吸附速率的不同实现两组分的分离。
采用LDF模型对三组分气体在13X和CMS上的吸附速率曲线进行拟合,结果如表 3所示:
| 表 3 CH4、N2和CO2在13X和CMS上吸附动力学参数 Table 3 Adsorption dynamic parameters of CH4, N2 and CO2 on 13X and CMS |
采用选择的数学模型对N2、CH4和CO2在13X和CMS上的穿透曲线进行计算,吸附剂和固定床参数如表 4所示。
| 表 4 吸附剂和固定床参数 Table 4 Parameters of the adsorbents and the fixed bed |
图 4为CO2、CH4和N2混合气在13X和CMS上穿透曲线的实验值和计算值。由图 4可知,在相同的条件下,CO2在13X和CMS上的穿透时间远大于N2和CH4的穿透时间;当原料气流量500 mL·min-1时,CO2在13X上的穿透时间为3000 s,而N2和CH4的穿透时间则为1000 s左右。其原因可从吸附等温线测定结果来说明,13X对CO2的吸附量远大于N2和CH4,而N2和CH4吸附量大致相近;且随着原料气流量的增大,穿透时间越来越短。

|
图 4 压力6 bar不同流量下CH4、CO2和N2在13X和CMS上的穿透曲线 Fig.4 Breakthrough curves of CH4, CO2 and N2 on 13X and CMS at 6 bars under different flowrates ● CH4 △ CO2 ■ N2 —calculation |
通过对比CO2、CH4和N2穿透曲线的实验值和计算值,发现二者存在一定的偏差。其主要原因是计算过程基于一定的假设,忽略了实际过程中床层吸附剂装填不均匀、颗粒直径不一致、气体流量控制有波动等因素。但实验结果和计算结果仍有较好的一致性,可以验证所选数学模型的可靠性和准确性。
4.4 真空变压吸附工艺CO2、CH4和N2在13X和CMS上的吸附等温线测定结果表明,13X对CO2的吸附选择性高于CH4和N2,可以利用吸附量的不同可实现CO2的脱除;而CH4和N2在CMS上的吸附速率相差较大,基于吸附速率的不同可以实现N2的脱除。为此,将脱除CH4、CO2和N2混合气中的CO2和N2的VPSA工艺分为两个阶段。第一阶段VPSA工艺以13X为吸附剂,用于CO2的脱除;第二阶段VPSA工艺以CMS为吸附剂,用于N2的脱除。
| 表 5 第一段VPSA工艺时序图 Table 5 Schedule of the first-stage VPSA process |
| 表 6 第二段VPSA工艺时序图 Table 6 Schedule of the second-stage VPSA process |
第一段工艺采用六床七步法,时序如表 5所示。组成为60% CH4、30% CO2和10% N2的原料气,从吸附床底部进入,依次经过吸附、均降、逆放、吹扫、抽真空、均压升和原料气充压步骤,各步骤在时间上相互错开,交替进行,但始终有3个吸附床处于吸附状态,以保证过程连续进行。第一段工艺的产品气进入第二段进一步提纯。第二段工艺采用三床六步法,其时序如表 6所示。每个吸附床依次经过吸附、均压降、逆放、抽真空、均压升及终升压步骤。过程中始终有一个吸附床处于吸附状态,保证过程的连续性。
第一段吸附床高为3.6 m,直径为1.2 m;第二段床层高4 m,直径为1 m。因CO2吸附会释放大量的热量,第一段VPSA过程的床层视为非等温;第二段过程的床层视为等温,因为CH4和N2在CMS上吸附量较小,放出热量可以忽略[18]。
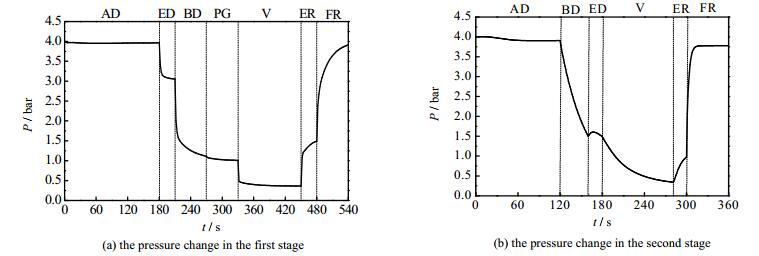
4.5 两段VPSA计算结果分析 4.5.1 吸附床层压力变化图 5为两段VPSA工艺一个周期内床层压力变化。气体在吸附压力4 bar下进行吸附,时间为180 s。该步骤大部分的CO2被13X吸附,吸附床顶部流出N2和CH4。均压降步骤,把吸附床与抽真空后的吸附床进行均压,床层压力降为3 bar。逆放及冲洗步骤,床层压力降至1 bar;抽真空时床层压力降为0.5 bar,气体从吸附剂上解吸出来,吸附剂得以再生。均压升及终升压步骤将床层升至4 bar。
|
图 5 一个周期内床层压力变化 Fig.5 Pressure change profiles in the two-stage VPSA process |
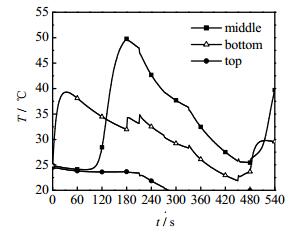
图 6为第一段VPSA工艺一个周期内吸附床层的温度变化。由图可知,床层不同位置的温度有一定的波动。将图 6与图 5(a)床层压力图相联系,可以看出,温度的变化与压力密切相关。当床层压力升高时,温度也随之升高。吸附步骤,床层底部和中部温度上升幅度较大,床层内最大温升为22℃。这是由于大量的CO2被吸附导致。CO2是一种强吸附组分,被吸附时会释放出大量的热;而顶部则因为气体流出带走热量导致温度有所降低。床层压力降低时,被吸附的气体从吸附剂上脱附下来,脱附过程为吸热过程,床层温度随之降低。抽真空步骤,床层内温度降至最低。
|
图 6 一个周期内床层温度变化 Fig.6 Temperature change profiles within one VPSA cycle in the first stage |
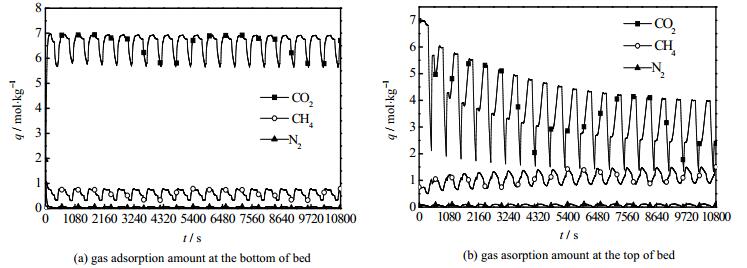
图 7为第一段过程CO2、N2和CH4气体在吸附床顶部和底部固相浓度的变化。由图可知,CO2的吸附量远大于CH4和N2,N2的吸附量接近于0。由图 7(b)可知,CO2吸附量随着时间变化呈下降的趋势,而CH4的吸附量呈上升趋势。这是因为在吸附床的顶部富集更多的CH4,而大部分CO2在吸附床内已经被吸附,在吸附床顶端含量降低,所以固相浓度降低。经第一段VPSA工艺提纯,在吸附压力4 bar、脱附压力为0.5 bar条件下,所得产品气组成为82% CH4、17% N2和1% CO2,可以看出大部分的CO2已经被脱除。
|
图 7 气体在吸附床底部和顶部固相浓度变化 Fig.7 Gas adsorption profiles in the solid phase at the bottom and top of the bed |
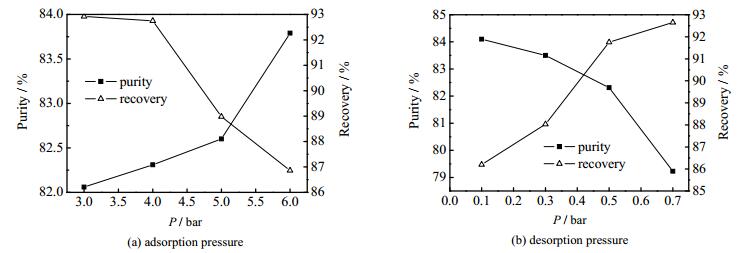
图 8为第一段工艺操作压力对CH4纯度和回收率的影响。从图 8(a)看出,吸附压力增大,CH4纯度上升,但回收率下降。这是由于吸附压力增大,吸附剂对气体的吸附量增大,相同时间内吸附更多的气体,导致产品气中CO2含量下降,CH4纯度升高;同时,压力增大使得气体在吸附剂的传质阻力降低,加快了气体的传质速率。吸附压力越高,在吸附剂再生阶段损失的气体量就越多,导致产品端流出的气体量减少,CH4回收率降低。当吸附压力为4 bar时,CH4纯度为82.3%,回收率为92.8%。
|
图 8 操作压力对CH4纯度和回收率的影响 Fig.8 Effects of adsorption pressure on purity and recovery of CH4 |
由图 8(b)可知,增大吸附床的抽真空压力,CH4纯度下降,回收率上升。脱附压力上升时,吸附剂再生效果降低,床层内被吸附的气体不能完全从吸附剂上解吸出来,导致在后面的循环中吸附气体能力下降,导致CH4纯度下降;床层死体积中CH4含量升高,产品气流出量增多,床内气体量减少,回收率上升。
4.5.5 CH4和N2分离过程特性分析表 7为N2吸附动力学参数对CH4纯度和回收率的影响。保持KCH4为2.3×10-3 s-1不变,增大KN2,发现CH4纯度不断增加,回收率变化不明显。当KN2为0.22 s-1时,可得CH4纯度为99.45%,能够达到车用燃料的标准。表 8为CH4的吸附动力学参数对CH4纯度和回收率的影响。保持KN2为2.2×10-3 s-1不变,减小CH4的吸附动力学参数,发现CH4纯度和回收率稍有增加,说明CH4的吸附动力学参数对CH4和N2分离过程影响较小。KN2为0.22 s-1和KCH4为2.3×10-3s-1是采用LDF方程拟合CO2、N2和CH4的吸附速率曲线得到,此时CH4纯度为87%,说明现有的CMS很难从CH4和N2混合气中获得高纯度CH4。当具备CMS对CH4有较小的吸附速率、对N2吸附速率较大的吸附特性时,才可实现二者更好的分离。通过分析CH4和N2在CMS的分离过程特性,进而对吸附剂性能提出要求,这对实际过程中吸附剂的研发有一定的指导作用。
| 表 7 N2吸附动力学参数对CH4纯度和回收率的影响 Table 7 Effects of KN2 on purity and recovery of CH4 |
| 表 8 CH4吸附动力学参数对CH4纯度和回收率的影响 Table 8 Effects of KCH4 on purity and recovery of CH4 |
(1) CO2、CH4和N2纯组分在13X和CMS上的吸附性能测定结果表明,13X对CO2的吸附选择性高于CH4和N2,可利用不同的吸附选择性实现CO2的脱除;而CH4和N2在CMS吸附速率相差较大,可利用CH4和N2不同的吸附速率实现二者分离。为此,将VPSA工艺分为两个阶段以脱除沼气中CO2和N2。
(2) 选择数学模型对CH4、CO2和N2混合气在13X和CMS上穿透曲线进行计算,并与实验值进行对比,二者有较好的一致性,验证了数学模型的可靠性。在此基础上,对两段VPSA工艺提纯CH4的过程计算,在吸附压力为4 bar、脱附压力为0.5 bar的条件下,可获得纯度为99%、总回收率为65%的CH4,能够满足车用燃料的要求。
(3) 过程操作压力对产品纯度和回收率有较大的影响,吸附压力升高,脱附压力下降,有利于提高CH4纯度,但降低回收率,选择操作压力时要综合考虑产品纯度和回收率之间的关系。CH4和N2过程特性分析的结果表明,现有的CMS吸附剂分离CH4和N2混合气的吸附性能较低;当对CH4和N2在CMS上的吸附速率相差足够大时,才可得获得纯度大于95%的CH4。
符号说明:
| Cpg, i | —气相混合物定压热容,kJ·kg-1·K-1 | MA | —组分A气体摩尔质量,kg·mol-1 |
| Cpg | —吸附剂定压热容,kJ·kg-1·K-1 | MB | —组分B气体摩尔质量,kg·mol-1 |
| ci | —组分i的气相浓度,mol·m-3 | N | —气体总分子数 |
| c | —总气相浓度,mol·m-3 | P | —压力,bar |
| Dm | —分子吸附系数,m2·s-1 | qi | —组分i的吸附量,mol·kg-1 |
| Dax | —有效轴向吸附系数,m2·s-1 | qi* | —组分i的平衡吸附量,mol·kg-1 |
| dp | —颗粒直径,m | R | —理想气体常数,J·mol-1·K-1 |
| Dv, A | —吸附质A分子吸附体积,cm3·mol-1 | Rb | —床层半径,m |
| DV, B | —吸附质B分子吸附体积,cm3·mol-1 | Rp | —颗粒半径,m |
| Eb | —空隙率 | RHOs | —吸附剂堆积密度,kg·m-3 |
| Ep | —孔隙率 | t | —时间,s |
| F | —气体摩尔流率,kmol·s-1 | T | —温度,K |
| H | —气体与吸附床壁间的传热系数,W·m-2·K-1 | Tw | —床壁温度,K |
| HTC | —总传热系数,W·m-2·K-1 | vg | —表观流速,m·s-1 |
| Hb | —床层高度,m | z | —轴向方向 |
| h | —气体与吸附床壁间的传热系数,W·m-1·K-1 | 希腊字母 | |
| ΔHi | —组分i的吸附热,kJ·mol-1 | ρg | —气相密度,kg·m-3 |
| IP1 | —吸附平衡参数1,kmol·kg-1·bar-1 | ρp | —吸附剂颗粒密度,kg·m-3 |
| IP2 | —吸附平衡参数2,bar-1 | μ | —气相粘度,Pa·s |
| kg | —轴向有效热传导系数,W·m-1·K-1 | φ | —吸附剂形状因子 |
| Ki | —组分i吸附动力学参数,s-1 |
| [1] | Rasi S, Veijanen A, Rintala J. Trace compounds of biogas from different biogas production plants[J]. Energy , 2007, 32(8): 1375-1380. DOI:10.1016/j.energy.2006.10.018. |
| [2] | SUN Jiao(孙姣), LI Guo(李果), CHEN Zhen-bin(陈振斌). Biogas purification technology for producing vehicle gas(沼气净化提纯制备车用燃气技术)[J]. Modern Chemical Industry(现代化工) , 2014, 34(4): 141-146. |
| [3] | WU Jie-min(吴杰民). Study on biogas application model for vehicle gas(沼气作为车用燃气应用模式的研究)[J]. Solar Energy(太阳能) , 2011(11): 9-11. DOI:10.3969/j.issn.1003-0417.2011.11.003. |
| [4] | Compress natural gas for vehicles (车用压缩天然气): GB18047-2000[S]. Beijing (北京): China Standards Press (中国标准出版社), 2000. |
| [5] | Leung D Y C, Caramanna G, Marotovaler M M. An overview of current status of carbon dioxide capture and storage technologies[J]. Renewable & Sustainable Energy Reviews , 2014, 39(39): 426-443. |
| [6] | Campo M C, Ribeiro A M, Ferreira A F P, et al. Carbon dioxide removal for methane upgrade by a VSA process using an improved 13X zeolite[J]. Fuel Processing Technology , 2016, 143: 185-194. DOI:10.1016/j.fuproc.2015.11.024. |
| [7] | ZHOU Yan(周言), YAN Hai-yu(阎海宇), LI Dong-dong(李冬冬), et al. Experimental and simulative studies on vacuum pressure swing adsorption processes for CO purification from syngas(真空变压吸附提纯合成气中CO的实验与计算)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(5): 1027-1035. |
| [8] | Cavenati S, Grande C A, Rodrigues A E. Upgrade of methane from landfill gas by pressure swing adsorption[J]. Energy & Fuels , 2005, 19(6): 2545-2455. |
| [9] | Cavenati S, Grande C A, Rodrigues A E. Layered pressure swing adsorption for methane recovery from CH4/CO2/N2 streams[J]. Adsorption , 2005, 11(1): 549-554. |
| [10] | Yin C B, Sun W N, Yang H W, et al. Optimization of three-bed VPSA system for biogas upgrading[J]. Chemical Engineering Science , 2015, 135: 100-108. DOI:10.1016/j.ces.2015.06.022. |
| [11] | LI Ke-bing (李克兵), YIN Wen-hua (殷文华), LIU Li (刘丽), et al. Method for purifying and recovering methane from landfill gas (从垃圾填埋气中净化回收甲烷的方法): CN, 1634813 A[P]. 2005-07-06. |
| [12] | Silva F A D, Silva J A, Rodrigues A E. A general package for the simulation of cyclic adsorption processes[J]. Adsorption , 1999, 5(3): 229-244. DOI:10.1023/A:1008974908427. |
| [13] | Silva F A D, Rodrigues A E. Propylene/propane separation by vacuum swing adsorption using 13X zeolite[J]. AIChE Journal , 2001, 47(2): 341-357. DOI:10.1002/(ISSN)1547-5905. |
| [14] | SUN Wei-na(孙伟娜), YAN Hai-yu(阎海宇), ZHANG Dong-hui(张东辉). Sensitivity analysis and optimization of vacuum pressure swing adsorption process for N2/CH4 separation(真空变压吸附分离氮气甲烷流程灵敏度分析与优化)[J]. CIESC Journal(化工学报) , 2016, 67(2): 598-605. |
| [15] | YANG Hua-wei(杨华伟), ZHANG Zheng-wang(张正旺), ZHANG Dong-hui(张东辉). Modeling and experiment of vacuum pressure swing adsorption process for N2 and CH4 separation(真空变压吸附分离氮气甲烷计算与实验研究)[J]. Chemical Industry and Engineering(化学工业与工程) , 2013, 30(5): 55-60. |
| [16] | Silva F A D, Rodrigues A E. Vacuum swing adsorption for propylene/propane separation with 4A zeolite[J]. Industrial & Engineering Chemistry Research , 2001, 40(24): 5758-5774. |
| [17] | Arya A, Divekar S, Rawat R, et al. Upgrading biogas at low pressure by vacuum swing adsorption[J]. Industrial & Engineering Chemistry Research , 2015, 54(1): 404-413. |
| [18] | Grande C A, Cavenati S, Silva F A D, et al. Carbon molecular sieves for hydrocarbon separations by adsorption[J]. Industrial & Engineering Chemistry Research , 2005, 44(18): 7218-7227. |