膜生物反应器(membrane bioreactor,MBR)结合了生物处理和膜分离过程,具有出水水质高、占地面积小、污泥产量低等优点[1-2]。随着污水排放标准的提高和水回用需求的增加,MBR已经越来越广泛地应用于市政废水和工业废水处理[3]。然而,MBR在运行中,不可避免地发生膜污染,制约了其应用。膜污染是由于溶解性微生物产物(soluble microbial products,SMP)、胶体、细菌等吸附、沉积到膜面及膜孔内,并逐渐在膜表面形成污泥层,最终造成膜通量减少或跨膜压差(transmembrane pressure,TMP)增大 [4]。为减缓膜污染,研究者们采用了多种方法,包括高强度曝气、低通量运行[5]、反冲洗[6]、膜改性[7]等。MBR中添加多孔介质不仅可以有效减缓膜污染,而且可提高污染物的去除率。
多孔介质中,活性炭由于具有较好的吸附性能得到广泛关注。MA等[8]发现粉末活性炭能有效吸附SMP、胞外聚合物(extracellular polymeric substances,EPS)等物质,附着细菌,从而控制膜污染,促进污染物的去除,且活性炭投加量存在最优值。现有的研究也主要集中于活性炭投加量对于膜污染的影响,对于活性炭粒径和膜污染关系的研究较少[9]。NG等[9]考察了粉末活性炭粒径对膜污染的影响,结果表明粉末活性炭能有效减缓膜污染,但是粒径与膜污染的关系并不明确,粒径越小不代表膜污染的抑制能力越好。因此,不同活性炭粒径下,膜污染减缓机理尚不明确,有必要进一步研究活性炭粒径对膜污染的影响。
针对以上问题,本文通过研究颗粒和粉末活性炭对MBR运行性能及膜污染的影响,探讨活性炭对SMP、EPS、活性污泥脱水性能的影响,扫描电镜技术(scanning electron microscope,SEM)分析膜面滤饼层,阐明了粉末活性炭和颗粒活性炭减缓膜污染的机理。
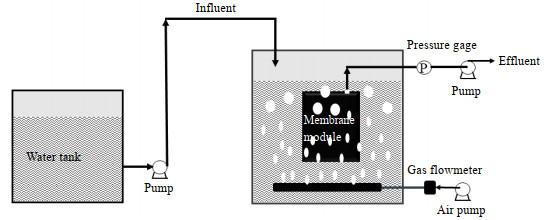
2 实验方法 2.1 实验仪器和材料实验采用浸没式的MBR装置,如图 1所示。反应器有效容积为1.8 L,内置聚偏二氟乙烯(polyvinylidene fluoride,PVDF)平板膜组件(斯纳普),膜面积为0.02 m2。在蠕动泵(YZ1515X)抽吸作用下,经膜过滤得到出水,抽吸模式为10 min ON,2 min OFF。压力计可随时记录TMP的变化,当TMP > 35 kPa时,取出膜组件进行酸洗和碱洗恢复膜通量。通过气泵进行曝气,空气流量为60 L·h-1,既保证了微生物正常的新陈代谢,又起到减缓膜污染的作用。粉末活性炭(powdered activated carbon,PAC)和颗粒活性炭(granular activated carbon,GAC)购于国药化学集团,粒径分别为75~150 µm和500~710 µm。实验设置对照组(Con,即不加入活性炭)、PAC组、GAC组,反应器中活性炭量为1.5 g·L-1。水力停留时间为6 h,通过每天排泥的方式将污泥停留时间控制在30 d,并补充相应量的活性炭。
|
图 1 MBR装置示意图 Fig.1 Schematic diagram of MBR |
实验所用活性污泥取自杭州市七格污水处理厂。实验废水采用模拟废水,分别以葡萄糖、NH4Cl、KH2PO4提供碳、氮、磷源,并加入NaHCO3和少量的MgSO4·7H2O及CaCl2,溶于自来水,各主要物质浓度见表 1。实验运行中,通过加入NaOH和HCl调控pH在合理范围(6.5~8.5)。
|
|
表 1 模拟废水组成 Table 1 Composition of feed water |
氨氮(NH4+-N)、污泥浓度(MLSS)的测定根据国标法。亚硝态氮(NO2--N)、硝态氮(NO3--N)采用离子色谱(戴安)测定,总有机碳(total organic carbon,TOC)则采用全自动TOC分析仪(TOC V-CPH,岛津)进行测定。
取少量污泥混合液,用激光粒度仪(LS 230,马尔文)测定其絮体粒径分布。另取少量污泥混合液,混匀后,通过污泥毛细吸水时间(capillary suction time,CST)测试仪(Triton 304M)测定污泥的毛细吸水时间。
取25 mL污泥混合液,于4000 r·min-1转速下离心5 min,上清液经0.22 µm滤膜过滤可得到SMP。松散结合型胞外聚合物(loosely bound EPS,LB-EPS)和紧密结合型胞外聚合物(tightly bound EPS,TB-EPS)的提取采用热提取技术[10]。SMP和EPS中的多糖(polysaccharides,PS)和蛋白质(proteins,PN)分别采用苯酚-硫酸法[11]和Folin-酚法[12],标准物分别为葡萄糖和牛血清蛋白。
利用荧光分光光度计(RF-5031PC,岛津)对SMP和EPS进行三维荧光光谱(EEM)分析。激发波长为200~450 nm,发射波长为220~550 nm,间隔都为5 nm。扫描速率为2 000 nm·min-1,狭缝宽度为5 nm。得到的数据先减去空白水样,然后采用三角插值法去除瑞利散射和拉曼散射,最后通过origin作图。
在运行周期的终点,通过冷场发射扫描电子显微镜(Hitachi SU-8010)对污染严重的膜面进行SEM观察。观察前对膜进行如下预处理:(1)浸泡在2.5%的戊二醛溶液中,于4 ℃过夜;(2)经0.1 mol·L-1的PBS溶液漂洗3次,每次15 min;(3)经1%的锇酸固定1 h,再用PBS漂洗3次。(4)用30%、50%、70%、80%、90%和95%乙醇溶液依次对样品进行脱水处理,每次15 min,再用100%乙醇处理2次,每次20 min;(5)临界点干燥,镀膜。
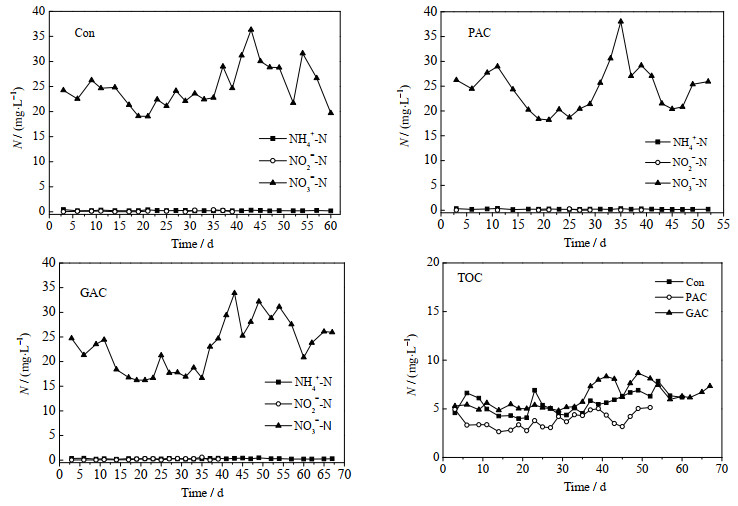
3 结果与讨论 3.1 活性炭对MBR处理性能的影响图 2为出水中TOC、NH4+-N、NO2--N、NO3--N浓度随时间的变化。3个MBR的最高出水TOC浓度都低于10 mg·L-1,Con,PAC和GAC的出水TOC平均浓度分别为(5.55±1.03)、(3.74±0.81)和(6.22±1.25) mg·L-1,去除率分别为97.6%,98.4%和97.4%。PAC的出水TOC最低,主要是因为PAC的吸附性能好,能有效的去除污泥混合液的SMP,从而降低了出水TOC。GAC的TOC去除率最低,是由于颗粒状的活性炭在膜表面冲刷破坏了膜表面的过滤层,截留作用降低,导致出水TOC升高。出水NH4+-N都低于0.5 mg·L-1,去除率大于98.7%,表明MBR具有非常好的硝化能力。硝化完全,进水中大部分NH4+-N转化为NO3--N,NO2--N的浓度始终在0.4 mg·L-1以下。3个反应器出水中NO3--N的浓度变化较大,在16~38 mg·L-1之间波动。总体而言,MBR具有极高的TOC和NH4+-N去除率。
|
图 2 3个反应器中出水TOC和无机N的对比 Fig.2 Comparison of TOC and N in the effluents from three MBRs |
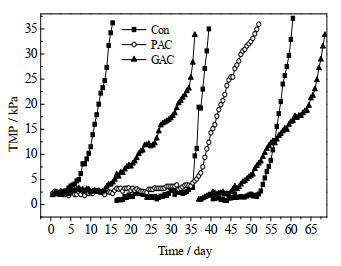
TMP变化反应了膜污染速率,当TMP增加到一定值后必须进行膜清洗以保证MBR正常运行。本实验中,当TMP大于35 kPa后进行膜清洗。图 3是3个反应器TMP随时间的变化。对照组中膜污染速率最快,平均每20 d需清洗一次,投加GAC的膜运行周期为34 d,而投加PAC的膜污染速率最低,在运行了52 d后才进行了一次膜清洗。膜污染过程主要分两个阶段,即TMP缓慢变化的第1阶段及TMP快速上升的第2阶段。对比PAC及其他两组,发现PAC的加入显著的增加了第1阶段的持续时间。可能是由于粉末活性炭吸附溶液中的SMP,减少了SMP在膜表面的吸附与沉积,而且粉末活性炭也能冲刷掉膜面的污染物,降低了凝胶层的形成速率[13];另一方面,在过滤作用下,粉末活性炭也沉积到膜表面,形成了过滤性能较好的过滤层,减缓了膜污染速率(见3.6节)。通过对比GAC和Con组,发现颗粒活性炭的加入主要是增加了TMP快速上升阶段的持续时间。颗粒活性炭具有较大的尺寸(500~710 µm),在曝气作用下,颗粒活性炭会不断冲击膜面,刮除膜面的污泥层,抑制污泥层的生长,从而减缓了膜污染速率。而颗粒活性炭的吸附能力较弱,不能有效地去除溶液中的SMP,难以减缓膜污染初期由于SMP在膜孔道或膜面吸附沉积导致的污染。
|
图 3 三个反应器膜污染速率的比较 Fig.3 Comparison of membrane fouling rates in three MBRs |
污泥混合液中EPS和SMP是引起膜污染的重要因素。在膜过滤作用下,由于浓差极化SMP易在膜表面富集并在膜面或孔道沉积形成凝胶层,造成膜污染[14-15]。EPS是形成污泥絮体的主要物质,先前的研究[16-17]表明膜污染与LB-EPS含量密切相关,而与TB-EPS无明显关系。EPS和SMP中主要含有多糖(PS)和蛋白质(PN),本实验将EPS、SMP的总量等同于多糖和蛋白质之和。
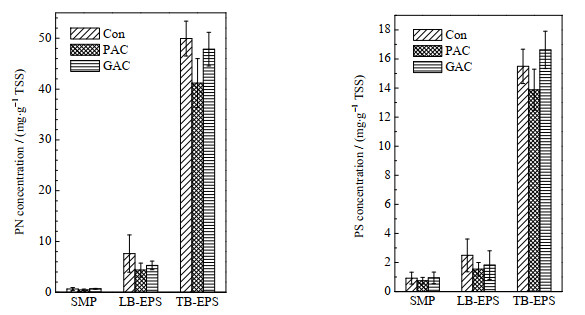
图 4为3个反应器中EPS和SMP含量。多糖和蛋白质的含量可由低到高排序为:SMP < LB-EPS < TB-EPS。SMP中的多糖含量高于蛋白质,EPS中多糖的含量则小于蛋白质,可能是与本试验中污泥龄较长有关。Con组SMP中多糖和蛋白质的含量分别为0.92 mg·g-1 (以MLSS计,下同)和0.65 mg·g-1,GAC组SMP中多糖和蛋白质的含量分别为0.94和0.69 mg·g-1,较之Con组有略微的增大。而PAC组SMP中多糖和蛋白质的含量分别为0.75和0.47 mg·g-1,明显低于其余两组反应器,直接证明了PAC可以有效吸附SMP。
|
图 4 活性炭对EPS和SMP浓度的影响 Fig.4 Effects of powdered and granular activated carbon on EPS and SMP concentrations |
对于LB-EPS,Con组多糖和蛋白质的含量最高,分别为2.49和7.62 mg·g-1;GAC组多糖和蛋白质的含量次之,分别为1.82和5.28 mg·g-1;PAC组多糖和蛋白质的含量最低,分别为1.54和4.38 mg·g-1。活性炭的加入明显降低了LB-EPS的含量,且粉末活性炭的效果更好。可能的原因有:活性炭可作为载体供微生物生长,微生物从悬浮生长转变为附着生长,改变了微生物生物群落和生理性质,降低了EPS的产生[18];在水力作用下,活性炭与絮体发生碰撞摩擦,导致处于絮体外表面的LB-EPS的脱落并被活性炭所吸附。同样地,PAC组的TB-EPS多糖和蛋白质的含量最低,分别为13.88和41.88 mg·g-1。Con组和GAC组TB-EPS中多糖和蛋白质的含量没有明显规律。
3.4 LB-EPS和SMP的EEM分析图 5为3个反应器中LB-EPS和SMP的EEM图谱,表 2整理了EEM光谱中存在的峰及其对应的物质[19-20]。由EEM可知,LB-EPS和SMP具有荧光性质的物质主要有3大类:蛋白质(峰A,Ex/Em = 275/320 nm;峰B,Ex/Em = 240/340 nm;峰E,Ex/Em = 225/340 nm),腐殖酸(峰C,Ex/Em = 345/425 nm)和富里酸(峰D,Ex/Em = 265/445 nm;峰F,Ex/Em = 240/450 nm)。荧光类腐殖酸被认为是引起膜初始污染的主要物质,蛋白质则与不可逆污染高度相关[21]。Con组SMP中含有蛋白类、腐殖酸和富里酸,且蛋白质的荧光强度最高。PAC的加入明显降低了这3大类物质的荧光强度,即减少了对应物质的浓度,而GAC加入后荧光强度只有略微减弱。对于LB-EPS,PAC和GAC的加入都明显降低了3大类物质的含量,且PAC的作用更显著。
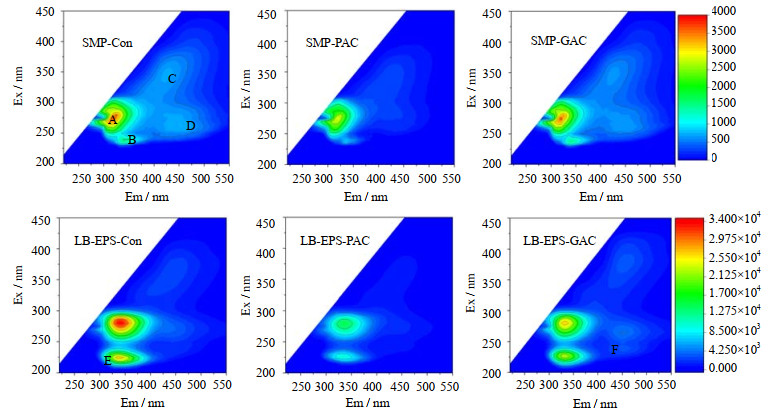
|
图 5 3个反应器中LB-EPS和SMP的EEM图谱 Fig.5 EEM spectra of LB-EPS and SMP from three MBRs |
|
|
表 2 EEM图谱峰及其对应的物质 Table 2 EEM spectra parameters and their associated substances |
絮体粒径的大小表明了活性污泥絮凝性质,越小的絮体粒径往往对膜的污染程度越高。由图 6可知,Con组的平均絮体粒径最小,为109 μm。加入PAC后,平均粒径有了明显的增大,达到128 μm。本实验所用PAC的粒径为75~150 μm,粒径分布在絮体粒径分布范围内。PAC具有很好的吸附性,能有效的附着游离细菌及微小絮体,甚至嵌入了活性污泥絮体中,从而形成了更大的絮体[22],且嵌有PAC的絮体粒径具有更好的机械强度,不易受到水力剪切力的破坏。GAC组的絮体粒径则为118 μm。由此可见,活性炭的加入可以起到增大污泥絮体粒径的作用,且粉末活性炭的效果好于颗粒活性炭。
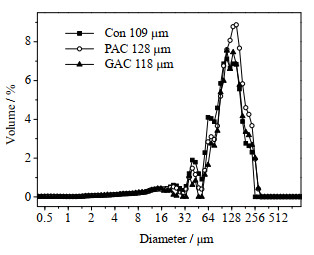
|
图 6 PAC和GAC对絮体粒径的影响 Fig.6 Effects of powdered and granular activated carbon on floc size distribution |
毛细吸水时间反映了污泥的过滤性能和脱水性能,与活性污泥絮体物理化学性质密切相关[23]。一般而言,污泥过滤性能好则膜污染趋势减缓。图 7显示了PAC和GAC对污泥CST的影响。其中,Con组的CST为25.8 s。加入PAC后,CST只有19.0 s降低了26%,而GAC组的CST为23.4 s,只降低了9%。推测PAC的加入明显的减少了SMP和LB-EPS的含量,从而提高了污泥的脱水性能。ROSENBERGER、IVERSEN等[24-25]也发现SMP、EPS的含量与活性污泥的过滤性能密切相关,且SMP含量的减少有效的提升了其过滤性,与本文结果一致。
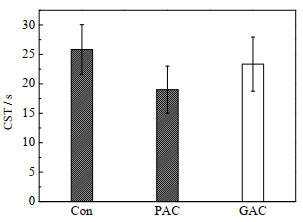
|
图 7 3个反应器中毛细吸水时间(CST)比较 Fig.7 Comparison of CST in three MBRs |
通过扫描电镜技术(SEM)观察了膜面滤饼层的形态结构(图 8)。从图中可以看出,在运行终点,膜表面形成了明显的污泥滤饼层。对比低倍率下的SEM图(图(a),(b)和(c)),发现呈条状的PAC (75~150 μm)沉积到了膜表面(图(b)),增加了污泥层的过滤性能。图(c)中的污泥层上未能发现大颗粒的GAC (500~710 μm)。相对于Con和PAC的膜面,GAC的污泥层表面比较光滑致密,菌胶团之间相互独立,且菌胶团数量更少。通过测定膜表面污染物总量,发现其TSS分别只有PAC的50%和Con的87%,因此GAC表面的污泥层厚度较薄。对比高倍率下的SEM图(图(d),(e)和(f)),可以清楚的看到,Con组细菌被EPS紧紧包裹,难以分辨细菌个体。PAC污泥层表面可以清晰的看到细菌直接连接着EPS,并有丝状物质连接。而且PAC污泥层具有明显的孔隙结构,利于过滤。GAC污泥层细菌个体分明,几乎看不到EPS。可能是由于GAC能有效的冲刷膜面污泥层,刮除了菌胶团表面的EPS。GAC组颗粒分明的污泥层结构及其更薄的厚度维持了较Con更慢的膜污染速率。

|
图 8 膜面污泥层SEM图 Fig.8 SEM micrographs of cake layers for Con, PAC, GAC |
(1) MBR对于TOC及NH4+-N的去除十分有效(> 97%),是否投加活性炭对去除效果无明显作用,且投加粉末活性炭的TOC去除率最高。
(2) 投加PAC与GAC的膜运行周期分别是未投加活性炭组的2.6倍和1.7倍。活性炭的加入增大了污泥絮体粒径,提升了污泥混合液过滤性能,且PAC好于GAC。投加PAC后,由于粉末活性炭的吸附作用,SMP和EPS含量相对于对照组都有明显的减少。投加GAC仅仅是是减少了LB-EPS含量。
(3) PAC通过改变污泥性质,包括提高污泥脱水性能,减少SMP、EPS含量等,减缓了膜污染。GAC则是通过冲刷膜面,抑制污泥层的形成,最终延长了膜运行周期。
| [1] |
JUDD S. The status of membrane bioreactor technology[J]. Trends in Biotechnology, 2008, 26(2): 109-116. DOI:10.1016/j.tibtech.2007.11.005 |
| [2] |
唐吴晓, 李卫星, 邢卫红. 膜生物反应器处理造纸废水试验研究[J]. 高校化学工程学报, 2016, 30(2): 439-445. TANG W X, LI W X, XING W H. Treatment of papermaking wastewater using a membrane bio-reactor[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(2): 439-445. DOI:10.3969/j.issn.1003-9015.2016.02.027 |
| [3] |
LIN H, GAO W, MENG F, et al. Membrane bioreactors for industrial wastewater treatment:A critical review[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(7): 677-740. DOI:10.1080/10643389.2010.526494 |
| [4] |
PING CHU H, LI X Y. Membrane fouling in a membrane bioreactor (MBR):Sludge cake formation and fouling characteristics[J]. Biotechnology and Bioengineering, 2005, 90(3): 323-331. DOI:10.1002/bit.20409 |
| [5] |
CHO B D, FANE A G. Fouling transients in nominally sub-critical flux operation of a membrane bioreactor[J]. Journal of Membrane Science, 2002, 209(2): 391-403. DOI:10.1016/S0376-7388(02)00321-6 |
| [6] |
BOUHABILA E H, BEN AïM R, BUISSON H. Fouling characterisation in membrane bioreactors[J]. Separation and Purification Technology, 2001, 22/23: 323-331. |
| [7] |
MA H, BOWMAN C N, DAVIS R H. Membrane fouling reduction by backpulsing and surface modification[J]. Journal of Membrane Science, 2000, 173(2): 191-200. DOI:10.1016/S0376-7388(00)00360-4 |
| [8] |
MA C, YU S, SHI W, et al. High concentration powdered activated carbon-membrane bioreactor (PAC-MBR) for slightly polluted surface water treatment at low temperature[J]. Bioresource Technology, 2012, 113: 136-142. DOI:10.1016/j.biortech.2012.02.007 |
| [9] |
NG C A, SUN D, ZHANG J, et al. Mechanisms of fouling control in membrane bioreactors by the addition of powdered activated carbon[J]. Separation Science and Technology, 2010, 45(7): 873-889. DOI:10.1080/01496391003667138 |
| [10] |
LI X Y, YANG S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41(5): 1022-1030. DOI:10.1016/j.watres.2006.06.037 |
| [11] |
DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017 |
| [12] |
LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275. |
| [13] |
JOHIR M A H, ARYAL R, VIGNESWARAN S, et al. Influence of supporting media in suspension on membrane fouling reduction in submerged membrane bioreactor (SMBR)[J]. Journal of Membrane Science, 2011, 374(1): 121-128. |
| [14] |
MENG F, ZHANG S, OH Y, et al. Fouling in membrane bioreactors:An updated review[J]. Water Research, 2017, 114: 151-180. DOI:10.1016/j.watres.2017.02.006 |
| [15] |
孙飞云, 李晓岩. 浸没式MBR中溶解性微生物产物聚集态演变影响膜污染机理研究[J]. 高校化学工程学报, 2013, 27(6): 1064-1071. SUN F Y, LI X Y. Effect of soluble microbial products (SMP) and its transformation on membrane fouling in a submerged membrane bioreactor (SMBR)[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(6): 1064-1071. |
| [16] |
YU L, YANG Y, YANG B, et al. Effects of solids retention time on the performance and microbial community structures in membrane bioreactors treating synthetic oil refinery wastewater[J]. Chemical Engineering Journal, 2018, 344: 462-468. DOI:10.1016/j.cej.2018.03.073 |
| [17] |
RAMESH A, LEE D J, WANG M L, et al. Biofouling in membrane bioreactor[J]. Separation Science and Technology, 2006, 41(7): 1345-1370. DOI:10.1080/01496390600633782 |
| [18] |
KIM J S, LEE C H, CHUN H D. Comparison of ultrafiltration characteristics between activated sludge and BAC sludge[J]. Water Research, 1998, 32(11): 3443-3451. DOI:10.1016/S0043-1354(98)00104-3 |
| [19] |
JACQUIN C, LESAGE G, TRABER J, et al. Three-dimensional excitation and emission matrix fluorescence (3DEEM) for quick and pseudo-quantitative determination of protein- and humic-like substances in full-scale membrane bioreactor (MBR)[J]. Water Research, 2017, 118: 82-92. DOI:10.1016/j.watres.2017.04.009 |
| [20] |
CHEN W, QIAN C, ZHOU K G, et al. Molecular spectroscopic characterization of membrane fouling:A critical review[J]. Chem, 2018, 4(7): 1492-1501. DOI:10.1016/j.chempr.2018.03.011 |
| [21] |
WANG H, DING A, GAN Z, et al. Fluorescent natural organic matter responsible for ultrafiltration membrane fouling:Fate, contributions and fouling mechanisms[J]. Chemosphere, 2017, 182: 183-193. DOI:10.1016/j.chemosphere.2017.04.148 |
| [22] |
LIN H, WANG F, DING L, et al. Enhanced performance of a submerged membrane bioreactor with powdered activated carbon addition for municipal secondary effluent treatment[J]. Journal of Hazardous Materials, 2011, 192(3): 1509-1514. DOI:10.1016/j.jhazmat.2011.06.071 |
| [23] |
POLLICE A, LAERA G, SATURNO D, et al. Effects of sludge retention time on the performance of a membrane bioreactor treating municipal sewage[J]. Journal of Membrane Science, 2008, 317(1/2): 65-70. |
| [24] |
ROSENBERGER S, KRAUME M. Filterability of activated sludge in membrane bioreactors[J]. Desalination, 2002, 146(1): 373-379. |
| [25] |
IVERSEN V, MEHREZ R, HORNG R Y, et al. Fouling mitigation through flocculants and adsorbents addition in membrane bioreactors:Comparing lab and pilot studies[J]. Journal of Membrane Science, 2009, 345(1/2): 21-30. |




