2. 浙江大学生物质化工教育部重点实验室, 浙江大学 化学工程与生物工程学院, 浙江 杭州 310027
2. Key Laboratory of Biomass Chemical Engineering of Ministry of Education, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
氮氧化物(NOx)是我国主要的大气污染物之一。NOx的过量排放会引起一系列大气污染现象,包括酸雨、光化学烟雾以及灰霾等[1-2]。因此,国家相继出台了《火电厂氮氧化物防治技术政策》(环发〔2010〕10号),全新修订的《火电厂大气污染物排放标准》(GB13223-2011)和《锅炉大气污染物排放标准》(GB13271-2014)。新标准实施以来,火电厂NOx减排成效显著。根据2018年《中国生态环境状况公报》,全国实现超低排放的煤电机组约8.1亿千瓦,占全国煤电总装机容量的80%。然而,燃煤工业锅炉的NOx减排仍任重道远。究其原因,我国的工业锅炉以中小型为主,量多面广,选择性催化还原(SCR) 高昂的投资和运行成本不利于其面向中小型锅炉推广,而选择性非催化还原(SNCR)因其脱硝效率低、存在氨泄漏风险等方面的问题,难以稳定满足新排放标准和氮氧化物总量减排的目标[3-4]。
络合吸收-生物还原法(chemical absorption-biological reduction, CABR)是21世纪提出的湿法脱硝技术[5-7]。CABR基于络合吸收剂Fe(Ⅱ)EDTA对烟气中NO的强大吸收能力,并通过反硝化菌和铁还原菌实现吸收剂的再生,特别适用于烟气量较小的中小型燃煤工业锅炉。在实验室条件下,CABR系统可以获得90% 左右的脱硝效率[8]。然而,实验室模拟烟气中氧气的体积分数φ(O2)远低于实际烟气中的水平。张士汉的研究表明,当φ(O2)从3%上升到8%,CABR的脱硝效率从90% 下降到66%[9]。因为氧气不仅会氧化Fe(Ⅱ)EDTA,还会抑制铁还原菌的活性。因此,进一步提高生物还原速率是CABR系统工业化应用的关键。络合吸收-电极生物膜反应器集成系统(chemical absorption-biofilm electrode reactor,CABER)是在CABR基础上发展而来的烟气脱硝新技术。CABER利用电极生物膜反应器代替了CABR中的滴滤塔或生物转鼓等传统的生物反应器,强化了生物还原速率,从而有效提高了脱硝效率。根据前期的研究结果[10],在实验室条件下,CABER的NO最大去除负荷从生物滴滤塔的18.78 g·m−3·h−1提高到电极生物膜反应器的104.2 g·m−3·h−1,最小气体停留时间从45 s缩短到20 s,最大的氧气耐受度从3% 提高到10%。
CABER一定程度上缓解了烟气中的氧气对生物还原体系的不利影响,但在电化学强化和氧气抑制的双重作用下,CABER的运行规律仍然未知。探明氧气作用下Fe(Ⅱ)EDTA的浓度变化规律和微生物群落结构的动态响应,对于进一步提高CABER脱硝效率和耐氧能力意义重大。本研究在实验室规模下,考察了不同φ(O2)胁迫下,CABER中Fe(Ⅱ)EDTA的浓度变化规律以及微生物群落结构的动态响应。
2 实验方法 2.1 实验试剂本实验所用试剂包括Na2EDTA (质量分数99.95%)、FeSO4(NH4)2SO4·6H2O、D-(+)-葡萄糖、FeCl3·6H2O,质量分数均为99.5%,由上海阿拉丁生化科技股份有限公司提供;所用气体包括NO(φ(NO)=5%,φ(N2)=95%)、CO2、氧气、氮气,体积分数均为99.999%,由浙江今工气体有限公司提供;所有其他化学试剂均为分析纯。
Fe(Ⅲ)EDTA溶液的制备:用去离子水将等摩尔的FeCl3·6H2O和Na2EDTA·2H2O配制成100 mmol·L-1的Fe(Ⅲ)EDTA溶液备用。
微量元素溶液的制备:精确称取240 mg CoCl2、990 mg MnCl2·4H2O、250 mg CuSO4·5H2O、220 mg Na2MoO4·2H2O、190 mg NiCl2·6H2O、14 mg H3BO4和100 mg ZnCl2溶于1 L去离子水备用。
2.2 微生物与培养基本实验采用之前驯化分离并保存的高效脱氮菌Pseudomonas sp. DN-2(GenBank accession NO. DQ811956)[11]和铁还原菌Escherichia coli FR-2(GenBank accession NO. DQ411026)[12]进行混合培养。基础培养基的配方如下:KH2PO4 (300 mg·L-1)、Na2SO3 (70 mg·L-1)、MgCl2 (100 mg·L-1)、CaCl2 (20 mg·L-1)、NaHCO3 (5 400 mg·L-1)和微量元素液(2 mL)。本实验开始前微生物已经过驯化挂膜,并处于稳态[13]。
2.3 实验装置本实验采用自主研发的络合吸收-电极生物膜反应器集成系统,集成系统原理如图 1所示。该集成系统包括配气系统、吸收装置、生物还原装置和尾气检测装置。模拟烟气由质量流量计(1)精确调控气体组分,经气体混合器充分混合后进入筛板塔(2),经络合吸收液吸收之后排出,并利用氮氧化物分析仪(7)监测尾气中的氮氧化物浓度,吸收液进入电极生物膜反应器(3)进行再生,从而实现集成系统的连续运行。

|
图 1 络合吸收-电极生物膜反应器集成系统示意图 Fig.1 Schematic diagram of the experimental setup (1. mass flow meter 2. sieveplate column 3. biofilm electrode reactor 4. thermostatic water bath 5. DC power 6. magnetic pump |
配制3 L的吸收液,其中Fe(Ⅲ)EDTA的浓度为10 mmol·L-1,调节pH至6.8左右,然后将吸收液转移到储液罐和电极生物膜反应器内。模拟烟气由N2、O2(0、3%、6%、9%)、CO2和NO(500 μL·L-1)组成,气体流量为1或2 L·min-1。循环液流量为10 L·h-1,葡萄糖的补给速率为0.5 g·L-1·h-1。每隔1 h测定液相中的Fe(Ⅱ)EDTA的浓度和尾气中NOx的浓度。Fe(Ⅱ)EDTA的测定采用分光光度法[12],尾气中的NOx由美国热电公司Thermo 42i-HL分析仪在线分析测定,溶解氧的检测采用YSI 550A便携式溶解氧仪。
在φ(O2)分别为0、3%、6% 和9% 的情况下,连续稳定运行反应器1周。从反应器的上、中、下各取3个挂有生物膜的填料,混合后置于20 mL的去离子水中,用玻璃棒充分搅拌,使生物膜与载体表面交联程度大大降低。再转移至超声波清洗机中,在100 W功率下超声1 min,可使填料表面99% 的生物膜剥落,形成菌液并离心,每个样品各取5 mL左右。将实验提取的DNA样品以及污泥样品送至生工生物工程(上海)股份有限公司进行PCR扩增、定量混合、高通量测序等一系列操作。
3 结果与讨论作者通过研究不同氧气浓度下,CABER集成系统中Fe(Ⅱ)EDTA浓度、溶解氧和脱硝效率的变化以及微生物群落结构的动态响应,全面分析了氧气对CABER的影响,并对氧气作用下CABER的运行规律进行了讨论。
3.1 氧气对CABER脱硝效率的影响氧气对CABER脱硝效率的影响见图 2,图中c0(Fe(Ⅲ)EDTA)为Fe(Ⅲ)EDTA初始物质的量浓度,ρ0(glucose)为初始葡萄糖质量浓度。由图 2可以看到,在实验室规模下,模拟烟气中氧气浓度的变化对CABER集成系统的脱硝效率没有明显的影响。即使φ(O2)上升到9%,在系统稳定之后,其脱硝效率仍能达到90% 左右。但是φ(O2)从0突变到3% 时,CABER的脱硝效率出现了明显的下降。出现这种现象的原因可能有2个,1是氧气对Fe(Ⅱ)EDTA的氧化作用使吸收液中的Fe(Ⅱ)EDTA浓度下降;2是无氧环境转换为有氧环境,在无氧环境下已经趋于稳定的微生物群落结构受到了冲击,微生物需要适应新的环境。因此氧气浓度变化初期,脱硝效率下降了将近15%。经过4 d的连续运行之后,脱硝效率重新回到了90% 以上,说明成熟的微生物群落体系具有较强的适应能力。其后继续提高φ(O2),对于集成系统的冲击明显减小,脱硝效率的恢复时间也明显缩短。而在CABR系统中,相同条件下,当φ(O2)上升到8% 时,脱硝效率下降到66%[9]。与传统的CABR系统相比,CABER的适应能力、抗冲击负荷能力得到了大幅提高。

|
图 2 氧气对CABER集成系统脱硝效率的影响 Fig.2 Effects of oxygen on NO removal efficiency of CABER V = 3 L, c0(Fe(Ⅲ)EDTA) = 10 mmol·L-1, φ(NO) = 500 μL·L-1, ρ0(glucose) = 0.5 g·L-1, feed rate of glucose: 0.1 g·L-1·h-1, I = 0.04 A |
在氧气的作用下,Fe(Ⅱ)EDTA极易被氧化为Fe(Ⅲ)EDTA,从而影响CABER体系中的Fe(Ⅱ)EDTA浓度水平[14]。Fe(Ⅱ)EDTA浓度水平又直接影响NO的络合吸收速率,因此,Fe(Ⅱ)EDTA的变化规律可以反映出CABER体系对不同φ(O2)的耐受能力。从图 3可以看到,在稳态运行的CABER集成系统中,当模拟烟气中不含氧气时,Fe(Ⅱ)EDTA的浓度水平维持在5 mmol·L-1左右;当烟气中的φ(O2)上升到3% 时,Fe(Ⅱ)EDTA浓度略有下降,但仍维持在4 mmol·L-1以上;随着φ(O2)继续提高,Fe(Ⅱ)EDTA浓度会出现一些波动,但是总体水平仍维持在4 mmol·L-1附近。前期研究发现,当Fe(Ⅱ)EDTA浓度保持在3 mmol·L-1以上时,CABR的脱硝效率可以维持在90% 以上[9]。因此,本实验的结果表明,CABER通过强化生物还原过程,提升了Fe(Ⅲ)EDTA的还原速率,使Fe(Ⅱ)EDTA浓度始终保持在较高水平,从而明显改善了集成系统对氧气的耐受能力。

|
图 3 不同氧气体积分数下吸收液中Fe(Ⅱ)EDTA的浓度变化曲线 Fig.3 Profiles of Fe(Ⅱ)EDTA concentrations in absorbent solution at different oxygen concentrations V = 3 L, c0(Fe(Ⅲ)EDTA) = 10 mmol·L-1, φ(NO) = 500 μL·L-1, ρ0(glucose) = 0.5 g·L-1, feed rate of glucose: 0.1 g·L-1·h-1, I = 0.04 A |
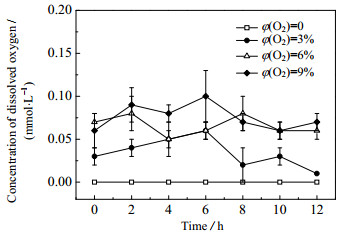
由于CABER集成系统采用筛板塔和电极生物膜反应器的双塔结构,烟气中的氧气不会直接接触到填料表面的微生物,但是吸收液中的溶解氧仍会对厌氧微生物造成影响。如图 4所示,随着氧气体积分数的提高,吸收液中的溶解氧也会随之提高。当φ(O2)从0提高到3%,吸收液中的溶解氧质量浓度从0提高到0.04 mg·L-1左右。由于Fe(Ⅱ)EDTA极易与氧气发生反应生成Fe(Ⅲ)EDTA,并且其过程速率与NO的络合吸收速率接近[15]。因此大部分的溶解氧被吸收液中的Fe(Ⅱ)EDTA快速清除。当氧气体积分数提高到9%,吸收液中的溶解氧质量浓度也仅在0.06~0.1 mg·L-1。根据李伟等[16]的研究结果,当溶解氧质量浓度大于1 mg·L-1时,反硝化作用将停止,当溶解氧大于0.2 mg·L-1时,反硝化作用将会变弱。在CABER集成系统中,Fe(Ⅱ)EDTA浓度始终保持在较高水平,因此可以起到溶解氧清除剂的作用,大大减少溶解氧对微生物的抑制作用,保证了反硝化菌的还原活性,从而确保了CABER在高氧气浓度下的脱硝性能。
|
图 4 不同氧气体积分数下吸收液中溶解氧的变化曲线 Fig.4 Profiles of dissolved oxygen in absorbent solution at different oxygen concentrations V = 3 L, c0(Fe(Ⅲ)EDTA) = 10 mmol·L-1, φ(NO) = 500 μL·L-1, ρ0(glucose) = 0.5 g·L-1, feed rate of glucose: 0.1 g·L-1·h-1, I = 0.04 A |
为研究氧气对CABER集成系统微生物群落结构的影响,在每个氧气浓度下系统达到稳态之后,取微生物样品进行DNA提取、扩增和高通量测序,结果见表 1。表中,Reads为高通量测序得到的基因序列,Raw为原始的基因序列,Clean为优化序列,OTUs为可操作分类单元,不同的16S rRNA序列的相似性大于98%就可以把它定义为一个OTU,每个OTU对应于一个不同的16S rRNA序列,也就是每个OTU对应于一个不同的细菌(微生物)种。从表 1可以看到,各样品克隆文库的覆盖率Good’s coverage均超过了0.95,测序结果可以反映样品的真实情况。不同氧气浓度下提取的微生物样品经过总基因组序列提取,然后扩增V3-V4区的16S rRNA基因,分别获得15 458、15 260、14 457和16 420个优化序列,在相似度97% 时,将所得序列归类为OUTs进行系统发育多样性分析。Chao1指数显示,随着φ(O2)从0提高到6%,微生物群落结构多样性略有降低,但当φ(O2)提高到9%时,微生物群落结构多样性又有明显的提升。这可能是由于氧气浓度提高导致吸收液中的溶解氧浓度上升,在初期抑制了部分厌氧菌的生长,而在后期又激活了好氧微生物的生长,从而使微生物群落结构表现出这样的变化趋势。但总体来说,如Shannon多样性指数所示,不同氧气浓度下的微生物群落结构多样性差异不大。而在反应器内部的不同位置,微生物群落结构多样性的差异反而比较明显。
|
|
表 1 样品信息和高通量测序得到的多样性指数分析(相似性97%) Table 1 Sample information and analysis of diversity indexes obtained by high-throughput sequencing (97% similarity) |
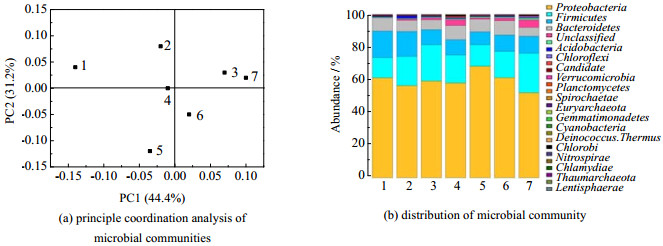
不同的φ(O2)对CABER的脱硝效率、Fe(Ⅱ)EDTA浓度和溶解氧浓度都带来了影响。Xia等[15]的研究表明,Fe(Ⅱ)EDTA的氧化速率常数随着φ(O2)升高基本保持稳定,因此烟气中的φ(O2)与Fe(Ⅱ)EDTA的氧化速率呈正相关,φ(O2)的上升导致Fe(Ⅱ)EDTA被过量氧化。然而从图 4可以看到,Fe(Ⅱ)EDTA浓度保持相对稳定,说明Fe(Ⅲ)EDTA的生物还原速率也得到了提升。因此,CABER之所以能够表现出强大的氧气耐受能力,微生物的还原能力起到了至关重要的作用。随着外部环境的变化,微生物通过群落结构的动态调整,使微生物还原能力得到保证。图 5(a)展示了不同φ(O2)下,微生物群落结构在门水平上的相似度,图中,PC1和PC2是主成分分析(PCA)中的两个维度,从图中可以看到,φ(O2)=0时的微生物群落结构与有氧条件下的微生物群落结构之间存在较大差异,#1点与其他点之间均存在较大的距离,而#2、#3、#4之间的差异相对较小。造成此差异的主要因素是吸收液中的溶解氧浓度,即PC1(44.4%)。#5、#6和#7代表了φ(O2)=6% 时电极生物膜反应器上、中、下层的微生物群落结构。由于吸收液在反应器中的流向为自下而上,因此下层的微生物接触的吸收液中Fe(Ⅱ)EDTA-NO和溶解氧的浓度较高,而Fe(Ⅱ)EDTA的浓度较低。由于本实验中NO的浓度不变,影响反应器不同位置微生物群落结构的主要因素是溶解氧浓度和Fe(Ⅱ)EDTA浓度。从图 5(b)中可以看到这样的变化规律,随着氧气浓度提高,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)等偏向于厌氧环境的微生物含量逐渐下降,而厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)等兼性厌氧或需氧型微生物的占比明显上升。而在φ(O2)=6% 时,反应器中不同位置的微生物也因为溶解氧浓度水平的不同而呈现出较大的差异,如在反应器上层,厚壁菌门的相对丰度为12.6%,而在反应器下层,厚壁菌门的相对丰度达到25.9%。反应器上部接触的吸收液由于经过了微生物的还原以及溶解氧的消耗,其群落结构更接近于无氧条件,而反应器下部则正好相反。
|
图 5 门水平上的微生物群落结构分析 Fig.5 Analysis of microbial community structure at phylum level (1. 0% O2 2. 3% O2 3. 6% O2 4. 9% O2 5. 6% O2 upper layer 6. 6% O2 middle layer 7. 6% O2 under layer) |
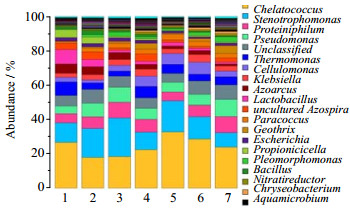
溶解氧质量浓度对微生物群落结构的影响已经在门水平上得到了很好的体现,而Fe(Ⅱ)EDTA浓度对微生物群落结构的影响可以在属水平上进行深入分析。图 6给出了相对丰度前20的菌属,其中鳌台球菌属(Chelatococcus)、假单胞菌属(Pseudomonas)、寡养单胞菌属(Stenotrophomonas)、热单胞菌属(Thermomonas)和副球菌属(Paracoccus)等反硝化相关的微生物[17-20]的相对丰度总体保持稳定,φ(O2)=0时相对丰度为53.8%,φ(O2)=3%时相对丰度为50.5%,φ(O2)=6%时相对丰度为53.6%,φ(O2)=9%时相对丰度为48.9%。由于反硝化菌的种类繁多,在未列出的菌属中也可能包含反硝化微生物,可以认为反硝化相关的微生物在φ(O2)变化的情况下,总体丰度保持了稳定,是CABER脱硝效率保持稳定的基础。而与铁还原相关的微生物,如克雷伯氏菌属(Klebsiella)、埃希氏杆菌属(Escherichia)和地发菌属(Geothrix)[21-23],随着φ(O2)上升,相对丰度明显上升。当φ(O2)=0时,主要的铁还原菌相对丰度为4.2%,当φ(O2)=3% 时,相对丰度上升到5.3%,而当φ(O2)=9% 时,相对丰度上升到8.3%。随着φ(O2)上升,Fe(Ⅱ)EDTA氧化反应加剧,Fe(Ⅲ)EDTA的还原负荷上升,但是铁还原菌相对丰度的上升,维持了吸收液中Fe(Ⅱ)EDTA浓度的相对稳定,从而保证了集成系统的稳定运行。这从微生物群落结构的角度反映了CABER应对氧气浓度上升的内在机制。
|
图 6 微生物群落在属水平上的分布 Fig.6 Distribution of microbial community at the genus level (1. 0% O2 2. 3% O2 3. 6% O2 4. 9% O2 5. 6% O2 upper layer 6. 6% O2 middle layer 7. 6% O2 under layer) |
本研究对不同氧气体积分数下CABER脱硝效率和微生物群落结构的变化进行了分析。结果表明,CABER具有强大的氧气耐受能力,可以在氧气体积分数φ(O2)=9%下依然维持高效运行。通过监测Fe(Ⅱ)EDTA和溶解氧浓度发现,溶解氧因为Fe(Ⅱ)EDTA的存在而得到了有效清除,从而降低了溶解氧对微生物活性的影响。在φ(O2)上升的情况下,脱氮菌的相对丰度保持稳定,从而保证了脱硝效率的相对稳定;而铁还原菌的相对丰度会随之上升,抵消了Fe(Ⅲ)EDTA还原负荷上升带来的影响。微生物群落结构的变化规律揭示了CABER耐受氧气冲击的内在机制。
| [1] |
白春礼. 中国科学院大气灰霾追因与控制研究进展[J]. 中国科学院院刊, 2017, 32(3): 215-218. BAI C L. Research progress on formation mechanism and control strategies of haze in Chinese Academy of Sciences[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(3): 215-218. |
| [2] |
牛彧文, 浦静姣, 邓芳萍, 等. 1992-2012年浙江省酸雨变化特征及成因分析[J]. 中国环境监测, 2017, 33(6): 55-62. NIU Y W, PU J J, DENG F P, et al. Analysis on spatial and temporal evolution of acid rain and its causes from 1992 to 2012 in Zhejiang[J]. Environmental Monitoring in China, 2017, 33(6): 55-62. |
| [3] |
吴楠楠, 卢晗, 王灵志, 等. 燃煤工业锅炉脱硝费用效益分析[J]. 环境工程, 2018, 36(2): 104-108. WU N N, LU H, WANG L Z, et al. Cost benefit analysis of denitration in coal-fired industrial boilers[J]. Environmental Engineering, 2018, 36(2): 104-108. |
| [4] |
王新雷, 罗家松, 田雪沁, 等. 京津冀地区烟气脱硝工艺现状及综合评价[J]. 节能技术, 2018, 36(2): 145-150. WANG X L, LUO J S, TIAN X Q, et al. Technics situation and synthesis evaluation of flue gas De-NOx in Jing-jin-ji District[J]. Energy Conservation Technology, 2018, 36(2): 145-150. |
| [5] |
MAAS P V D, BOSCH P V D, KLAPWIJK B, et al. NOx removal from flue gas by an integrated physicochemical absorption and biological denitrification process[J]. Biotechnology & Bioengineering, 2005, 90(4): 433-441. |
| [6] |
LI W, WU C Z, SHI Y. Metal chelate absorption coupled with microbial reduction for the removal of NOx from flue gas[J]. Journal of Chemical Technology & Biotechnology, 2006, 81(3): 306-311. |
| [7] |
CHEN J, DAI Q, QIAN H, et al. Nitric oxide enhanced reduction in a rotating drum biofilter coupled with absorption by FeⅡ(EDTA)[J]. Journal of Chemical Technology & Biotechnology, 2013, 88(4): 579-584. |
| [8] |
刘楠, 吴成志, 刘芸, 等. Fe(Ⅱ)EDTA吸收-微生物还原体系处理烟气中NO试验[J]. 浙江大学学报(工学版), 2011, 45(12): 2196-2201. LIU N, WU C Z, LIU Y, et al. Evaluation of Fe(Ⅱ)EDTA absorption-biological reduction integrated process on removal of NO from flue gas in lab-scale[J]. Journal of Zhejiang University (Engineering Science Edition), 2011, 45(12): 2196-2201. DOI:10.3785/j.issn.1008-973X.2011.12.019 |
| [9] |
ZHANG S H, SHI Y, LI W. Biological and chemical interaction of oxygen on the reduction of Fe(Ⅲ)EDTA in a chemical absorption-biological reduction integrated NOx removal system[J]. Applied Microbiology and Biotechnology, 2012, 93(6): 2653-2659. DOI:10.1007/s00253-011-3573-z |
| [10] |
XIA Y F, SHI Y, ZHOU Y, et al. A new approach for NOx removal from flue gas using a biofilm electrode reactor coupled with chemical absorption[J]. Energy & Fuels, 2014, 28(5): 3332-3338. |
| [11] |
ZHANG S H, LI W, WU C Z, et al. Reduction of Fe(Ⅱ)EDTA-NO by a newly isolated Pseudomonas sp. strain DN-2 in NOx scrubber solution[J]. Applied Microbiology and Biotechnology, 2007, 76(5): 1181-1187. DOI:10.1007/s00253-007-1078-6 |
| [12] |
LI W, WU C Z, ZHANG S H, et al. Evaluation of microbial reduction of Fe(Ⅲ)EDTA in a chemical absorption-biological reduction integrated NOx removal system[J]. Environmental Science & Technology, 2007, 41(2): 639-644. |
| [13] |
XIA Y F, CHEN H, ZHAO J K, et al. Shifts of biomass and microbial community structure in response to current densities in a biofilm electrode reactor for NOx removal[J]. Energy & Fuels, 2019, 33(6): 5415-5421. |
| [14] |
LI W, LI M F, ZHANG L, et al. Enhanced NOx removal performance and microbial community shifts in an oxygen-resistance chemical absorption–biological reduction integrated system[J]. Chemical Engineering Journal, 2016, 290: 185-192. DOI:10.1016/j.cej.2016.01.044 |
| [15] |
XIA Y F, LU B H, LIU N, et al. NOx removal in chemical absorption–biological reduction integrated system: Process rate and rate-limiting step[J]. Bioresource Technology, 2013, 149: 184-190. DOI:10.1016/j.biortech.2013.09.056 |
| [16] |
LI W, ZHANG L, LIU N, et al. Evaluation of NO removal from flue gas by a chemical absorption–biological reduction integrated system: Complexed NO conversion pathways and nitrogen equilibrium analysis[J]. Energy & Fuels, 2014, 28(7): 4725-4730. |
| [17] |
ZHANG H, ZHAO Z F, CHEN S, et al. Paracoccus versutus KS293 adaptation to aerobic and anaerobic denitrification: Insights from nitrogen removal, functional gene abundance, and proteomic profiling analysis[J]. Bioresource Technology, 2018, 260: 321-328. DOI:10.1016/j.biortech.2018.03.123 |
| [18] |
ZHU J, YU L, BAKKEN L, et al. Controlled induction of denitrification in Pseudomonas aureofaciens: A simplified denitrifier method for dual isotope analysis in NO3-[J]. Science of the Total Environment, 2018, 633: 1370-1378. DOI:10.1016/j.scitotenv.2018.03.236 |
| [19] |
KOSTRYTSIA A, PAPIRIO S, MORRISON L, et al. Biokinetics of microbial consortia using biogenic sulfur as a novel electron donor for sustainable denitrification[J]. Bioresource Technology, 2018, 270: 359-367. DOI:10.1016/j.biortech.2018.09.044 |
| [20] |
WEI Z D, HUANG S B, ZHANG Y Q, et al. Characterization of extracellular polymeric substances produced during nitrate removal by a thermophilic bacterium Chelatococcus daeguensis TAD1 in batch cultures[J]. RSC Advances, 2017, 70(7): 44265-44271. |
| [21] |
ZHOU Z M, JING G H, ZHENG X. Reduction of Fe(Ⅲ)EDTA by Klebsiella Sp. Strain FD-3 in NOx scrubber solutions[J]. Bioresource Technology, 2013, 132: 210-216. DOI:10.1016/j.biortech.2013.01.022 |
| [22] |
KLUEGLEIN N, LOSEKANN-BEHRENS T, OBST M, et al. Magnetite formation by the novel Fe(Ⅲ)-reducing Geothrix fermentans strain HradG1 isolated from a hydrocarbon-contaminated sediment with increased magnetic susceptibility[J]. Geomicrobiology Journal, 2013, 30(10): 863-873. DOI:10.1080/01490451.2013.790922 |
| [23] |
GESCHER J S, CORDOVA C D, SPORMANN A M. Dissimilatory iron reduction in Escherichia coli: Identification of CymA of Shewanella oneidensis and NapC of E. coli as ferric reductases[J]. Molecular Microbiology, 2008, 68(3): 706-719. DOI:10.1111/j.1365-2958.2008.06183.x |




