邻苯二胺(o-phenylenediamine,OPD)等苯胺类有机化合物是制造染料、农药、橡胶、油漆等化学制品的重要原料或中间体,具有毒性以及致畸和致癌作用,随污水排入环境后,会对水生生物和人体健康产生潜在危害。苯胺类化合物化学结构稳定,不易分解,可生化性差,在有机污染物的去除实验中具有较强的代表性,利用传统物理化学手段或生物降解等水处理技术难以有效去除,高级氧化技术处理苯胺类污水成为研究热点[1]。
Fe2+/H2O2经典芬顿试剂由于产生的·OH氧化能力极强,在已知氧化剂中仅弱于F2,可几乎无选择性地氧化降解污水中的有机物[2],且整体工艺操作简单,是目前最常用的高级氧化技术之一[3-5]。如贾永强等[6-8]采用芬顿高级氧化技术分别用于高浓度造纸污水、高浓度印染污水和焦化污水等难降解有机污水的处理,均取得了较好的降解效果。Fe2+/H2O2经典芬顿的氧化性能受pH值的严重影响[9-10],在处理废水时需使用大量的酸液将pH值控制在3以下,降解完成后,还需要使用大量的碱液进行中和,造成污水的处理成本大幅度增加[11-12]。为解决Fe2+/H2O2经典芬顿pH适应范围窄的问题,以固相复合材料催化H2O2分解产生·OH的多相类芬顿技术获得了广泛研究[13-15]。Deng等[16]采用液相沉积法制备钒酸铁催化剂,将降解的pH适应范围拓展到3.0~8.0。Sun等[17]在中性条件下采用水热法制备钒酸铁类Fenton催化剂,样品长度相对较短,纳米棒的分散性更好,在pH为1.0~9.0时获得了较高的氧化降解能力。这些多相类芬顿技术拓宽了反应适宜的pH范围[18-20],但反应活性低和多相催化剂制作成本高的问题一直未得到根本性解决,实际应用受到严重制约[21-23]。
近年来,采用Fe3+催化H2O2产生·OH自由基的Fe3+/H2O2类芬顿高级氧化技术渐有研究。但是,有关H2O2和Fe3+药剂投加顺序对Fe3+/H2O2类芬顿体系pH适应性以及Fe3+/H2O2类芬顿体系碱性条件下反应机理的研究尚无文献报道。为解决Fe2+/H2O2经典芬顿降解污水过程pH适应范围窄和多相类芬顿催化活性低的问题,本研究以OPD为目标污染物,研究了药剂投加顺序、H2O2投加浓度、Fe3+投加浓度、pH值等反应条件对Fe3+/H2O2类芬顿降解性能的影响,并对Fe3+/H2O2类芬顿体系的反应机理进行了初步探讨。
2 实验材料和方法仪器:pH测试仪(PHS-3C型,上海佑科仪器仪表有限公司),温湿度记录仪(TH22R-XX型,深圳市华汉维科技有限公司),COD测试仪(JHR-2型,青岛金仕达电子科技有限公司),数显恒温水浴锅(HH-S,赛得利斯实验分析仪器制造厂)。
试剂:双氧水(H2O2,质量分数为33%)、Fe2(SO4)3(分析纯)、FeSO4(分析纯)、OPD(C6H8N2)、Ag2SO4(分析纯)、(NH4)2SO4·FeSO4·6H2O(分析纯)、K2Cr2O7(分析纯)、H2SO4(分析纯)均购于国药集团化学试剂有限公司。
模拟废水的配制:用精密天平准确称取一定质量的OPD药剂,用去离子水在2 000 mL容量瓶中配制成一定浓度的OPD模拟废水。模拟废水的pH用0.05 mol·L-1的硫酸溶液和0.10 mol·L-1的氢氧化钠溶液进行调节。
降解实验:实验前,用量筒准确量取300 mL OPD溶液置于恒温水浴锅中圆底烧瓶内,开启电源加热至恒温水浴锅设定的反应温度。开启搅拌机(转速为600 r·min-1),按照“H2O2+Fe3+”的药剂投加顺序(先投加H2O2,间隔2 min,再投加Fe2(SO4)3)或“Fe3++H2O2”的药剂投加顺序(先投加Fe2(SO4)3,间隔2 min,再投加H2O2)向OPD污水中投加H2O2和Fe2(SO4)3固体粉末,同时启动温湿度记录仪,记录溶液的反应时间。反应开始后每间隔10 min移取样液,用102型中速定性滤纸对样液进行过滤,滤液采用重铬酸钾法测定溶液的化学需氧量(chemical oxygen demand,COD)浓度,溶液的COD浓度降解量Δρ、降解率η、平均降解速率νCOD分别为
| $ {\rm{\Delta }}\rho {\rm{ = }}{\rho _{\rm{0}}} - \rho $ | (1) |
| $ \eta {\rm{ = \Delta }}\rho /{\rho _{\rm{0}}} \times 100\% $ | (2) |
| $ {\nu _{\rm{COD}}}{\rm{ = }}\Delta {\rho _{\rm{0}}}/t $ | (3) |
式中:Δρ为OPD溶液降解前后的COD浓度降解量,mg·L-1;ρ0为OPD溶液的COD浓度初始值,mg·L-1;ρ为OPD溶液降解后的COD浓度值,mg·L-1;η为OPD溶液的COD降解率,%;νCOD为OPD溶液的COD浓度平均降解速率,mg·L-1·min-1;t为反应时间,min。
3 实验结果与讨论 3.1 药剂投加顺序的影响如图 1所示为“H2O2+Fe3+”和“Fe3++H2O2”药剂投加顺序对Fe3+/H2O2类芬顿降解性能影响的变化规律。反应条件为:OPD污水浓度为0.04 mol·L-1,初始反应温度θ0=30 ℃,H2O2投加浓度为0.20 mol·L-1,Fe3+投加浓度为10 mmol·L-1,反应时间为30 min。
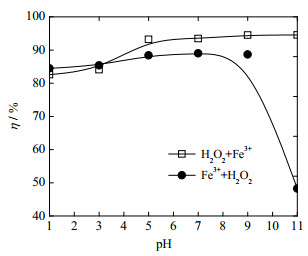
|
图 1 药剂投加顺序对降解性能的影响 Fig.1 Effects of reactant dosing order on degradation performance |
由图 1可知,pH值为1.0和3.1时,“H2O2+Fe3+”和“Fe3++H2O2”药剂投加顺序下的OPD污水的降解率分别为82.6%、84.1%和84.5%、85.4%,2种药剂投加顺序下的OPD污水的降解率较为接近。这是由于pH值较低时,溶液的H+浓度高,Fe3+不易产生沉淀所致。溶液pH值为5.0、7.8、9.0、11.3时,“H2O2+Fe3+”药剂投加顺序下的OPD污水的降解率分别为93.2%、93.5%、94.5%和94.5%,“Fe3++H2O2”药剂投加顺序下的OPD污水的降解率分别为88.4%、89.0%、88.7%和48.3%,在pH=5.0~11.3,“H2O2+Fe3+”药剂投加顺序下的OPD污水的降解率明显高于“Fe3++H2O2”药剂投加顺序下的OPD污水的降解率,在pH值为9.0和11.3时的碱性条件下降解效果更为明显。这是由于在pH值5.0至11.3的较大范围内先投加Fe2(SO4)3药剂时,溶液中的部分Fe3+在投加H2O2前就形成了沉淀从溶液中析出,从而减少了催化H2O2产生·OH的机会。
3.2 H2O2投加浓度的影响如图 2所示为H2O2投加浓度c(H2O2)对Fe3+/H2O2类芬顿降解OPD污水性能的影响,反应条件:OPD污水浓度为0.04 mol·L-1,θ0=30 ℃,pH=7.8,Fe3+投加浓度为10 mmol·L-1,H2O2的投加浓度范围为0.05~0.30 mol·L-1,药剂投加顺序为“H2O2+ Fe3+”。
| $ {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + H}}{{\rm{O}}_{\rm{2}}} \cdot {\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (4) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }} \cdot {\rm{OH + H}}{{\rm{O}}^ - } $ | (5) |
| $ {\rm{RH + }} \cdot {\rm{OH}} \to {{\rm{H}}_{\rm{2}}}{\rm{O + R}} \cdot \to {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (6) |
| $ {{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ + }} \cdot {\rm{OH}} \to {{\rm{H}}_{\rm{2}}}{\rm{O + H}}{{\rm{O}}_{\rm{2}}} \cdot $ | (7) |
| $ \cdot {\rm{OH + H}}{{\rm{O}}_{\rm{2}}} \cdot \to {{\rm{H}}_{\rm{2}}}{\rm{O + }}{{\rm{O}}_{\rm{2}}} $ | (8) |
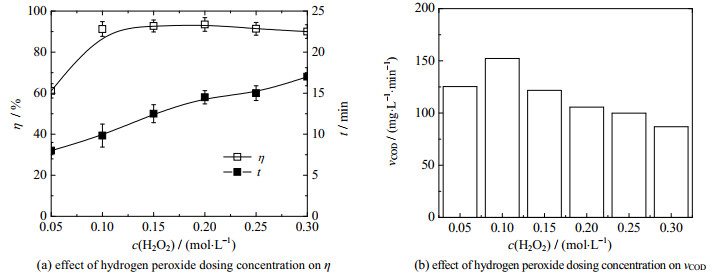
|
图 2 H2O2投加浓度对降解性能的影响 Fig.2 Effects of hydrogen peroxide dosing concentration on degradation performance |
由图 2(a)和(b)可知,H2O2的投加浓度由0.05增加到0.20 mol·L-1时,OPD污水的降解率由61.1% 增加到93.5%;继续增加H2O2投加浓度至0.30 mol·L-1时,降解率降低至90.0%,OPD的降解率随H2O2投加浓度的增加呈现先升高后降低的规律[24]。由图 2(b)可以看出,H2O2的投加浓度由0.05增加到0.10 mol·L-1时,Fe3+/H2O2体系降解OPD污水的平均降解速率由125.3增加到152.2 mg·L-1·min-1;继续增加H2O2投加浓度至0.30 mol·L-1时,Fe3+/H2O2体系降解OPD污水的平均降解速率降为86.8 mg·L-1·min-1,平均降解速率随H2O2投加浓度的增加呈现先升高后降低的规律。这主要是由于在H2O2的投加浓度较低时,Fe3+和Fe2+循环催化H2O2(式(4)、(5))生成的·OH和HO2·等自由基通过式(6)几乎全部与OPD反应,此时的降解率和降解反应速率会随着H2O2投加浓度的升高而升高;当H2O2的投加浓度达到一定数值后,H2O2、·OH和HO2·等自由基会通过式(7)和式(8)产生自我消耗,造成部分双氧水发生无效分解[25],导致OPD的降解率随H2O2投加浓度的升高而降低。
3.3 Fe3+投加浓度的影响如图 3所示为Fe3+投加浓度c(Fe3+)对Fe3+/H2O2类芬顿降解OPD污水性能的影响,反应条件为:OPD污水浓度为0.04 mol·L-1,θ0=30 ℃,pH=7.8;H2O2投加浓度为0.20 mol·L-1,反应时间为30 min,Fe3+投加浓度范围为5~30 mmol·L-1,药剂投加顺序为“H2O2+ Fe3+”。
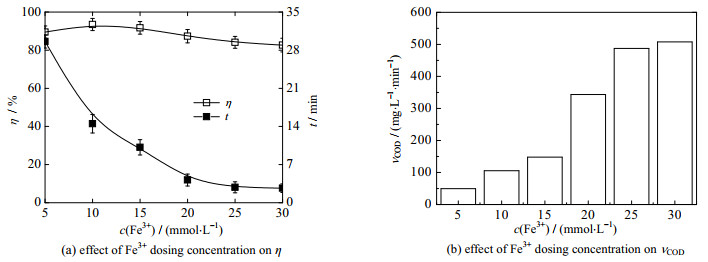
|
图 3 Fe3+投加浓度对降解性能的影响 Fig.3 Effects of Fe3+ dosing concentration on degradation performance |
由图 3(a)可以看出,Fe3+投加浓度由5 mmol·L-1增加到10 mmol·L-1时,OPD污水的降解率由89.5%增加到93.5%;继续增加Fe3+投加浓度至30 mmol·L-1时,降解率依次降低至82.7%,随着Fe3+投加浓度的增加,OPD污水的降解率呈现先升高后降低的规律[26]。由图 2(a)和(b)还可以看出,Fe3+投加浓度由5 mmol·L-1增加到30 mmol·L-1时,降解反应时间由29.6 min缩短至2.7 min,Fe3+/H2O2体系降解OPD污水的平均降解速率由49.6增加到507.8 mg· L-1·min-1,降解反应时间随Fe3+投加浓度的增加呈现迅速减少的规律,平均降解速率随Fe3+投加浓度的增加呈现迅速增加的规律。这主要是由于Fe3+浓度过低时,式(4)、(5)的反应速率慢,抑制·OH和HO2·等自由基的产生,影响自由基和OPD之间的反应,造成反应时间长、降解效率低;随着Fe3+投加浓度的增大,反应速率加快,自由基的产生数量增加,降解效率随之增加;当Fe3+投加浓度达到一定数值时,有利于OPD分子降解的式(4)、(5)和引起自身消耗的式(7)、(8)的反应速率均同时快速增加,当·OH和HO2·等自由基的自身消耗反应速率超过有机物降解反应速率时,降解效率随之下降。
3.4 初始反应温度的影响如图 4所示为初始反应温度对Fe3+/H2O2类芬顿体系降解OPD污水性能的影响,反应条件为:OPD污水浓度为0.04 mol·L-1,pH=7.8;H2O2投加浓度为0.2 mol·L-1,Fe3+投加浓度为10 mmol·L-1,初始反应温度范围为10~60 ℃,药剂投加顺序为“H2O2+ Fe3+”。
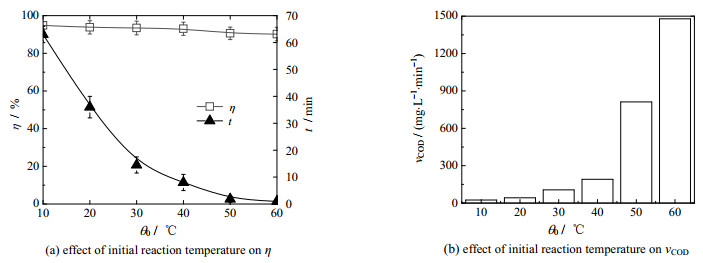
|
图 4 初始反应温度对降解性能的影响 Fig.4 Effects of initial reaction temperature concentration on degradation performance |
由图 4(a)和(b)可知,当初始反应温度为10 ℃时,OPD污水的降解率为94.8%,降解反应时间为63.0 min,Fe3+/H2O2体系降解OPD污水的平均降解速率为24.7 mg·L-1·min-1;当初始反应温度为60 ℃时,OPD污水的降解率为90.2%,降解反应时间为1.0 min,Fe3+/H2O2体系降解OPD污水的平均降解速率为1 479.0 mg·L-1·min-1。OPD污水的降解率随初始反应温度的增加略微降低,降解反应时间随初始反应温度的增加迅速减少,溶液的平均降解速率随初始反应温度的增加迅速增加。降解反应速率随反应温度的增加而增加主要是由于反应温度升高时,活化分子数量迅速增加,提高了反应的有效碰撞几率[27]。OPD污水的降解率随初始反应温度的增加略微降低,主要是由于反应温度升高时,·OH和HO2·等自由基在快速氧化降解OPD的同时,由公式(7)引起的自身消耗以及H2O2热分解生成O2和H2O的速率亦同时增大,造成对OPD污水的降解性能下降所致[28]。
3.5 OPD浓度的影响如图 5所示为OPD污水初始浓度对Fe3+/ H2O2类芬顿降解OPD污水性能的影响,反应条件为:OPD污水体积为300 mL,θ0=30 ℃,pH=7.8;H2O2投加浓度为0.2 mol·L-1,Fe3+投加浓度为10 mmol·L-1,OPD污水初始浓度c(OPD)=0.01~0.06 mol·L-1,药剂投加顺序为“H2O2+ Fe3+”。
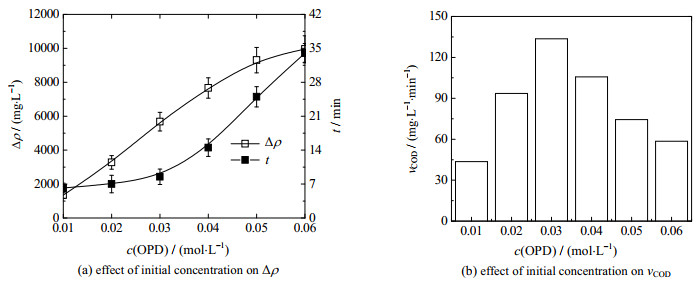
|
图 5 OPD污水初始浓度对降解性能的影响 Fig.5 Effects of initial concentration of o-phenylenediamine solution on degradation performance |
从图 5(a)中可以看出,当OPD污水的初始浓度为0.01 mol·L-1时,COD浓度的降解量为1 352.73 mg·L-1;当OPD污水的初始浓度为0.06 mol·L-1时,COD浓度的降解量为9 956.62 mg·L-1,OPD污水COD浓度的降解量和降解反应时间均随OPD污水初始浓度的升高而延长。这是由于OPD污水初始浓度增大时,溶液中OPD分子的量和OPD分子与·OH和HO2·等自由基的碰撞几率相应增加,引起COD浓度的降解量增大[29]。
由图 5(a)和(b)可以看出,OPD污水的初始浓度由0.01增加到0.03 mol·L-1时,Fe3+/H2O2类芬顿降解OPD污水的平均降解速率由43.6增加到133.6 mg·min-1,继续增加OPD污水的初始浓度至0.06 mol·L-1时,Fe3+/H2O2体系降解OPD污水的平均降解速率降至58.6 mg·min-1,Fe3+/H2O2体系降解OPD污水的平均降解速率随OPD污水的初始浓度的增加呈现先升高后降低的规律,相较于Fe3+投加浓度、初始反应温度对平均降解速率的影响,OPD污水的初始浓度对平均降解速率的影响较小。
3.6 反应机理分析为分析Fe3+/H2O2类芬顿体系的降解反应机理,对Fe3+/H2O2类芬顿降解OPD污水过程中溶液pH值的变化情况、Fe3+/H2O2类芬顿体系与Fe2+/H2O2经典芬顿体系降解OPD污水过程的pH适应性进行对比。如图 6所示为不同Fe3+投加浓度下Fe3+/H2O2类芬顿降解OPD污水过程中溶液pH值变化规律,反应条件:OPD污水浓度为0.04 mol·L-1,pH=7.8,θ0=30 ℃;H2O2投加浓度为0.2 mol·L-1,Fe3+投加浓度范围为5~30 mmol·L-1,药剂投加顺序为“H2O2+Fe3+”。
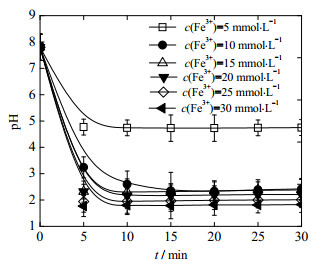
|
图 6 反应过程溶液pH值变化规律 Fig.6 Profiles of pH variation during reaction |
由图 6可知,投加H2O2和Fe3+后5 min内,降解反应溶液的pH值迅速降低;反应10 min时,OPD污水的pH值接近恒定。由此可以看出,投加Fe3+后溶液的pH值变化主要集中在反应前期。反应进行到30 min,Fe3+投加浓度由5依次增加到30 mmol·L-1时,反应液的pH值分别为4.8、2.4、2.4、2.2、2.0和1.8,Fe3+/H2O2类芬顿体系降解OPD过程中溶液的pH值随Fe3+投加浓度的增加而降低。这是由于Fe3+在溶液中发生了水解反应(式(9)),生成了Fe(OH)3胶体粒子,Fe3+投加浓度越高,溶液中产生的Fe(OH)3胶体粒子和H+越多,造成溶液的pH值越低。
| $ {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Fe(OH}}{{\rm{)}}_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}^{\rm{ + }}} $ | (9) |
如图 7所示为Fe3+/H2O2类芬顿体系和Fe2+/H2O2经典芬顿体系分别降解OPD污水过程的pH适应性对比曲线,反应条件:OPD污水浓度为0.04 mol·L-1,H2O2投加浓度为0.2 mol·L-1,Fe3+和Fe2+的投加浓度均为10 mmol·L-1,θ0=30 ℃,反应时间为30 min,药品投加顺序分别为:“H2O2+Fe3+” (Fe3+/ H2O2类芬顿体系)和“H2O2+Fe2+”(Fe2+/H2O2均相芬顿体系)。
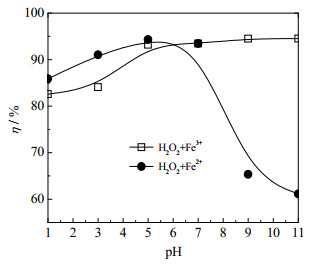
|
图 7 不同芬顿体系的pH适应性分析 Fig.7 Analysis of pH adaptability of different fenton systems |
由图 7可知,在先投加H2O2后投加铁离子的顺序下,OPD溶液初始pH值由1.0增加至11.3的变化过程中,Fe3+/H2O2类芬顿体系降解OPD污水的降解率分别为82.6%、84.1%、93.2%、93.5%、94.4%、94.5%,溶液的降解率随OPD污水初始pH值的升高而升高;Fe2+/H2O2均相芬顿体系降解OPD污水的降解率分别为85.9%、91.0%、94.3%、93.5%、65.3%、61.1%,溶液的降解率随OPD污水初始pH值的升高呈现先升高后降低的规律[30]。从图 7中还可以看出,在pH=1.0~7.8时,Fe3+/H2O2类芬顿体系的降解率低于Fe2+/H2O2均相芬顿体系的降解率,说明在酸性或弱酸性条件下,Fe3+对H2O2的催化活性低于Fe2+对H2O2的催化活性;在pH=7.8~11.3时,Fe2+/H2O2均相芬顿体系的降解率迅速降低,Fe3+/H2O2类芬顿体系的降解率仍略微提升,这说明在弱碱性或碱性条件下,Fe3+对H2O2的催化活性明显高于Fe2+对H2O2的催化活性,Fe3+/H2O2类芬顿体系表现出更优异的pH适应性能。这是由于Fe3+/H2O2类芬顿体系在弱碱性或碱性条件下,部分Fe3+发生了催化H2O2产生HO2·和·OH等自由基降解OPD的均相反应(式(4)~(8));部分Fe3+在溶液中发生了水解反应(式(9)),转化成了悬浮在溶液中的Fe(OH)3胶体粒子,具有吸附性能的Fe(OH)3胶体粒子与H2O2发生异相界面反应(式(10)~(11)),产生HO2·和·OH等自由基,增强了Fe3+/H2O2类芬顿体系的降解性能。而Fe2+/H2O2经典芬顿体系在pH值接近或高于7时,溶液中的Fe2+以氢氧化物的形式沉淀而失去催化能力[31],造成Fe2+/H2O2均相芬顿体系在高pH值条件下的降解性能迅速下降。
| $ {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + H}}{{\rm{O}}_{\rm{2}}} \cdot {\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (10) |
| $ {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}{\rm{ + }} \cdot {\rm{OH + H}}{{\rm{O}}^{\rm{ - }}} $ | (11) |
基于上述实验可以推导出,碱性条件下Fe3+/H2O2类芬顿降解OPD的过程应为均相反应和异相反应的协同作用。在“H2O2+ Fe3+”药剂投加顺序下,Fe3+首先催化H2O2产生Fe2+和HO2· (式(4)),生成的Fe2+继续催化H2O2产生Fe3+和·OH(式(5)),Fe3+和Fe2+循环催化H2O2产生HO2·和·OH等自由基,部分HO2·和·OH等自由基氧化降解OPD分子(式(6)),部分HO2·和·OH等自由基发生淬灭反应(式(7)~(8))。在碱性或弱碱性条件下,Fe3+除发生上述均相反应外,部分Fe3+还会转变为具有吸附性能的Fe(OH)3胶体粒子(式(9)),H2O2和Fe(OH)3胶体粒子之间发生式((10)~(11))的界面反应,产生出HO2·和·OH等活性自由基。式(10)和(11)之间循环异相类芬顿界面反应是Fe3+/H2O2类芬顿体系pH适应性增强的主要原因。
4 结论(1) 药剂投加顺序是碱性条件下影响Fe3+/H2O2类芬顿体系降解性能的重要因素。反应条件为c(H2O2)=0.2 mol·L-1、c(Fe3+)=10 mmol·L-1、c(OPD) =0.04 mol·L-1、θ0=30 ℃时,在pH=7.8~11.3内,“H2O2+Fe3+”和“Fe3++H2O2”药剂投加顺序下的降解率分别为93.5%~94.5% 和89.0%~48.3%,“H2O2+Fe3+”药剂投加顺序下的降解性能明显优于“Fe3++H2O2”药剂投加顺序下的降解性能。
(2) Fe3+/H2O2类芬顿体系表现出较强的pH适应性。在pH=7.8~11.3内,OPD污水的降解率为94.4%~94.5%,远高于相同pH范围内Fe2+/H2O2均相芬顿体系65.3%~61.1%的降解率。
酸性条件下,Fe3+/H2O2类芬顿主要发生Fe3+催化H2O2产生HO2·和·OH自由基降解OPD的均相反应;碱性条件下,Fe3+/H2O2类芬顿体系既存在Fe3+催化H2O2产生HO2·和·OH自由基降解OPD的均相反应,又存在Fe(OH)3胶体粒子催化H2O2产生HO2·和·OH自由基降解OPD的非均相反应。发生在Fe(OH)3胶体粒子界面产生HO2·和·OH的非均相反应,是Fe3+/H2O2类芬顿体系pH适应性增强的主要原因。
| [1] |
陈新才, 潘辉环, 吴勇民, 等. 芬顿-混凝法去除印染废水中的苯胺类化合物[J]. 环境科学与技术, 2015, 38(5): 144-147. CHEN X C, PAN H H, WU Y M, et al. Treatment of aniline com pounds in dyeing wastewater by Fenton-coagulation method[J]. Environmental Science & Technology, 2015, 38(5): 144-147. |
| [2] |
SU C Y, LI W G, HUANG Z, et al. Influence on activated sludge characteristics of anthraquinones before and after pre-treatment by heterogeneous Fenton-like[J]. China Environmental Science, 2015, 35(8): 2351-2359. |
| [3] |
NG L K, MARTIN I, ALFA M, et al. Multiplex PCR for the detection of tetracycline resistant genes[J]. Molecular and Cellular Probes, 2001, 15(4): 209-215. DOI:10.1006/mcpr.2001.0363 |
| [4] |
王炫, 李焕焕, 张乾, 等. 蛋白土-Fe2O3非均相Fenton催化剂高效降解罗丹明B染料废水[J]. 化工进展, 2017, 36(8): 3116-3124. WANG X, LI H H, ZHANG Q, et al. Research on opal-Fe2O3 as a heterogeneous Fenton catalyst for degrading the Rhodamine B dye wastewater[J]. Chemical Industry and Engineering Progress, 2017, 36(8): 3116-3124. |
| [5] |
MICHAEL I, HAPESHI E, MICHAEL C, et al. Solar photo-Fenton process on the abatement of antibiotics at a pilot scale: Degradation kinetics, ecotoxicity and phytotoxicity assessment and removal of antibiotic resistant enterococci[J]. Water Research, 2012, 46(17): 5621-5634. DOI:10.1016/j.watres.2012.07.049 |
| [6] |
贾永强, 李伟, 贾立庄, 等. Fenton氧化深度处理高浓度造纸污水的中试实验[J]. 环境工程学报, 2014, 8(1): 215-221. JIA Y Q, LI W, JIA L Z, et al. A pilot study on advanced treatment of high-concentration papermaking wastewater by Fenton oxidation process[J]. Chinese Journal of Environmental Engineering, 2014, 8(1): 215-221. |
| [7] |
马丽华, 万金泉. Fe2+催化H2O2、S2O82-、S2O82--H2O2降解橙黄G[J]. 化工进展, 2012, 31(10): 2330-2334. MA L H, WAN J Q. Degradation of orange G by H2O2、S2O82-、S2O82--H2O2with ferrous ion[J]. Chemical Industry and Engineering Progress, 2012, 31(10): 2330-2334. |
| [8] |
吴丽雅, 宋秀兰, 林金华, 等. Fenton试剂法深度处理焦化污水的研究及产物分析[J]. 科学技术与工程, 2015, 15(9): 271-274. WU L Y, SONG X L, LIN J H, et al. Advanced treatment of coking wastewater by Fenton reagent oxidation[J]. Science Technology and Engineering, 2015, 15(9): 271-274. DOI:10.3969/j.issn.1671-1815.2015.09.050 |
| [9] |
魏晓币, 王光华, 李文兵, 等. 磁性Fe3O4/改性焦炭的制备及其降解性能[J]. 化工进展, 2017, 36(7): 2577-2583. WEI X B, WANG G H, LI W B, et al. Preparation and degradation properties of magnetic Fe3O4/modified coke[J]. Chemical Industry and Engineering Progress, 2017, 36(7): 2577-2583. |
| [10] |
蒋胜韬, 祝建中, 管玉江, 等. Si-FeOOH/H2O2类芬顿降解盐酸四环素废水的效能及其机理[J]. 化工学报, 2015, 66(10): 4244-4251. JIANG S T, ZHU J Z, GUAN Y J, et al. Degradation and mechanism of tetracycline hydrochloride in wastewater by Si-FeOOH/H2O2 Fenton-like[J]. CIESC Journal, 2015, 66(10): 4244-4251. |
| [11] |
XU H Y, MURARI P, LIU Y S. A novel catalyst in mineral-catalyzed Fenton-like system for dyeing wastewater discoloration[J]. Journal of Hazardous Materials, 2009, 165: 1186-1192. DOI:10.1016/j.jhazmat.2008.10.108 |
| [12] |
马子川, 李俊淑, 邢胜涛. 环己烷辅助水热法简易合成改性δ-MnO2及其类Fenton催化性能[J]. 高等学校化学学报, 2017, 38(4): 636-641. MA Z C, LI J S, XING S T. Facile cyclohexane-mediated hydrothermal synthesis of modified δ-MnO2 with enhanced Fenton-like catalytic activity[J]. Chemical Journal of Chinese Universities, 2017, 38(4): 636-641. |
| [13] |
朱文俊, 吴正颖, 林艳, 等. 介孔Fe-SiO2复合材料的制备及吸附协同催化性能[J]. 复合材料学报, 2019, 36(1): 222-233. ZHU W J, WU Z Y, LIN Y, et al. Synthesis of mesoporous Fe-SiO2 composites and adsorption and synergetic catalytic performance[J]. AMCS, 2019, 36(1): 222-233. |
| [14] |
于晓丹, 林鑫辰, 冯威, 等. Fe3O4/TiO2@生物碳骨架复合材料的一步法制备及UV-Fenton催化性能[J]. 高等学校化学学报, 2018, 39(11): 2500-2506. YU X D, LIN X C, FENG W, et al. One-step preparation and UV-Fenton properties of Fe3O4/TiO2@Bio-carbon composities[J]. Chemical Journal of Chinese Universities, 2018, 39(11): 2500-2506. DOI:10.7503/cjcu20180450 |
| [15] |
王列, 姚玉元, 孙利杰, 等. 活性炭纤维耦合柠檬酸铁在中性pH条件下活化双氧水降解染料[J]. 化学学报, 2013, 71(12): 1633-1638. WANG L, YAO Y Y, SUN L J, et al. Activation of hydrogen peroxide by activated carbon fibers coupled with Fe(Ⅲ)-Citrate for degradation of dyes at neutral pH[J]. ActaChimicaSinica, 2013, 71(12): 1633-1638. |
| [16] |
DENG J H, JIANG J Y, ZHANG Y Y, et al. FeVO4 as a highly active heterogeneous Fenton-like catalyst towards the degradation of Orange Ⅱ[J]. Applied Catalysis B: Environmental, 2008, 84(3/4): 468-473. |
| [17] |
SUN H, WU J, MA D, et al. Preparation of iron (Ⅲ) vanadate Fenton-like catalyst and its catalytic performance[J]. China Environmental Science, 2015, 35(6): 1734-1739. |
| [18] |
闫云涛, 张柯, 毛岩鹏, 等. Fe2O3@SCe类芬顿催化剂的制备及其降解放热性能[J]. 中国环境科学, 2020, 40(8): 3375-3384. YAN Y T, ZHANG K, MAO Y P, et al. Preparation of Fe2O3@SCe heterogeneous Fenton catalyst and its degradation exothermic performance[J]. China Environmental Science, 2020, 40(8): 3375-3384. DOI:10.3969/j.issn.1000-6923.2020.08.015 |
| [19] |
张武, 纪妍妍, 彭涵, 等. FeY型分子筛的高效制备及非均相Fenton催化降解性能[J]. 高等学校化学学报, 2018, 39(9): 1985-1992. ZHANG W, JI Y Y, PENG H, et al. High efficiency synthesis of FeY type zeolite and its heterogeneous Fenton catalytic degradation[J]. Chemical Journal of Chinese Universities, 2018, 39(9): 1985-1992. |
| [20] |
张巨擘, 孙晓晗, 高桥娇, 等. 可再生Fe3O4/CuFeS2/生物质复合降解柱对有机染料的处理性能[J]. 高等学校化学学报, 2019, 40(3): 425-430. ZHANG J B, SUN X H, GAO Q J, et al. Degradation of organic dyes over regenerative Fe3O4/CuFeS2/biomass composite column[J]. Chemical Journal of Chinese Universities, 2019, 40(3): 425-430. |
| [21] |
方嘉声, 于光认, 陈晓春, 等. 石墨烯掺杂分子筛负载氧化铁芬顿催化降解苯酚影响因素的研究[J]. 环境科学学报, 2015, 35(11): 3529-3537. FANG J S, YU G R, CHEN X C, et al. The influence factors on the Fenton catalytic degradation of phenol using iron-loadedgraphene modified molecular sieve catalyst[J]. ActaScientiaeCircumstantiae, 2015, 35(11): 3529-3537. |
| [22] |
徐丹, 张丽丽, 柳丽芬, 等. Cu-Al2O3中骨架铜类芬顿催化去除水中有机污染物[J]. 环境科学, 2017, 38(3): 1054-1060. XU D, ZHANG L L, LIU L F, et al. Fenton-like catalytic removal of organic pollutants in Water by framework Cu in Cu-Al2O3[J]. Environmental Science, 2017, 38(3): 1054-1060. |
| [23] |
唐佳伟, 宁可, 雷伟香, 等. 悬浮填料负载氧化铁Fenton流化床法对腈纶废水的处理[J]. 化工进展, 2018, 37(11): 4476-4484. TANG J W, NING K, LEI W X, et al. Treatment of acrylic fiber wastewater by fenton fluidized bed oxidation process with suspended filler coated iron oxide[J]. Chemical Industry and Engineering Progress, 2018, 37(11): 4476-4484. |
| [24] |
YAN Y T, MAO Y P, MA C Y, et al. Investigation into the exothermic laws of degradation for o-phenylenediamine-containing wastewater by the fenton reaction[J]. Journal of Environmental Engineering, 2019, 145(10): 04019059. DOI:10.1061/(ASCE)EE.1943-7870.0001572 |
| [25] |
JIANG F, QIU B, SUN D. Advanced degradation of refractory pollutants in incineration leachate by UV-Peroxymonosulfate[J]. Chemical Engineering Journal, 2018, 349(1): 338-346. |
| [26] |
董家麟, 付双, 周昊, 等. 纳米过氧化钙对地下水中硝基苯的类-Fenton降解效果[J]. 中国环境科学, 2019, 39(11): 4730-4736. DONG J L, FU S, ZHOU H, et al. Effect of nano calcium peroxide on the Fenton-like degradation of nitrobenzene in groundwater[J]. China Environmental Science, 2019, 39(11): 4730-4736. DOI:10.3969/j.issn.1000-6923.2019.11.031 |
| [27] |
LIANG C, SU H W. Identification of sulfate and hydroxyl radicals in thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 2009, 48(11): 5558-5562. |
| [28] |
冯欣欣, 杜尔登, 郭迎庆, 等. UV/H2O2降解羟苯甲酮反应动力学及影响因素[J]. 环境科学, 2015, 36(6): 2129-2137. FENG X X, DU E D, GUO Y Q, et al. Degradation of organic sunscreens 2-hydroxy-4-methoxybenzophenone by UV/H2O2 process: kinetics and factors[J]. Environmental Science, 2015, 36(6): 2129-2137. |
| [29] |
曾萍, 刘诗月, 张俊珂, 等. 芬顿法深度处理生物处理排水中的四环素抗性基因[J]. 中国环境科学, 2017, 37(9): 3315-3323. ZENG P, LIU S Y, ZHANG J K, et al. Advanced fenton oxidation treatment of tetracycline resistance genes in effluent discharged from biological wastewater treatment[J]. China Environmental Science, 2017, 37(9): 3315-3323. DOI:10.3969/j.issn.1000-6923.2017.09.014 |
| [30] |
王宏杰, 曹喆, 赵子龙, 等. 微波-过氧化氢工艺处理含Cu-EDTA污水[J]. 化工学报, 2017, 68(12): 4756-4763. WANG H J, CAO Z, ZHAO Z L, et al. Treatment of Cu-EDTA containing wastewater by microwave-H2O2 process[J]. CIESC Journal, 2017, 68(12): 4756-4763. |
| [31] |
吕来, 胡春. 多相芬顿催化水处理技术与原理[J]. 化学进展, 2017, 29(9): 981-999. LU L, HU C. Heterogeneous Fenton catalytic water treatment technology and mechanism[J]. Progress in Chemistry, 2017, 29(9): 981-999. |




