2. 商洛学院 化学工程与现代材料学院, 陕西 商洛 726000
2. College of Chemical Engineering and Modern Materials, Shangluo University, Shangluo 726000, China
糖尿病是常见的慢性病,严重危害人类的健康。连续实时血糖监测以及自我调节的胰岛素释放体系是控制血糖波动的有效方法。葡萄糖敏感水凝胶可以对体系的葡萄糖浓度进行监控并自动给出响应,释放负载的胰岛素,实现对糖尿病患者血糖浓度智能调控。葡萄糖响应材料主要基于葡萄糖氧化酶(GOD)、伴刀豆球蛋白A(ConA)和苯硼酸(PBA)3种敏感基元[1-3],其中苯硼酸具有对环境变化适应能力强、稳定性好、没有免疫反应等优势[4],但是存在生理pH下(pH=7.3)对葡萄糖响应程度低的问题。
PBA的pKa为8.6,生理pH下与葡萄糖的结合力弱,响应性低[5]。目前解决这一问题主要方法有:(1)合成具有较低解离常数pKa的PBA衍生物,例如在PBA的间位引入卤素或硝基,或在邻位引入氨基或羧基,但合成过程较复杂,产率较低;(2)在PBA聚合物链上引入含氨基的侧基,氨基会与硼原子发生配位,降低PBA的pKa[6],但是侧基上的氨基并不能完全裸露而与B原子配位,重现性不高,且糖敏感的响应区间(≥300 mg·dL-1)高于糖尿病患者的血糖浓度。
葡萄糖敏感水凝胶因高分子链段松弛和三维网络结构限制,在合成过程中缺乏分子水平上的有序结构,导致响应迟缓。响应速率慢是影响水凝胶应用的重要因素之一。水凝胶溶胀收缩的弛豫时间τ与粒子半径R的平方呈正比,与扩散系数D呈反比,τ≈R2/(π2D),尺寸越小,其响应速度越快。基于微凝胶的快速响应能力,将微凝胶经物理包埋或化学交联制备复合水凝胶的方法,有望提高水凝胶响应速度[7-8]。
石墨烯拥有丰富的物理特性,例如巨大的电子迁移率[9]、良好的弹性和硬度等[10]。氧化石墨烯(GO)是石墨烯的氧化产物[11]、表面有大量的亲水基团,在水中分散性良好[12]。作者将GO添加到含AAPBA的水凝胶中,由于GO是由sp2和sp3杂化碳原子组成[13],表面含有羟基(—OH)、环氧基[—C(O)C—]、羰基(—C=O)、羧基(—COOH)、酯基(—COO—)等活性基团[14],如图 1所示。未氧化的sp2杂化区域的π-π共轭电子迁移,与PBA的B原子形成B负离子,诱导降低PBA的pKa,在pH为7.3时能够与葡萄糖快速形成硼酸酯,产生显著的响应。将Poly(AAPBA-DMAA-co-AAm)微凝胶引入水凝胶,制备出以微凝胶为交联点的具有均匀网络结构的复合水凝胶,达到生理pH下对葡萄糖的快速响应。
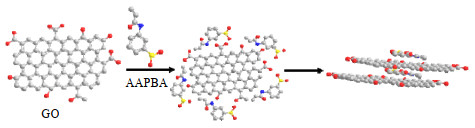
|
图 1 GO调节AAPBA的pKa的机理示意图 Fig.1 Schematic diagram of GO regulated pKa of AAPBA |
实验原料:3-丙烯酰胺基苯硼酸(AAPBA)(质量分数为98%,百灵威化学试剂公司);丙烯酰胺(AAm)(中国医药公司北京采购供应站);N, N′-亚甲基双丙烯酰胺(MBA)(国药集团化学试剂有限责任公司);十二烷基硫酸钠(SDS)(天津市百世化工有限公司);N, N′-二甲基丙烯酰胺(DMAA)(Sigma公司);四甲基乙二胺(TEMED)(Aladdin公司);过硫酸钾(KPS)(天津市盛奥化学试剂有限公司);葡萄糖(天津市科密欧化学试剂);石墨粉(天津大茂化学试剂厂);双氧水(质量分数为30%,天津大茂化学试剂厂);高锰酸钾(四川西陇化工厂有限公司)。上述试剂均为分析纯。胰岛素注射液(100 IU·mL-1,诺和诺德(中国)制药有限公司)。
实验仪器:DF-101S集热式型恒温加热磁力搅拌器(巩义市予华仪器有限公司);SB-5200DTN超声波清洗机(宁波新芝生物科技股份有限公司);AL-104分析天平(梅特勒-托利多仪器(上海)有限公司);DZF-6020真空干燥箱(上海一恒科学仪器有限公司);LGJ-FD-1冷冻干燥机(西安予辉仪器有限公司);恒温振荡器(西安造鑫公司)。
2.2 GO的制备准确称量石墨粉1.0 g,加入烧杯中,量取浓硫酸46.0 mL (质量分数w=98%),浓硫酸缓慢滴加至石墨粉中同时在冰水中超声搅拌0.5 h。将KMnO4 3.0 g缓慢加入烧杯中,同时超声搅拌1 h,移至40 ℃的恒温水浴中搅拌反应0.5 h。烧杯放置在冰水浴中,缓慢加水200 mL并超声,滴加H2O2(w=30%)水溶液,直至溶液变成亮黄色。静置6 h,弃去上层清液,将下层产物离心(10 000 r·min-1,10 min),用盐酸(w=30%)和水各洗涤6次,透析5 d,直至pH接近中性,真空干燥。
2.3 GO/Poly(AAPBA-DMAA-co-AAm)水凝胶的制备称取适量的GO,加入5 mL水,超声50 min,得到GO分散液,移取1 mL于烧杯中,依次加入一定量的AAPBA、AAm、DMAA、MBA,搅拌均匀,加入KPS溶液0.5 mL (ρ=40 mg·mL-1),10 μL的TEMED,常温静置反应12 h。将制备好的水凝胶分成2 cm×2 cm的小块置于蒸馏水中纯化,每隔6 h换一次水,质量恒定后冷冻干燥,得到GO/Poly(AAPBA-DMAA-co-AAm)水凝胶。
2.4 GO/微凝胶复合水凝胶的制备称取一定量的AAPBA、AAm、MBA、SDS置于烧杯中,用移液管移取0.5 mL DMAA,加水48 mL搅拌溶解,然后置于100 mL圆底烧瓶中,装上冷凝管,磁力搅拌并通N2 30 min。升温至70 ℃,1 h后,加入KPS溶液5 mL (ρ=13.5 mg·mL-1),反应5 h,得到Poly(AAPBA-DMAA-co-AAm)微凝胶乳液。
移取1 mL微凝胶乳液,1 mL GO分散液,加入一定量的AAPBA、AAm、DMAA搅拌,混合均匀后加入KPS溶液0.5 mL(ρ=40 mg·mL-1),常温静置12 h,将制备好的水凝胶分成2 cm×2 cm的小块并放置于蒸馏水中纯化,每隔6 h换1次水,质量恒定后冷冻干燥,形成GO/微凝胶复合水凝胶。
2.5 表征将真空干燥后的水凝胶,研磨成粉末,采用Frontier IR傅里叶变换红外光谱仪(Vertex 70,德国)测定红外吸收光谱,选择波数为4 000~500 cm-1;采用SEM(德国ZEISS SIGMA)观察GO、微凝胶和水凝胶的形貌。水凝胶在pH为7.3的40 mmol·L-1葡萄糖溶液中溶胀平衡,冷冻干燥,切成5 mm×5 mm小块,喷金后粘在导电胶上观察切面的形貌;GO分散于水中超声50 min后滴于载玻片上,真空干燥,喷金后观察其微观形貌;取0.5 mL微凝胶与少量乙醇混合均匀,滴于载玻片上,真空干燥,喷金后观察其微观形貌;采用英国MALVER ZEN3690纳米粒度仪检测微凝胶的粒径分布。取微凝胶分散液1 mL,超声分散30 min,放入样品池进行扫描。每1个样测量3次取平均值;将GO真空干燥后,研成粉末在Smart LabSE XRD上测试,扫描范围为5°~60°,速度为2(°)·min-1。
2.6 微凝胶的双键浓度测量采用碘量法测定微凝胶的双键含量,称取质量为m(g)的干燥的微凝胶,放入250 mL碘量瓶中,加入6 mL三氯甲烷,分散均匀,加入1 mL韦氏试剂,振荡后置于25 ℃以下避光处,2 h后加入2 mL碘化钾溶液(150 mg·mL-1)和2 mL蒸馏水,用浓度c标为0.1 mol·L-1的硫代硫酸钠标准滴定液滴定,至黄色消失,加入2 mL淀粉指示剂,继续滴定至蓝色消失,溶液由黄色变为蓝色消耗的滴定液体积为V(mL),设置一个空白对照样,溶液由黄色变为蓝色消耗的滴定液体积为V0(mL),微凝胶双键浓度Y(mmol·g-1)计算如式(1):
| $ Y=\frac{c_{\text {标 }}\left(V-V_{0}\right)}{m \times 1\ 000} $ | (1) |
取干燥水凝胶放在pH为7.3的磷酸缓冲溶液(PBS)中浸泡,直至凝胶的质量不变,记为md。再放入pH为7.3的葡萄糖溶液中,间隔一定时间称量水凝胶的质量,并记为mt,根据式(2)计算其溶胀度SD(%):
| $ \mathrm{SD}(\%)=\frac{m_{\mathrm{t}}-m_{\mathrm{d}}}{m_{\mathrm{d}}} \times 100 $ | (2) |
移取1 mL微凝胶乳液,1 mL GO分散液,加入一定量的AAPBA、AAm、DMAA搅拌,用针管量取适量胰岛素注射液与混合溶液混匀,混合均匀后加入0.5 mL KPS溶液(ρ=40 mg·mL-1),静置12 h,形成原位包裹载药的GO/微凝胶复合水凝胶。
以pH=7.3的PBS作为空白对照,在271 nm处测得质量浓度为0、5、10、20、30、40、50 μg·mL-1的胰岛素溶液吸光度A,以药物浓度c对吸光度线性回归,得到标准方程A=0.01c+0.006 55,拟合优度R2=0.997 91。
包封率EE(%)测定:对于原位包裹法制备的载药水凝胶,已知投药量为m0(μg),待水凝胶在100 mL PBS中达到溶胀平衡,取适量上述PBS在271 nm下测溶液的吸光度,根据标准曲线方程得到溶液的质量浓度ρ测(μg·mL-1),进一步计算该投药量对应的EE(%),计算如式(3):
| $ \mathrm{EE}(\%)=\left[\left(m_{0}-\rho_{\text {测 }} \times 100\right) / m_{0}\right] \times 100 $ | (3) |
药物累计释放率R(%)测定:将投药量为m0,包封率为EEmax(%)的载药水凝胶浸泡于体积为Vt(mL)的pH为7.3的40 mmol·L-1葡萄糖溶液中,在温度为37 ℃、转速为60 r·min-1的恒温振荡器中进行释药,隔一定时间移取5 mL溶液后,向体系中补充5 mL葡萄糖溶液,在271 nm处测定不同时间段所取溶液的吸光度,分别计算其药物浓度ρ1、ρ2、…、ρn-2、ρn-1、ρn(其中n为取样次数),利用式(4)计算R(%):
| $ R(\%)=\frac{\rho_{n} \times V_{\mathrm{t}}+5 \times\left(\rho_{n-1}+\rho_{n-2}+\cdots+\rho_{1}\right)}{m_{0} \times \mathrm{EE}_{\max }} \times 100 $ | (4) |
图 2为GO的XRD谱图。从谱图看出,在10.64°处有明显的衍射峰,峰形尖锐,分布较窄,根据布拉格公式2dsinθ=nλ计算GO的层间距为0.83 nm,证明得到了GO。
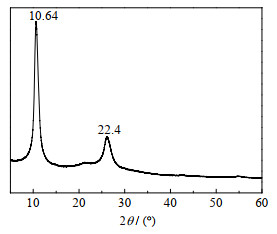
|
图 2 GO的XRD衍射图 Fig.2 XRD spectrum of GO |
图 3为GO和水凝胶的FT-IR谱图。由图 3看出,由于GO表面含有丰富的含氧基团,在3 400 cm-1处归属于羟基(O—H)不对称伸缩振动吸收峰,峰形较宽;1 720 cm-1处归属于羧基中(C=O)的伸缩振动吸收峰;1 200 cm-1处归属于(C—OH)的伸缩振动吸收峰,1 060 cm-1处归属于(C—O—C)的对称伸缩振动吸收峰,这两处峰形较宽,说明GO上面含有大量的—OH和环氧基。1 618 cm-1处归属于芳环的特征吸收峰,是GO独特的sp2结构产生的。
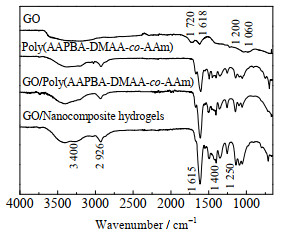
|
图 3 GO和水凝胶的FT-IR光谱图 Fig.3 FT-IR spectra of GO and hydrogels |
与图 3中Poly(AAPBA-DMAA-co-AAm)水凝胶IR谱图相比,GO/Poly(AAPBA-DMAA-co-AAm)水凝胶和GO/微凝胶复合水凝胶在3 400和1 615 cm-1处的吸收峰明显增强,这是GO中含有大量的芳环和羟基所致;3种水凝胶在2 926 cm-1处均有强的C—H的吸收峰,表明存在较长的碳链,1 349 cm-1处归属于—B(OH)2的特征吸收峰,1 640~1 680 cm-1没有双键吸收峰,表明发生了聚合反应。
3.3 SEM表征图 4为GO和水凝胶的SEM图。图 4(a)为GO的SEM图,可以看出GO为片层结构,表面有褶皱,没有堆积。图 4(b)为Poly(AAPBA-DMAA-co-AAm)水凝胶的SEM图,内部孔结构不均一,孔道较少。由GO/Poly(AAPBA-DMAA-co-AAm)水凝胶的SEM图,水凝胶孔道数量明显增多且结构均匀,表明GO经过超声后均匀分散在水凝胶中;图 4(d)为GO/微凝胶复合水凝胶的SEM图,发现微凝胶在GO/微凝胶复合水凝胶中没有产生颗粒团聚堆积,影响水凝胶孔道结构。水凝胶孔道密度较大且均匀。

|
图 4 GO和水凝胶的SEM图 Fig.4 SEM micrographs of GO and hydrogels |
采用激光粒度仪对微凝胶的粒径进行分析,结果表明微凝胶的平均粒径为79.5 nm,粒径分布窄。碘量法测定表面双键含量为1.168 2 mmol·g-1。Poly(AAPBA-DMAA-co-AAm)微凝胶的SEM见图 5,从图 5(a)和(b)看出微凝胶呈球形,分散性良好,表面较光滑,乳液中不存在明显的团聚现象。

|
图 5 微凝胶的SEM图 Fig.5 SEM micrographs of microgels |
图 6为葡萄糖(pH=7.3,10 mmol·L-1)溶液中不同GO含量GO/Poly(AAPBA-DMAA-co-AAm)水凝胶的葡萄糖响应性能曲线。当水凝胶未添加GO时,水凝胶的平衡溶胀度仅为2.68%,随着GO添加量由0.5% 增加到1.0%,水凝胶在葡萄糖溶液中的SD明显增大。AAPBA的pKa为8.5,在pH为7.3环境中,仅有7% 的硼酸电离,因此Poly(AAPBA-DMAA-co-AAm)水凝胶对葡萄糖响应不明显。含GO质量分数为0.5% 的GO/Poly(AAPBA-DMAA-co-AAm)水凝胶中,GO分子上未氧化的sp2杂化区域的π-π共轭电子发生迁移,使链段中的PBA形成B负离子,与葡萄糖的羟基快速结合,提高了水凝胶对葡萄糖的响应性,420 min达到溶胀平衡,平衡溶胀度为4.28%。随着GO含量增加,水凝胶网络中B负离子进一步增加,响应性提高。含GO为1.0% 的GO/Poly(AAPBA-DMAA-co-AAm)水凝胶360 min达到溶胀平衡,平衡溶胀度为8.45%。但当GO的质量分数增大到1.5%,GO与聚合物链段形成的物理交联点增多,使水凝胶的响应强度降低,360 min的平衡溶胀度为7.45%。
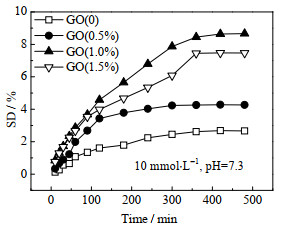
|
图 6 葡萄糖(pH=7.3, 10 mmol·L-1)溶液中不同GO含量GO/Poly(AAPBA-DMAA-co-AAm)水凝胶的葡萄糖响应性能 Fig.6 Glucose response of GO/Poly(AAPBA-DMAA-co-AAm) hydrogels with different GO contents in glucose solution (pH=7.3, 10 mmol·L-1) |
根据Tanaka-Fillmore理论[15],微凝胶具有快速响应能力。表面存在烯键的微凝胶作为交联剂,化学交联构成复合水凝胶,小粒径的微凝胶快速响应,带动周围连接微凝胶的链桥构象变化,从而使宏观水凝胶产生快速响应。图 7分别为含GO质量分数为1.0% 的GO/Poly(AAPBA-DMAA-co-AAm)水凝胶和GO/微凝胶复合水凝胶在pH为7.3的不同浓度葡萄糖溶液中的响应曲线。从图 7(a)看出,GO/Poly(AAPBA-DMAA-co-AAm)水凝胶的响应速率较慢,随着葡萄糖浓度增大,SD逐渐增大,在40 mmol·L-1的葡萄糖溶液中,300 min达到溶胀平衡,SD为17%。图 7(b)为GO/微凝胶复合水凝胶对葡萄糖的响应性,在40 mmol·L-1的葡萄糖溶液中,300 min达到溶胀平衡,SD为18%,响应时间比MBA为交联剂的GO/Poly(AAPBA-DMAA-co-AAm)水凝胶缩短了约1/10。
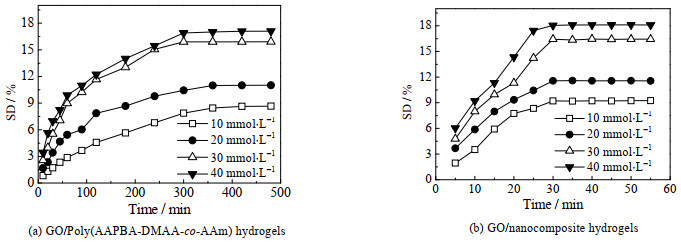
|
图 7 水凝胶在不同葡萄糖溶液(pH=7.3)中的响应性能 Fig.7 Hydrogel response in different glucose solutions(pH=7.3) |
图 8为GO/微凝胶复合水凝胶在不同葡萄糖浓度中(pH=7.3)的药物释放曲线。在释药过程中,0~10 h胰岛素的释放速率较快,在载药时,水凝胶表面会吸附一部分药物,游离的药物以较快的速率从水凝胶的表面及亲水通道扩散释放,主要为表面扩散的释放;10~24 h胰岛素的释药速率缓慢加快,释放时间较长,以水凝胶孔道内部的药物扩散为主;超过24 h释药已基本达到平衡。当环境的葡萄糖浓度由10增加到40 mmol·L-1,复合水凝胶的响应速度加快,SD增大,使胰岛素的累计释放量随之增加。葡萄糖浓度为40 mmol·L-1时,10 h累计释放率达到52.59%,GO/微凝胶复合水凝胶对胰岛素具有一定的缓释控释作用。
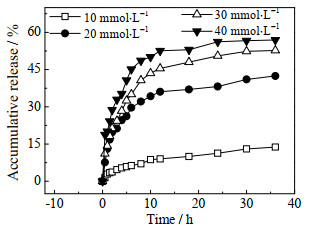
|
图 8 GO/微凝胶复合水凝胶在不同葡萄糖浓度中 (pH=7.3)的药物释放曲线 Fig.8 Insulin release curves of GO/nanocomposite hydrogels at different glucose concentrations(pH=7.3) |
(1) 采用Hummers法制备GO,并采用FT-IR,SEM,XRD进行表征,结果证实得到了片状GO。
(2) 在GO超声剥离得到的悬浮液中添加反应单体,以MBA为交联剂制备了GO/Poly(AAPBA-DMAA-co-AAm)水凝胶,并进行了表征,考察了GO含量对水凝胶葡萄糖敏感性的影响。水凝胶在pH为7.3的40 mmol·L-1葡萄糖溶液中的响应时间为300 min,响应溶胀度达到17%,GO降低了AAPBA的pKa,改善了水凝胶在生理条件下对葡萄糖的响应性。
(3) 以Poly(AAPBA-DMAA-co-AAm)微凝胶为交联点,制备了GO/微凝胶复合水凝胶。水凝胶在pH为7.3的40 mmol·L-1葡萄糖中的响应时间为30 min,响应溶胀度达到18%,响应速度大幅提高。复合水凝胶对于胰岛素的包封率为85.64%,10 h累计释放率为52.59%。
| [1] |
JAMWAL S, RAM B, RANOTE S, et al. New glucose oxidase-immobilized stimuli-responsive dextran nanoparticles for insulin delivery[J]. International Journal of Biological Macromolecules, 2019, 123(2): 968-978. |
| [2] |
李艳霞, 黄露, 陈毅挺, 等. 糖蛋白印迹二维光子晶体水凝胶传感器的构建[J]. 分析测试学报, 2020, 39(3): 389-395. LI Y X, HUANG L, CHEN Y T, et al. Construction of a two-dimensional photonic crystal hydrogel sensor with glycoproteins imprinting[J]. Journal of Instrumental Analysis, 2020, 39(3): 389-395. DOI:10.3969/j.issn.1004-4957.2020.03.015 |
| [3] |
SHAN M, GONG C, LI B Q, et al. A pH, glucose, and dopamine triple-responsive, self-healable adhesive hydrogel formed by phenylborate-catechol complexation[J]. Polymer Chemistry, 2017, 8(19): 2997-3005. DOI:10.1039/C7PY00519A |
| [4] |
TRAM N, JULES J M, PRASHANT T. Manipulation of the isoelectric point of polyampholytic smart hydrogels in order to increase the range and selectivity of continuous glucose sensors[J]. Sensors and Actuators B: Chemical, 2018, 255: 1057-1063. DOI:10.1016/j.snb.2017.08.022 |
| [5] |
SMITHMYER M E, DENG C C, CASSEL S E, et al. Self-healing boronic acid-based hydrogels for 3D co-cultures[J]. ACS Macro Letters, 2018, 7(9): 1105-1110. DOI:10.1021/acsmacrolett.8b00462 |
| [6] |
GABALLA H, SHANG J J, MEIER S, et al. The glucose-responsive behavior of a block copolymer featuring boronic acid and glycine[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2019, 57(3): 422-431. DOI:10.1002/pola.29226 |
| [7] |
COMPAAN A M, SONG K, CHAI W, et al. Cross-linkable microgel composite matrix bath for embedded bioprinting of perfusable tissue constructs and sculpting of solid objects[J]. ACS Applied Materials & Interfaces, 2020, 12(7): 7855-7868. |
| [8] |
FARJAMI T, MADADLOU A, LABBAFI M. Characteristics of the bulk hydrogels made of the citric acid cross-linked whey protein microgels[J]. Food Hydrocolloids, 2015, 50: 159-165. DOI:10.1016/j.foodhyd.2015.04.011 |
| [9] |
贺晓东, 魏作君, 刘迎新, 等. 氧化石墨烯的制备及其催化水解大豆异黄酮[J]. 高校化学工程学报, 2012, 26(1): 56-60. HE X D, WEI Z J, LIU Y X, et al. The preparation of graphene oxide and using it as catalyst for the hydrolyzation of soybean isoflavone[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(1): 56-60. DOI:10.3969/j.issn.1003-9015.2012.01.010 |
| [10] |
刘艳, 牛卫芬. 石墨烯-纳米金修饰电极的制备及其对痕量铅(Ⅱ)的测定[J]. 高校化学工程学报, 2014, 28(3): 685-689. LIU Y, NIU W F. Preparation of graphene-Aunano modified electrodes and their application in trace lead(Ⅱ) detection[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(3): 685-689. DOI:10.3969/j.issn.1003-9015.2014.03.040 |
| [11] |
FEICHT P, BISKUPEK J, GORELIK T E, et al. Frontispiece: Brodie's or hummers' method: Oxidation conditions determine the structure of graphene oxide[J]. Chemistry A European Journal, 2019, 25: 8955-8959. DOI:10.1002/chem.201901499 |
| [12] |
单国荣, 张宁. 氧化石墨烯复合水凝胶研究进展[J]. 化工学报, 2018, 69(2): 535-545. SHAN G R, ZHANG N. Research progress on graphene oxide composite hydrogels[J]. CIESC Journal, 2018, 69(2): 535-545. |
| [13] |
SHINOHARA T, OBATA S, SAIKI K. Analysis of the low-temperature restoration process of graphene oxide based on in situ conductivity measurement[J]. Journal of Materials Chemistry C, 2019, 7: 2583-2588. DOI:10.1039/C8TC06577B |
| [14] |
JESUS GUERRERO-CONTRERAS F, CABALLERO-BRIONES, et al. Graphene oxide powders with different oxidation degree, prepared by synthesis variations of the hummers' method[J]. Materials Chemistry & Physics, 2015, 153: 209-220. |
| [15] |
TANAKA T, FILLMORE D J. Comb-type grafted hydrogels with rapid deswelling response to temperature changes[J]. Journal of Chemical Physics, 1979, 70: 1214-1218. DOI:10.1063/1.437602 |




