大孔材料(孔径大于50 nm)相较于微孔与介孔具有许多独特的性能,例如良好的通透性、材质选择的广泛性、高效的吸附和分离性能,以及易于化学改性[1-2]。例如,YI等[3]利用O/W型Pickering高内相比乳液模板法制备了内部相互连通的大孔聚丙烯酸水凝胶,所形成的非有序大孔结构对有机染料和重金属离子展现出一定的吸附能力。ZHANG等[4]采用反相微乳液聚合相分离法制备了具有不同结构层次的富含大孔的活性炭,所得到的孔结构非有序,大孔-介孔的多层次孔道展现出优良的电容特性。而微球状的多孔材料因其物理形态带来的优越性能以及操作简便,成为大孔材料研究的热点之一[5]。WANG等[6]详细归纳了近年来关于微流体控制法合成大孔微球的研究,其中利用特定的微流体仪能合成粒径均一、孔隙高度有序、比表面积可控的大孔微球。但是,仪器设备成本较高,且流量调节、外力控制、表面改性等操作较复杂,限制了该方法在合成大孔微球材料方面的发展。喷雾干燥法[7-10]、乳液聚合法[11-14]、溶剂挥发法[15-18]等方法操作简单、成本低廉、实验周期短,在微球状材料的合成上优势明显。WEI等[19]采用不同疏水嵌段的共聚物聚谷氨酸交联聚乙二醇和聚乳酸-羟基乙酸交联聚乙二醇,通过复乳液溶剂挥发法得到了多孔聚合物微球,研究发现疏水嵌段是产生微球多孔结构的原因之一,而向乳状液中加入碳酸氢钠和乙酸乙酯会发生闭孔现象。LI等[20]合成了一种接枝型两亲性嵌段共聚物聚4-乙烯基吡啶-b-聚6-[4-(4-丁氧基苯基偶氮)苯氧基]甲基丙烯酸己酯(P4VP-b-PAzoMA),通过乳液溶剂挥发法得到了表面多孔的聚合物微球,研究认为产生多孔结构的原因是两亲性聚合物在水的扩散过程中起到协同作用,使得水分子充当了特殊的致孔剂。WANG等[21]在利用复乳液溶剂挥发法合成聚乳酸-羟基乙酸微球时发现,通过调控致孔剂或乳化剂浓度、挥发性有机溶剂的种类、聚合物浓度等因素,可合成出多孔球状、类红细胞状、中空球状的微球。由此可见,利用溶剂挥发法制备多孔聚合物微球的优势是不需加入额外的致孔剂,仅通过调节聚合物的性质或改变工艺参数即可形成多孔结构。但现有的研究大多是合成含有不同亲水性嵌段的特定共聚物,利用聚合物各个嵌段性质的差异产生多孔结构。这些聚合物的合成过程通常较为复杂,原料利用率低,且往往采用复乳液溶剂挥发法,而复乳状液的稳定涉及的因素众多,实验操作较繁琐,溶剂挥发周期较长。本文拟采用两种常见的聚合物乙基纤维素(ethyl cellulose,EC)和聚丙烯酸树脂Ⅳ(Polyacrylic resin Ⅳ,PAR)为原料,利用原料聚合物的亲疏水性以及PAR的pH响应性,采用溶剂挥发法制备大孔微球材料,将分析多孔结构形成的机理,探究聚合物浓度、组成比例、乳化剂浓度、pH等对微球粒径和孔隙率的影响,从而得到调控此类大孔聚合物微球大小和孔结构的方法。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料乙基纤维素(EC,9~11 mPa·s),广州东巨实验公司;聚丙烯酸树脂Ⅳ (PAR),上海德祥医药技术有限公司;聚乙烯醇(polyvinyl alcohol PVA,1788型,醇解度87.0%~89.0%),上海泰坦科技股份有限公司;二氯甲烷(CH2Cl2,AR),上海阿拉丁生化科技股份有限公司;正己烷(AR,97%),百灵威科技有限公司;氢氧化钠(NaOH,≥96%,AR),广州东巨实验公司;盐酸(HCl,36%~38%,AR)Adamas公司;去离子水,实验室自制。
2.1.2 表征仪器激光散射粒度分布分析仪(LA-960S,日本HORIBA公司)测定聚合物微球平均粒径和分布。场发射扫描电子显微镜(SEM,日立SU8220)观察微球粒径、球形度、孔径等表观形貌。比表面积孔径测定仪(NOVA4200E,广州市华裕电子服务公司)测定大孔微球的比表面积(BET法)。全自动压汞仪(AutoPore lv 9510,美国麦克公司)测定大孔微球的孔径分布、孔隙率等形貌特性。倒置荧光显微镜(IX83,日本奥林巴斯株式会社)观察乳状液形成过程中的形貌。
2.2 聚合物微球的制备按一定的质量比称取PAR与EC,加入装有150 mL CH2Cl2的烧杯中,用超声波清洗器(KQ-600KDE、昆山市超声仪器有限公司)在420 W超声30 min,完全溶解得到有机溶液。称取2.0 g PVA,加入到200 mL去离子水的烧杯中,加热至完全溶解,冷却至室温。可按具体要求调节至不同的pH。将有机溶液逐滴加入到PVA溶液中,室温下500 r·min-1搅拌,直到有机溶剂完全挥发后停止搅拌。静置形成沉淀。倒掉上层清液,一定量正己烷洗涤沉淀,干燥后得到微球。
3 实验结果与讨论 3.1 微球的形貌和性质聚合物(PAR/EC质量比为1:3)质量浓度为5.86 g·L-1,CH2Cl2体积为150 mL,PVA质量浓度为5.71 g·L-1,水相体积为200 mL,pH为6.2,该条件下形成的乳状液、聚合物微球的形貌和分布如图 1所示。图 1A为乳状液的显微镜图,乳液液滴上的白色亮斑推测为有机溶剂挥发过程中,水相进入有机相内部导致浓度不均所致。溶剂挥发完全后得到的聚合物微球,由SEM电镜图显示分散性好,粒径均匀(图 1B)图 1B中的曲线图为聚合物微球粒径分布曲线,平均粒径为74.3 μm,分布曲线较集中,说明粒径均匀,与扫描电镜观察到的结果相一致。由放大的微球形貌图(图 1C、D)观察到,微球的球形度高、表面多孔且分布密集,微球内部也出现了多空腔结构,相互有孔道连通。

|
图 1 乳状液和聚合物微球的形貌 Fig.1 Morphologies of emulsion and polymer microspheres A. Microscope image of emulsion B. SEM image of microspheres and distribution of particle size C. SEM image of single microsphere and its local sites D. SEM image of internal structure of microspheres |
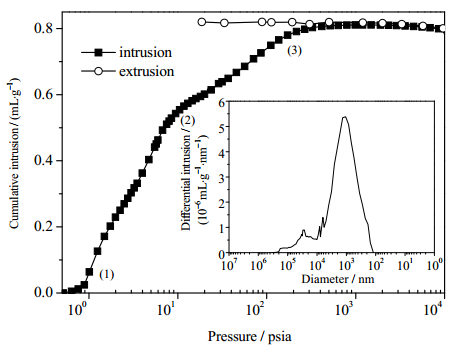
利用压汞法对微球的孔结构进行表征,结果如图 2所示。图 2中的大图为压汞和退汞的过程曲线,图中阶段(1)为粉末压缩过程注汞体积的变化,阶段(2)为颗粒间空隙体积的填充过程,阶段(3)为大孔体积的填充过程。阶段(3)之后压力继续增大,曲线并未出现明显的阶段变化,说明孔结构类型以大孔为主[22]。退汞曲线明显滞后,且终点没有回到零点,说明存在复杂的网状结构的孔[23],推测是该样品中存在着大量的“瓶颈孔”(两端狭窄,中部空腔),导致部分汞在减压过程中滞留在样品的孔结构中。由压汞法得到的孔径分布密度曲线(小图)可以看到,曲线的峰值在103 nm处,表明孔径为103 nm的孔分布密度最大。换言之,该聚合物微球拥有大量孔径为1 μm左右的大孔,并且由压汞法的测试数据显示孔隙率为63.8%。
|
图 2 注汞与退汞过程曲线以及孔径分布密度曲线 Fig.2 Profiles of mercury porosimetry results and density distribution of pore size |
多孔微球粒径的大小影响应用性能[24]。聚合物和PVA的浓度、搅拌速率是影响微球粒径大小的主要因素。本实验中乳化所形成的是O/W型乳状液,稳定乳状液的形成过程是自身黏性力与体系中扰动的剪切应力相互抗衡的动态过程[25-26]。将搅拌速率固定在500 r·min-1,即固定体系中的剪切应力,研究聚合物(PAR和EC)和乳化剂质量浓度对微球粒径大小的影响。
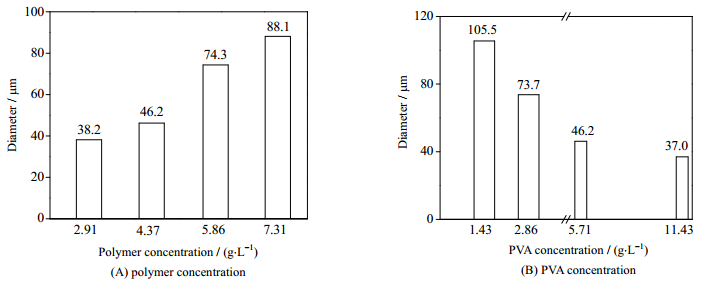
二氯甲烷为150 mL,水相体积为200 mL,pH为6.2。图 3(A)是PVA浓度为5.71 g·L-1时,不同聚合物浓度(PAR/EC质量比为1:3)下微球粒径大小。聚合物浓度由2.91增大到7.31 g·L-1,微球粒径从38增大到88 μm。当剪切力固定时,聚合物浓度增大,有机相黏性力增大,有机相的分散变得困难,固化后形成较大粒径的微球[27-28]。图 3(B)是聚合物浓度为4.37 g·L-1时不同PVA浓度下微球的粒径变化。当PVA浓度由1.43增大到11.43 g·L-1,微球粒径从105减小到37 μm。随PVA浓度的增大,油相的界面张力减小,易于分散成体积较小的液滴,且液滴之间的空间位阻也会随着PVA浓度的增加而增大,利于乳状液的稳定,因而形成粒径较小的微球。
|
图 3 聚合物和乳化剂浓度对微球大小的影响 Fig.3 Effects of polymer and emulsifier concentrations on particle size |
聚合物微球多孔结构的形成与其组分的性质有关。在聚合物乳状液中,有机相与分散相之间有一定梯度的渗透压[29],随着有机溶剂逐渐挥发,水相进入有机相的趋势增强,而聚合物原料中的亲水性组分有助于水相进入液滴内部。聚丙烯酸树脂Ⅳ是甲基丙烯酸丁酯、甲基丙烯酸二甲胺基乙酯和甲基丙烯酸甲酯(1:2:1)的共聚物[30]。由于其叔胺基上的氮原子具有孤对电子,在偏酸性条件下(pH < 5)会发生质子化,水溶性增强,在本实验体系中充当了亲水性组分,从而为水相进入乳状液液滴内部提供了通道。正是由于水对乳状液由外至内的侵入形成了微球表面多孔的结构[31]。此外,水相进入有机相会在其内部发生聚结,最终形成众多小空腔的结构[32]。本实验体系中的乙基纤维素不溶于水,在水向有机相内部扩散形成内部孔室结构的过程中起到了协同作用,促使了内部孔道的产生。压汞法测试结果也显示出微球内部存在大量“瓶颈孔”。
3.3.2 PAR/EC质量比对微球多孔结构的影响固定搅拌转速为500 r·min-1,溶液pH为6.2,聚合物浓度为4.37 g·L-1,PVA浓度为5.71 g·L-1,CH2Cl2用量为150 mL,水相体积200 mL。不同PAR/EC的质量比下微球形貌如图 4所示,平均粒径与比表面积数据列于表 1。

|
图 4 不同PAR/EC质量比时微球形貌的SEM图 Fig.4 SEM micrographs of microsphere morphologies obtained at different PAR/EC mass ratios A. 1:1 B. 1:2 C. 1:3 D. 1:4 |
|
|
表 1 PAR/EC质量比对微球比表面积的影响 Table 1 Effects of PAR/EC mass ratio on size and specific surface area of microspheres |
结果显示,微球表面均出现了多孔结构,但随着PAR/EC质量比由1:1变化到1:4,微球表面的孔结构更加规整,孔分布更为致密。由表 1数据可知,随着PAR/EC质量比的减小,微球粒径逐渐增大,这是由于EC占比越大,弱酸性条件下原料聚合物的疏水性越强,在乳液中更易聚集形成较大的颗粒。微球比表面积随着PAR/EC质量比的减小,先增大然后减小。pH为6.2时,保持聚合物总质量浓度不变,随着PAR所占比例减小,形成乳状液时PAR分布更加均匀,导致微球表面的孔更致密,孔径也相对减小,因而比表面增大。当质量比1:4时,比表面积减小,可能是微球粒径增大所致。综合考虑微球的平均粒径和比表面积,确定PAR/EC质量比1:3为最佳。
3.3.3 pH对微球多孔结构的影响固定搅拌转速为500 r·min-1,聚合物浓度为4.37 g·L-1,PAR/EC的质量比1:3,PVA浓度为5.71 g·L-1,CH2Cl2用量为150 mL,水相体积200 mL。不同pH下微球形貌如图 5所示,微球的平均粒径与比表面积数据列入表 2。

|
图 5 不同pH条件下微球形貌的SEM图 Fig.5 SEM micrographs of microsphere morphology obtained under different pH values A. pH=3.0 B. pH=4.4 C. pH=6.2 D. pH=7.5 E. pH=9.8 |
|
|
表 2 pH对微球比表面积的影响 Table 2 Effects of pH on size and specific surface area of microspheres |
由表 2数据观察到pH对微球比表面积的影响明显,随着pH增大,比表面积先增大然后减小,这主要是微球孔结构变化所致。当pH为3.0时,PAR的亲水性强,促进更多的水相进入液滴内部,因而形成较大的孔(图 5A),比表面积较小,为2.886 m2/g。pH增大,PAR的亲水性适当,形成的微球表面孔密集(图 5B、C),比表面积较大。pH增大到7.5时,PAR的疏水性增强,不利于水进入乳液液滴内部,因而孔明显减少(图 5D),当pH继续增大至9.8,微球表面基本无孔(图 5E)。
4 结论以乙基纤维素(EC)和聚丙烯酸树脂Ⅳ(PAR)为原料,聚乙烯醇(PVA)为乳化剂,利用溶剂挥发法制备大孔微球材料。该大孔微球制备方法简单,易通过调节聚合物和PVA质量浓度调控微球粒径大小,调节PAR/EC的比例和溶液pH可实现对微球表面孔结构的调控。
(1) 随着聚合物浓度的减小或PVA浓度的增大,微球平均粒径逐渐减小。
(2) PAR/EC的比例和溶液pH影响微球的孔结构,PAR/EC质量比为1:3时微球表面出现致密均匀的孔,且粒径均一,微球分散性好。
(3) 随着乳状液pH由酸性向碱性变化,PAR由亲水向疏水转变,微球的孔结构由多孔结构向无孔结构变化。
| [1] |
张霄, 贾爱忠, 赵新强, 等. 气泡模板法合成无机多孔材料的研究进展[J]. 高校化学工程学报, 2018, 32(5): 983-993. ZHANG X, JIA A Z, ZHAO X Q, et al. Bubble template methods for the synthesis of porous inorganic materials:A review[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(5): 983-993. DOI:10.3969/j.issn.1003-9015.2018.05.001 |
| [2] |
HAN S, WU D, LI S, et al. Porous graphene materials for advanced electrochemical energy storage and conversion devices[J]. Advanced Materials, 2014, 26(6): 849-864. DOI:10.1002/adma.201303115 |
| [3] |
YI W, WU H, WANG H, et al. Interconnectivity of macroporous hydrogels prepared via graphene oxide-stabilized pickering high internal phase emulsions[J]. Langmuir, 2016, 32(4): 982-990. DOI:10.1021/acs.langmuir.5b04477 |
| [4] |
ZHANG D, ZHAO J, FENG C, et al. Scalable synthesis of hierarchical macropore-rich activated carbon microspheres assembled by carbon nanoparticles for high rate performance supercapacitors[J]. Journal of Power Sources, 2017, 342: 363-370. DOI:10.1016/j.jpowsour.2016.12.072 |
| [5] |
XIA H, WAN G, ZHAO J, et al. Preparation and characterization of monodisperse large-porous silica microspheres as the matrix for protein separation[J]. Journal of Chromatography A, 2016, 1471: 138-144. DOI:10.1016/j.chroma.2016.10.025 |
| [6] |
WANG B, PRINSEN P, WANG H, et al. Macroporous materials:Microfluidic fabrication, functionalization and applications[J]. Chemical Society Reviews, 2017, 46(3): 855-914. DOI:10.1039/C5CS00065C |
| [7] |
PAL M, WAN L, ZHU Y, et al. Scalable synthesis of mesoporous titania microspheres via spray-drying method[J]. Journal of Colloid and Interface Science, 2016, 479: 150-159. DOI:10.1016/j.jcis.2016.06.063 |
| [8] |
HUH Y, CHO H J, YOON I S, et al. Preparation and evaluation of spray-dried hyaluronic acid microspheres for intranasal delivery of fexofenadine hydrochloride[J]. European Journal of Pharmaceutical Sciences, 2010, 40(1): 9-15. DOI:10.1016/j.ejps.2010.02.002 |
| [9] |
SOSNIK A, SEREMETA K P. Advantages and challenges of the spray-drying technology for the production of pure drug particles and drug-loaded polymeric carriers[J]. Advances in Colloid and Interface Science, 2015, 223: 40-54. DOI:10.1016/j.cis.2015.05.003 |
| [10] |
陈鑫, 郑柏存, 沈军. 喷雾干燥条件对VAE聚合物粉体粒径影响[J]. 高校化学工程学报, 2013, 27(3): 538-541. CHEN X, ZHENG B C, SHEN J. Effects of spray drying conditions on particle sizes of VAE polymer powders[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(3): 538-541. DOI:10.3969/j.issn.1003-9015.2013.03.028 |
| [11] |
ZHOU H, SHI T, ZHOU X. Preparation of polystyrene/SiO2 microsphere via pickering emulsion polymerization:Synergistic effect of SiO2 concentrations and initiator sorts[J]. Applied Surface Science, 2013, 266: 33-38. DOI:10.1016/j.apsusc.2012.11.054 |
| [12] |
CHEN H, ZHOU J, DENG J. Helical polymer/Fe3O4NPs constructing optically active, magnetic core/shell microspheres:Preparation by emulsion polymerization and recycling application in enantioselective crystallization[J]. Polymer Chemistry, 2016, 7(1): 125-134. DOI:10.1039/C5PY01549A |
| [13] |
ZHOU T, ZHANG K, KAMRA T, et al. Preparation of protein imprinted polymer beads by Pickering emulsion polymerization[J]. Journal of Materials Chemistry B, 2015, 3(7): 1254-1260. DOI:10.1039/C4TB01605J |
| [14] |
施一鸣, 单国荣. 聚乙二醇分子量对苯乙烯/甲基丙烯酸甲酯无皂乳液聚合稳定性的影响[J]. 高校化学工程学报, 2013, 27(2): 272-276. SHI Y M, SHAN G R. Effects of poly(ethylene glycol) molecular weight on the stability of surfactant-free emulsion polymerization system consisting of styrene and methyl methacrylate[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(2): 272-276. |
| [15] |
FAN J, ZHENG Y, XIE Y, et al. Effect of solvent evaporation technique on the characteristics of curing agent microcapsules and the curing process[J]. Composites Science and Technology, 2017, 138: 80-90. DOI:10.1016/j.compscitech.2016.11.014 |
| [16] |
FENG S, FU D, NIE L, et al. A detailed view of PLGA-mPEG microsphere formation by double emulsion solvent evaporation method[J]. Chinese Journal of Polymer Science, 2015, 33(7): 955-963. DOI:10.1007/s10118-015-1660-9 |
| [17] |
ZUO J, DONG B, XING F, et al. Preparation of polystyrene/sodium monofluorophosphate microcapsules by W/O/W solvent evaporation method[J]. Advanced Powder Technology, 2016, 27(4): 1086-1092. DOI:10.1016/j.apt.2016.03.017 |
| [18] |
CHAIYASAT P, PHOLSRIMUANG P, BOONTUNG W, et al. Influence of poly (L-lactic acid) molecular weight on the encapsulation efficiency of urea in microcapsule using a simple solvent evaporation technique[J]. Polymer-Plastics Technology and Engineering, 2016, 55(11): 1131-1136. DOI:10.1080/03602559.2015.1132447 |
| [19] |
WEI Y, WANG Y, ZHANG H, et al. A novel strategy for the preparation of porous microspheres and its application in peptide drug loading[J]. Journal of Colloid and Interface Science, 2016, 478: 46-53. DOI:10.1016/j.jcis.2016.05.045 |
| [20] |
LI C, WANG W, WANG X, et al. Fabrication of porous polymer microspheres by tuning amphiphilicity of the polymer and emulsion-solvent evaporation processing[J]. European Polymer Journal, 2015, 68: 409-418. DOI:10.1016/j.eurpolymj.2015.05.011 |
| [21] |
WANG S, SHI X, Gan Z, et al. Preparation of PLGA microspheres with different porous morphologies[J]. Chinese Journal of Polymer Science, 2015, 33(1): 128-136. DOI:10.1007/s10118-014-1507-9 |
| [22] |
WEBB P A. An introduction to the physical characterization of materials by mercury intrusion porosimetry with emphasis on reduction and presentation of experimental data[M]. Norcross, Georgia: Micromeritics Instrument Corp, 2001.
|
| [23] |
YAO Y, LIU D. Comparison of low-field NMR and mercury intrusion porosimetry in characterizing pore size distributions of coals[J]. Fuel, 2012, 95: 152-158. DOI:10.1016/j.fuel.2011.12.039 |
| [24] |
FLOYD J A, GALPERIN A, RATNER B D. Drug encapsulated polymeric microspheres for intracranial tumor therapy:A review of the literature[J]. Advanced Drug Delivery Reviews, 2015, 91: 23-37. DOI:10.1016/j.addr.2015.04.008 |
| [25] |
TSUNASHIMA D, YAMASHITA K, OGAWARA K, et al. Preparation of extended release solid dispersion formulations of tacrolimus using ethylcellulose and hydroxypropylmethylcellulose by solvent evaporation method[J]. Journal of Pharmacy and Pharmacology, 2016, 68(3): 316-323. DOI:10.1111/jphp.12515 |
| [26] |
IIQBAL M, ZAFAR N, FESSI H, et al. Double emulsion solvent evaporation techniques used for drug encapsulation[J]. International Journal of Pharmaceutics, 2015, 496(2): 173-190. DOI:10.1016/j.ijpharm.2015.10.057 |
| [27] |
HONG Y, GAO C, SHI Y, et al. Preparation of porous polylactide microspheres by emulsion-solvent evaporation based on solution induced phase separation[J]. Polymers for Advanced Technologies, 2005, 16(8): 622-627. DOI:10.1002/pat.629 |
| [28] |
SINGH V, CHAUDHARY A K. Preparation of Eudragit E100 microspheres by modified solvent evaporation method[J]. Acta Poloniae Pharmaceutica, 2011, 68(6): 975-80. |
| [29] |
CAI Y, CHEN Y, HONG X, et al. Porous microsphere and its applications[J]. International Journal of Nanomedicine, 2013, 8: 1111. |
| [30] |
FAROOQ U, KHAN S, NAWAZ S, et al. Enhanced gastric retention and drug release via development of novel floating microspheres based on Eudragit E100 and polycaprolactone:Synthesis and in vitro evaluation[J]. Designed Monomers and Polymers, 2017, 20(1): 419-433. DOI:10.1080/15685551.2017.1326702 |
| [31] |
RUAN G, FENG S S, LI Q T. Effects of material hydrophobicity on physical properties of polymeric microspheres formed by double emulsion process[J]. Journal of Controlled Release, 2002, 84(3): 151-160. DOI:10.1016/S0168-3659(02)00292-4 |
| [32] |
DAVIES O R, MARLOW M, STOLNIK S. Macroporous surface modified microparticles[J]. Soft Matter, 2008, 4(8): 1597-1601. DOI:10.1039/b805421e |




