2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China
抗体是机体对外源物质进行免疫应答而产生的一类特殊的免疫球蛋白,具有鉴别和中和毒素或病毒、抗体依赖细胞介导的细胞毒性、细胞吞噬等功能[1],抗体药物特异性高、靶向性强而且毒副作用小,在生物医药方面发展迅速[2~4]。亲和层析法选择性高,操作方便,具有高纯度、高收率的特点,在抗体纯化方面的应用也越来越广泛[5]。目前,我国抗体药物市场正处于快速发展时期[6],而国内在抗体生产纯化方面存在一定壁垒,优化抗体药物生产工艺,高效亲和介质国产化显得尤为重要[7]。
链球菌蛋白G(Septococcal protein G,SPG)是链球菌A、C、G群许多菌株细胞壁中存在的能与免疫球蛋白G结合的蛋白[8]。与金黄色葡萄球菌蛋白A(Staphylococcal protein A,SPA)不同,SPG与IgG的结合能力更强,结合谱更广泛,因而可替代SPA,应用于抗体的分析检测及纯化等方面[9~13]。

|
图 1 SPG基因结构示意图 Fig.1 Structure of the nature SPG |
SPG的基因结构主要可分为四个部分,N端信号肽区域、白蛋白结合区域、免疫球蛋白结合区域、以及包括W区和M区的C端蛋白锚定区域,其抗体结合域包含三个高度同源的IgG结合区(C1、C2、C3),分别被基因序列完全相同的D1、D2隔开。经NMR和X射线晶体衍射证实,C区均由一个α螺旋和两对反向平行的β片段组成,这种拓扑结构使得蛋白分子比较稳定。各结合域相互独立互不影响,即白蛋白结合区及蛋白锚定区域的去除不会影响C区与IgG的结合[14~16]。其中,C3区与IgG的结合能力最高。化学合成蛋白G的C3D基因,构建成C3DC3和C3DC3DC3的形式,得到的两种重组蛋白均可有效与不同来源抗体特异性结合,这种C3DC3DC3方式提高了重组蛋白G与不同物种IgG的结合能力[17, 18]。基于此,本研究运用基因工程的手段,重构SPG抗体结合域,并利用大肠杆菌原核表达系统,表达重组蛋白G,试图获得具有IgG纯化和定向固定化的高效重组蛋白G,具有一定的研究意义和商业价值。
2 材料与方法 2.1 材料E. coli JM109、E. coli BL21(DE3)菌株和PET21a(+)表达载体均由本实验室保藏。质粒DNA小量提取试剂盒、DNA胶回收试剂盒、氨苄青霉素(Amp)、异丙基硫代-D-半乳糖苷(IPTG)购自生工生物工程(上海)有限公司;DL 2000 DNA Marker、Premixed Protein Marker (Broad)、限制性核酸内切酶NdeⅠ和Hind Ⅲ购自宝生物工程(大连)有限公司;Ni-NTA Purose 6 Fast Flow、Epoxy Purose 4 Fast Flow购自江苏千纯生物科技有限公司;商品蛋白G层析介质(Protein G Sepharose 4 FF)购自美国GE Healthcare公司;人免疫球蛋白hIgG购自成都蓉生药业有限责任公司;正常人血清、小鼠腹水购自江苏艾赛氏生物科技有限公司;其余试剂均为国产分析纯。
2.2 重组表达质粒设计与构建根据GenBank中SPG基因序列,查找编码C3区和D2区的基因,以C3D为基础单元,分别重复串联拼接3、4、5、6次,得到4个不同的基因片段并将其分别命名为G3C、G4C、G5C、G6C。根据大肠杆菌对密码子偏爱性对序列进行优化。此外,每组基因片段的两端设计起始密码子ATG和终止密码子TAA, 以及NdeⅠ(CATATG)和Hind Ⅲ(AAGCTT)两个酶切位点,5’端添加6×His标签,便于通过亲和层析快速获得蛋白纯品,3’引入半胱氨酸,便于蛋白固定。最后将序列交由通用生物系统(安徽)有限公司合成。
提取含目的基因质粒和PET21a质粒,利用限制性内切酶NdeⅠ和Hind Ⅲ进行质粒的双酶切,利用常规分子克隆技术构建PET21a-G重组质粒并转化E. coli BL21(DE3),阳性克隆菌质粒双酶切验证、测序鉴定无误后,得重组菌E. coli BL21(DE3)/PET21a-G。
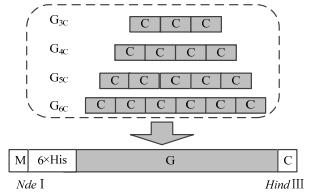
|
图 2 重组蛋白G结构的设计 Fig.2 Structure of the recombinant protein G |
测序正确的各重组菌经37℃,200 r·min-1过夜培养,以1%接种量接到含有Amp(终浓度50 μg·mL-1)的50 mL LB液体培养基中。待菌液OD600达到0.6~0.8时,加入诱导剂IPTG (终浓度为0.2 mmol·L-1),30℃,160 r·min-1,诱导表达12 h。取菌液进行全菌蛋白SDS-PAGE验证。诱导结束后,8000 r·min-1,4℃离心10 min收集菌体,磷酸盐缓冲液(20 mmol·L-1 PBS,pH 7.4)清洗2~3次,4℃离心收集沉淀,平衡缓冲液A (20 mmol·L-1 NaH2PO4,0.5 mol·L-1 NaCl,50 mmol·L-1咪唑,pH7.4)重悬菌体,冰浴超声破碎,4℃离心收集上清。
本研究采用千纯生物Ni-NTA亲和层析介质进行重组蛋白的纯化。实验参照产品使用步骤进行,并收集各重组蛋白破胞原液、流穿液、洗脱液,进行SDS-PAGE电泳鉴定。验证无误后透析除盐低温保存。
2.4 亲和层析介质的制备 2.4.1 偶联条件的优化本研究以千纯生物的环氧活化介质Epoxy Purose 4 Fast Flow为基质,进行蛋白G的偶联[19]。分别对偶联过程的pH、温度和反应时间进行单因素的优化,具体如下:
(a) 称取1 g抽干介质于25 mL小三角瓶内,加入10 mg·mL-1蛋白溶液(0.1 mol·L-1 Na2CO3/NaHCO3,pH 10.0、10.5、11.0、11.5)搅拌混匀,于40℃,恒温振荡反应18 h,反应结束后用大量去离子水冲洗,加入适量20%乙醇,4℃保存。
(b) 称取1 g抽干介质于25 mL小三角瓶内,加入10 mg·mL-1蛋白溶液(0.1 mol·L-1 Na2CO3/NaHCO3,pH 10.0)搅拌混匀,于40℃,分别恒温振荡反应12、18、24、36、48 h,反应结束后,充分洗涤,4℃保存。
(c) 称取1 g抽干介质于25 mL小三角瓶内,加入10 mg·mL-1蛋白溶液(0.1 mol·L-1 Na2CO3/NaHCO3,pH 10.0)搅拌混匀,分别于25、30、35、40℃,恒温振荡反应18 h,反应结束后,充分洗涤,4℃保存。
2.4.2 静态吸附载量选用hIgG作为模型吸附蛋白,分别测定层析介质的静态吸附量。取一定量蛋白G层析介质于砂芯漏斗中,用去离子水清洗介质,将其置于平衡缓冲液B(20 mmol·L-1 PBS,pH 7. 4)中约15 min后,抽干,分别称取0.1 g的抽干介质于5个25 mL具塞锥形瓶中,编号并依次加入5 mL浓度为0.25、0.5、1、2、3 mg·mL-1平衡缓冲液配置的hIgG溶液,25℃,180 r·min-1,恒温震荡5 h,反应停止后,室温静置10 min,吸取上清,测定OD280。蛋白偶联量根据测定上清溶液中的蛋白量与投入量的差值计算。利用Langmuir方程衡量亲和介质对hIgG的吸附性能,按照式(1)计算介质的饱和吸附容量Qm和解离常数Kd[19, 20]。
| $ Q* = \frac{{{Q_{\rm{m}}} - C*}}{{{K_{\rm{d}}} + C*}} $ | (1) |
式中:Qm为介质的饱和吸附容量(mg·mL-1);Kd为解离常数(mg·mL-1)。Q*和C*分别为介质的吸附量和平衡时体系中的蛋白浓度(mg·mL-1)。根据Q*和C*进行非线性拟合,绘制等温吸附曲线,得出层析介质的吸附参数Qm和Kd。
2.5 层析介质吸附载量比较以最优pH、温度和反应时间等反应条件制备层析介质,分别偶联等量SPG3C、SPG4C、SPG5C、SPG6C,按照2.4.2节中步骤测定介质的静态吸附量,绘制等温吸附曲线。比较不同介质对hIgG吸附情况,确定吸附性能较高的层析介质。
2.6 自制层析介质的性能研究 2.6.1 动态吸附性能[21]选用hIgG作为模型吸附蛋白。将1 mL层析介质装柱,用平衡缓冲液B (20 mmol·L-1 PBS,pH7.4)冲洗5个柱床体积,取hIgG平衡缓冲液稀释上样(1 mg·mL-1),流速0.15 mL·min-1,通过紫外检测仪记录的OD280,绘制穿透曲线。当流穿hIgG浓度超过初始上样浓度的10%时停止上样,此时蛋白浓度即每毫升介质吸附蛋白量动态吸附量。
| $ {Q_{10\% }} = \frac{{C0 \times \int_0^{V{\rm{solition}}, 10\% } {\left( {1 - \frac{C}{{C0}}} \right){\rm{d}}V{\rm{solution}}} }}{{V{\rm{absorbents}}}} $ | (2) |
式中:Q10%为动态吸附载量(mg·mL-1介质);C和C0和分别为柱出口蛋白浓度和初始蛋白浓度(mg·mL-1),Vsolution, 10%为穿透时蛋白溶液的体积用量(mL),Vabsorbents为柱中介质的体积(mL)。
2.6.2 重复使用性能将自制层析介质装填层析柱,以平衡10个柱体积、洗脱3个柱体积、平衡5个柱体积为一个循环,并在5、10、15、20、25、30个循环后分别测定介质对hIgG的静态吸附量,考察自制介质重复使用情况。
2.7 介质的纯化应用以小鼠腹水和人血清为样品,采用ÄKTA purifier层析系统进行纯化实验。自制层析介质装于1 mL预装柱中,用平衡缓冲液B (20 mmol·L-1PBS,pH7.4)冲洗10个柱体积,以0.5 mL·min-1的流速上样,上样量为1 mL,继续用平衡缓冲液冲洗杂蛋白,收集穿透液,基线持平后,用洗脱缓冲液(0.1 mol·L-1甘氨酸-HCl缓冲液,pH 2.7)洗脱,收集洗脱液,并立即用中和缓冲液(1 mol·L-1 Tris-HCl,pH9.0)中和至中性。
在相同操作条件下用商品亲和层析介质进行两种样品的纯化实验,收集流穿液与洗脱液。
3 结果与讨论 3.1 重组菌的设计构建重组质粒双酶切后经1.5%琼脂糖凝胶电泳如图 3,可得到清晰的条带,其分子大小与理论分子量591bp、801bp、1011bp、1221bp一致,经DNAMAN软件分析,序列的测序结果与所设计序列100%同源,重组表达菌构建成功。
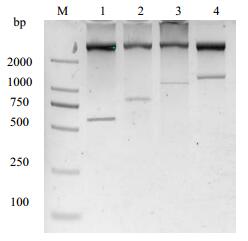
|
图 3 重组质粒双酶切验证图 Fig.3 Double enzyme digestion of the recombinant plasmid. M-Marker; 1-4: plasmid of PET21a-G3C, G4C, G5C, G6C |
如图 4,蛋白理论分子量分别为23、30、37、44 kD,诱导后菌体相应位置均有较明显条带(泳道4、5)。电泳结果经Image J软件分析,纯化后各重组蛋白纯度基本大于90%。本研究发现,纯化脱盐后的重组蛋白SPG5C和SPG6C在4℃冰箱中存放一定时间后均出现不同程度的白色沉淀(数据未给出),经过多次实验均出现类似现象,初步判定重组蛋白SPG5C和SPG6C稳定性较差。
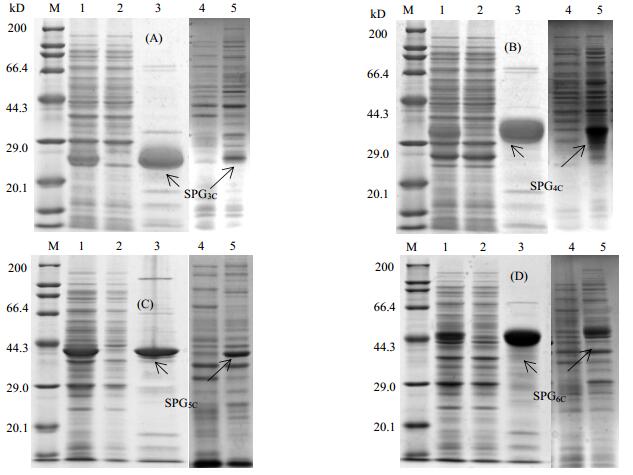
|
图 4 重组蛋白G亲和层析SDS-PAGE电泳结果 Fig.4 SDS-PAGE images of affinity purification of recombinant protein G (A-D). Recombinant SPG3C, SPG4C, SPG5C, SPG6C. M-Protein marker; 1. crude sample 2. break through 3. elution 4. uninduced recombinant protein G 5. induced recombinant protein G |
亲和介质制备过程中配基的偶联是影响配基结合量的关键因素[22],偶联过程中环氧基与巯基的反应主要受反应体系的pH、温度、反应时间等因素的影响,故本实验以重组蛋白SPG4C为参考,对偶联条件进行优化,分别考察其静态吸附量,确定高载量亲和介质的制备方法。不同偶联pH下介质等温吸附情况如图 5(A),所选pH条件下曲线的走势无明显差别,由表 1可知,pH为10.5时介质的饱和吸附量最高,为58.57 mg·mL-1介质,且继续提高pH,介质饱和吸附量反而降低,最终选择pH 10.5为偶联反应的pH。如图 5(B)所示,不同反应时间等温曲线趋势相似,由表 1可知,反应不同时间,介质的饱和吸附量变化基本不大,反应48 h时介质饱和吸附量最大,但是与反应24 h相比,提高的幅度不是很大,故确定偶联反应的反应时间为24 h。由图 5(C)可以看出,反应温度对于配基偶联情况有较大的影响,反应温度越高介质吸附量越大,由表 1得知反应温度为40℃介质饱和吸附量最大,为61.83 mg·mL-1介质,最终确定反应温度为40℃。
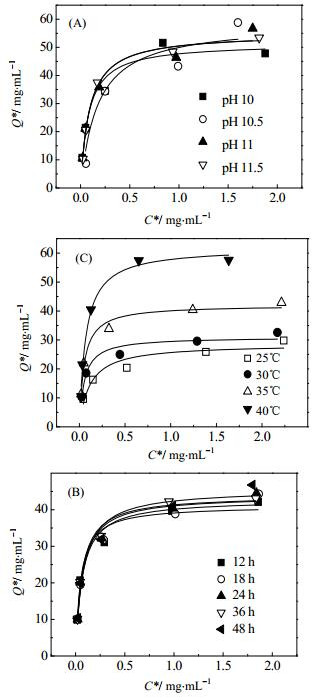
|
图 5 偶联条件对介质hIgG等温吸附情况的影响 Fig.5 Effects of coupling conditions on isothermal adsorption of hIgG. (A-C) factors: pH, time and temperature |
|
|
表 1 不同偶联条件层析介质的饱和吸附量和解离常数 Table 1 Saturated adsorption capacities and dissociation constants of resins under different coupling conditions |
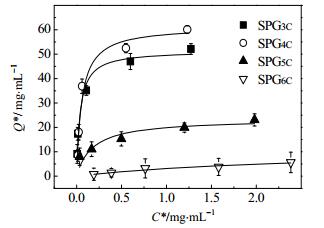
偶联不同蛋白介质等温吸附情况如图 6所示。不同介质的等温吸附曲线差异明显,表明不同蛋白配基对hIgG的吸附能力不同。经吸附曲线拟合并根据蛋白偶联前后差值计算配基密度得表 2,配基SPG4C的饱和吸附量最高,为66.78 mg·mL-1介质,配基SPG3C饱和吸附量略低于SPG4C,为50.57 mg·mL-1介质,而配基SPG5C、SPG6C的饱和吸附量却很低。理想情况下,包含5、6个C3区,其抗体吸附量应该比SPG4C高,而配基SPG5C和SPG6C吸附量很低的原因可能是在配基与抗体结合的过程中分子之间的空间位阻效应增强,对配基的屏蔽作用变大,不利于大部分结合位点的暴露,使抗体结合部位没有充分被占用。
|
图 6 不同介质等温吸附曲线 Fig.6 Isothermal adsorption curves of different resins |
|
|
表 2 不同层析介质的饱和吸附量和解离常数 Table 2 Saturated adsorption capacities and dissociation constants of different resins |
考虑到重组蛋白SPG5C和SPG6C稳定性差的情况,故造成低吸附的原因也有可能是重复序列较长使蛋白不稳定,容易聚集沉淀,导致很少的蛋白真正参与抗体结合反应,从而不能有效的吸附hIgG。关于是否是因为重复序列影响蛋白稳定性目前尚不清楚,本实验只期望通过载量大小获得一种高效结合抗体的串联形式的重组蛋白,故并未进行深入的研究。综合考虑,选择SPG4C作为后续实验的研究对象,考察SPG4C亲和层析介质性能。
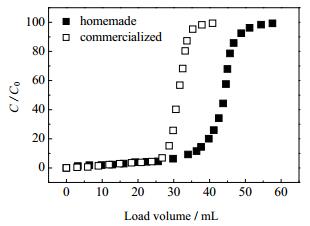
3.5 自制层析介质性能测定 3.5.1 动态吸附性能介质的穿透曲线如图 7,相同操作条件下,两种亲和介质对hIgG的穿透行为很相似,经计算,自制层析介质的Q10%动态载量为35 mg·mL-1介质,商业层析介质Q10%动态载量为27 mg·mL-1介质,自制的介质动态载量较商品介质高。
|
图 7 层析介质的穿透曲线 Fig.7 Breakthrough curves of different resins |
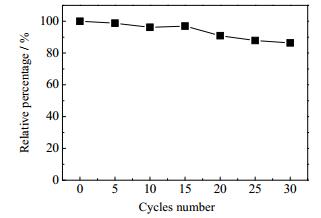
由图 8知,随着使用次数的增加,层析介质的吸附载量逐渐下降,20次使用范围内载量约为初始载量的90%,30次以后降为85%,整体来讲重复稳定性较好。
|
图 8 自制层析介质的重复使用率 Fig.8 Reusability of the prepared chromatography resins |
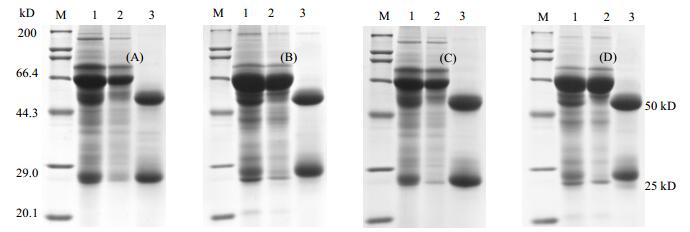
由图 9知,血清和腹水原液中都存在较多的杂带,而洗脱液中只得到两条清晰的带,分子量约在50 kD,25 kD,几乎没有其他的杂带。Image J分析电泳结果,考马斯亮蓝法测定蛋白浓度,并测量样品体积,计算纯度和回收率。如表 3,自制层析介质获得抗体纯度基本在95%左右,这与商品介质纯化的效果相近,对于小鼠腹水IgG,回收率达90%,商品介质回收率为93.9%;对于人血清IgG,回收率达80%,商品介质回收率为83.8%,二者差异不大。
|
图 9 抗体亲和纯化结果
Fig.9 Results of antibody purification
(A-B) Purification of mouse ascites and human serum by self-made affinity chromatography (C-D) Purification of mouse ascites and human serum by Commodity medium M-Marker; 1. crude product 2. flow through 3. eluention |
|
|
表 3 层析介质纯化抗体的结果 Table 3 Results of chromatographic media purification of antibodies |
本研究成功构建了四株蛋白G重组菌。通过优化配基偶联过程的反应条件,确定偶联缓冲液pH为10.5,反应温度为40℃,反应时间为24 h。通过比较四个配基SPG3C、SPG4C、SPG5C、SPG6C亲和介质的静态吸附容量,筛选出对hIgG吸附载量较高的重组蛋白SPG4C。SPG4C制备的层析介质用于纯化抗体获得95%的纯度,回收率基本在80%以上,等同于或优于商品层析介质。
| [1] | Arora S, Saxena V, Ayyar B V. Affinity chromatography:a versatile technique for antibody purification[J]. Methods, 2017, 116: 84-94. DOI:10.1016/j.ymeth.2016.12.010. |
| [2] | CHEN Quan(陈泉), ZHUO Yan-ling(卓燕玲), XU Ai-na(许爱娜), et al. Improved protein A chromatography for monoclonal antibody purification(蛋白A亲和层析法纯化单克隆抗体工艺的优化)[J]. Chinese Journal of Biotechnology(生物工程学报), 2016, 32(6): 807-818. |
| [3] | Horenstein A L, Chillemi A, Quarona V, et al. Antibody mimicry, receptors and clinical applications[J]. Human Antibodies, 2017, 25(3-4): 75-85. DOI:10.3233/HAB-160305. |
| [4] | Thomas A, Teicher B A, Hassan R. Antibody-drug conjugates for cancer therapy[J]. The Lancet Oncology, 2016, 17(6): e254-e262. DOI:10.1016/S1470-2045(16)30030-4. |
| [5] | Ayyar B V, Arora S, Murphy C, et al. Affinity chromatography as a tool for antibody purification[J]. Methods, 2012, 56(2): 116-129. DOI:10.1016/j.ymeth.2011.10.007. |
| [6] | XU Zhuo-bin(许卓斌), WANG Min(王旻). Pastlife of antibody and antibody drug(抗体与抗体药物的前世今生)[J]. Chinese Journal of Nature(自然杂志), 2016, 38(4): 271-277. |
| [7] | LI Min(李敏), WU Ri-wei(吴日伟). The market overview of monoclonal antibodies in both domestic and abroad(国内外单抗药物市场概述)[J]. China Biotechnology(中国生物工程杂志), 2017, 37(3): 106-114. |
| [8] | Kronvall G. A surface component in group A, C, and G Streptococci with non-immune reactivity for immunoglobulin G[J]. Journal of Immunology, 1973, 111(5): 1401-1406. |
| [9] | Lund L N, Gustavsson P E, Michael R, et al. Novel peptide ligand with high binding capacity for antibody purification[J]. Journal of Chromatography A, 2012, 1225(1225): 158-167. |
| [10] | Zhang H C, Liang W G, Fan H T, et al. Immunological characterization and verification of recombinant Streptococcal protein G[J]. Molecular Medicine Reports, 2015, 12(4): 6311-6315. DOI:10.3892/mmr.2015.4162. |
| [11] | Krainer F W, Darnhofer B, Birner-Gruenberger R, et al. Recombinant production of a peroxidase-protein G fusion protein in Pichia pastoris[J]. Journal of Biotechnology, 2016, 219: 24-27. DOI:10.1016/j.jbiotec.2015.12.020. |
| [12] | Owuor B O, Remarque E J, Faber B W, et al. A novel method to clean protein G agarose for affinity column matrix with renewed binding capacity and high IgG selectivity[J]. Journal of Immunological Methods, 2010, 352(1-2): 192-194. DOI:10.1016/j.jim.2009.10.008. |
| [13] | FANG Guo-liang(房国梁), LIU Zhi-guo(刘志国), ZONG Yi-qiang(宗义强), et al. Cloning, expression and function of protein G IgG Fc binding domain(蛋白G IgG Fc段结合域的克隆表达及功能研究)[J]. Biotechnology Bulletin(生物技术通报), 2009(9): 111-116. |
| [14] | Guss B, Eliasson M, Olsson A, et al. Structure of the IgG-binding regions of Streptococcal protein G[J]. The EMBO Journal, 1986, 5(7): 1567-1575. |
| [15] | Olsson A, Eliasson M, Guss B, et al. Structure and evolution of the repetitive gene encoding Streptococcal protein G[J]. European Journal of Biochemistry, 1987, 168(2): 319-324. DOI:10.1111/ejb.1987.168.issue-2. |
| [16] | Du H N, Zhang T Y, Chang Y G, et al. Effects of segment substitution on the structure and stability of immunoglobulin G binding domain of Streptococcal protein G[J]. Biopolymers, 2005, 79(1): 9-17. DOI:10.1002/(ISSN)1097-0282. |
| [17] | XU Rui(许瑞), ZHAO Deng-yun(赵登云), HONG Yang(洪炀), et al. Reconstruction expression and identification of a Streptococcal protein G domlain(链球菌蛋白G的结构域重构、表达及鉴定)[J]. Chinese Journal of Animal Infectious Diseases(中国动物传染病学报), 2015, 23(5): 46-52. DOI:10.3969/j.issn.1674-6422.2015.05.009. |
| [18] | AN Ming-yan(安明岩), CHU Zhong-mei(褚仲梅), ZHANG Yi(张毅). Construction, expression and identification of a recombinant Streptococcal protein G(链球菌蛋白G的构建、重组表达及鉴定)[J]. Industrial Microbiology(工业微生物), 2012, 42(2): 1-5. DOI:10.3969/j.issn.1001-6678.2012.02.001. |
| [19] | SHENG Zhi(盛志), SHI Hong-qing(史洪清), BAI Shu(白姝). Microcalorimetric analysis on antibody adsorption and alkali resistance of protein A adsorbents(蛋白A介质抗体吸附性能及耐碱性的量热学)[J]. Chemical Industry and Engineering(化学工业与工程), 2017, 34(4): 75-82. |
| [20] | Zhao W W, Shi Q H, Sun Y. Dual-ligand affinity systems with octapeptide ligands for affinity chromatography of hIgG and monoclonal antibody[J]. Journal of Chromatography A, 2014, 1369: 64-72. DOI:10.1016/j.chroma.2014.09.083. |
| [21] | Griffith C M, Morris J, Robichaud M, et al. Fluidization characteristics of and protein adsorption on fluoride-modified porous zirconium oxide particles[J]. Journal of Chromatography A, 1997, 776(2): 179-195. DOI:10.1016/S0021-9673(97)00282-3. |
| [22] | YI Qiu-fen(易秋分), ZHANG Cui-ying(张翠英), JIANG Yong-ji(蒋永吉), et al. The preparation of GSH affinity chromatographic adsorbent and the research of its chromatographic characteristics(谷胱甘肽亲和层析介质的制备条件及其层析特性研究)[J]. Journal of Tianjin University of Science & Technology(天津科技大学学报), 2015, 30(5): 7-14. |




