阿维拉霉素(Avilamycin)是绿色产色链霉菌(Streptomyces viridochromogenes)发酵产生的一种寡糖类抗生素,主要抑制革兰氏阳性菌,它通过与细菌核糖体结合来抑制蛋白质的合成,是一种特殊的蛋白质合成抑制剂[1]。因其具有稳定而良好的促生长和预防动物疾病的双重效果,安全性高、残留量低,对环境无影响等优点,所以作为畜禽用促生长剂在大部分国家和地区被广泛应用[2-3]。2005年我国农业部己批准使用阿维拉霉素预混剂[进口兽药再注册目录,(2005)外兽药证字56号],但国内的抗生素生产企业还没有足够的技术能力进行阿维拉霉素的工业化生产。
发酵动力学主要包括菌体生长动力学、底物消耗动力学和产物合成动力学,研究的是各种条件因素对微生物代谢的相互作用随时间变化的规律,从而为发酵技术的建立和产业化生产提供指导意义。绿色产色链霉菌代谢过程的认识仍不明确,因此从发酵动力学角度来分析阿维拉霉素发酵过程中的主要参数随时间及控制变量的变化规律,可以简单有效的描述其发酵过程[4]。目前国内关于阿维拉霉素的研究主要集中在高产菌株筛选、摇瓶或罐上发酵工艺优化以及动物实验方面[5-6],对于绿色产色链霉菌发酵动力学的研究国内外尚未报道。因此本文在优化了转速、初始pH及前体物质L-缬氨酸(L-Val)流加等发酵条件的基础上,研究了绿色产色链霉菌生产阿维拉霉素的动力学过程。通过构建绿色产色链霉菌生产阿维拉霉素的发酵动力学模型,为今后阿维拉霉素发酵的在线控制、自动化以及工业化生产提供理论依据。
2 材料与方法 2.1 菌种及培养基本实验室选育保藏的绿色产色链霉菌Streptomyces viridochromogenes gs 54菌株(以下简称为S.viridochromogenes gs 54菌株)
斜面培养基(g·L-1):琼脂20.0,可溶性淀粉20.0,KNO3 5.0,K2HPO4 2.5,MgSO4·7H2O 2.5,NaCl 2.5,FeSO4·7H2O 0.01,pH 7.2~7.4。
种子培养基(%):酵母粉0.25,葡萄糖0.5,黄豆饼粉1.5,麦芽糊精2.0,CaCO3 0.1,CaCl2 0.2,pH调至7.5~7.7。
发酵培养基(%):金龙鱼大豆油1.0,甘露醇2.5,葡萄糖1.8,黄豆饼粉1.25,玉米淀粉4.0,CaCl2 1.8,CaCO3 0.5,NaCl 0.1,NaNO3 0.45,MnCl2 0.002,Fe SO4·7 H2O 0.002,MgSO4·7 H2O 0.002,ZnSO4 0.002,CuSO4 0.001,CoCl2 0.001,(NH4)2SO4 0.02,消泡剂0.03,pH调至设定值。
2.2 培养方法 2.2.1 菌种培养方法S.viridochromogenes gs 54菌株斜面培养10 d左右。无菌操作下,将其菌苔斜面切块接种至含有100 mL种子培养基的500 mL锥形瓶中,160 r·min-1,28 ℃下摇床培养24 h得一级种子培养液。再将一级种子按接种量
在摇瓶发酵参数及培养基组分优化的基础上,本文分别考察了发酵罐转速(220、320、420 r·min-1)、发酵培养基初始pH(7.0、7.5、8.0)、L-缬氨酸流加0.1 %对阿维拉霉素的产量和生物量的影响。确定适宜发酵罐转速、发酵pH及L-缬氨酸补料条件,记录发酵过程pH、溶氧(Dissolve oxygen,DO)等数据。
2.3 分析方法 2.3.1 菌体生物量测定方法发酵液样品摇匀后,取30 mL于离心管中,3 000 r·min-1下离心10 min,上清液用于测定总糖、pH等。所得菌体细胞沉淀经蒸馏水洗涤离心两次后,取适量,用快速水份测定仪测定水分含量。经计算,得菌体干重浓度(Dry cell weigh,DCW)。
2.3.2 阿维拉霉素浓度测定发酵液样品摇匀后,取5 mL加入一定量甲醇在37 ℃下浸提过夜,离心取上清液过膜后进行HPLC法[7]分析,由标准曲线计算出发酵液样品中阿维拉霉素A、B组分的总含量(标准曲线方程:阿维拉霉素A组分:Y=16 691X+61 133,R2=0.999 9,阿维拉霉素B组分:Y=16 694X+3 720.3,R2=0.999 9)。
2.3.3 总糖浓度测定采用DNS法测定发酵上清液中的总糖浓度[8]。
2.3.4 罐内溶氧和发酵液pH的测定分别用Mettler-toledo溶氧电极和Mettler-toledo 405-DPAS-SC-k8s/120 pH电极在线检测采集数据。
2.4 数据处理发酵过程数据处理、模型参数非线性拟合和检验采用Origin 8.0软件。
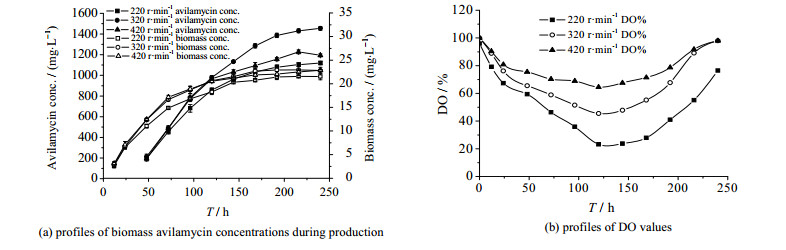
3 结果与分析 3.1 发酵优化结果 3.1.1 转速对阿维拉霉素发酵的影响在发酵罐通气量为2.0 vvm, 初始pH为7.5,28 ℃发酵240 h,考察不同转速(220、320、420 r·min-1)对S.viridochromogenes gs 54菌株产阿维拉霉素的影响,结果如图 1所示。由图 1(a)可知,3个转速下的发酵前期罐内生物量均快速增长;120 h之后,增长缓慢。结合图 1(b)可知,在通气量恒为2.0 vvm下,三个转速下罐内溶氧在0~120 h持续降低,120 h后开始缓慢的回升。分批发酵过程中微生物的耗氧量与培养基的成分和浓度、菌龄及发酵条件等因素有关,尤其培养基成分和浓度影响显著。发酵前期培养基营养丰富,菌体快速增长,耗氧量大,所以发酵液中的溶氧持续下降。随着发酵进行,培养基各营养成分浓度减小,菌体呼吸强度相对快速生长期减弱且趋于平稳,因此出现了120 h后溶氧回升的现象;此阶段菌体浓度、呼吸强度相对平稳,阿维拉霉素开始大量合成,说明在发酵120 h左右进入产物合成稳定期。分析各组的产素情况,220 r·min-1组罐内溶氧始终低于其他两组,溶氧不足导致菌体生长较其它组慢,阿维拉霉素合成偏低。320 r·min-1与420 r·min-1组在发酵前120 h罐内阿维拉霉素产量相差不大,120 h后420 r·min-1组阿维拉霉素合成明显受阻。分析原因可能是搅拌转速过高对S.viridochromogenes gs 54菌丝体破坏导致阿维拉霉素合成受阻。本发酵罐采用的是平直叶涡轮式的三层六叶搅拌桨,该搅拌桨产生的剪切作用力随转速增大增强,对丝状菌体细胞破坏严重[9]。综上,发酵转速控制在320 r·min-1为宜。
|
图 1 搅拌转速对阿维拉霉素发酵菌体生物量、阿维拉霉素产量和溶氧的影响 Fig.1 Effects of impeller rotational speed on avilamycin fermentation |
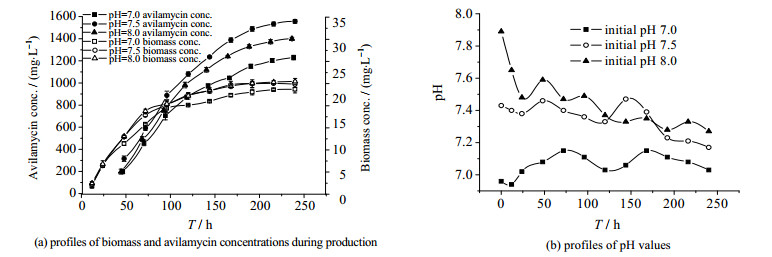
在发酵罐通气量为2.0 vvm、转速320 r·min-1下考察不同初始pH(7.0、7.5、8.0)对S.viridochromogenes gs 54菌株产阿维拉霉素的影响,结果如图 2所示。图 2表明初始pH为7.0、7.5、8.0时,发酵48 h内发酵液pH会先降低再回升,之后趋于相对稳定或略微下降,发酵终点pH分别为7.05、7.17、7.27。初始pH 7.0时,发酵过程pH稳定在7.05左右,菌体生物量及阿维拉霉素产量在发酵96 h前与pH为7.5、8.0差异不是很显著而之后明显低于其它两组。而初始pH为7.5时,菌体生物量和阿维拉霉素合成量最高。该结果表明在发酵中后期,发酵体系略高的pH更有利于阿维拉霉素的合成。综上,选择发酵培养基初始pH 7.5为宜。
|
图 2 培养基初始pH对阿维拉霉素发酵菌体生物量、阿维拉霉素产量和pH的影响 Fig.2 Effects of initial pH on avilamycin fermentation |
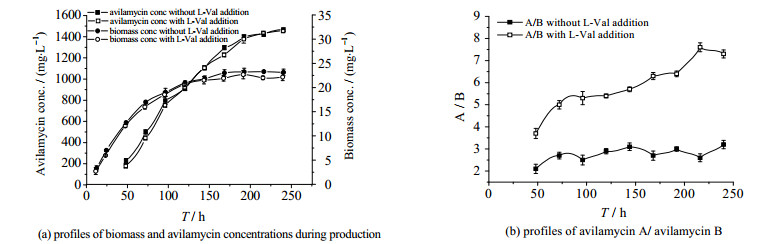
阿维拉霉素发酵过程中重要的前体物质主要是L-Val及其类似物[5],摇瓶研究发现低浓度L-Val的添加对阿维拉霉素发酵效价的提高及各组分的比例有显著的影响。通过优化摇瓶发酵过程中L-Val的添加量和添加方式,考察罐上发酵过程中流加0.1 %的L-Val对阿维拉霉素发酵的影响。阿维拉霉素有多种组分,主要组分是阿维拉霉素A和B,两者相差二个甲基,A组分的活性为1 451 U·mg-1,明显高于B组分的活性908 U·mg-1[6]。在发酵罐通气量为2.0 vvm、转速320 r·min-1、初始pH 7.5的条件下流加0.1 % L-Val,研究它对菌体生物量、阿维拉霉素产量及阿维拉霉素不同组分比例变化的影响。结合图 3(a)、(b)可知,阿维拉霉素发酵前体物质L-Val[5, 10]的添加对S.viridochromogenes gs 54菌株的生长基本无影响,但能促进阿维拉霉素的合成,并能极大提高阿维拉霉素A/B组分的比例。发酵过程中随着发酵时间的增加,添加L-Val组阿维拉霉素A含量显著增加,B含量基本不增加;未添加L-Val组阿维拉霉素A含量增加不明显,B含量不断增加;这可能是L-Val添加的促使了阿维拉霉素B组分向其A组分的转化。发酵240 h时添加L-Val组的阿维拉霉素的产量较对照提高4.3%,且阿维拉霉素A/B组分的比例由3.2提高至7.3。
|
图 3 L-Val的添加对阿维拉霉素发酵菌体生物量、阿维拉霉素产量和组分A/B的影响 Fig.3 Effects of L-Val addition on avilamycin fermentation |
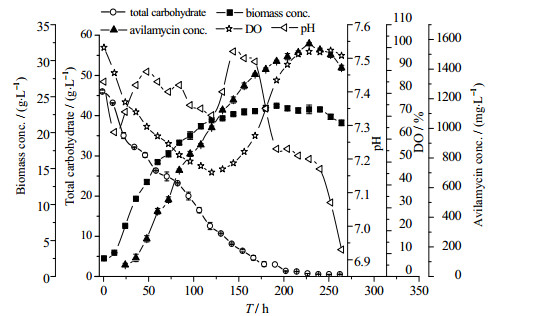
在优化后的发酵条件(初始pH 7.5,转速320 r·min-1,流加0.1 % L-Val)下28 ℃发酵264 h,定时取样测定各参数,获得S.viridochromogenes gs 54菌株在30 L发酵罐上的分批发酵过程曲线,如图 4所示。由图 4可知,阿维拉霉素发酵分为4个阶段,分别为延滞期、快速生长期、稳定期、衰亡期。第1阶段0~12 h菌株生长延滞期时间较短,此阶段菌体细胞生长和总糖消耗都比较缓慢。第2阶段12~120 h为菌体快速生长期,此阶段总糖消耗加快,溶氧下降迅速,菌体细胞大量积累,阿维拉霉素开始合成。第3阶段120~228 h菌体的生长进入稳定期,各取样点菌体生物量差异不明显,在192 h达最高值2 373 mg·L-1,但阿维拉霉素仍在稳步合成,在228 h时达到最大值1 571.04 mg·L-1,说明阿维拉霉素的合成与菌体生长呈部分偶联。第4阶段228~264 h衰亡期,此时菌体开始自溶、镜检菌丝断裂,生物量开始下降。
|
图 4 S.viridochromogenes gs 54产阿维拉霉素分批发酵过程曲线 Fig.4 Cultivation profiles of S.viridochromogenes gs 54 for avilamycin production in batch fermentation |
由S.viridochromogenes gs 54菌株分批发酵过程曲线(图 4)可知,S.viridochromogenes gs 54细胞生长呈S型,而Logistic生长模型描述的是典型的S型曲线,它能较好反映菌体细胞的增加对菌体自身生长的抑制,因此其发酵过程中菌体生长规律用Logistic方程来拟合[10-11]。
| $ \frac{\mathrm{d} X}{\mathrm{d} t}=\mu_{\mathrm{m}}\left(1-\frac{X}{X_{\mathrm{m}}}\right) X $ | (1) |
式中,dX/dt为菌体的生长速率(g·L-1·h-1);X为菌体浓度(g·L-1);t为发酵时间(h);μ为比生长速率(h-1);μm为菌体细胞最大比生长速率(h-1);Xm为最大菌体浓度(g·L-1);μm、Xm为常数。
当t=0时,X=X0,对上述方程进行从时间0 min到t min的定积分后得到:
| $ X=\frac{X_{0} X_{m} \mathrm{e}^{\mu_{\mathrm{m}} t}}{X_{m}-X_{0}+X_{0} \mathrm{e}^{\mu_{\mathrm{m}} t}} $ | (2) |
结合图 4可知,在发酵稳定期菌体生物量趋于稳定时,阿维拉霉素的产量仍缓慢增加,同时总糖浓度仍继续减少,由此判断阿维拉霉素合成与菌体细胞生长呈部分偶联,因此可用Luedeking-Piret方程对产物合成曲线进行拟合[12-13]。见式(3):
| $ \frac{\mathrm{d} P}{\mathrm{d} t}=\alpha \frac{\mathrm{d} X}{\mathrm{d} t}+\beta X $ | (3) |
式中,dP/dt为产物合成速率(g·L-1·h-1);P为产物浓度(g·L-1);α为与菌体生长速率有关联的产物合成常数(g·L-1·h-1),β为与菌体浓度关联的产物合成常数(g·L-1·h-1)。
对Luedeking-Piret方程进行从时间0 min到t min的定积分,得式(4):
| $ P=P_{0}-\alpha X_{0}+\alpha \frac{X_{0} X_{\mathrm{m}} \mathrm{e}^{\mu_{\mathrm{m}} t}}{X_{\mathrm{m}}-X_{0}+X_{0} \mathrm{e}^{\mu_{\mathrm{m}} t}}+\beta\left(X_{\mathrm{m}} / \mu_{\mathrm{m}}\right) \ln \left(\frac{X_{\mathrm{m}}-X_{0}+X_{0} \mathrm{e}^{\mu_{\mathrm{m}} t}}{X_{\mathrm{m}}}\right) $ | (4) |
在本发酵过程中,底物总糖消耗主要用于菌体细胞生长、产物阿维拉霉素合成及菌体细胞代谢过程的维持。因此可用Luedeking-Piret-Like方程对阿维拉霉素发酵的底物消耗进行拟合[12-13],其方程为:
| $ -\frac{\mathrm{d} S}{\mathrm{d} t}=\left(\frac{\mathrm{d} X}{\mathrm{d} t}\right)\left(\frac{1}{Y_{\mathrm{X} / \mathrm{S}}}\right)+\left(\frac{\mathrm{d} P}{\mathrm{d} t}\right)\left(\frac{1}{Y_{\mathrm{P} / \mathrm{S}}}\right)+m_{0} X $ | (5) |
式中,-dS/dt为底物消耗速率(g·L-1·h-1);S为底物浓度(g·L-1);YX/S为菌体对底物的得率(g·g-1),YP/S为产物对底物的得率(g·g-1),m0为菌体维持因子(h-1)。
结合式(1)、(3),对式(5)合并同类项并化简得式(6):
| $ -\frac{\mathrm{d} S}{\mathrm{d} t}=b_{1}\left(\frac{\mathrm{d} X}{\mathrm{d} t}\right)+b_{2} X $ | (6) |
其中,
对上式进行从时间0 min到t min的定积分,得式(7):
| $ S=S_{0}+b_{1} X_{0}-b_{1} \frac{X_{0} X_{\mathrm{m}} \mathrm{e}^{\mu_{\mathrm{m}} t}}{X_{\mathrm{m}}-X_{0}+X_{0} \mathrm{e}^{\mu_{\mathrm{m}} t}}-b_{2}\left(X_{\mathrm{m}} / \mu_{\mathrm{m}}\right) \ln \left(\frac{X_{\mathrm{m}}-X_{0}+X_{0} \mathrm{e}^{\mu_{\mathrm{m}} t}}{X_{\mathrm{m}}}\right) $ | (7) |
采用Origin8.0软件对S.viridochromogenes gs 54菌株产阿维拉霉素的动力学方程(2)、(4)、(7)式进行非线性拟合,所得动力学参数如表 1所示。将所得模型参数值分别代入到(2)、(4)、(7)式,得到菌体细胞生长、阿维拉霉素合成和底物总糖消耗的动力学方程如下:
|
|
表 1 发酵动力学的模型参数 Table 1 Parameters of fermentation kinetic models |
| $ X=\frac{75.140 \mathrm{e}^{0.041 t}}{19.797+3.259 \mathrm{e}^{0.041t}} $ | (8) |
| $ P=-329.016+44.182 \frac{75.140 \mathrm{e}^{0.041 t}}{19.797+3.259 \mathrm{e}^{0.041 t}}+120.903 \ln \frac{19.797+3.259 \mathrm{e}^{0.041 t}}{23.056} $ | (9) |
| $ S=47.299-1.163 \frac{75.140 e^{0.041 t}}{19.797+3.259 e^{0.041 t}}-2.868 \ln \frac{19.797+3.259 e^{0.041 t}}{23.056} $ | (10) |
S.viridochromogenes gs 54菌株发酵产阿维拉霉素的动力学曲线如图 5所示,其实验值和模型曲线拟合度依次为0.989 6、0.990 9和0.981 9,说明以上所采用的模型以及方程简化的可行性良好。
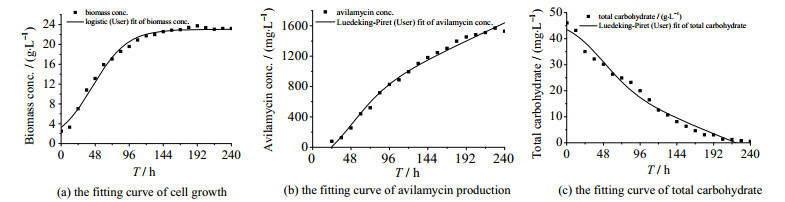
|
图 5 实验值与拟合值比较 Fig.5 Comparison of experimental data and predictive values |
在以上动力学研究相同发酵条件下进行实验,以检验动力学模型的误差,将所得实验数据与模型计算值进行比较。经验证,该模型预测的菌体生长、阿维拉霉素合成和总糖消耗值与实验值的误差平均值依次为5.9 %、7.1 %和6.5 %,说明以上建立的模型能较好地反映S.viridochromogenes gs 54菌株发酵产阿维拉霉素的分批发酵过程。
4 讨论目前国内外对阿维拉霉素发酵的优化多集中在利用摇瓶实验进行发酵培养基及发酵条件优化[5]。但在工业化大型发酵罐生产时,由于搅拌桨的剪切作用、机械热及液体深层发酵溶氧不足等问题[14],其菌体生长环境与摇瓶中生长环境不尽相同,而菌体产素受生长环境影响较大。本研究采用单因素法对阿维拉霉素罐上发酵条件进行优化,所得最佳发酵条件如下:在通气量2.0 vvm,装液量60 %,接种量
发酵动力学在发酵过程中具有广泛的应用和重要的指导意义[15]。鲁明波等[16]利用其研究了法夫酵母产虾青素的发酵过程,并考虑到底物抑制作用模型,计算出最适细胞生长底物糖浓度,提出两阶段补料策略,相比于传统补料发酵终点细胞干重和虾青素产量分别提高了52.8 %和109 %。郭朝江等[17]通过研究玫瑰孢链霉菌补料分批发酵生产达托霉素的动力学特征,为高效生产达托霉素提供可靠的调控策略和手段。本文对S.viridochromogenes gs 54发酵生产阿维拉霉素的动力学进行了研究,建立了其发酵动力学模型,通过分批发酵试验摸索了S.viridochromogenes gs 54菌株生长与代谢的基本规律。本研究表明模型参数中α > 0,β > 0,说明阿维拉霉素发酵过程属于部分生长关联型,这也与发酵过程曲线相吻合。基于Logistic、Luedeking-Piret、Luedeking-Piret-Like 3个模型对绿色产色链霉菌发酵合成阿维拉霉素过程曲线的较好拟合,说明该模型能够较好的预测发酵过程中菌体的生长、底物的的消耗和产物的合成,同时在一定程度上可以反映阿维拉霉素发酵代谢过程特征,可用于分析S.viridochromogenes gs 54分批发酵产阿维拉霉素过程。这为后续发酵过程的精细控制、工艺的改进、目标产物的积累及后续分批补料模型的建立积累了经验。
由模型预测可知发酵过程的特性,从而进行宏观调控。由模型方程(2)、(4)和(7)可知,阿维拉霉素的合成和菌体成正相关,菌体生长和产物合成与底物消耗有关。今后可进一步优化发酵工艺,比如在菌体的生长阶段通过调整培养基成分的比例、工艺参数的控制使菌体生长处于最佳生长状态;合成阶段在维持菌体较佳状态的同时,使阿维拉霉素的合成速率达到最高。此外可考虑补料发酵的系统化研究,为实现S.viridochromogenes gs 54菌株的高密度发酵并应用于产业化奠定基础。
|
|
| [1] |
WEITNAUCR G, MUHLENWEG A, TREFZER A. Biosynthesis of the orthosomycin antibiotic avilamycin A: Deductions from the molecular analysis of the avi biosynthetic gene cluster of Streptomyces viridochromogenes Tü57 and production of new antibiotics[J]. Chemical and biology, 2001, 8(6): 569-581. DOI:10.1016/S1074-5521(01)00040-0 |
| [2] |
DELSOL A A, RANDAL L L, COOLES S, et al. Effects of the growth promoter avilamycin on emergence and presistence of antimicrobial resistence in enteric bacteria in the pig[J]. Journal of applied microbiology, 2005, 98(3): 564-571. DOI:10.1111/j.1365-2672.2004.02461.x |
| [3] |
郭金玲. 饲料中效美素对仔猪生产性能和经济效益的影响[J]. 安徽农业科学, 2008, 36(20): 8608-8618. GUO J L. Effects of Maxus in feed on performance and economical efficiency of piglets[J]. Journal of Anhui Agricultural Sciences, 2008, 36(20): 8608-8618. DOI:10.3969/j.issn.0517-6611.2008.20.086 |
| [4] |
谭云, 黎继烈, 王卫, 等. 重组毕赤酵母产青霉素G酰化酶的分批发酵动力学研究[J]. 菌物学报, 2016, 35(1): 94-103. TAN Y, LI J L, WANG W, et al. A kinetic study of batch fermentation for penicillin G acylase enzyme production by recombinant Pichia pastoris[J]. Mycosystema, 2016, 35(1): 94-103. |
| [5] |
李国栋.阿维拉霉素生产菌诱变育种及发酵工艺优化[D].天津: 天津大学, 2011. LI G D. The mutation breeding and optimization of fermentation process for avilamycin producing strains[D]. Tianjin: Tianjin University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10056-1012008366.htm |
| [6] |
邹军彪, 姜平. 阿维拉霉素研究进展[J]. 国外畜牧业, 2017, 37(10): 94-97. ZOU J B, JIANG P. The research development of Avilamycin[J]. Animal science, 2017, 37(10): 94-97. |
| [7] |
潘镇涛, 林凌, 郑雪媚, 等. HPLC法测定阿维拉霉素预混剂中阿维拉霉素的含量[J]. 安徽农学通报, 2017, 23(12): 157-159. PAN Z T, LIN L, ZHENG X M, et al. Determination of the content of Avilamycin in 10% Avilamycin premix by HPLC method[J]. Anhui Agricultural Science Bulletin, 2017, 23(12): 157-159. DOI:10.3969/j.issn.1007-7731.2017.12.063 |
| [8] |
MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428. |
| [9] |
周建, 王军峰, 吴春海, 等. 剪切力对必特螺旋霉素发酵的影响[J]. 食品与药品, 2008, 10(1): 18-21. ZHOU J, WANG J F, WU C H, et al. Effect of shear force on Biotechmycin fermentation[J]. Food and Drug, 2008, 10(1): 18-21. DOI:10.3969/j.issn.1672-979X.2008.01.005 |
| [10] |
KYRIAKIS S C. The effect of Avilamycin in the control of stress-induced post-weaning diarrhea in piglets[J]. Journal of Veterinary Pharmacology and Therapeutics, 1989, 12(3): 296-301. DOI:10.1111/j.1365-2885.1989.tb00674.x |
| [11] |
KAHAR P, IWATA T, HIRAKI J, et al. Enhancement of ε -polylysine production by Streptomyces albulus strain 410 using pH control[J]. Journal of Bioscience and Bioengineering, 2001, 91(2): 190-194. DOI:10.1016/S1389-1723(01)80064-5 |
| [12] |
王涛, 张书衍, 吴绵斌, 等. 一株产新型水溶性抗真菌化合物的海洋芽胞杆菌发酵动力学的研究[J]. 高校化学工程学报, 2014, 28(6): 1295-1301. WANG T, ZHANG S Y, WU M B, et al. Studies on batch fermentation kinetics of a novel water soluble antifungal antibiotic producing strain bacillus amyloliquefaciens ZJU-2011[J]. Journal of Chemical Engineering of Chinese Univerisities, 2014, 28(6): 1295-1301. |
| [13] |
付永前, 高振, 李霜, 等. 米根霉分批发酵生产富马酸的动力学模型[J]. 高校化学工程学报, 2008, 22(6): 1077-1079. FU Y Q, GAO Z, LI S, et al. A kinetic model of batch fermentation for Fumaric acid production by rhizopus oryzae[J]. Journal of Chemical Engineering of Chinese Univerisities, 2008, 22(6): 1077-1079. |
| [14] |
玲温, 路飞, 王泽建, 等. 供氧水平对黑曲霉发酵生产葡萄糖酸钠的影响[J]. 食品工业科技, 2014, 7: 154-157. LING W, LU F, WANG Z J, et al. The effect of oxygen on the fermentation process of sodium gluconate by Aspergillus niger[J]. Science and Technology of Food Industry, 2014, 7: 154-157. |
| [15] |
庄英萍, 陈洪章, 夏建业, 等. 我国工业生物过程工程研究进展[J]. 生物工程学报, 2015, 31(6): 778-796. ZHUANG Y P, CHEN H Z, XIA J Y, et al. Progress in industrial bioprocess engineering in China[J]. Chinese Journal of Biotechnology, 2015, 31(6): 778-796. |
| [16] |
鲁明波, 纪磊, 刘永胜, 等. 基于动力学模型的法夫酵母发酵生产虾青素的补料策略优化[J]. 生物工程学报, 2008, 24(11): 1937-1942. LU M B, JI L, LIU Y S, et al. Kinetic model for optimal feeding strategy in astaxanthin production by xanthophyllomyces dendrorhous[J]. Chinese Journal of Biotechnology, 2008, 24(11): 1937-1942. DOI:10.3321/j.issn:1000-3061.2008.11.014 |
| [17] |
郭朝江, 王相金, 王化民, 等. 玫瑰孢链霉菌补料分批发酵生产达托霉素的动力学模型[J]. 中国抗生素杂志, 2014, 39(4): 241-252. GUO C J, WANG X J, WANG H M, et al. Kinetics model for daptomycin fed-batch fermentation by Streptomyces roseosporus[J]. Chinese Journal of Antibiotics, 2014, 39(4): 241-252. DOI:10.3969/j.issn.1001-8689.2014.04.001 |




