2. 四川大学 化学工程学院,四川 成都 610065;
3. 成都理工大学 材料与化学化工学院,四川 成都 610059
2. College of Chemical Engineering, Sichuan University, Chengdu 610065, China;
3. College of Materials and Chemistry & Chemical Engineering, Chengdu University of Technology, Chengdu 610059, China
近年来随着电子产品的普及,锂离子电池的需求越来越大,对其性能也提出了更高的要求。为解决汽车尾气的污染,需大力推广电动汽车,为此必须发展电池技术。尽管国内外已经实现电动汽车量产,但受电池能量密度限制,其续航里程离燃油车还存在较大差距。国家明确提出十三五期间我国单体锂电池能量密度要达到300 W·h·kg-1,要完成既定目标必须采用更高能量密度的正极材料。高镍层状锂离子三元正极材料LiNi1-x-yCoxMnyO2(1-x-y≥0.6)具有高放电比容量、高能量密度等特点,被认为是有发展潜力的锂离子电池正极材料,得到广泛的研究。然而,脱锂态下的高镍三元材料氧化电位较高,材料的晶体结构易破坏且和电解液发生反应。因此,三元材料的倍率性能和循环稳定性较差[1]。为了改善其性能,研究者通常通过形貌调控、离子体相掺杂以及表面修饰等方法进行改性[2-7]。常见的阳离子掺杂有Al、Mg、Cr、Zr、Ti等,常见的阴离子掺杂元素有F和S[8-9]等。HUANG等[9-10]报道了Na掺杂LiNi0.6Co0.2Mn0.2O2的电化学性能远优于未掺杂的材料的电化学性能,掺杂后材料的层间距增大,阳离子混排程度减小。改性后材料在不同电压下具有提升锂离子扩散系数、降低阻抗和增加循环稳定性。
基于Ti─O键能较M─O(M=Ni、Co、Mn)的键能高,可以有效稳定结构的特点[11],本文研究Ti掺杂对LiNi0.6Co0.2Mn0.2O2晶体结构和电化学性能的影响。通过氢氧化物共沉淀加固相烧结的方法,采用TiO2为原料合成Ti替换LiNi0.6Co0.2Mn0.2O2的部分过渡金属离子的掺杂型高镍材料。探究了不同Ti掺杂量对材料的晶体结构、形貌、电化学性能的影响,确定了最优掺杂量;并探讨了Ti掺杂对材料电化学性能提升的作用机制。
2 实验方法采用高温固相烧结方法合成未掺杂的LiNi0.6Co0.2Mn0.2O2材料。将预先合成的Ni0.6Co0.2Mn0.2(OH)2前驱体和Li2CO3按照2:1.05的摩尔比放入研钵加乙醇研磨0.5 h。研磨混合物于烘箱中100 ℃干燥除去乙醇后,将混合物在氧气氛围的管式炉中在550 ℃保温6 h,再升温到800 ℃保温12 h,在自然冷却至室温后得到正极材料。
除在研磨过程加入二氧化钛,掺杂材料的合成步骤和上述未掺杂材料相同。按照掺杂比例称取适量Ni0.6Co0.2Mn0.2(OH)2和TiO2于研钵中,加入乙醇研磨0.5 h混匀。研磨混合物于烘箱中100 ℃干燥除去乙醇后,将混合物在氧气氛围的管式炉中在550 ℃保温6 h,再升温到800 ℃保温12 h,在自然冷却至室温后得到正极材料。根据加入TiO2量的差异,合成掺杂钛的材料Li(Ni0.6Co0.2Mn0.2)1-xTixO2(x=0、0.005、0.01、0.02)分别标记为Ti0、Ti0.5、Ti1和Ti2。
3 结果与讨论 3.1 材料的结构和形貌表征为研究制备材料的晶体结构,对样品进行X射线衍射测试。如图 1所示,材料都呈现出单一的典型α-NaFeO2型层状结构,R (3m)空间群。尖锐和窄的XRD图谱衍射峰说明材料的结晶性良好。Ti掺杂的材料Ti0.5、Ti1和Ti2的峰型中没有其他杂峰,说明Ti掺杂没有影响原材料LiNi0.6Co0.2Mn0.2O2的层状结构。4个样品的特征组峰(006)/(102)以及(108)/(110)的峰分裂明显,说明4种材料具有较有序的层状结构。掺杂前后的样品的c/a值均大于4.899,说明Ti掺杂未破坏材料的层状结构。
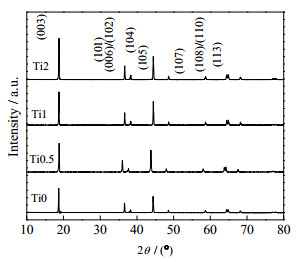
|
图 1 未掺杂样品Ti0和掺杂Ti样品(Ti0.5、Ti1、Ti2)的XRD图谱 Fig.1 XRD patterns of starting material (Ti0) and Ti-doped LiNi0.6Co0.2Mn0.2O2 (Ti0.5, Ti1 and Ti2) |
图 2和表 1分别为XRD的精修图谱和精修XRD后的晶胞参数。从表中可以看出,精修的误差较小,结果较为可靠。(003)峰和(104)峰的峰强比I(003)/I(104)可衡量Li+/Ni2+阳离子混排程度。当值大于1.2时,混排程度较小,且其值越大,则混排程度越小。4个样品的I(003)/I(104)都远大于1.2,说明Li+/Ni2+混排程度较小。Ti掺杂后,I(003)/I(104)的比值增大,且随着掺杂比例的增加而增加,说明Ti掺杂有利于减小Li+/Ni2+阳离子混排。这是因为Ti─ O键解离能(ΔHƒ298=662 kJ·mol-1)远大于M─ O的键解离能(ΔHƒ298 (Ni─ O)=391.6 kJ·mol-1、ΔHƒ298 (Co─ O) = 368 kJ·mol-1和ΔHƒ298 (Mn─ O) = 402 kJ·mol-1)[12]。因此,Ti的掺杂能够有效地稳定材料的晶体结构,减小混排的发生,有效提升材料的循环稳定性。
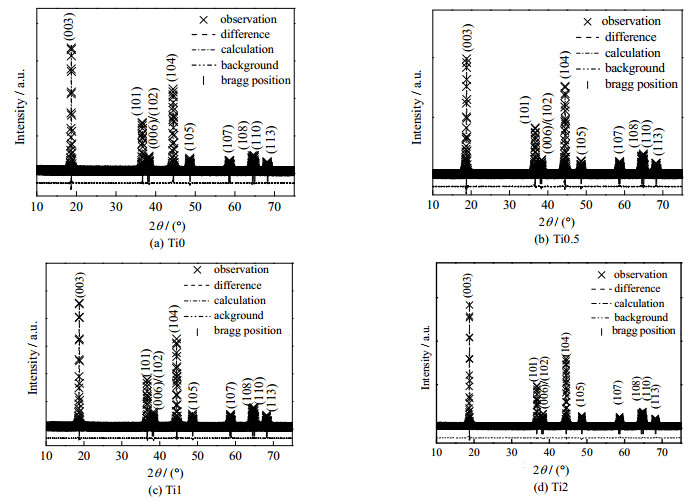
|
图 2 样品Ti0、Ti0.5、Ti1和Ti2的XRD精修图谱 Fig.2 Rietveld refinement patterns of the Ti0, Ti0.5, Ti1 and Ti2 sample |
|
|
表 1 样品的晶胞参数对比 Table 1 Lattice parameters of prepared samples |
随着掺杂比例的增大,晶胞参数c值也在增加。这是因为Ti4+的半径为0.60 Å,而Ni2+、Ni3+、Co3+和Mn4+分别为0.69、0.56、0.545和0.54 Å[13]。根据Vegard定律可以计算得到LiNi0.6Co0.2Mn0.2O2的过渡金属平均粒径为0.579 Å。Ti4+的半径大于原材料中的过渡金属离子平均半径,因此Ti的掺杂会增大LiNi0.6Co0.2Mn0.2O2的层间距(表现为c值的增大)。根据文献可知层间距增大会使材料的倍率性能得到提升,因而适量Ti存在会使材料有更好的倍率性能。掺杂样品的I(003)/I(104)值和晶胞参数的变化进一步说明Ti掺杂进入了材料晶格,而不是以钛氧化物包覆层存在。
图 3为所有样品的SEM图,可以观察到所有样品均为由一次颗粒组装的二次球形颗粒。Ti掺杂前后材料二次颗粒及一次颗粒形貌基本一致,一次颗粒均为500 nm左右的小颗粒。Ti掺杂后的形貌并无明显变化,说明Ti掺杂对材料的形貌没有影响。

|
图 3 样品的SEM图 Fig.3 SEM images of samples |
为进一步了解材料Ti1中Ni离子和Ti离子的价态,对Ti0和Ti1两样品进行X射线光电子能谱(XPS)测试,测试结果如图 4所示。图 4(a)为Ni 2p的XPS图谱,Ti0和Ti1的Ni2p3/2主峰位于结合能为855.1 eV的位置,861 eV左右为卫星峰。通过高斯拟合,结合能为854.3 eV左右的位置存在的分峰对应的是Ni2+,这与文献中LiNi0.5Mn1.5O4中Ni2+的数据一致。而在结合能为855.8 eV位置的分峰,则对应的是Ni3+的存在。这表明样品Ti0和Ti1中的Ni元素是存在着Ni2+和Ni3+的混合价态,而分峰面积越大,离子所占比例越大。Ni3+的分峰面积明显高于Ni2+的分峰面积,说明Ni3+在材料中所占的比例越大,这也符合LiNi0.6Co0.2Mn0.2O2中的价态情况。图 4(b)则是Ti1中的Ti 2p的XPS谱图,图中存在着结合能为464.7和459.0 eV的峰。根据文献[14],这两个峰分别对应的是Ti4+的Ti 2p1/2和Ti 2p3/2,表明了Ti在材料中是以4价的形式存在。
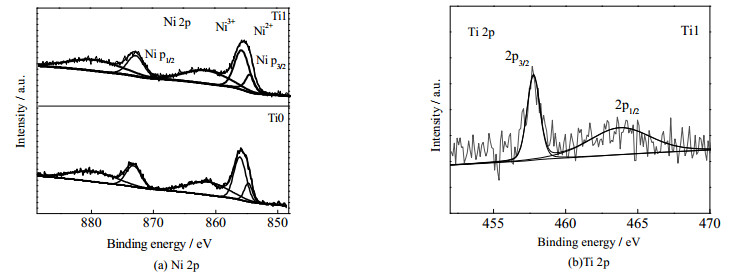
|
图 4 样品Ti0和Ti1的XPS图谱 Fig.4 XPS patterns of Ni 2p (a) and Ti 2p (b) of Ti0 and Ti1 sample |
为研究Ti掺杂对材料电化学性能的影响,将材料组装成扣式电池在3.0~4.3 V和室温下进行充放电测试。图 5是4种样品在0.1 C下的首次充放电曲线。所有样品的充放电曲线均较平滑,且在3.7 V电压附近出现倾斜的放电平台,这和文献中报道的三元材料充放电曲线特点相似。样品Ti0、Ti0.5、Ti1和Ti2在0.1 C下的首次充放电比容量分别为195.3/164.8、190.6/162.5、189.6/161.1和185.2/158.3 mA·h·g-1,首次库伦效率分别为84.4%、85.3%、85.0%和85.5%,可以看出,随着Ti的掺杂量的增多,放电容量逐渐减小。这是因为Ti4+掺杂使材料中的电化学惰性元素增多,使首次放电比容量降低。
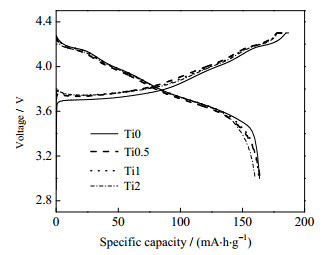
|
图 5 样品在电压范围为3.0~4.3 V和0.1 C下的首次充放电曲线 Fig.5 Initial charge/discharge curves of samples at the voltage of 3.0~4.3 V and 0.1 C |
图 6(a)为4种样品在3.0~4.3 V和不同充放电倍率下的倍率性能。由于电化学惰性元素Ti4+不参与氧化还原反应,所以在0.1 C初始放电时掺杂后的材料相比于原材料容量都有所降低。随着电流密度增大,原材料的放电比容量衰减较快。图 6(b)为4种样品不同倍率下容量相对于0.1 C的放电容量的保持率。随倍率的增大,4种样品的容量保持率均下降,但Ti掺杂之后的材料保持率明显提高。在5.0 C时,Ti0、Ti0.5、Ti1和Ti2的放电容量分别为91.0,120.1,126.6和113.2 mA·h·g-1,容量保持率分别为54.8%、73.6%、78.4%、71.4%。掺杂的材料Ti0.5、Ti1和Ti2的放电容量保持较好,远高于原材料Ti0。因为Ti4+的掺杂降低了材料中Li+/Ni2+阳离子混排,减小了锂离子在脱嵌过程中的阻抗,并且Ti─O键能较大,可以极好地稳定晶体结构,抑制材料结构坍塌,进一步提升锂脱嵌速率。图 6(c)、(d)分别是Ti0和Ti1在不同倍率下的充放电曲线。从图中可以看出,随着充放电倍率的增大,2种材料都出现了充电曲线电压平台升高,放电曲线电压平台降低,放电容量下降。这是电材料在高倍率充放电过程中极化程度增大所致。相比较而言,Ti0的极化增加趋势更为显著。在3.0 C和5.0 C时,Ti0的放电曲线基本呈一条直线,放电电压平台消失,而Ti1极化较小。进一步说明Ti掺杂有利于减小电极材料极化,提高材料电性能。
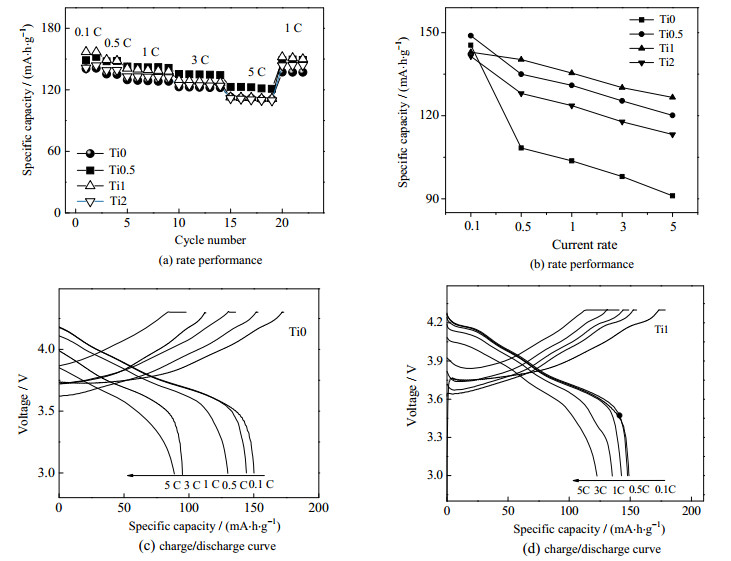
|
图 6 材料在电压范围为3.0~4.3 V和0.1~5.0 C的不同倍率下的倍率性能图 Fig.6 Rate performance (a) and capacity retentions curves (b) of samples; charge/discharge curves of Ti0 (c) and Ti1 (d) sample at different current densities at the voltage of 3.0~ 4.3 V and 0.1 ~ 5.0 C |
图 7为4个样品在3.0~4.3和3.0~4.6 V不同截止电压下的电化学性能。Ti0、Ti0.5、Ti1和Ti2在3.0~4.3 V范围1 C下的首次放电比容量分别为139.2、141.1、143.0和138.0 mA·h·g-1(图 7(a))。1 C电流密度下,Ti1高于原材料的容量可能与Ti扩大了材料的层间距并提高锂离子扩散速率有关。循环100周后,4种样品的放电比容量分别为118.2、129.0、135.9和121.5 mA·h·g-1,循环保持率分别为85.0%、91.4%、95.0%和88.2%,说明Ti掺杂之后可以提升材料的循环性能。3.0~4.6 V电压范围的循环性能(图 7(b))显示Ti1的初始放电容量为177.0 mA·h·g-1,高于Ti0的170.0 mA·h·g-1。两材料容量差距相较于3.0~4.3 V范围进一步增大。循环100周后,Ti0和Ti1的放电比容量分别为118.5和148.8 mA·h·g-1,容量保持率分别为69.7%和84.1%。以上结果表明Ti1相比于Ti0在高电压下具有更优异的循环性能,这主要是Ti掺杂进入过渡金属层,增大层间距,提升了锂离子的扩散速率,同时Ti和O形成了更加稳定的Ti─O键,可以抑制循环过程中副反应的发生,有效地稳定层状结构。Ti2倍率性能和循环性能不如Ti1,可能与掺杂量过大、在一定程度上破坏了材料的结构有关。图 7(c)、(d)分别是材料Ti0和Ti1在1 C倍率、室温下3.0~4.6 V的不同循环次数的充放电曲线。可以看出两样品的充放电曲线形状相似,电压平台都在3.7 V左右,符合典型的三元材料的特征。随着充放电次数的增多,两者都出现充电曲线上升,放电曲线下降的趋势,这是极化程度增大的体现。Ti0相比于Ti1不论是放电比容量还是放电平台均衰减得更快,这主要是由于高电压下材料锂的脱嵌程度更大,高脱锂状态下Ni4+不稳定,容易失去氧而变成Ni2+,形成绝缘的岩盐相NiO阻碍充放电。Ti1在循环过程中极化程度变化较慢,放电平台和放电比容量在放电过程中保持得较好。表明在4.6 V高截止电压下Ti1具有较稳定的晶体结构,进而降低电极材料的极化。Ti─O键具相比于Ni、Co和Mn具有更强的键解离能,在高脱锂态下对氧有较强的束缚作用,可以有效地稳定材料的晶体结构。这也意味着在长时间的充放电循环时,Ti掺杂后的样品能够提供更高的放电比容量和比能量,这进一步说明了Ti掺杂有利于增强材料的高电压循环稳定性。
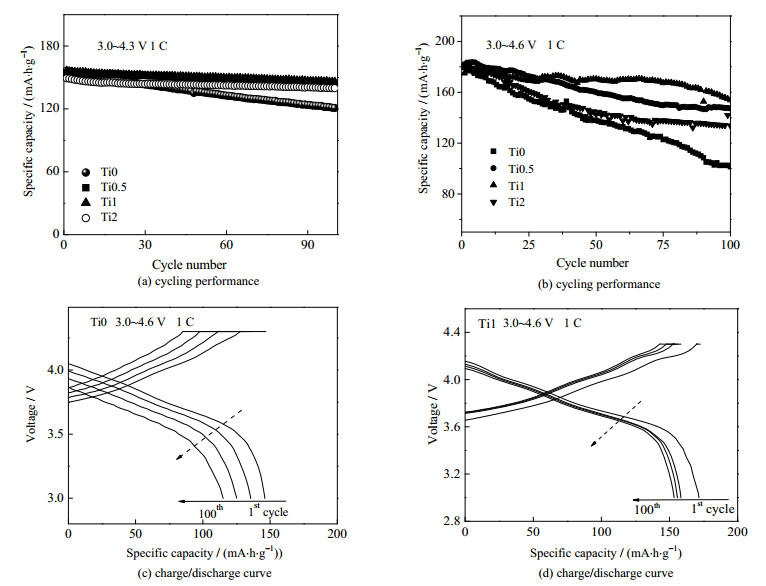
|
图 7 所有样品在3.0~4.3 V下1 C倍率的循环性能图(a)、容量保持率图(b);Ti0 (c) Ti1 (d)样品在不同倍率下的充放电曲线 Fig.7 Cycling performance of samples at 3.0~4.3 V and 1.0 C (a); cycling performance of samples at 3.0~4.6 V and 1.0 C (b); charge/discharge curves of Ti0 (c) and Ti1 (d) at 3.0~4.6 V and 1.0 C |
Ti掺杂改性LiNi0.6Co0.2Mn0.2O2正极材料后对材料的形貌无明显影响。Ti掺杂后锂层间距增大,锂镍阳离子混排程度降低。Ti掺杂改性后,LiNi0.6Co0.2Mn0.2O2正极材料的倍率性能和循环性能均有所提升。其中1% Ti掺杂的材料性能提升最好,在5.0 C下放电比容量为126.6 mA·h·g-1,较原材料的91.0 mA·h·g-1有明显提升。在室温下3.0~4.3和3.0~4.6 V、1 C下循环100周后,1% Ti掺杂的材料的容量保持率分别可达95.0%和84.1%,较原材料提升较大。
| [1] |
KIM H, KIM M G, JEONG H Y, et al. A new coating method for alleviating surface degradation of LiNi0.6Co0.2Mn0.2O2 cathode material: Nanoscale surface treatment of primary particles[J]. Nano Letters, 2015, 15(3): 2111-2119. DOI:10.1021/acs.nanolett.5b00045 |
| [2] |
XU Y-D, XIANG W, WU Z-G, et al. Improving cycling performance and rate capability of Ni-rich LiNi0.8Co0.1Mn0.1O2 cathode materials by Li4Ti5O12 coating[J]. Electrochimica Acta, 2018, 268: 358-365. DOI:10.1016/j.electacta.2018.02.049 |
| [3] |
SCHIPPER F, BOUZAGLO H, DIXIT M, et al. From surface ZrO2 coating to bulk Zr doping by high temperature annealing of nickel-rich lithiated oxides and their enhanced electrochemical performance in lithium ion batteries[J]. Advanced Energy Materials, 2018, 8(4): 1701682. DOI:10.1002/aenm.201701682 |
| [4] |
CHOI J, KIM J, LEE K-T, et al. Effect of Na2SO4 Coating layer on nickel-rich Li(NixCoyMnz)O2 cathode materials for Lithium-Ion Batteries[J]. Advanced Materials Interfaces, 2016, 3(24): 160074. |
| [5] |
XU C L, XIANG W, WU Z G, et al. Constructing a protective pillaring layer by incorporating gradient Mn4+ to stabilize the surface/interfacial structure of LiNi0.815Co0.15Al0.035O2 cathode[J]. ACS Applied Materials & Interfaces, 2018, 10(33): 27821-27830. |
| [6] |
LI Y C, XIANG W, XIAO Y, et al. Synergy of doping and coating induced heterogeneous structure and concentration gradient in Ni-rich cathode for enhanced electrochemical performance[J]. Journal of Power Sources, 2019, 423: 144-551. DOI:10.1016/j.jpowsour.2019.03.073 |
| [7] |
XU C L, XIANG W, WU Z G, et al. A comparative study of crystalline and amorphous Li0.5La0.5TiO3 as surface coating layers to enhance the electrochemical performance of LiNi0.815Co0.15Al0.035O2 cathode[J]. Journal of Alloys and Compounds, 2018, 740: 428-435. DOI:10.1016/j.jallcom.2017.12.193 |
| [8] |
LIU W, OH P, LIU X, et al. Nickel-rich layered lithium transition-metal oxide for high-energy lithium-ion batteries[J]. Angewandte Chemie-International Edition, 2015, 54(15): 4440-4457. DOI:10.1002/anie.201409262 |
| [9] |
XIANG W, ZHU C Q, ZHANG J, et al. Synergistic coupling effect of sodium and fluorine co-substitution on enhancing rate capability and cycling performance of Ni-rich cathode for lithium ion battery[J]. Journal of Alloys and Compounds, 2019, 786: 56-64. DOI:10.1016/j.jallcom.2019.01.264 |
| [10] |
HUANG Z, WANG Z, JING Q, et al. Investigation on the effect of Na doping on structure and Li-ion kinetics of layered LiNi0.6Co0.2Mn0.2O2 cathode material[J]. Electrochimica Acta, 2016, 192: 120-126. DOI:10.1016/j.electacta.2016.01.139 |
| [11] |
XIAO B, LIU H, LIU J, et al. Nanoscale manipulation of spinel lithium nickel manganese oxide surface by multisite Ti occupation as high-performance cathode[J]. Advanced Materials, 2017, 29(47): 1703764. DOI:10.1002/adma.201703764 |
| [12] |
DEAN J A, LANGE N A. Lange's handbook of chemistry[M]. New York: McGraw-Hill, 1992.
|
| [13] |
MYUNG S-T, KOMABA S, HOSOYA K, et al. Synthesis of LiNi0.5Mn0.5-xTixO2 by an emulsion drying method and effect of Ti on structure and electrochemical properties[J]. Chemistry of Materials, 2005, 17(9): 2427-2435. DOI:10.1021/cm050033j |
| [14] |
SULLIVAN J L, SAIED S O, BERTOTI I. Effect of ion and neutral sputtering on single crystal TiO2[J]. Vacuum, 1991, 42(18): 1203-1208. DOI:10.1016/0042-207X(91)90131-2 |




