2. 国药集团威奇达药业有限公司,山西 大同 037000
2. SinopharmWeiqida Pharmaceutical Co., Ltd., Datong 037000, China
克拉维酸 (Clavulanic acid) 是目前临床上应用最广泛的β-内酰胺酶抑制剂,与阿莫西林钠及替卡西林钠按一定比例制成复合制剂,可显著降低药物的最小抑菌浓度[1],大大增强其抗菌活性,是解决细菌耐药性最有效的方法之一[2]。
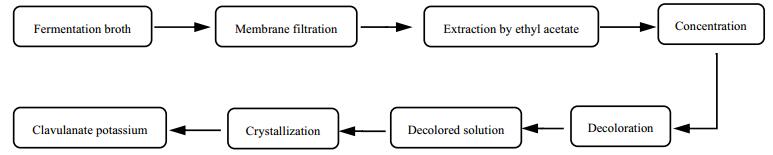
英国Beecham公司于1976年率先从棒状链霉菌 (Streptomyces clavuligerus) 发酵液中分离得到克拉维酸[2],其自身是一种易吸湿的油状物质[3],产品常以钾盐形式存在。克拉维酸对温度和pH极为敏感,在水溶液中其最适pH值为6.4~6.8[4]。研究表明,克拉维酸在水溶液中的降解反应主要受温度、pH、离子强度的影响,符合一级反应动力学[5~10];同时还有人研究了克拉维酸在不同分子量、不同浓度的聚乙二醇中的稳定性[11, 12]。实际工业生产中,克拉维酸的生产流程大致经历发酵、膜过滤、有机溶剂萃取、浓缩、脱色、结晶等步骤 (如图 1所示),其中除了发酵和膜过滤外,其它操作都是在乙酸乙酯溶媒体系中进行的,即使结晶过程也是在乙酸乙酯中克拉维酸与钾盐反应形成克拉维酸钾的,而且除发酵和膜过滤是在其较稳定的pH条件下进行外,萃取、浓缩、脱色等单元操作则在强酸、低温条件下进行,尤其是浓缩、回收乙酸乙酯工段,降膜蒸发的介质操作温度高至50℃。在这种条件下克拉维酸的降解可直接影响其产品质量,因此研究温度和水分对克拉维酸稳定性的影响对实际操作条件的选取显得尤为重要。
|
图 1 克拉维酸的生产流程图 Fig.1 Production flowsheet of clavulanic acid |
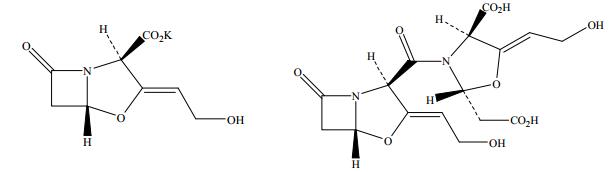
已有研究表明克拉维酸降解生成多种产物[13, 14],其中与克拉维酸钾相关的产物A-G已被欧洲药典收录[15],而杂质E (结构式如图 2) 是影响克拉维酸钾产品质量的主要杂质[16],也是重要的质控指标之一。因此本文将从克拉维酸在分离过程中的降解产物—杂质E的分析入手,着重探讨克拉维酸在乙酸乙酯中的降解动力学和热力学,为改进生产工艺提供理论依据。
|
图 2 克拉维酸钾和杂质E的分子结构式 (左为克拉维酸钾,右为杂质E) Fig.2 Molecular structures of Clavulanate potassium and the related substance E |
岛津2010A高效液相色谱仪、梅特勒卡尔费休水分分析仪,乙酸乙酯脱色液为克拉维酸浓度在36~45 g·L-1,pH=2±0.2的浓缩液,甲醇等其它试剂均为分析纯,购自中国国药集团有限公司。
2.2 分析方法克拉维酸的浓度由高效液相色谱测定,具体条件为:流动相:称取3.3953 g硫酸氢四丁基胺溶于1 L水中,使用0.5 mol·L-1的NaOH溶液调节pH值至6.00±0.05,加入130 mL乙腈,混合均匀后用0.45 μm有机滤膜过滤,超声脱气,待用。色谱仪为岛津LC-2010A,色谱柱为ODS Hypersil (5 μm,4.6 mm×100 mm)(Thermo Fisher Scientific),检测器为紫外可见吸收检测器 (UVD),流速1.0 mL·min-1,进样量20 μL,柱温33℃,检测波长210 nm。克拉维酸降解产物--杂质E的测定采用高效液相色谱法,其方法参照《中华人民共和国药典》 [17],因无标准品,按峰面积计算其相对含量。乙酸乙酯脱色液中含水量由梅特勒卡尔费休水分分析仪测定,水分含量符合测定范围。
2.3 克拉维酸的降解及其产物测定检测图 1各步骤所得产品中克拉维酸及杂质E的浓度或百分含量,其中结晶步骤包括铵盐和钾盐两步。并向图 1中的乙酸乙酯脱色液中加水配成不同含水量的样品,然后放在不同温度的水浴中保温7h,分别测定克拉维酸的浓度和杂质E的相对含量,杂质E的相对百分含量由公式 (1) 得出,克拉维酸的降解百分率D(%) 由式 (2) 计算得,
| $ E(\% ) = \frac{{{A_E}}}{{{A_{con}}}} $ | (1) |
式中AE为样品中杂质E的峰面积,Acon为原样品稀释100倍后克拉维酸的峰面积。
| $ D = \frac{{\Delta c}}{{{c_0}}} \times 100\% $ | (2) |
式中c0为克拉维酸初始浓度,Δc为克拉维酸的降解浓度 (反应前后浓度差)。
2.4 克拉维酸的降解动力学和热力学根据不同含水量的克拉维酸乙酸乙酯溶液在不同温度、不同时间下克拉维酸浓度的变化,依据一级反应动力学方程 (3) 描述乙酸乙酯中克拉维酸的降解动力学。
| $ \frac{{dc}}{{dt}} =-kc $ | (3) |
式中,c为克拉维酸的浓度 (g·L-1),t表示时间 (h),k为降解反应速率常数 (h-1)。公式 (3) 可进一步表示为:
| $ \ln \frac{c}{{{c_0}}} =-kt $ | (4) |
| $ {t_{1/2}} =-\frac{{\ln 0.5}}{k} $ | (5) |
式中,c0为克拉维酸的初始浓度 (g·L-1),t1/2 为克拉维酸的半衰期 (h)。对于式 (3),可通过以−ln (c/c0) 为纵坐标,t为横坐标进行线性拟合,拟合得到的斜率即为k,可用Arrhenius方程 (6) 描述:
| $ k = A{e^{^{ - Ea}{/_{RT}}}} $ | (6) |
式中,A为指前因子 (h-1),Ea为活化能 (J·mol-1),R为气体常数 (8.314 J·(mol·K)-1),T表示绝对温度 (K) 同样地,式 (6) 可进一步表示为:
| $ \ln k = \ln A-\frac{{Ea}}{R} \times \frac{1}{T} $ | (7) |
同时根据Eyring方程,可建立起ln (k/T)-1/T的方程:
| $ \ln \frac{k}{T} = \ln \frac{{{k_B}}}{h} + \frac{{\Delta S}}{R}-\frac{{\Delta H}}{{RT}} $ | (8) |
式中,kB为玻尔兹曼常数 (1.38×10-23 J·K-1),h为普朗克常数 (6.63×10-34 J·s)。Δ6为熵变 (J·mol-1),ΔH为焓变 (J·mol-1),它们与反应自由能ΔG的关系可用公式 (9) 描述:
| $ \Delta G = \Delta H-T \times \Delta S $ | (9) |
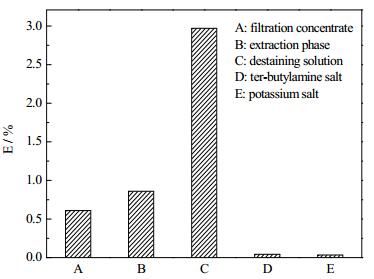
在克拉维酸钾的生产过程中,杂质的含量是产品质量和纯度的重要指标,其中杂质E是克拉维酸降解的典型产物。如图 3所示,杂质E的相对含量在生产的各个步骤都有所变化,其中乙酸乙酯萃取在克拉维酸提取过程中发挥了重要作用,可以将发酵液中绝大多数水溶性杂质除去,但萃取操作必须在低pH和低温下进行,同时加入4倍体积的萃取剂,才能确保产物的收率和稳定性。即便如此,乙酸乙酯萃取过程中仍有新的杂质形成 (图 3B),而回收乙酸乙酯过程中则使杂质E成倍增加 (图 3C)。后续结晶操作则大大减少,但仍有少量残余,影响产品的纯度。
|
图 3 克拉维酸钾下游工艺中杂质E的相对百分含量 Fig.3 Relative percentages of impurity E in downstream process of clavulanate potassium |
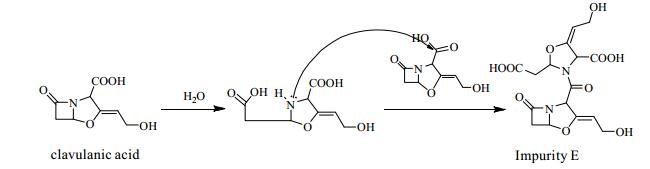
有研究表明,杂质E是克拉维酸水解后形成的二聚体[16],如图 4所示。在酸性水溶液中,杂质E的形成主要受克拉维酸浓度和温度的影响,克拉维酸浓度或温度越高,杂质E的生成量越多。尽管有关克拉维酸在水溶液中稳定性已比较清晰[10],但它在乙酸乙酯中的稳定性未有研究报道。除了温度和pH外,含水量无疑是影响乙酸乙酯中克拉维酸稳定性的重要参数,因此有必要对不同含水量的乙酸乙酯中克拉维酸的稳定性做进一步探讨。
|
图 4 杂质E的生成路径 Fig.4 Formation pathway of the related substance E |
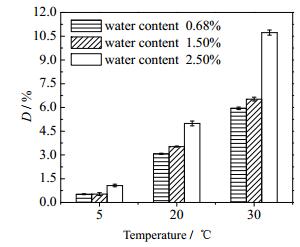
在相同的克拉维酸浓度和pH2.0条件下,提高温度将导致克拉维酸降解率显著增加 (图 5),并且可以看出含水量越大,其降解就越多,尤其是在较高温度下更明显。如图 5中30℃下,含水量2.50%的乙酸乙酯脱色液中,克拉维酸的降解率是含水量0.68%的1.8倍。水在乙酸乙酯中的溶解度 (25℃下为2.94%) 随着温度升高而增大,因此温度越高、水分越多,克拉维酸降解量越大、稳定性越差。
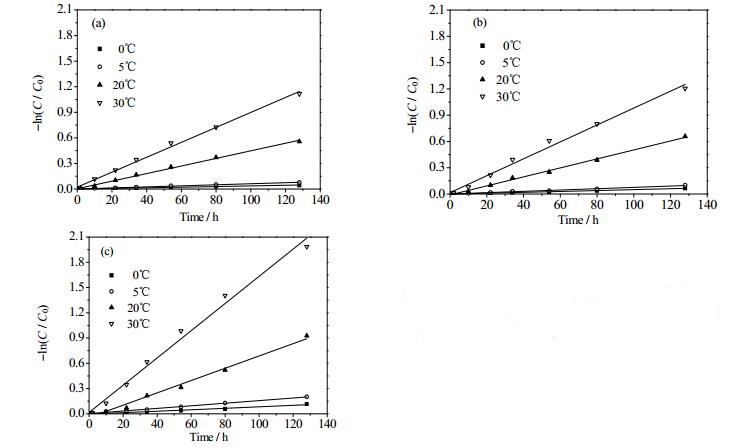
乙酸乙酯中克拉维酸的降解仍然遵从一级反应动力学 (图 5),用方程 (4) 对降解数据进行线性拟合,得到降解速率常数k和半衰期t1/2(表 1)。拟合相关系数R2表明,温度越高,降解反应符合一级动力学的线性越好。结合图 6和表 1数据得出,相同含水量条件下,温度越高,其降解速率常数越大;而相同温度下,含水量越大,降解速率常数也越大。
|
图 5 温度和水分对克拉维酸降解的影响 Fig.5 Effects of temperature and water content on clavulanic acid degradation |
|
图 6 温度和含水量对克拉维酸降解影响的动力学拟合 Fig.6 Kinetic fitting of clavulanic acid degradation in ethyl acetate under different temperatures and water contents Water content: a. 0.68% b. 1.50% c. 2.50% |
| 表 1 不同含水量乙酸乙酯脱色液中克拉维酸的降解常数与半衰期 Table 1 Degradation rate constants and half-life of clavulanic acid degradation in ethyl acetate under different water contents and temperatures |
已有的研究报道表明,水溶液中克拉维酸的降解主要受到温度、pH、离子强度的影响[5~8],同时水分子参与了杂质E的形成[16](图 4)。上述实验结果再次表明,在乙酸乙酯中克拉维酸的降解不仅与温度等因素相关,而且含水量也至关重要。根据Bersanetti等的实验结果[18]可以计算出20℃、pH2.0条件下水溶液中克拉维酸的降解速率常数约为0.501 h-1。从表 1可以看出,同样条件下,不同含水量的乙酸乙酯中克拉维酸的降解速率常数在0.00445~0.00732 h-1。二者相比差异显著,说明乙酸乙酯对克拉维酸的稳定性起到保护作用,那么控制含水量对提高克拉维酸的稳定性就显得尤为重要。温度的作用是显而易见的,降解速率常数随温度的升高而增大,这与克拉维酸在水溶液中的降解趋势一致[19];如表 1中含水量2.5%的情形下,0℃与30℃的克拉维酸半衰期相差18.6倍。这个事实说明乙酸乙酯萃取在低温下操作是必要的,同时也能解释乙酸乙酯回收阶段杂质E显著增加 (图 3C) 的原因。
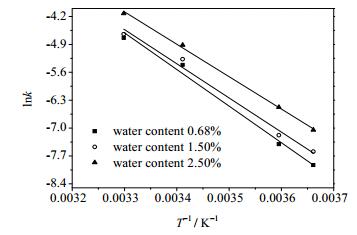
3.3 克拉维酸降解热力学根据Arrhenius方程 (式 (6)) 的变换形式 (式 (7)),对表 1中的降解速率常数和温度进行重新拟合,求得相应的活化能Ea与指前因子A,如图 7和表 2。从表 2可以看出,克拉维酸降解反应的活化能随含水量的增加而减小,说明水含量越大,克拉维酸降解反应越易进行,即克拉维酸越不稳定,使得形成的杂质越多,那么克拉维酸的分离纯化就越困难。
|
图 7 不同含水量乙酸乙酯脱色液中克拉维酸的Arrhenius方程拟合 Fig.7 Arrhenius equation fitting of clavulanic acid degradation in ethyl acetate under different water contents |
| 表 2 Arrhenius方程中的指前因子A和活化能Ea Table 2 Pre-exponential factors and activation energies of Arrhenius equation studied under different conditions |
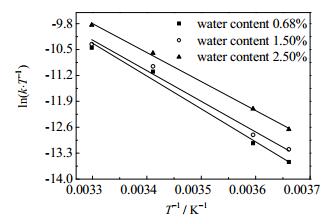
同样地,以T-1为横坐标,ln (k·T-1) 为纵坐标进行线性拟合,如图 8所示;从中可求得相应的ΔS和ΔH,再通过公式 (9) 求得吉布斯自由能ΔG,如表 3。
|
图 8 不同含水量乙酸乙酯脱色液中克拉维酸的Eyring方程拟合 Fig.8 Eyring fitting curves of clavulanic acid degradation in ethyl acetate under different water contents |
| 表 3 不同含水量乙酸乙酯脱色液中克拉维酸降解的热力学参数 Table 3 Thermodynamic parameters of clavulanic acid degradation in ethyl acetate under different water contents and temperatures |
从表 3可以看出,降解反应的焓变ΔH值均为正数,表明降解过程为吸热反应;且随着水含量的增加而减少,说明含水量的增加减少了反应所需热量,使得降解反应更易发生。熵变ΔS均为负值,且随水分增加而减小。吉布斯自由能ΔG均为正值,说明克拉维酸降解是一个非自发的反应,即纯的克拉维酸是比较稳定的。
上述实验结果和理论分析有助于理解克拉维酸下游过程中存在的问题,对于改进生产工艺也具有指导意义。例如,降低含水量对稳定克拉维酸非常必要,在回收乙酸乙酯前若能采取脱水方法降低含水量,那么杂质E的含量将不会明显增加;若选用疏水性更强、沸点更低的溶剂萃取克拉维酸,杂质的生成将会减少;当然若能用膜而不是蒸发脱除溶剂,克拉维酸的降解自然会减少。
4 结论(1) 克拉维酸钾的整个生产工艺中,杂质E主要产生于浓缩操作单元。
(2) 不同含水量乙酸乙酯中克拉维酸的降解动力学研究表明,在相同pH、温度、克拉维酸浓度条件下,含水量对克拉维酸的稳定性有显著影响,含水量越大,克拉维酸降解的越多,如2.50%的乙酸乙酯脱色液中克拉维酸的降解率是含水量0.68%的1.8倍。
(3) 降解热力学分析表明,含水量增大,反应活化能降低,在乙酸乙酯中克拉维酸的降解反应是一个吸热非自发反应。研究结果对克拉维酸下游生产工艺的改进具有重要的指导意义。
| [1] | SaudagarP S, Survase S A, Singhall R S. Clavulanic acid:a review[J]. Biotechnology Advances , 2008, 26(4): 335-351. DOI:10.1016/j.biotechadv.2008.03.002. |
| [2] | Kim D J, King J A, Zuccarelli L, et al. Clavulanic acid:A competitive inhibitor of beta-lactamases with novel anxiolytic-like activity and minimal side effects[J]. Pharmacology, Biochemistry and Behavior , 2009, 93: 112-120. DOI:10.1016/j.pbb.2009.04.013. |
| [3] | Cole M, Howarth T T, Reading C. Novel beta-lactam antibiotic from Streptomyces clavuligerus:GB1508977[P]. 1978-04-26. |
| [4] | Hirata D B, Oliveira J, Leão K V, et al. Precipitation of clavulanic acid from fermentation broth with potassium 2-ethyl hexanoate salt[J]. Separation and Purification Technology , 2009, 66(3): 598-605. DOI:10.1016/j.seppur.2009.01.010. |
| [5] | Haginaka J, Nakagawa T, Uno T. Stability of clavulanic acid in aqueous solutions[J]. Chemical andPharmaceutical Bulletin , 1981, 29(11): 3334-3341. DOI:10.1248/cpb.29.3334. |
| [6] | Mayer A F, Deckwer W D. Simultaneous production and decomposition of clavulanic acid during Streptomyces clavuligerus cultivations[J]. Applied Microbiology and Biotechnology , 1996, 45(1-2): 41-46. DOI:10.1007/s002530050646. |
| [7] | Roubos J A, Krabben P, de Laat W T A M, et al. Clavulanic acid degradation in Streptomyces clavuligerus fed-batch cultivations[J]. Biotechnology Progress , 2002, 18(3): 451-457. DOI:10.1021/bp020294n. |
| [8] | Marques D A V, Oliveirar P S, Perego P, et al. Kinetic and thermodynamic investigation on clavulanic acid formation and degradation during glycerol fermentation by Streptomyces, DAUFPE 3060[J]. Enzyme & Microbial Technology , 2009, 45(2): 169-173. |
| [9] | Santos V C, Pereir J F B, Haga R B, et al. Stability of clavulanic acid under variable pH, ionic strength and temperature conditions. A new kinetic approach[J]. Biochemical Engineering Journal, , 2009, 45(2): 89-93. DOI:10.1016/j.bej.2009.02.013. |
| [10] | REN Jie(任杰), WANG Yong-hua(王永华), YANG Bo(杨博), et al. The study of degradation of clavulanic acid in ferment(发酵中克拉维酸降解因素的探讨)[J]. China Biotechnology(中国生物工程杂志) , 2014, 24(9): 82-85. |
| [11] | Peraira J F B, Santos V C, Johansson H O, et al. A stable liquid-liquid extraction system for clavulanic acid using polymer-based aqueous two-phase systems[J]. Separation & Purification Technology , 2012, 98(39): 441-450. |
| [12] | Carneiro-da-cunha M N, Souza K P S, Mota A M O, et al. Stability of clavulanic acid in PEG/citrate and liquid-liquid extraction in aqueous two-phase system[J]. Fluid Phase Equilibria , 2014, 375(375): 104-109. |
| [13] | Haginaka J, Yasuda H, Uno T, et al. Degradation of clavulanic acid in aqueous alkaline solution:isolation and structural investigation of degradation products[J]. Chemical & Pharmaceutical Bulletin , 1985, 33(1): 218-224. |
| [14] | Finn MJ, Harris M A, Hunt E, et al. Studies on the hydrolysis of clavulanic acid[J]. Journal of the Chemical Society Perkin Transactions , 1984, 42(6): 1345-1349. |
| [15] | European Pharmacopoeia commission of the council of europe. european pharmacopoeia 5.0[M]. 2005, 2278-2279. |
| [16] | Zhong C Q, Cao G X, Jin X Q, et al. Studies on the formation and forming mechanism of the related substance E in potassium clavulanate production by HPLC-MS/MS[J]. Brazilian Journal of Pharmaceutical Science , 2014, 50(2): 391-399. DOI:10.1590/S1984-82502014000200019. |
| [17] | Chinese Pharmacopoeia Commission (国家药典委员会). Pharmacopoeia of the People's Republic of China :The second part(中华人民共和国药典:二部)[M].8 th ed.Beijing(北京): Chemical Industry Press(化学工业出版社), 2005: 310. |
| [18] | Bersanetti P A, Barboza M, Hokka C O, et al. Kinetic study of clavulanic acid hydrolysis (Estudos Cinética de hidrólise de ácidoclavulânico) [C]//Proceedings of the XIII SINAFERM (SimposioNacional de Fermentação), Teresópolis, 200, 6: 1-39. |
| [19] | Bersanetti P A, Almeida R M R G, Barboza M, et al. Kinetic studies on clavulanic acid degradation[J]. Biochemical Engineering Journal , 2005, 23(1): 31-36. DOI:10.1016/j.bej.2004.10.007. |




