随着人口不断增长,经济的快速发展,能源资源日益紧张,应尽可能扩大资源种类,充分利用资源,选用储量丰富、环境友好的资源及再生资源,最大幅度地提高资源有效利用率。锂是1817年由著名化学家贝齐里乌斯的学生阿尔费特逊在分析一种矿石的成分时发现的[1],被公认为“推动世界进步的能源金属”。锂及其盐类是国民经济和国防建设中具有重要意义的战略物资,近年来,在化学电源领域,锂离子电池已成为世界范围的研究热潮[2~4]。锂离子电池具有工作电压高[5~8]、能量密度高[9~13]、寿命长[14~16]、自放电速率小[17~19]、无记忆效应[20, 21]、不含铅镉等有害物质[22]、对环境友好[23, 24]等优点,迅速取代其它电池能源,成为应用最广泛的电池能源。
我国有丰富的锂资源,海水、盐湖、含锂矿物质、温泉水等等矿床资源中含有大量的锂,另外,生产锂离子电池的厂家,排放出的大量工业废水中含有大量有害离子,其中Li+含量远高于其他任何形式锂资源中的锂含量。如何高效、低能耗、低污染地提取锂是极有前景和值得深入探讨的。实现高效提锂可以大大降低锂离子电池的成本,使锂离子电池能够应用于更广泛的领域中。全球已查明的陆地锂资源总量为1376万吨,远远不能满足锂的远景市场需求。而海卤水中锂资源量非常巨大,是陆地锂资源总量的一万余倍[25~27]。因此,近些年海卤水提锂技术受到国内外科研工作者的重视,并取得了一些进展。
2 文献统计分析本文采用Web of Science和Histcite两个工具对海卤水提锂为主题的所有177篇论文进行统计分析并选择阶段代表性技术进行报道。如图 1(a)所示,以2011年为分水岭,在纳米材料的快速发展和锂离子电池的广泛应用两方面推动下,溶液提锂技术越来愈受到关注。如图 2所示,海水提锂研究主要集中在中日韩三国,但这只是从论文数量来看,表示三国科研工作人员在此领域投入了很多精力,具有较高的论文产出量。但是进一步对LCS (local citation score,论文在当前数据库中被引用次数)、GCS(总被引次数)、LCS/Recs和GCS/Recs分析可知,统计学上,中日韩论文数量虽然占主导地位,但是研究创新性和对其他研究者的启发影响作用来看,中国和韩国的相关研究却低于日本、美国、英国和法国等;如图 1(b)所示,总体上,LCS和GCS值表明日本和中国两国的科学家对海卤水提锂技术发展做出了更显著的贡献。

|
图 1 Web of Science中海卤水提锂为主题的论文分布 Fig.1 Time (a) and region (b) distribution of publications on Web of Science about lithium extraction from seawater and brine |

|
图 2 LiFePO4/FePO4电化学提锂装置示意图[42] Fig.2 Schematic diagram of an LiFePO4/FePO4 electrolytic cell for lithium extraction [42] |
对于传统技术海卤水提锂,前人已经做了很多细致的综述[28~30],在此只做简单介绍:对于低镁锂比盐湖卤水开发,目前已经工业化的以沉淀法为主,比如SQM在阿塔卡玛盐湖,先利用太阳能将卤水中的氯化钠氯化钾等先蒸发沉淀出获得富锂母液,然后加入碳酸钠沉淀出碳酸锂。缺点是工艺流程长,且只适用于低镁锂比盐湖资源;还有吸附法,FMC采用铝盐吸附剂吸附-脱附-浓缩-加碱-沉锂,该过程缺点是吸附剂破碎熔损导致产量不理想[31]。对于高镁锂比盐湖卤水,已经工业化的主要是膜法电渗析,一级或多级截留镁离子,得到富锂溶液后进行浓缩精制,该法能源利用率低且膜组件对技术和材料装置要求较高。另外,萃取法尚在研究发展阶段,虽然具有较高的分离系数,但是对技术和设备要求较高,另外大量有机溶剂的参与将来可能有较大环境压力。本文主要综述近些年出现的新技术,这些技术普遍尚处于研究期,很少有实际应用案例,有些甚至还处在概念阶段,而将来海卤水提锂要求低能耗,低污染,高效率,高选择性,这些尚未成熟的新技术在这些评价指标面前都远远高于传统技术,所以需要更多的关注,对这些技术进行综述具有现实必要性。这些新技术包括:电渗析[32~35],电场辅助电极提锂[36~45],离子液体萃取[46~52],离子筛吸附[53~69],纳滤膜结晶[70~73]等。
3 提锂新技术 3.1 电化学法本文中电化学法主要是采用锂离子电池工作原理所设计的电场辅助下电极选择性嵌脱锂技术。
2012年Pasta提出用于卤水中提锂的电池,报道了采用能够捕获锂离子的阳极材料磷酸铁锂和捕获氯离子的阴极组建的电池用于锂离子提取,可以144 Wh·kg-1的能耗将富钠卤水(Li:Na= 1:100) 成功转换成富锂溶液(Li:Na= 5:1)。2012年之后,德国,韩国和中国的一些科学家陆续提出一些基于锂电池储能原理设计出的电化学提锂方法,并进行了深入的理论研究。
Zhao于2013年研究了Li+,Na+,K+,Mg2+于LiFePO4/ FePO4结构中嵌入脱嵌的电化学行为[43]。循环伏安实验显示Na+存在一些可逆嵌脱行为, 其还原峰出现在-0.511 V,区别于Li+的-0.197 V,表示更正的电位有利于降低钠离子的嵌入。而钾离子难以嵌入FePO4,另外,通过对超高镁锂比(493:1) 真实卤水体系在0.7 V下进行研究发现,每1 g磷酸铁锂能获得24.1 g Li,7.32 g Mg和4.61 g Na。镁锂比从493降至0.30,钠锂比从16.7降至0.19,证明了对于高镁锂比的卤水,施加适当的电势可以以较高的分离系数分离出锂离子。
本文作者在同年发表的论文中提到,由于镁离子拥有较高电荷密度,较容易形成水合物[44],如图 3所示,通过在不同电解液中进行循环伏安测试,镁离子的氧化还原峰位于1.403 V,锂离子的氧化还原峰位于0.592 V,表明镁离子嵌入脱嵌表现出更明显的极化行为。证实了锂离子可以自由嵌入脱嵌磷酸铁锂晶格内,而镁离子则较难。电解液为纯的含锂溶液时,控制电势1.0 V可以是嵌锂容量达到41.26 mg Li+·g-1 LiFeO4,达到理论容量的93.78%,随后脱锂容量为38.93 mg Li+·g-1LiFePO4,脱出/嵌入比达到94.3%。而镁离子脱嵌容量为5.5 mg·g-1 LiFeO4.作者还证明了更低的电势对于分离镁锂更为有利,该方法在真实的卤水体系中从镁锂比60降到0.45[44]。

|
图 3 λ-MnO2分别在1 mol·L-1LiCl、NaCl中的循环伏安[73] Fig.3 Cyclic voltammogram of λ-MnO2 in LiCl and NaCl electrolytes(1 mol·L-1) [73] |
Zhao的研究表明尖晶石二氧化锰电极对离子有显著的选择性,如图 3所示,在氯化锂溶液中的循环伏安曲线有明显的氧化还原峰,说明锂离子有明显的嵌脱过程,而钠离子并没有进行嵌脱过程。在1 mol·L-1氯化锂中的氧化还原峰相较于在卤水中更加明显,同样的电压扫描区间(0~1.2 V),前者的峰电流更高,此结果表明卤水中的杂质离子对锂离子在电极界面的扩散过程有抑制作用。
Liu和Zhao[39]于2014年发表了关于卤水中钠离子对磷酸铁锂电极嵌锂脱锂行为影响的研究,通过电化学分析研究了钠离子对于锂离子嵌入脱嵌的负面影响,控制循环伏安扫描电势低于0.3 V可以消除钠离子的副作用,再次电势下电极表现出很好的循环稳定性,当电势降至0.25 V,循环10次嵌锂脱锂浓缩之后,锂离子的浓度达到432 mg·L-1,10次的平均嵌锂容量达到38.6 mg·g-1 LiFePO4。
2014年Trocoli[40]提出一种一步恒流充放电循环往复操作的电化学过程,该过程能耗低且大幅增加卤水锂离子纯度。磷酸铁锂的010面主要嵌入隧道的尺寸通过Li-O的键长获得,隧道的维度约为2.96 Å × 2.96 Å× 4.42 Å,钾离子的离子半径大约为锂离子的1.8倍,明显更难嵌入。假设钾离子能嵌入,那么钾离子之间嵌入位约为1.38Å,大于实际观测的锂离子之间3.01Å,离子之间更短的距离导致更强烈的排斥力,进一步限制钾离子的嵌入。通过Delmas提出的多米诺多级模型分析,尽管镁离子与锂离子具有相似的性质,但是更多的成键位点动力学牵制了镁离子的嵌入。从工业角度来说,不同的现实条件决定了不同工艺参数,当锂离子在低纯度下被提取时,需要更高的电流密度。假设采用如上方式建立电化学反应器针对salar de Atacama盐湖进行提锂,现有lime-soda蒸发工艺的提锂效率一年所提取锂产量,可以在0.5 mA·cm-2电流下8天提取获得,或者5 mA·cm-2电流下19.2 h就可获得。
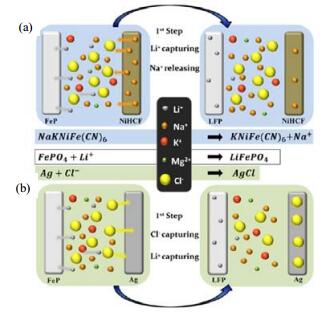
Trocoli于2016提出一种电化学离子泵[42],并研究阳离子捕获能力和选择性。如图 4(a)所示,依据电中性原理,如果在一个电极上锂离子被捕获,同时另一个电极会获得一个阴离子,X-,或者释放一个阳离子,M+,或者选择性交换。
|
图 4 选择性离子交换与锂离子捕获示意图[42] Fig.4 Schematic diagram of selective exchange and salt capturing lithium recovery methods[42] |
|
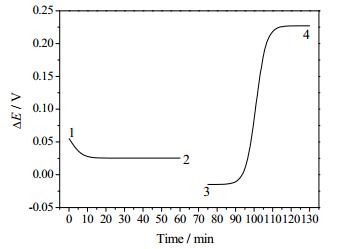
图 5 提锂四步操作电势分布图 Fig.5 Typical potential profiles of a lithium recovery process 1. capture of lithium ions from a brine solution; 2. exchange of brine solution with recovery solution; 3. release of lithium ions into recovery solution; 4. exchange of lithium-enriched recovery solution with fresh brine solution[42] |
如图 4(b)所示,锂离子被M+替换,前一步操作可以采用FePO4和Ag分别作为锂离子和氯离子捕获电极,通过以下反应:
| ${\rm{FeP}}{{\rm{O}}_4} + {\rm{Agl}} + {\rm{L}}{{\rm{i}}^ + } + {\rm{C}}{{\rm{l}}^-} \leftrightarrow {\rm{LiFeP}}{{\rm{O}}_4} + {\rm{AgCl}}$ | (1) |
该选择交换过程基于两种材料,一种是锂离子捕获材料,在此为磷酸铁锂,另一种是能够捕获其他金属阳离子的铁氰化物。工作原理如下:
| ${\rm{FeP}}{{\rm{O}}_4} + {\rm{MKNI}}[{\rm{F}}{{\rm{e}}^{{\rm{II}}}}{({\rm{CN}})_6}] + {\rm{L}}{{\rm{i}}^ + } \leftrightarrow {\rm{LiFeP}}{{\rm{O}}_4} + {\rm{KNI}}[{\rm{F}}{{\rm{e}}^{{\rm{III}}}}{({\rm{CN}})_6}] + {{\rm{M}}^ + }$ | (2) |
离子捕获与选择交换不仅仅采用的材料不同,受热动力学和动力学两方面影响的能耗也不相同,提锂步骤可以分为四步:
依据能量消耗,对比基于普鲁士蓝衍生物离子插层反应的选择性交换方法和基于银/氯化银反应的离子捕获方法。通过热力学和动力学分布,理论计算比较了试验结果,选择交换方法在纯度和效率两方面均较离子捕获有更好的表现,然而,也承受更高的能耗。
通过以上可以看出:电化学法提锂在高选择性,低能耗,高效率,高能源利用率等方面具有很大优势,受益于锂电池纳米电极材料的飞速发展,其优势还在继续扩大。然而,卤水组成非常复杂且多变,不同地区海水或卤水各阴阳离子组分差距很大,锂离子在这些体系中受杂质离子影响,其在电极/海卤水界面上和电极材料纳米孔道中的扩散动力学也有很大差异;另外,高效提锂电极材料的大规模生产制备和规模化提锂操作中电解池组装也面临不少难题。
3.2 离子筛吸附离子筛吸附剂是预先在无机化合物中导入目标离子,在不改变结晶结构的前提下将目标离子抽出,获得具有规则空隙结构的无机物质。这种空隙嵌入目标离子的势垒低于其他离子,且目标离子的嵌脱对其空隙结构不会造成破坏,即其对原导入目的离子有筛选和记忆作用,这种作用即为“离子筛效应”[63]。锂离子筛由于具有能够选择性吸附锂离子而阻挡其他离子进入的空穴,在复杂组成的卤水提锂领域具有选择性优势,本文对离子筛提锂新型吸附材料和吸附工艺进展进行跟踪:
相比电化学法,离子筛法的研究相对较早,2003年日本科学家Koyanaka和Matsubaya发表于Journal of Electroanalytical Chemistry的论文研究了尖晶石型二氧化锰中氢离子含量和锂离子吸附量之间的定量关系[69],不同氢含量的二氧化锰对含锂溶液进行提锂实验,结果显示锂吸附容量,即离子交换能力与二氧化锰中氢离子含量呈线性关系,Koyanaka认为尖晶石型lambda二氧化锰对锂离子的选择性吸附并不是基于通常认为的离子筛效应,而是一种离子交换反应,而这种离子交换反应只能发生在氢离子和锂离子之间,这种限定的离子交换行为就造成了含锂溶液提锂的高选择性。
Chung[68]于2004年提出用溶胶凝胶法制备纳米二氧化锰吸附剂提取海水中的锂离子,作者采用Tartaric Acid gel Process合成了尖晶石结构Li1.33Mn1.67O4前驱体后用酸洗,表现出很好的选择性和吸附效率,在对模拟海水进行提锂实验中得到28.2 mg·g-1的嵌锂容量,采用该吸附剂进行5次循环提锂操作后,提锂容量衰减小于10%。
Wang[67]于2006年报道了采用LiCO3和LiOH作为不同的锂源固态法制备尖晶石锰酸锂前驱体。Wang研究了提锂容量和制备参数的关系,包括前驱体,不同的锂源,Li/Mn摩尔比例和加热时间。结果显示相比Li2CO3和MnCO3,采用LiOH中心位点H2O和MnCO3制备的提锂材料具有更高的锂吸附容量;当前驱体中Li/Mn比例增加时,提锂容量也会以非线性比例上升,Mn2O3杂质可能是降低锂吸附容量的主要原因。作者认为从尖晶石型锰酸锂获得的Li/Mn = 1.0的提锂材料因为具备高选择性和大吸附容量,可以作为一种锂离子吸附剂。该作者于2008年进一步采用pH = 8.0的氨/氯化铵缓冲溶液调节pH的溶液研究pH对离子筛提锂效率的影响[65],同时考虑了离子强度对离子筛在海卤水中提锂潜能的作用,吸附等温线符合Langmuir模型,热动力学结果显示两种离子筛的吸附均为吸热过程。全过程反应速率受离子内部扩散过程和边缘层扩散过程控制。
Park等于2014年提出通过静电纺丝技术制备H1.6Mn1.6O4锂离子筛-聚丙烯腈纳米纤维复合材料(HMO-PAN)并应用于提锂技术[61]。HMO-PAN的锂离子吸附容量大于没有纳米纤维支撑的粉末HMO,纳米纤维表面暴露的HMO对锂离子来说更易接近,而PAN纳米纤维所有经过测试的吸附剂随着PAN纳米纤维上负载的HMO量增加,HMO-PAN复合材料表现出更好的吸附性能,当HMO/PAN为60%时最高吸附容量为10.3 mg·g-1。循环操作10次之后吸附衰减小于4%,表明HMO-PAN具备长期使用循环稳定性。对脱盐后海水进行提锂实验,锂离子的分离系数可以达到99~5312,锂离子分布系数(K-D)高达770。经过HMO-PAN吸附处理后的海水,锂离子浓缩倍数达到486倍,而其他阳离子最高只有7倍。
伊朗科学家Zandevakili于2014年报道了采用MnO2离子筛对伊朗尔米亚湖卤水进行提锂的研究[60],该盐湖卤水含有饱和的Na,Mg,K离子,和很低的Li含量(2.45 mmol·L-1或者17 mg·L-1),对于传统技术来说,这三种高浓度的杂质离子存在下提锂难度非常大,所以,他们用水热法合成了直径40~90 nm,长度150~900 nm的尖晶石型二氧化锰纳米棒锂离子筛,该离子筛提锂容量达到9 mmol·g-1,高于之前其他文献报道的锂离子筛提锂容量。
该研究组同年提出另一种提锂容量高于9 mmol·g-1的锂离子筛[59],考察了锂含量,锰含量,氧化剂,煅烧温度,加热时间和锂锰摩尔比对提锂容量的影响。其中氧化剂对所制备离子筛提锂容量影响最大。

|
图 7 不同LIS负载的PVA泡沫样品 Fig.7 SEM micrographs of selected PVA foam samples with varied LIS loadings (a) optical picture, (b) low magnification showing open cell structure, (c) pure PVA foam, (d) 50%(wt) LIS/PVA, (e) 250%(wt) LIS/PVA, (f) 300%(wt) LIS/PVA. (Insets: higher magnification micrographs of the samples) [57] |
Nisola等于2015年提出大孔聚乙烯醇(PVA)泡沫复合物均匀负载锂离子筛(LIS/PVA)用于海卤水提锂[57],表面活性剂结合冷冻干燥产生大孔和中孔的分层多孔LIS/PVA,戊二醛交联LIS/PVA泡沫使其不溶于水且存在较高吸水性能。相比锂离子筛粉末,LIS/PVA泡沫具有高孔隙率和比表面积,亲水性,较高比例的LIS颗粒可以与溶液接触,这些特性使得其促进液流穿过孔道并使锂离子和LIS表面亲密接触。250%(wt)比例的LIS/PVA表现出最高的吸附性能并可以长期重复使用。
利用泡沫的弹性特制,通过吸附-挤压循环操作,节省了能耗较高过程,比如膜过滤或填充床操作,使得LIS/PVA较LIS粉末离子筛具备更好的应用潜质。
2016年,韩国的Chung提出采用H2TiO3锂离子筛替换常用的锰基离子筛[68]。研究溶液pH,固/液比例,温度,喂料浓度对吸附的影响。H+的累积严重的限制了锂离子的吸附容量,锂离子吸附是Langmuir型,遵从pseudo-second-order rate model,H2TiO3锂离子筛最高吸附容量为94.5 mg·g-1,远高于现在已知的LIS,且具备长期稳定循环使用能力。
同年,Chung研究组的Park提出矩阵纳米纤维作为溢流道膜吸附剂,用于连续操作海水提锂[53],基于聚砜(PSf)混合阵列纳米纤维(MMN),将锂离子筛(LIS)均匀分散负载在PSf-MMN上作为溢流道膜Li+吸附剂,通过静电纺丝,热煅烧,酸浸过程制备MMN,LIS: Li0.67H0.96Mn1.58O4或者MO活化,大空隙MMN纤维阵列独特的空间特性使得更高的MO均匀分布,并暴露在纳米纤维的表面,至于膜,MMNs具备在最小跨膜压力下高度透过水溶液的特性。海水对流穿过MMN使得Li+快速移动至MO表面。连续流动操作控制在非常短的吸附-脱附周期(1 d)即可保持MMN的动态锂离子吸附容量。循环操作保证了MMN的循环可再生性能和其吸附性能稳定性。从海水或者其他含锂溶液采用溢流道膜吸附剂连续提锂操作具备应用前景。
文献中离子筛虽然表现出很高的吸附性能和较高的离子选择性,然而离子筛多为纳微米尺度粉末材料,规模化应用于海卤水提锂时,高品质离子筛材料的大量生产,大规模吸附时如何保持文献报道的实验室吸附容量,吸附剂再生方式,成本等都需要更深入研究,才有可能真正走向产业化。
3.3 离子液体萃取以憎水的离子液体代替常规有机溶剂,并在其阳离子取代基上引入配位原子或配位结构,以提高锂离子在离子液体中的分配系数,使锂离子从水相进入离子液体项达到与其他离子分离的目的。
日本的Hoshino提出采用离子液体膜电渗析法从海水中提锂技术[33, 48],锂离子从阳极选择性透过离子液体(PP13-TGSI)有机膜到阴极。阴极侧的的离子浓度显示在2 V电势差下锂离子浓度2 h上升至5.94%,海水中其他离子不会穿过PP13-TGSI离子液体膜。另外当膜的两端被Nafion324覆盖以防离子液体外漏,锂离子浓度增加至22.2%。这一新方法表现出较高能量效率,且容易放大,非常适用于海水提锂。
青海盐湖所的Shi, 和Duan于2014年等提出包含离子液体的磷酸三丁酯高效溶液提锂萃取系统[47],将室温离子液体(RTILs),1-丁基-3-甲基咪唑六氟磷酸盐([C(4) mim][PF6])结合三丁基磷酸盐(TBP)作为萃取剂应用到盐湖卤水萃取提锂。研究温度,pH,相比率和其他因素对萃取效果的影响,与传统萃取技术相比,该离子液体萃取系统表现出更高的效率,通过对公益参数进行优化,获得90.93%的单次提取率,根据傅立叶红外分析萃取机理为锂离子通过在离子液体中阳离子交换形成[Li.1TBP]+。该体系相比传统有机溶剂萃取技术在液/液界面金属离子提取更有前景。
|
图 8 Li+和Na+在离子液体膜的转移机理[52] Fig.8 Schematic diagram of Li+ and Na+ transfer mechanism in liquid ion exchange membrane[52] |
天津科技大学的Deng等于2015年提出磷酸三叔丁酯在离子液体和煤油体系盐湖卤水提锂技术[49],最优化工艺条件下锂离子的单步萃取效率达到83.71%,单步反萃取效率达到85.61%。
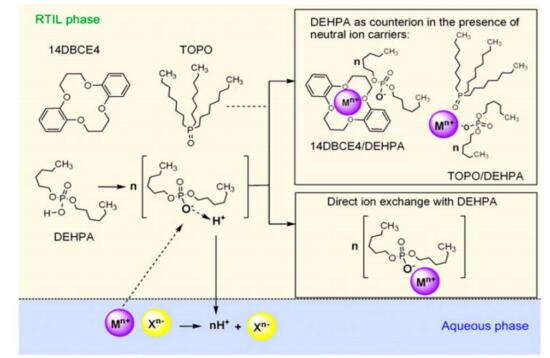
韩国的Torrejos和Chung提出针对多种金属离子的溶液的环境友好的离子液体液液萃取技术[52]。疏水室温离子液体(RTIL)作为萃取剂,质子电离剂bis(2-ethylhexyl) phosphoric acid (DEHPA)加入RTIL增强金属提取选择性,三种锂离子中性离子媒介比如6-hydroxy-dibenzo-14-crown-4, dibenzo-14-crown-4和tri-n-octyl-phosphine (TOPO)加入作为萃取添加剂,经过测试可知磷基CYPHO IL 109是最稳定的萃取剂,添加DEHPA则可以提升多价阳离子选择性提取能力,添加TOPO到DEHPA/CYPHOS IL 109萃取剂,将pH维持在13,以TOPO:DEHPA = 8:1(mol),获得最高的提锂效率。整个过程分为两步,第一步是多价阳离子先通过DEHPA/CYPHOS IL 109提出,剩余溶液通过使用TOPO/DEHPA/CYPHOS IL 109体系选择性提锂。
青海盐湖所Shi等于2016提出通过采用室温离子液体tri-n-butyl phosphate萃取溶液提锂[47]。采用离子液体([C4mim][NTf2]在中性磷化合物3-正丁基磷酸盐(TBP)作为萃取剂,研究其对富镁含锂盐湖卤水提锂应用。该提锂过程受盐湖卤水酸度,离子液体剂量和相比率等参数影响。在最优化条件下,锂离子的单次提取率达到92.37%,基于热力学研究获得锂离子提取反应热力学参数,通过斜率分析方法可知复合物金属/配合基比例为1:1。
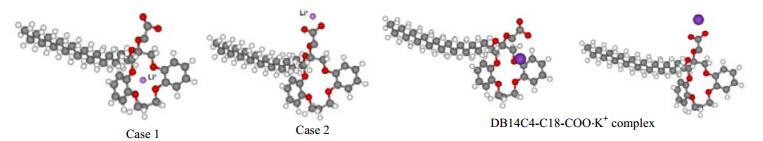
Torrejos等于2016年提出采用亲油性二苯并-14-冠-4醚羧酸(CE DB14C4-C18-COOH)在疏水性室温离子液体(RTIL CYPHOS IL 109) 中液液萃取提锂,去质子化的羧基充当阴离子替代物促使锂离子方便的转移到萃取剂相。羧基同时加强了锂离子对CE配合基的亲和性,两者通常以1:1络合。CE浓度为60 mmol·L-1时,充分搅拌下10 min即可完成萃取,萃取剂通过稀盐酸溶液再生。密度泛函理论计算也表明DB14C4-C18-COOH和Li+以1:1络合,室温下,LLE系统以高达1954的Li/Na分离系数和138的Li/K分离系数,DB14C4-C18-COOH/CYPHOS IL 109系统离子液体萃取法在海卤水提锂中存在应用潜力。
|
图 9 DFT计算DB14C4-C18-COO−Li+的优化结构的两种构象 Fig.9 Two configurations of the optimized structure of DB14C4-C18-COO−Li+ complex obtained by DFT calculation Binding energy: −242 kJ·mol -1(case 1-left) and −282 kJ·mol -1 (case2-right). DB14C4-C18-COO−K+, −156 kJ·mol -1 (left) and −224 kJ·mol -1 (right)[52] |
离子液体作为一种代替常规萃取剂的绿色介质,可避免常规溶液萃取法有机溶剂挥发产生的环境污染,且具有较常规溶剂萃取更高的锂萃取效率和容量。如果用于规模化提锂,离子液体的大量合成需要更仔细的摸索和研究,尤其是多步反应中如何保证其纯度,对于提锂容量至关重要。
3.4 纳滤Li+、Na+和Mg2+的离子Stockes半径分别为0.238、0.184和0.348 nm;水合能分别为636、454和2555 kJ·mol−1。纳滤过程通常解释为溶液扩散和对流传质,Mg2+具有较大的Stockes半径,导致其扩散速率较慢,且纳滤膜本身带有电荷,对多价离子具有较高截留率。而钠锂之间的竞争系数随着钠锂摩尔比增加而减小,Li+较钠离子水合能略高,导致其截留率略高于Na+。
突尼斯的Somrani和法国的Pontie研究了通过纳滤(NF)和低压反渗透技术(LPRO)从盐湖卤水中分离锂离子[74]。NF90膜对纯水和0.1 mol·L-1的NaCl溶液具有更高的透水性和更低的临界压强(Pc= 0),在低膜压(低于15 bar)对单价离子具有更高的选择性(40%),以及其更低的平均粗糙度((105±10) nm)降低了被污染倾向,相比低压反渗透XLE膜表现出更高的提锂效率。NF90在第一步对稀释10倍的突尼斯盐湖卤水分离中阻挡掉100%的镁离子,最终Mg2+/Li+分离85%,在放大过程中可用稀卤水的渗透性为0.7 L·h-1 m-2·bar-1。在第二步针对并没完全分离锂离子和钠离子(15%)的问题,加入渗析过程,最终在扩散通量4.42×10-7mol·s-1·m-2,20℃下对0.1 mol·L-1NaCl溶液得到锂和钠的完全分离。然而,对稀释卤水纳滤操作6 h后,由于膜污染,在渗透性0.7 L·h-1·m-2·bar-1下生产能力衰减50%,在该过程中膜污染的内在机理和渗析过程优化尚需进一步研究。
3.5 膜结晶膜结晶是通过膜蒸馏脱去溶液中的溶剂是溶液过饱和而结晶析出溶质的过程。普通的结晶过程由于料液表面即蒸发界面和料液主体温度和过饱和度等存在很大差别,导致晶体均一性差,影响氯化锂晶体纯度。相比蒸发结晶,膜结晶过程蒸发界面在膜组件内部,结晶过程则发生在过饱和度均一的单独容器内。
意大利的Quist-Jensen和沙特阿拉伯的Mondal等合作于2016年分别在Journal of Membrane Science[72],Desalination and Water Treatment[71]和Crystal[70]先后发表了膜结晶海卤水提锂方面的研究成果,膜结晶技术是一种针对常压驱动膜过程在高浓度溶液中严重受限的新型解决方案。对于LiCl单盐溶液,浓度高于14 mol·L-1时才会结晶析出。在该浓度下渗透压非常高,直接接触膜蒸馏(DCMD)和渗透膜蒸馏(OMD)处理LiCl溶液极限浓度分别为至7和10 mol·L-1,采用真空膜蒸馏(VMD)使体系达到结晶所需过饱和度,而氯化锂晶体形貌取决于VMD工艺参数,高温且剧烈流体流动状态下易得到斜方晶结构,温和的条件下则获得立方晶结构,本文虽然获得了真空膜蒸馏结晶氯化锂最优工艺参数,然而如何针对复杂混盐卤水体系中选择性提取锂资源还需要优化结晶工艺研究。
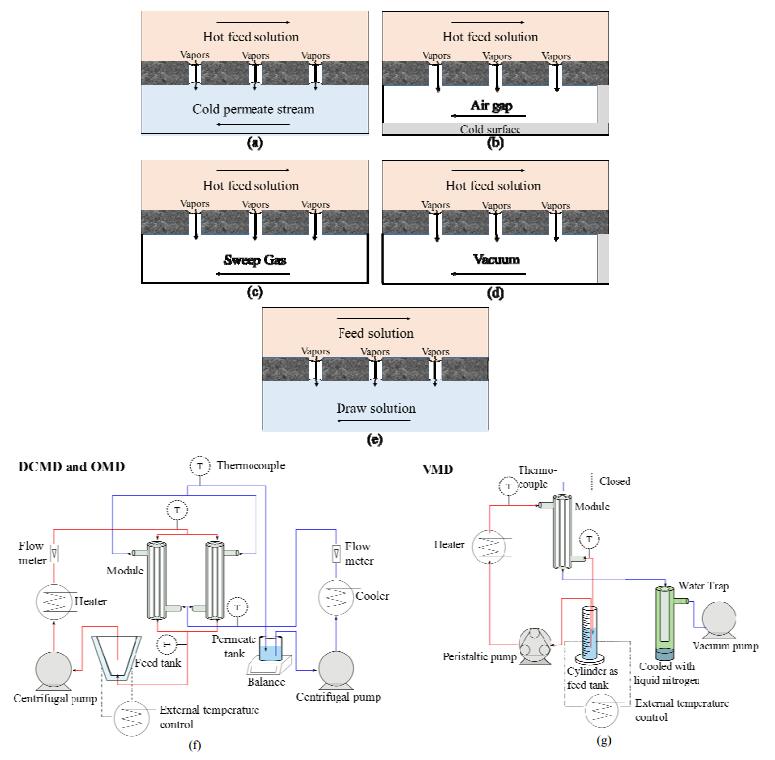
|
图 10 直接接触膜蒸馏,渗透膜蒸馏,真空膜蒸馏示意图和流程图[71] Fig.10 Schematic diagrams and flow charts of direct contact membrane distillation, osmotic membrane distillation and vacuum membrane distillation[71] |
2011年以来溶液提锂领域激发出了更多的技术理论创新,得益于材料领域的快速发展,出现了一些不同于传统提锂手段的新技术。各地海水和卤水中离子组成差别很大,根据不同的组成,以上提到的各种技术各有优劣,但总的来说,较现有蒸发沉淀,吸附等传统方法具备更节能更绿色更高选择性的优势;以上所提到的技术中,纳滤+渗析,离子液体萃取等处于更成熟甚至已经工业应用的阶段,其中一些比如电场辅助电极提锂,泡沫状离子筛吸附等目前则处于实验室研究阶段,然而其所报道的能耗和效率表现出惊人的应用潜力,随着纳米材料的快速发展,电极材料,锂离子筛材料的性能也日新月异,推动着这些新技术的在海卤水提锂领域快速发展。基于这些新材料和新技术,对于实际海水卤水体系,如何调整工艺参数,优化设备结构,改进工艺条件,将会是其工业化应用于海卤水提锂产业的关键。
| [1] | Weeks L M E. Arfwedson and his services to chemistry[J]. Journal of Chemical Education, 1937, 14(9): 403-423.DOI:10.1021/ed014p403. |
| [2] | Dilic K M, Holl K. Recent progress in rechargeable nickel metal hydride and lithium ion miniature rechargeable batteries[J]. Journal of Power Sources, 1999, 80(1): 112-115. |
| [3] | Ryu T, Shin J, Lee D H, et al. Improvement of lithium adsorption capacity of porous cylinder-type lithium manganese oxide through introduction of additive[J]. Materials Chemistry and Physics, 2015, 167: 225-230.DOI:10.1016/j.matchemphys.2015.10.036. |
| [4] | Yoshino A. The birth of the lithium-ion battery[J]. Angewandte Chemie International Edition, 2012, 51(24): 5798-5800.DOI:10.1002/anie.201105006. |
| [5] | Zhou L N, Leskes M, Liu T, et al. Probing dynamic processes in lithium-ion batteries by in situ NMR spectroscopy: application to Li1.08Mn1.92O4 electrodes[J]. Angewandte Chemie International Edition, 2015, 54(49): 14782-14786.DOI:10.1002/anie.201507632. |
| [6] | Zhou L, Zhao D Y, Lou X W. LiNi0.5Mn1.5O4 hollow structures as high-performance cathodes for lithium-ion batteries[J]. Angewandte Chemie International Edition, 2012, 51(1): 239-241.DOI:10.1002/anie.201106998. |
| [7] | Wu F F, Xiong S L, Qian Y T, et al. Hydrothermal synthesis of unique hollow hexagonal prismatic pencils of Co3V2O8nH2O: a new anode material for lithium-ion batteries[J]. Angewandte Chemie International Edition, 2015, 54(37): 10787-10791.DOI:10.1002/anie.201503487. |
| [8] | Cui Y L, Wang M Z, Wang J L, et al. Effect of temperature on the electronic/ionic transport properties of porous LiNi0.5Mn1.5O4 with high voltage for lithium ion batteries[J]. Materials Chemistry and Physics, 2016, 180: 46-52.DOI:10.1016/j.matchemphys.2016.05.023. |
| [9] | Han X Y, Qing G Y, Sun J T, et al. How many lithium ions can be inserted onto fused C6 aromatic ring systems?[J]. Angewandte Chemie International Edition, 2012, 51(21): 5147-5151.DOI:10.1002/anie.201109187. |
| [10] | Tian N, Gao Y R, Li Y R, et al. Li2C2, a high-capacity cathode material for lithium ion batteries[J]. Angewandte Chemie International Edition, 2016, 55(2): 644-648.DOI:10.1002/anie.201509083. |
| [11] | Ma T, Zhao Q, Wang J B, et al. A sulfur heterocyclic quinone cathode and a multifunctional binder for a high-performance rechargeable lithium-ion battery[J]. Angewandte Chemie International Edition, 2016, 55(22): 6428-6432.DOI:10.1002/anie.201601119. |
| [12] | Ma G, Li S, Zhang W X, et al. A general and mild approach to controllable preparation of manganese-based micro-and nanostructured bars for high performance lithium-ion batteries[J]. Angewandte Chemie International Edition, 2016, 55(11): 3667-3671.DOI:10.1002/anie.201511196. |
| [13] | Liu W, Oh P, Liu X, et al. Nickel-rich layered lithium transition-metal oxide for high-energy lithium-ion batteries[J]. Angewandte Chemie International Edition, 2015, 54(15): 4440-4457.DOI:10.1002/anie.201409262. |
| [14] | Chen H Y, Armand M, Courty M, et al. Lithium salt of tetrahydroxybenzoquinone: toward the development of a sustainable Li-ion battery[J]. Journal of the American Chemical Society, 2009, 131(25): 8984-8988.DOI:10.1021/ja9024897. |
| [15] | Taniguchi K, Narushima K, Mahin J, et al. Construction of an artificial ferrimagnetic lattice by lithium ion insertion into a neutral donor/acceptor metal-organic framework[J]. Angewandte Chemie International Edition, 2016, 55(17): 5238-5242.DOI:10.1002/anie.201601672. |
| [16] | ZUO Peng-jian(左朋建), YIN Ge-ping(尹鸽平), WANG Zhen-bo(王振波), et al. Si/C/B2O3 composite anode for lithium ion batteries(锂离子电池Si/C/B2O3复合负极材料的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2009, 23(4): 705-708. |
| [17] | Baboul A G, Redfern P C, Sutjianto A, et al. Li+-(diglyme)2 and LiClO4-diglyme complexes: barriers to lithium ion migration[J]. Journal of the American Chemical Society, 1999, 121(31): 7220-7227.DOI:10.1021/ja990507d. |
| [18] | Ma C, Rangasamy E, Liang C, et al. Excellent stability of a lithium-ion-conducting solid electrolyte upon reversible Li+/H+ exchange in aqueous solutions[J]. Angewandte Chemie International Edition, 2015, 54(4): 1063-1063.DOI:10.1002/anie.201500056. |
| [19] | Azhagurajan M, Kajita T, Itoh T, et al. In situ visualization of lithium ion intercalation into MoS2 single crystals using differential optical microscopy with atomic layer resolution[J]. Journal of the American Chemical Society, 2016, 138(10): 3355-3361.DOI:10.1021/jacs.5b11849. |
| [20] | Ma C, Rangasamy E, Liang C D, et al. Excellent stability of a lithium-ion-conducting solid electrolyte upon reversible Li+/H+ exchange in aqueous solutions[J]. Angewandte Chemie International Edition, 2015, 54(1): 129-133.DOI:10.1002/anie.201408124. |
| [21] | Bockholt H, Haselrieder W, Kwade A. Intensive powder mixing for dry dispersing of carbon black and its relevance for lithium-ion battery cathodes[J]. Powder Technology, 2016, 297: 266-274.DOI:10.1016/j.powtec.2016.04.011. |
| [22] | Croguennec L, Palacin M R. Recent achievements on inorganic electrode materials for lithium-ion batteries[J]. Journal of the American Chemical Society, 2015, 137(9): 3140-3156.DOI:10.1021/ja507828x. |
| [23] | Chun C Y, Cho B H, Kim J. Implementation of discharging/charging current sensorless state-of-charge estimator reflecting cell-to-cell variations in lithium-ion series battery packs[J]. Internatianal Journal Automotive Technology-Korea, 2016, 17(5): 909-916.DOI:10.1007/s12239-016-0088-8. |
| [24] | Chen J, Zhao N, Li G D, et al. Superior performance of LiFePO4/C with porous structure synthesized by an in situ polymerization restriction method for lithium ion batteries[J]. Materials Chemistry and Physics, 2016, 180: 244-249.DOI:10.1016/j.matchemphys.2016.06.002. |
| [25] | Munk L, Hynek S, Boutt D, et al. Geology, geochemistry, and hydrogeology of lithium brines[J]. New Concepts and Discoveries, 2015, 1~2: 515-519. |
| [26] | ZHENG Mian-ping(郑绵平), LIU Xi-fang(刘喜方). Lithium resource of China(中国的锂资源)[J]. Advanced Materials Industry(新材料产业), 2007(8): 13-16. |
| [27] | YUAN Jun-sheng(袁俊生), JI Zhi-yong(纪志永). The progress of extracting lithium from seawater(海水提锂研究进展)[J]. Sea-Lake Salt and Chemical Industry(海湖盐与化工), 2003, 32(5): 29-33. |
| [28] | ZHU Hua-fang(朱华芳), GAO Jie(高洁), GUO Ya-fei(郭亚飞), et al. Progresses on solvent extraction for lithium recovery from brine(溶剂萃取法提锂的研究进展)[J]. Guangdong Weiliang Yuansu Kexue(广东微量元素科学), 2010, 17(11): 25-30.DOI:10.3969/j.issn.1006-446X.2010.11.003. |
| [29] | LIU Yuan-hui(刘元会), DENG Tian-long(邓天龙). Progresses on the process and technique of lithium recovery from salt lake brines around the world(国内外从盐湖卤水中提锂工艺技术研究进展)[J]. World Sci-Tech R & D(世界科技研究与发展), 2006, 28(5): 69-75. |
| [30] | YU Jiang-jiang(余疆江), ZHENG Mian-ping(郑绵平), WU Qian(伍倩). Research progress of lithium extraction process in lithium-containing salt lake(富锂盐湖提锂工艺研究进展)[J]. Chemical Industryand Engineering Progress(化工进展), 2013, 31(1): 13-21. |
| [31] | LI Chao(李超), XIAO Jia-li(肖伽励), SUN Shu-ying(孙淑英), et al. Preparation and lithium adsorption evaluation for spherical ion-sieve granulated by agarose(球形离子筛吸附剂的制备及其锂吸附性能评价)[J]. CIESC Journal(化工学报), 2014, 65(1): 220-226. |
| [32] | Hoshino T. Preliminary studies of lithium recovery technology from seawater by electrodialysis using ionic liquid membrane[J]. Desalination, 2013, 317: 11-16.DOI:10.1016/j.desal.2013.02.014. |
| [33] | Hoshino T. Development of technology for recovering lithium from seawater by electrodialysis using ionic liquid membrane[J]. Fusion Engineering and Design, 2013, 88(11): 2956-2959.DOI:10.1016/j.fusengdes.2013.06.009. |
| [34] | Hoshino T. Development of high-efficiency lithium recovery from seawater by electrodialysis using ionic liquid[J]. Abstracts of Papers of the American Chemical Society, 2013: 245-245. |
| [35] | Lan S J, Wen X M, Zhu Z H, et al. Recycling of spent nitric acid solution from electrodialysis by diffusion dialysis[J]. Desalination, 2011, 278(1-3): 227-230.DOI:10.1016/j.desal.2011.05.031. |
| [36] | Chitrakar R, Makita Y, Ooi K, et al. Synthesis of iron-doped manganese oxides with an ion-sieve property: lithium adsorption from Bolivian Brine[J]. Industrial & Engineering Chemistry Research, 2014, 53(9): 3682-3688. |
| [37] | Kim J S, Lee Y H, Choi S, et al. An electrochemical cell for selective lithium capture from seawater[J]. Environmental Science & Technology, 2015, 49(16): 9415-9422. |
| [38] | Kim S, Lee J, Kang J S, et al. Lithium recovery from brine using a lambda-MnO2/activated carbon hybrid supercapacitor system[J]. Chemosphere, 2015, 125: 50-56.DOI:10.1016/j.chemosphere.2015.01.024. |
| [39] | Liu X H, Chen X Y, Zhao Z W, et al. Effect of Na+ on Li extraction from brine using LiFePO4/FePO4 electrodes[J]. Hydrometallurgy, 2014, 146: 24-28.DOI:10.1016/j.hydromet.2014.03.010. |
| [40] | Trocoli R, Battistel A, La Mantia F. Selectivity of a lithium-recovery process based on LiFePO4[J]. Chemistry-A European Journal, 2014, 20(32): 9888-9891.DOI:10.1002/chem.201403535. |
| [41] | Trocoli R, Battistel A, La Mantia F. Nickel hexacyanoferrate as suitable alternative to Ag for electrochemical lithium recovery[J]. Chemsuschem, 2015, 8(15): 2514-2519.DOI:10.1002/cssc.201500368. |
| [42] | Trocoli R, Bidhendi G K, La Mantia F. Lithium recovery by means of electrochemical ion pumping: a comparison between salt capturing and selective exchange[J]. Journal of Physics: Condensed Matter, 2016, 28(11): 114005-114014.DOI:10.1088/0953-8984/28/11/114005. |
| [43] | Zhao Z W, Si X F, Liang X X, et al. Electrochemical behavior of Li+, Mg2+, Na+ and K+ in LiFePO4/FePO4 structures[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(4): 1157-1164.DOI:10.1016/S1003-6326(13)62578-9. |
| [44] | Zhao Z W, Si X F, Liu X H, et al. Li extraction from high Mg/Li ratio brine with LiFePO4/FePO4 as electrode materials[J]. Hydrometallurg, 2013, 133: 75-83.DOI:10.1016/j.hydromet.2012.11.013. |
| [45] | Sun S Y, Xiao J L, Wang J, et al. Synthesis and adsorption properties of Li1.6Mn1.6O4 by a combination of redox precipitation and solid-phase reaction[J]. Industrial & Engineering Chemistry Research, 2014, 53(40): 15517-15521. |
| [46] | Shi C L, Jing Y, Jia Y Z. Solvent extraction of lithium ions by tri-n-butyl phosphate using a room temperature ionic liquid[J]. Journal of Molecular Liquids, 2016, 215: 640-646.DOI:10.1016/j.molliq.2016.01.025. |
| [47] | Shi C L, Duan D P, Jia Y Z, et al. A highly efficient solvent system containing ionic liquid in tributyl phosphate for lithium ion extraction[J]. Journal of Molecular Liquids, 2014, 200: 191-195.DOI:10.1016/j.molliq.2014.10.004. |
| [48] | Gao D L, Yu X P, Guo Y F, et al. Extraction of lithium from salt lake Brine with triisobutyl phosphate in ionic liquid and Kerosene[J]. Chemical Research in Chinese Universities, 2015, 31(4): 621-626.DOI:10.1007/s40242-015-4376-z. |
| [49] | Gao D L, Guo Y F, Yu X P, et al. Extracting lithium from the high concentration ratio of magnesium and lithium Brine using imidazolium-based ionic liquids with varying alkyl Chain lengths[J]. Journal of Chemical Engineering of Japan, 2016, 49(2): 104-110.DOI:10.1252/jcej.15we046. |
| [50] | Shi C L, Jia Y Z, Zhang C, et al. Extraction of lithium from salt lake brine using room temperature ionic liquid in tributyl phosphate[J]. Fusion Engineering and Design, 2015, 90: 1-6.DOI:10.1016/j.fusengdes.2014.09.021. |
| [51] | Torrejos R E, Nisola G M, Park M J, et al. Liquid-liquid extraction of Li+ using mixed ion carrier system at room temperature ionic liquid[J]. Desalination and Water Treatment, 2015, 53(10): 2774-2781.DOI:10.1080/19443994.2014.931534. |
| [52] | Torrejos R E, Nisola G M, Jeong W H, et al. Liquid-liquid extraction of lithium using lipophilic dibenzo-14-crown-4 ether carboxylic acid in hydrophobic room temperature ionic liquid[J]. Hydrometallurgy, 2016, 164: 362-371.DOI:10.1016/j.hydromet.2016.05.010. |
| [53] | Park M J, Nisola G M, Vivas E L, et al. Mixed matrix nanofiber as a flow-through membrane adsorber for continuous Li+ recovery from seawater[J]. Journal of Membrane Science, 2016, 510: 141-154.DOI:10.1016/j.memsci.2016.02.062. |
| [54] | Limjuco L A, Nisola G M, Lawagon C P, et al. H2TiO3 composite adsorbent foam for efficient and continuous recovery of Li+ from liquid resources[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 504: 267-279.DOI:10.1016/j.colsurfa.2016.05.072. |
| [55] | Lawagon C P, Nisola G M, Mun J, et al. Adsorptive Li+ mining from liquid resources by H2TiO3: equilibrium, kinetics, thermodynamics, and mechanisms[J]. Journal of Industrial and Engineering Chemistry, 2016, 35: 347-356.DOI:10.1016/j.jiec.2016.01.015. |
| [56] | Chen L F, Xu X, Song J J, et al. Microwave assisted hydrothermal synthesis of MnO2×0.5H2O ion-sieve for lithium ion selective adsorption[J]. Separation Science & Technology, 2016, 51(5): 874-882. |
| [57] | Nisola G M, Limjuco L A, Vivas E L, et al. Macroporous flexible polyvinyl alcohol lithium adsorbent foam composite prepared via surfactant blending and cryo-desiccation[J]. Chemical Engineering Journal, 2015, 280: 536-548.DOI:10.1016/j.cej.2015.05.107. |
| [58] | Liu L F, Zhang H W, Zhang Y S, et al. Lithium extraction from seawater by manganese oxide ion sieve MnO2×0.5H2O[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2015, 468: 280-284. |
| [59] | Zandevakili S, Ranjbar M, Ehteshamzadeh M. Synthesis of lithium ion sieve nanoparticles and optimizing uptake capacity by Taguchi method[J]. Iranian Journal of Chemistry and Chemical Engineering, 2014, 33(4): 15-24. |
| [60] | Zandevakili S, Ranjbar M, Ehteshamzadeh M. Recovery of lithium from Urmia Lake by a nanostructure MnO2 ion sieve[J]. Hydrometallurgy, 2014, 149: 148-152.DOI:10.1016/j.hydromet.2014.08.004. |
| [61] | Park M J, Nisola G M, Beltran A B, et al. Recyclable composite nanofiber adsorbent for Li+ recovery from seawater desalination retentate[J]. Chemical Engineering Journal, 2014, 254: 73-81.DOI:10.1016/j.cej.2014.05.095. |
| [62] | Yu Q Q, Sasaki K, Hirajima T. Bio-templated synthesis of lithium manganese oxide microtubes and their application in Li+ recovery[J]. Journal of Hazardous Materials, 2013, 262: 38-47.DOI:10.1016/j.jhazmat.2013.08.027. |
| [63] | Xiao G P, Tong K F, Zhou L S, et al. Adsorption and desorption behavior of lithium ion in spherical PVC-MnO2 ion sieve[J]. Industrial & Engineering Chemistry Research, 2012, 51(33): 10921-10929. |
| [64] | Ma W, Wang Q, Wang R, et al. Development of synthetic solid inorganic material as adsorbents of Li and K from the enrichment brine[J]. Desalination and Water Treatment, 2012, 44(1-3): 1-6.DOI:10.1080/19443994.2012.691685. |
| [65] | Wang L, Meng C G, Han M, et al. Lithium uptake in fixed-pH solution by ion sieves[J]. Journal of Colloid and Interface Science, 2008, 325(1): 31-40.DOI:10.1016/j.jcis.2008.05.005. |
| [66] | Wang L, Ma W, Han M, et al. Soft chemical synthesis and adsorption properties of MnO2×0.5H2O, a high performance ion sieve for lithium[J]. Acta Chim Sinica, 2007, 65(12): 1135-1139. |
| [67] | Wang L, Ma W, Liu R, et al. Correlation between Li+ adsorption capacity and the preparation conditions of spinel lithium manganese precursor[J]. Solid State Ionics, 2006, 177(17-18): 1421-1428.DOI:10.1016/j.ssi.2006.07.019. |
| [68] | Chung K S, Lee J C, Kim E J, et al. Recovery of lithium from seawater using nano-manganese oxide adsorbents prepared by gel process[J]. Designing, Processing and Properties of Advanced Engineering Materials, Pts 1 And 2, 2004, 449(4): 277-280. |
| [69] | Koyanaka H, Matsubaya O, Koyanaka Y, et al. Quantitative correlation between Li absorption and H content in manganese oxide spinel lambda-MnO2[J]. Journal of Electroanalytical Chemistry, 2003, 559: 77-81.DOI:10.1016/S0022-0728(03)00040-8. |
| [70] | Quist-Jensen C A, Macedonio F, Drioli E. Integrated membrane desalination systems with membrane crystallization units for resource recovery: a new approach for mining from the sea[J]. Crystals, 2016, 6(4). |
| [71] | Quist-Jensen C A, Macedonio F, Drioli E. Membrane crystallization for salts recovery from brine -an experimental and theoretical analysis[J]. Desalination and Water Treatment, 2016, 57(16): 7593-7603.DOI:10.1080/19443994.2015.1030110. |
| [72] | Quist-Jensen C A, Ali A, Mondal S, et al. A study of membrane distillation and crystallization for lithium recovery from high-concentrated aqueous solutions[J]. Journal of Membrane Science, 2016, 505: 167-173.DOI:10.1016/j.memsci.2016.01.033. |
| [73] | Tang D H, Zhou D L, Zhou J B, et al. Preparation of H2TiO3-lithium adsorbent using low-grade titanium slag[J]. Hydrometallurg, 2015, 157: 90-96.DOI:10.1016/j.hydromet.2015.07.009. |
| [74] | Somrani A, Hamzaoui A H, Pontie M. Study on lithium separation from salt lake brines by nanofiltration (NF) and low pressure reverse osmosis (LPRO)[J]. Desalination, 2013, 317: 184-192.DOI:10.1016/j.desal.2013.03.009. |





