2. 广东省能源集团珠海发电厂,广东 珠海 519000
2. Zhuhai Power Station of Guangdong Energy Group, Zhuhai 519000, China
选择性催化还原法(SCR)是目前全球最为广泛应用的一种烟气脱硝技术,其中SCR催化剂是脱硝技术的核心[1-3]。由于化学中毒、微孔或内部流道堵塞等原因,SCR催化剂活性会逐步降低直至失活[4-7],预计至2020年,废脱硝催化剂年产量将达(20~25)×104 m3[8]。鉴于此,2014年8月,环保部发布了《关于加强废烟气脱硝催化剂监管工作的通知》,将废烟气脱硝催化剂(钒钛系)纳入危险废物进行管理,归类为“HW49其他废物”。随后,环保部又发布《废烟气脱硝催化剂危险废物经营许可证审查指南》,指出:“对于因破碎等原因而不可再生的废烟气脱硝催化剂,应尽可能回收其中的钒、钨和钛等金属资源进行再利用以避免污染环境”。因此,开展废脱硝催化剂中钒、钨和钛等的提取再利用研究具有重要的经济和社会意义。
目前,浸出是废脱硝催化剂回收利用的关键步骤[9],浸出液中钒、钨等离子需要进一步分离、纯化及回收,钒、钨等离子分离纯化方法主要包括化学沉淀法[10-11]、溶剂萃取法[12-13]、离子交换法[14-15]及吸附法[16-17]等。如MAZUREK等[11]以尿素为浸出剂,回收废脱硝催化剂中的V、K和Fe,并采用NH4Cl为沉淀剂回收浸出液中的VO3-,在最佳条件下,V的回收率达78%。THI HONG NGUYEN等[12]将少量MoO42-加入VO3-和WO42-的混合溶液中,考察LIX 63萃取剂对V的萃取效果。结果表明,当溶液pH = 8时,LIX 63对VO3-萃取率可达100%,再采用Aliquat 336+TBP组合萃取剂分离溶液中剩余的MoO42-和WO42-,当溶液pH=7.7时,可以实现WO42-和MoO42-分离,分离因子达403。采用沉淀法与萃取法可以实现对钒、钨金属离子的分离,但以上2种工艺适用pH范围窄,特别是针对废脱硝催化剂的强碱性浸出液,需要消耗大量酸以调节浸出液pH值,产生大量高盐废水,为工艺后续处理带来困难。相对而言,离子交换法适用pH范围宽,可在强碱性条件下实现钒、钨和钼等金属离子的高效分离,从而避免了不必要的酸碱中和,表现出良好的应用前景。如HUO等[18]采用多羟基螯合树脂D403直接分离碱液中的WO42-和MoO42-,发现D403对WO42-的吸附优于MoO42-,单柱实验表明,WO42-的去除率为93.35%~97.56%,同时WO42-还可以从D403树脂上高效洗脱。THI HONG NGUYEN等[19]采用季铵基TEVA树脂对酸液中微量的WO42-与MoO42-进行分离,结果表明TEVA对钨、钼离子具有高选择吸附性,在酸液中可优先吸附钨离子,吸附在TEVA树脂上的钨离子可通过NaOH和H2SO4溶液洗脱。ZHANG等[20]在含有WO42-与MoO42-的中性模拟液内,采用弱碱性D301树脂对这2种金属离子进行吸附分离,发现D301树脂可优先吸附钨离子,对钨、钼离子起到良好的分离效果。综上可知,在不同pH条件下,通过离子交换法可实现钨、钼离子的有效分离,但目前报道主要集中在模拟液体系中钨、钼离子的离子交换分离,还没有针对废脱硝催化剂实际碱浸液中钒、钨离子吸附分离的研究,而实际浸出液体系的钒、钨高效分离对于废脱硝催化剂钒、钨提取再利用是至关重要的一项分离过程。
因此,本文以废脱硝催化剂的碱浸液为研究对象,考察了D201树脂对碱浸液中钒、钨离子的吸附分离性能,包括吸附相平衡、吸附穿透曲线及解吸性能,为废脱硝催化剂碱浸液中钒、钨离子的高效提取及分离工艺提供了有益参考。
2 实验材料和方法 2.1 实验原料、试剂实验原料:废脱硝催化剂的NaOH碱性浸出液(实验室自制,pH = 12.8),其VO3-和WO42-离子浓度分别为47.39 mg·L-1和1.837 g·L-1;偏钒酸钠(上海阿拉丁生化科技股份有限公司,AR,99.0%);解析剂:NH4Cl+NH3·H2O混合溶液(实验室自制);D201树脂(大孔型强碱性树脂)、201*7树脂(凝胶型强碱性树脂)、IRA900Cl(大孔型强碱性树脂),上海劲凯有限公司。
实验试剂:NH4Cl (AR,天津市大茂化学试剂厂);氨水(AR,广州化学试剂厂);浓盐酸(AR,37.5%,广州化学试剂厂);NaCl (AR,广东光华科技股份有限公司);NaOH (AR,广州化学试剂厂);去离子水(实验室自制)。
2.2 实验仪器Φ20 mm×40 cm离子交换柱、分液漏斗、紫外可见分光光度计(岛津,UV-2450)、恒温培养摇床(上海一恒科学仪器)。
2.3 实验方法 2.3.1 树脂预处理树脂预处理:量取一定量树脂用饱和NaCl溶液浸泡3 h后过滤,再用5%盐酸浸泡12 h,过滤后用去离子水洗涤至中性,然后用5% NaOH溶液浸泡12 h,过滤后用去离子水洗涤至中性,最后用饱和NaCl溶液浸泡待用。
2.3.2 吸附实验吸附动力学实验:在500 mL碱性浸出液中,加入3 mL D201离子树脂,25 ℃恒温振荡,每隔一段时间取样分析浸出液中钒、钨离子浓度,直至吸附平衡,并计算不同时间点下钒、钨离子在D201树脂上的吸附量。
吸附等温线测定实验:在25 ℃下取1 000 mL碱性浸出液,加入2.5 mL离子树脂,测定不同初始浓度下达到吸附平衡后浸出液中钒、钨离子的平衡浓度。吸附量Q(mg·g-1)按式(1)计算:
| $ Q = V({C_0} - C)/M $ | (1) |
式中:C0为浸出液中钒或钨离子的初始浓度(mg·L-1),C为浸出液中钒或钨离子的平衡浓度(mg·L-1),V为浸出液体积(L),M为湿树脂对应的干树脂的质量(g)。
2.3.3 动态吸附与解吸实验吸附穿透曲线测定实验:将一定量预处理D201湿树脂装入离子交换柱中,常温下,使浸出液流过离子交换柱,定体积收集流出液,测定流出液中钒、钨离子的浓度,待钒、钨离子在离子树脂吸附柱上吸附饱和后,平衡吸附量Qe(mg·g-1)可用式(2)计算得出:
| $ {Q_{\rm{e}}} = \frac{{{C_0}}}{M}\left[ {1 \times {V_{\rm{b}}} - \int\limits_{{V_{\rm{a}}}}^{{V_{\rm{b}}}} {\frac{{C(V)}}{{{C_0}}}} {\rm{d}}V} \right] $ | (2) |
式中:Va为穿透点的出口溶液体积(L),Vb为吸附饱和点的出口溶液体积(L),C(V)为Va~Vb任一体积对应出口溶液中钒或钨离子的浓度(mg·L-1)。
钒、钨离子的分离系数β可用式(3)表示:
| $ \beta = {D_{\rm{V}}}/{D_{\rm{W}}} $ | (3) |
式中:Dv与Dw分别为吸附平衡后钒、钨离子在液固相中的分配比,其中,分配比D的计算式如下:
| $ D = {V_{\rm{b}}} \times {C_0}/W - 1 $ | (4) |
式中:W为钒或钨离子在离子交换树脂上的吸附总量(g)。
动态解吸过程:以2.5 mol·L-1 NH4Cl+1.0 mol·L-1 NH3·H2O作为解吸剂,解吸剂流经装填有已吸附饱和的D201树脂的离子交换柱,柱底收集解吸液,并取样分析其中的钨离子浓度,用式(5)计算解析率De:
| $ {D_{\rm{e}}} = [({V_{\rm{D}}} \cdot {C_{\rm{D}}})/(M \cdot {Q_{\rm{e}}})] \times 100\% $ | (5) |
式中:VD为解吸完全后所通过离子交换柱的解吸剂体积(L),CD为解吸剂中钨离子的浓度(mg·L-1)。
2.4 分析方法钒的测定:根据标准YB/T5328-2006(高锰酸钾—硫酸亚铁铵滴定法测定五氧化二钒量),采用高锰酸钾—硫酸亚铁铵滴定法测定浸出液中VO3-浓度(滴定误差:± 0.4%)。
钨的测定:根据标准GB/T 14352.1-2010(钨矿石、钼矿石化学分析方法第一部分:钨量测定),采用硫腈酸钾—三氯化钛分光光度法测定溶液中WO42-的含量,WO42-与硫氰化钾显色,在400 nm波长处检测吸光度,并计算WO42-的浓度。
3 实验结果与讨论 3.1 不同树脂对钒、钨离子的吸附性能表 1列出了3种树脂的结构参数及其在静态条件下对钒、钨离子的吸附性能,发现钒、钨离子在3种树脂上的吸附量存在差异,大孔型D201和IRA900Cl树脂对钒、钨离子的吸附量都高于凝胶型201*7树脂,这是因为大孔型D201和IRA900Cl树脂的孔径与孔容大于凝胶型201*7树脂,利于钒、钨离子进行交换。同时,D201对钨离子的吸附量要高于IRA900Cl树脂,是由于D201树脂表面强碱性基团容量(季铵基官能团)的数量要高于IRA900Cl树脂的原因[21]。
|
|
表 1 3种树脂的结构参数及其对钒、钨离子的吸附性能 Table 1 Structure parameters of three resins and their adsorption performances for V, W ions |
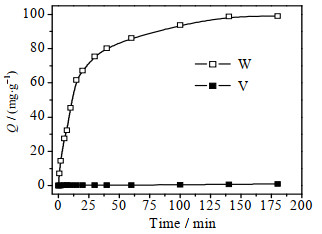
图 1为25 ℃下钒、钨离子在D201树脂上的吸附量随着吸附时间变化的关系曲线。由图可见,在前30 min内,D201树脂对钨离子的吸附量迅速增大,然后吸附动力学曲线趋缓,在140 min左右D201树脂对钨离子的吸附达到平衡,平衡吸附量为99.01 mg·g-1,而D201树脂对钒离子的吸附量仅为0.98 mg·g-1,D201树脂对钨离子的吸附量远远大于钒离子,表现出优异的钒、钨吸附选择性。其原因是:钒、钨离子在水溶液中以水合离子形式存在,水合离子的电势由其电荷量与半径的比值决定[22],而钒、钨水合离子的半径相似,故其电势主要由电荷量决定,钨离子(WO42-)的电荷量更大,因此电势更高,更易被D201树脂吸附。
|
图 1 25 ℃下吸附时间对D201树脂吸附钒、钨离子的影响 Fig.1 Effects of adsorption time on V and W ions adsorption on the D201 resin at 25 ℃ |
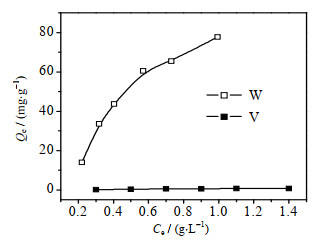
图 2为25 ℃下钒、钨离子在D201树脂上的吸附等温线。由图可见,随着平衡浓度增大,D201树脂对钨离子的吸附量不断上升,而其对钒离子几乎无吸附,吸附量不足1 mg·g-1。采用Langmuir和Freundlich等温吸附模型对钨离子在D201树脂上的吸附等温线进行拟合,模型对应方程如下:
|
图 2 25 ℃下D201树脂对钒、钨离子的吸附等温线 Fig.2 Adsorption isotherms of V and W ions on the D201 resin at 25 ℃ |
Langmuir模型:
| $ {C_{\rm{e}}}/{Q_{\rm{e}}} = {C_{\rm{e}}}/{Q_{\rm{m}}} + {K_{\rm{L}}}/{Q_{\rm{m}}} $ | (6) |
Freundlich模型:
| $ \log {Q_{\rm{e}}} = \log {K_{\rm{F}}} + (1/n) \cdot \log {C_{\rm{e}}} $ | (7) |
式中:KL为Langmuir特征常数(g·L-1);KF和n为Freundlich特征常数(mg·g-1;n无量纲);Qm为理论最大吸附量(mg·g-1);Ce为吸咐液中钒、钨离子的平衡浓度(g·L-1)。
表 2列出了Langmuir与Freundlich 2种模型对吸附等温线的拟合结果,对应的线性相关系数分别为0.955与0.974,D201树脂对钨离子的吸附等温线更符合Freundlich模型,且n (1.46) > 1,表明D201树脂对钨的吸附过程属于优惠吸附。此外,KF值的大小代表着吸附剂与吸附质之间的亲和力强弱[23],KF值为81.02,表明D201树脂对钨离子具有较强的吸附作用。
|
|
表 2 Langmuir和Freundlich模型对钨离子在D201树脂上的吸附等温线的拟合结果 Table 2 Adsorption isotherm fitting results of W ions on the D201 resin by Langmuir and Freundlich models |
基于图 1吸附动力学数据,分别采用拟一级和拟二级动力学模型对钨离子在D201树脂上的吸附动力学曲线进行拟合,拟合方程如下:
拟一级吸附动力学模型:
| $ \ln \;({Q_{\rm{e}}} - {Q_{\rm{t}}}) = \ln {q_{\rm{e}}} - {k_1} \cdot t $ | (8) |
拟二级吸附动力学模型:
| $ t/{Q_{\rm{t}}} = 1/({k_2} \cdot {q_{\rm{e}}}^2) + t/{q_{\rm{e}}} $ | (9) |
式中:k1为拟一级吸附速率常数(min-1);k2为拟二级吸附速率常数(g·mg-1·min-1);qe为理论平衡吸附量(mg·g-1);Qt为t时刻的吸附量(mg·g-1)。
拟合结果列于表 3,由表可知,在25 ℃、钨离子初始浓度为1.13 g·L-1条件下,拟一级和拟二级动力学模型对应的线性相关系数分别为0.945与0.974,拟二级动力学模型拟合计算得到的钨离子理论平衡吸附量为99.40 mg·g-1,与实际平衡吸附量(99.01 mg·g-1)更接近。因此,钨离子在D201树脂上的吸附动力学更符合拟二级动力学模型。
|
|
表 3 吸附动力学模型对钨离子在D201树脂上的吸附动力学曲线的拟合结果 Table 3 Adsorption kinetics fitting results of W ions on the D201 resin by kinetics models |
金属离子在离子交换树脂内的微观扩散过程呈现为树脂表面液膜扩散和树脂颗粒内扩散两种方式,速率最慢的扩散方式将决定吸附过程的速率[24]。基于图 1,分别采用液膜扩散模型与颗粒内扩散模型对钨离子的吸附动力学曲线进行拟合,拟合方程如下:
液膜扩散模型:
| $ - \ln \;({Q_{\rm{e}}} - {Q_{\rm{t}}}) = {K_1} \cdot t $ | (10) |
颗粒内扩散模型:
| $ 3 - 3{(1 - {Q_{\rm{e}}}/{Q_{\rm{t}}})^{2/3}} - 2({Q_{\rm{t}}}/{Q_{\rm{e}}}) = {K_2} \cdot t $ | (11) |
式中:K1为液膜扩散系数;K2为颗粒内扩散系数。
由表 4可知,液膜扩散模型与颗粒内扩散膜对应的线性相关系数分别为0.951与0.966,因此,钨离子在D201树脂内的扩散方式以颗粒内扩散为主,扩散系数为0.01。
|
|
表 4 扩散模型对钨离子在D201树脂上的吸附动力学曲线的拟合结果 Table 4 Fitting results of the adsorption kinetics of W ions on the D201 resin by diffusion models |
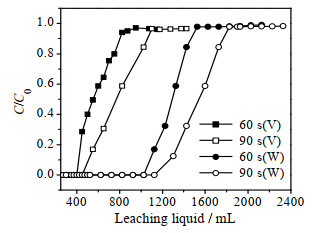
图 3为不同停留时间下钒、钨离子在D201树脂上的吸附穿透曲线。由图可知,当停留时间从60 s增至90 s,吸附穿透曲线穿透点均右移,说明钒、钨离子在D201树脂上的吸附容量都随着停留时间增加而增大。通过表 5给出的吸附穿透参数可知,当停留时间由60增大到90 s,钒、钨离子在D201树脂上的平衡吸附量由100.9、1.189 mg·g-1增大到101.7、1.192 mg·g-1。钨离子平衡吸附量远高于钒离子,表明动态吸附过程中,在高碱性条件下D201树脂可以实现实际浸出液中钒、钨离子的高效分离。
|
图 3 25 ℃时不同停留时间下D201吸附钒、钨离子的穿透曲线 Fig.3 Breakthrough curves of V, W ions adsorption on D201 with different dwell time at 25 ℃ |
|
|
表 5 D201树脂对钒、钨离子的吸附穿透参数 Table 5 Adsorption breakthrough parameters of V and W ions on the D201 resin |
此外,研究还发现:随着停留时间增加,D201树脂对钒、钨离子吸附量均有增大,但钒/钨分离系数却有所下降。这是由于钒离子在D201树脂上的吸附容量基数小,随着停留时间的延长,吸附容量增幅较明显,而钨离子在D201树脂上的吸附容量基数大,其吸附容量增幅小,结合式(3),显然钒离子的液固相分配比DV的降幅高于钨离子液固相分配比DW的降幅,故90 s停留时间下的钒/钨分离系数(DV/DW)反而下降。
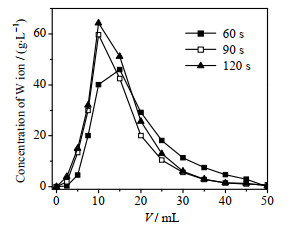
3.6 钨离子在D201树脂上的动态解吸采用2.5 mol·L-1 NH4Cl+1.0 mol·L-1 NH3·H2O混合液作为解吸液,考察钨离子在D201树脂上的解吸性能。图 4为不同解吸时间下钨离子在D201树脂上的解吸曲线,通过式(5)计算得到的钨离子解吸率列于表 6。显然,解吸时间越长,钨离子解吸效果越佳,因为延长解吸时间可使树脂内的钨离子与解吸液接触更充分,从而被有效洗脱。由表 6可知,当解吸时间为120 s时,钨离子的解吸率达到99.43%。因此,采用2.5 mol·L-1 NH4Cl+1.0 mol·L-1 NH3·H2O混合液作为解吸液,在合理的停留时间下,可实现钨离子在D201树脂上高效解吸再生。
|
图 4 25 ℃时不同解吸时间下钨离子的解吸曲线 Fig.4 Desorption curves for W ions under different desorption times at 25 ℃ |
|
|
表 6 不同解吸时间下钨离子在D201树脂上的解吸率 Table 6 Desorption rates of W ions on the D201 resin at different desorption times |
采用D201树脂对废脱硝催化剂碱浸液中的钒、钨离子进行了吸-脱附研究。在pH = 12.8条件下,D201树脂对碱浸液中钒、钨离子的饱和吸附量分别为0.98和99.01 mg·g-1,通过吸附相平衡差异可有效分离钒、钨离子;D201树脂对钨离子的吸附等温线符合Freundlich模型,吸附动力学曲线符合拟二级动力学模型,钨离子在D201树脂内的扩散方式以颗粒内扩散为主;钒、钨离子在D201树脂上吸附穿透过程的动态吸附量不易受停留时间影响,停留时间60 s时的钒/钨分离系数为97.6;D201树脂上的钨离子可通过NH4Cl+ NH3·H2O混合液解吸,延长解吸时间有利于提升钨离子的解吸率,最佳解吸率为99.43%。
| [1] |
DEKA U, LEZCANOGONZALEZ I, WECKHUYSEN B M, et al. Local environment and nature of cu active sites in zeolite-based catalysts for the selective catalytic reduction of nox[J]. Acs Catalysis, 2013, 3(3): 413-427. DOI:10.1021/cs300794s |
| [2] |
黄海凤, 金丽丽, 张宏华, 等. 高抗硫性的铜钒钛低温SCR脱硝催化剂的制备表征及催化活性[J]. 高校化学工程学报, 2013, 27(4): 721-728. HUANG H F, JIN L L, ZHANG H H, et al. Preparation and characterization of Cu-V/TiO2 catalysts with strong resistance to SO2 for low-temperature SCR of NOx[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(4): 721-728. |
| [3] |
张琛, 刘建华, 杨晓博, 等. 超声强化废SCR催化剂浸出V和W的研究[J]. 功能材料, 2015, 46(20): 20063-20067. ZHANG C, LIU J H, YANG X B, et al. Ultrasound assisted enhancement in vanadium and tungsten leaching from waste SCR catalyst[J]. Journal of Functional Materials, 2015, 46(20): 20063-20067. |
| [4] |
余岳溪, 廖永进, 李娟, 等. 废弃SCR脱硝催化剂无害化处理的研究进展[J]. 环境工程, 2016, 34(6): 136-139. YU Y X, LIAO Y J, LI J, et al. Research progress of harmless treatment of waste SCR denitration catalysts[J]. Environmental Engineering, 2016, 34(6): 136-139. |
| [5] |
史伟伟. SCR脱硝催化剂再生浸渍及其SO2氧化控制[D].广州: 华南理工大学, 2013. SHI W W. Impregnation regeneration and SO2 oxidation control of the scr denitration catalysts[D]. Guangzhou: South China University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1014153748.htm |
| [6] |
刘长东, 胡晨晖, 赵会民, 等.不可再生钒系SCR脱硝催化剂资源化利用研究进展[C]//2016火电厂污染物净化与节能技术研讨会, 合肥: 安徽人民出版社, 2016. LIU C D, HU C H, ZHAO H M, et al. Advances in utilization of nonrenewable scr denitrification catalysts[C]//2016 Seminar on Pollutant Purification and Energy Saving Technology For Thermal Power Plants, Hefei: Anhui Renmin Prees, 2016. |
| [7] |
段竞芳, 史伟伟, 夏启斌, 等. 失活钒钛基SCR催化剂性能表征及其再生[J]. 功能材料, 2012, 43(16): 2191-2195. DUAN J F, SHI W W, XIA Q B, et al. Characterization and regeneration of deactivated commercial SCR catalyst[J]. Journal of Functional Materials, 2012, 43(16): 2191-2195. |
| [8] |
孟维. 燃煤电厂失效脱硝催化剂的处理现状及前景[J]. 资源节约与环保, 2017, 37(10): 15-16. MENG W. Current situation and prospect of treatment of spent denitration catalysts in coal-fired power plants[J]. Resources Economization & Environmental Protection, 2017, 37(10): 15-16. |
| [9] |
ZHAO Z P, GUO M, ZHANG M. Extraction of molybdenum and vanadium from the spent diesel exhaust catalyst by ammonia leaching method[J]. Journal of Hazardous Materials, 2015, 286: 402-409. DOI:10.1016/j.jhazmat.2014.12.063 |
| [10] |
LUO L, LIU K J, SHIBAYAMA A, et al. Recovery of tungsten and vanadium from tungsten alloy scrap[J]. Hydrometallurgy, 2004, 72(1): 1-8. |
| [11] |
MAZUREK K, BIAŁOWICZ K, TRYPUĆ M. Recovery of vanadium, potassium and iron from a spent catalyst using urea solution[J]. Hydrometallurgy, 2010, 103(1): 19-24. |
| [12] |
THI HONG NGUYEN, LEE M S. Separation of vanadium and tungsten from sodium molybdate solution by solvent extraction[J]. Industrial & Engineering Chemistry Research, 2014, 53(20): 8608-8614. |
| [13] |
NING P G, CAO H B, ZHANG L. Selective extraction and deep removal of tungsten from sodium molybdate solution by primary amine N1923[J]. Separation & Purification Technology, 2010, 70(1): 27-33. |
| [14] |
HU J, WANG XW, XIAO LS, et al. Removal of vanadium from molybdate solution by ion exchange[J]. Hydrometallurgy, 2009, 95(3): 203-206. |
| [15] |
LI Q G, ZENG L, XIAO L S, et al. Completely removing vanadium from ammonium molybdate solution using chelating ion exchange resins[J]. Hydrometallurgy, 2009, 98(3): 287-290. |
| [16] |
ZHANG J, DENG Y, ZHOU Q, et al. Novel geochemistry-inspired method for the deep removal of vanadium from molybdate solution[J]. Journal of Hazardous Materials, 2017, 331: 210-217. DOI:10.1016/j.jhazmat.2017.02.051 |
| [17] |
夏启斌, 杨晓博, 吴凡, 等.一种高效提取废SCR脱硝催化剂中钒钨的方法: CN, 106636646 A[P]. 2017-05-10. XIA Q B, YANG X B, WU F, et al. Efficient extraction scr spent vanadium tungsten catalyst denitration: CN, 106636646 A[P]. 2017-05-10. |
| [18] |
HUO G S, PENG C, SONG Q, et al. Tungsten removal from molybdate solutions using ion exchange[J]. Hydrometallurgy, 2014, 147/148(8): 217-222. |
| [19] |
THI HONG NGUYEN, LEE M S. Separation of molybdenum (Ⅵ) and tungsten (Ⅵ) from sulfuric acid solution by ion exchange with TEVA resin[J]. Separation Science and Technology, 2015, 50(13): 2060-2065. |
| [20] |
ZHANG J L, LIU X H, CHEN X Y, et al. Separation of tungsten and molybdenum using macroporous resin:Competitive adsorption kinetics in binary system[J]. Hydrometallurgy, 2014, 144/145(4): 77-85. |
| [21] |
王方. 现代离子交换与吸附技术[M]. 北京: 清华大学出版社, 2015. WANG F. Modern ion exchange and adsorption techniques[M]. Beijing: Tsinghua University Presss, 2015. |
| [22] |
马莱骏. 离子交换在湿法冶金中的应用[M]. 北京: 冶金工业出版社, 1991. MA L J. Application of ion exchange in hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991. |
| [23] |
何秋香, 陈祖亮. 柚子皮制备生物炭吸附苯酚的特性和动力学[J]. 环境工程学报, 2014, 8(9): 3853-3859. HE Q X, CHEN Z L. Characterization and kinetics of biochar prepared from pomelo peel for adsorption of phenol[J]. Chinese Journal of Environmental Engineering, 2014, 8(9): 3853-3859. |
| [24] |
STROBL G R. Microscopic dynamical models[M]. Berlin, Heidelberg: Springer Press, 1997.
|




