2. 新疆大学 化学化工学院,煤炭清洁转化与化工过程自治区重点实验室,新疆 乌鲁木齐 830046
2. Key Laboratory of Coal Cleaning Conversion and Chemical Engineering Process, Xinjiang Uyghur Autonomous Region, College of Chemistry and Chemical Engineering, Xinjiang University, Urumqi 830046, China
离子液体(ILs)作为一种新型溶剂,其在室温或接近室温下呈现液体状态,是一种完全由阴阳离子组成的熔融盐[1]。作为一类非分子性质新型溶剂[2],ILs与传统分子型溶剂相比具有更多独特优点,如熔点低、热容大、导电性强、液态范围宽、溶解能力强、几乎没有蒸气压、较好的热及化学稳定性、绿色可循环等[3~6]。ILs的结构具有可设计性,因而可以根据具体应用要求,对阴阳离子结构或种类进行修饰或改变,从而改变其物理化学性质以达到所需性质[7]。然而,由于ILs相关物理化学参数较难获得,加上其生产成本较高,使其在真正进入工业应用阶段时,受到一定程度限制。
溶解度参数作为一种重要的物理化学参数,能够在溶剂选择、预测材料相容性等方面提供重要的参考作用。传统上,可以采用滴定法[8],黏度法[9],溶胀法[10]等来获得材料溶解度参数,但这些方法费时耗力且存在较大误差。自IGC技术测定材料热力学性质方法建立以来[11],该技术已成功用于聚合物、氧化物、木质素、ILs等材料的热力学参数测定[12~15]。此外,Charles M. Hansen提出由分散力(δd)、极性力(δp)和氢键力(δh)三种类型构成Hansen溶解度参数(HSP)的新概念,并开发出Hansen三维溶解度参数软件(HSPiP)。该软件依据溶剂对材料的溶解效果,标出每种溶剂在三维坐标中的相对位置,根据公式
本文分别采用IGC和HSPiP法测定了四种三氟甲磺酸盐咪唑基离子液体的溶解度参数,并对两种方法在测定ILs在溶解度参数方面的特点进行了比较。通过对ILs的溶解度参数测定,探索ILs在不同种类探针分子中的溶解规律,为ILs相关热力学研究及应用提供参考。
2 实验部分 2.1 实验试剂实验所用1-乙基-3-甲基咪唑三氟甲磺酸盐(EMIMOTF)、1-丁基-3-甲基咪唑三氟甲磺酸盐(BMIMOTF)、1-己基-3-甲基咪唑三氟甲磺酸盐(HMIMOTF)、1-辛基-3-甲基咪唑三氟甲磺酸盐(OMIMOTF)四种ILs均购于上海成捷化学有限公司,纯度均≥99.0%。上试202硅烷化担体(色谱用),颗粒度80~100目(90%)(中国上海试剂一厂)。探针分子,包括正戊烷(n-C5)、正己烷(n-C6)、正庚烷(n-C7)、正辛烷(n-C8)、正壬烷(n-C9)、正癸烷(n-C10)、正十一烷(n-C11)、正十二烷(n-C12)、苯、甲苯、乙苯、丙苯、甲醇、乙醇、丙醇、丁醇、三氯甲烷(CHCl3)、四氯化碳(CCl4)等购买于天津市百世化工有限公司,均为分析纯。
2.2 仪器及测试方法 2.2.1 IGC法测定咪唑基ILs的溶解度参数实验采用的气相色谱仪为日本岛津QP-2010,并配有热导池检测器。载气为高纯氮气(99.999%),流速为20 mL×min-1,使用皂膜流量计对载气流速进行标定。气化室温度及检测器温度均为523 K。采用浸湿法分别将四种ILs涂布在担体上,经实验确定适合涂布量为10%,采用抽吸法分别将上述涂布ILs的担体装入长度1200 mm内径为1 mm的不锈钢柱内,各色谱柱使用前在393 K下通载气老化处理8 h,采用空气作为死时间标定。测试温度分别为333.15、343.15、353.15、363.15和373.15 K,进样量为0.2 mL,重复进样3次测定保留时间,取平均值用于计算。
2.2.2 HSPiP法测定咪唑基ILs的溶解度参数HSP需经过溶解实验测定,在每只具塞试管中取2 mL ILs,之后,于每只具塞试管中加入不同的有机溶剂5 mL,置于60℃水浴中1 h,观察溶解情况,全部溶解的则记为“1”,未溶解的及部分溶解的记为“0”,用Hansen团队开发的软件HSPiP绘制“Hansen三维溶剂球”,使所有溶剂和ILs的HSP均分布在球中,球中心位置即为模拟计算所得的ILs的最优HSP。
3 结果与讨论 3.1 IGC技术测定ILs的溶解度参数ILs溶解度参数[17]可以根据探针分子在色谱柱中的保留时间来计算。比保留体积Vg0,用来表征探针溶剂的洗脱行为,在IGC中有如下的公式成立[18, 19]:
| $ V_\text{g}^0 = \frac{{273.15}}{{m{T_\text{a}}}}F\frac{{{P_0}-{P_w}}}{{{P_0}}}({t_\text{r}}-{t_0})\frac{3}{2}\frac{{{{({P_\text{i}}/{P_0})}^2}-1}}{{{{({P_\text{i}}/{P_0})}^3} - 1}} $ | (1) |
式中tr为探针溶剂的保留时间;t0为死时间;tr-t0为净保留时间;Pw表示室温下水的饱和蒸汽压;F为载气流速;Ta为室温;m为固定相中煤的质量;Pi和P0分别代表色谱柱进口与出口的压力。
根据Flory–Huggin理论,无限稀释状态下溶剂1在固定相2中的相互作用参数
| $ \chi _{12}^\infty = \ln (273.15R{V_2}/P_1^0V_\text{g}^0{V_1})-1-P_1^0({B_{11}}-{V_1})/RT $ | (2) |
式中R为气体常数;T为柱温;V2为色谱固定相中待测物的比体积;V1为探针溶剂的摩尔体积;Vg0是溶剂比保留体积;P10为探针溶剂的饱和蒸汽压,可通过公式logP10=A-B/(t+C)计算所得,其中t是柱温,A、B、C均为常数;V1为探针溶剂的摩尔体积;B11是探针溶剂的第二维利系数,可通过公式B11/Vc=0.430-0.886(Tc/T) -0.694(Tc/T)2-0.0375(n-1)(Tc/T)4.5计算得到,其中Vc和Tc是溶剂的临界摩尔体积和临界温度,n是溶剂的有效碳原子数。
溶解度参数是物质内聚能密度的平方根,是物质固有性质。探针溶剂溶解度参数δ1可通过公式(3)计算[22, 23]:
| $ {\delta _1} = {(\frac{{\Delta {E_\text{V}}}}{{{V_1}}})^{0.5}} = {(\frac{{\Delta {H_\text{V}}-RT}}{{{V_1}}})^{0.5}} = {(CED)^{0.5}} $ | (3) |
式中CED是内聚能密度;△Hv是溶剂蒸发焓;△Ev是内聚能。
ILs的溶解度参数δ2可通过公式(4)计算[24, 25]:
| $ (\frac{{\delta _1^2}}{{RT}}-\frac{{\chi _{12}^\infty }}{{{V_1}}}) = (\frac{{2{\delta _2}}}{{RT}}){\delta _1}-\frac{{\delta _2^2}}{{RT}} $ | (4) |
式(4)中探针溶剂溶解度参数δ1可从物理化学手册[26]中查询得到,根据公式(4),左侧[δ12/(RT)-χ12∞/V1]对δ1作图可得到一条直线,从斜率2δ2/(RT)或截距δ22/(RT)可计算出ILs的溶解度参数δ2。
ILs与探针分子间的
| 表 1 不同温度ILs与探针溶剂的相互作用参数 Table 1 Interaction parameters between probes and ILs at various temperatures |
通过表 1可以看出,测定时的温度对χ12值存在一定影响[27]。对于OTF基的ILs,随温度的升高,探针溶剂的χ12值递减,说明随着温度的升高,探针分子与OTF基的ILs之间的相互作用强度升高。烷烃为4种ILs共同的不良溶剂,其他探针溶剂对OTF基的ILs表现出较好的相容性。由表 1可知,相同温度下,不同溶剂对OTF基的ILs溶解能力的趋势为:醇类 > 芳香类 > 直链烷烃类溶剂。
根据式(4)左侧[δ12/(RT)-χ12∞/V1]对δ1作图可得到一条直线,由直线的斜率,可以计算出离子液体的溶解度参数。图 1为温度在333 K时四种OTF基的ILs的δ12/(RT)-χ12∞/V1对δ1作图。
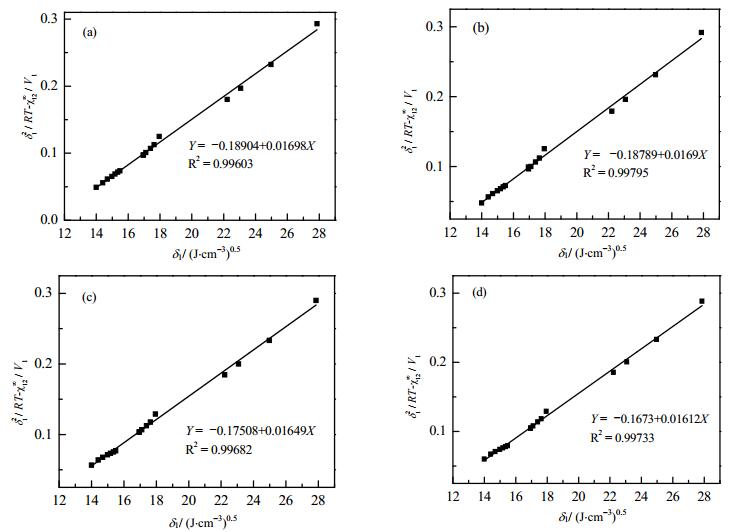
|
图 1 温度为333 K时δ12/(RT)-χ12∞ /V1对δ1作图 Fig.1 Relationship between δ1 and δ12/(RT)-χ12∞/V1 at 333 K (a) EMIMOTF (b)BMIMOTF (c) HMIMOTF (d) OMIMOTF |
表 2为不同温度时δ12/(RT)-χ12∞/V1对δ1作图所得斜率,以及所计算出的四种离子液体的溶解度参数。
| 表 2 离子液体的溶解度参数以及斜率 Table 2 Solubility parameters of ILs and slopes of fitting results |
由表 2可以看出,ILs的溶解度参数随着温度的升高而降低,这是因为摩尔蒸发焓随着温度的升高而降低,摩尔体积随着温度的升高而升高[28]。并且,随着ILs的阳离子的摩尔质量增大,溶解度参数减小。
3.2 HSPiP法模拟计算ILs的溶解度参数ILs总溶解度参数由三维溶解度参数共同确定[28],具体见式(5)
| $ \delta _\text{t}^2 = \delta _\text{d}^2 + \delta _\text{p}^2 + \delta _\text{h}^2 $ | (5) |
式中δt为ILs总溶解度参数,δd、δp、δh分别为色散力分量、极性力分量和氢键力分量。
相对能量差(RED)用来确定ILs和所选有机溶剂的可混溶性,由式(6)计算得到[29]
| $ {\rm{RED = }}{R_{\rm{a}}}/{R_0} $ | (6) |
式中,R0是使用HSPiP模拟优化出的三维溶解度球的半径,Ra为溶剂与ILs在三维空间中的距离,由式(7)计算得出[30]
| $ {R_\text{a}} = {\left[{4{{\left( {\delta _\text{d}^1-\delta _\text{d}^2} \right)}^2} + {{\left( {\delta _\text{p}^1-\delta _\text{p}^2} \right)}^2} + {{\left( {\delta _\text{h}^1-\delta _\text{h}^2} \right)}^2}} \right]^{1/2}} $ | (7) |
式中,δi1和δi2分别代表溶剂和ILs对应的三维溶解度参数。
溶剂在三维空间的对应位置可以根据其HSP确定[30]。RED数值能够反映溶剂与ILs之间溶解情况,若RED = 0,说明溶剂和ILs之间没有能量差,则ILs能够完全溶解于溶剂;若RED < 1,溶剂则为ILs的良溶剂,并且RED越小,溶解效果越好;若RED > 1,说明溶剂成为ILs的不良溶剂;若RED=1,即溶剂处于溶度参数球体的边界,属于边界溶剂,也是确定ILs所属HSP的关键溶剂。
将溶剂对ILs的溶解情况数据输入HSPiP软件,使用HSPiP软件进行模拟计算,能够得到不同ILs的HSP。溶解实验使用的溶剂越多,则模拟出的HSP越准确。以EMIMOTF为例,采用45种溶剂对溶解,得到其三维溶解度球如图 2所示。
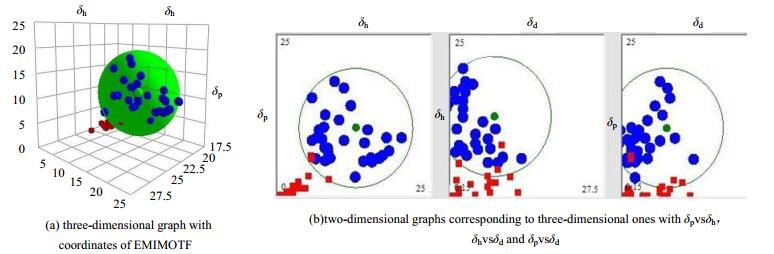
|
图 2 EMIMOTF的HSP图 Fig.2 HSP graphs of EMIMOTF |
在图 2(a)中,体积较大的实心球体为EMIMOTF的三维溶度参数球;较小的蓝色实心球体代表良溶剂,位于EMIMOTF三维溶度参数球内;较小的红色实心球体代表不良溶剂,位于EMIMOTF三维溶度参数球外;图 2(b)是与EMIMOTF三维溶度参数球对应的Hansen二维溶度参数图,结合计算机软件可以判断出何种溶剂为良溶剂或不良溶剂。对剩余三种ILs分别进行溶解实验,所得数据使用Hansen软件模拟。所得四种ILs的HSP值见表 3,可以看出,随着ILs咪唑阳离子的碳链增长,δt降低。可以根据该规律对ILs进行性质微调,使其满足具体应用要求。
| 表 3 Hansen软件模拟计算四种ILs的HSP值 Table 3 Three-dimensional solubility parameters of four ILs |
表 4是通过查阅文献得到的几种ILs的溶解度参数,通过与本文数据的对比可以看出本文数据与文献数据规律性相同,并且文献中BMIMOTF的数据与本实验数据接近,考虑到温度的影响,本实验数值与文献数值的差距会随实验温度的接近而接近,说明本实验数据具有较高的准确性。
| 表 4 几种不同离子液体的溶解度参数对比 Table 4 Comparison of solubility parameters of ionic liquids in literature |
由HSPiP软件对ILs溶解实验处理的结果与IGC计算得到的结果对比发现,两种方法得到的δt一致,说明了这两种方法测定ILs的HSP的适用性。在选择溶剂溶解或溶胀材料,或选择材料之间相容性,以及选择材料与其它基体(如生物大分子)生物相容性时,往往只考虑一维溶解度参数[31]。每种物质都有一套三维的溶解度参数值,只有两种物质的三维溶解度参数都相近时,才能获得两种物质的最佳相容性[32]。在一维溶解度参数无法解释的某些例外情况下,HSP能够进一步对实际情况进行解释。因此,使用IGC测定一维溶解度参数与HSPiP模拟HSP均具有实际应用价值。
4 结论分别利用IGC和HSPiP方法测定四种咪唑基离子液体的溶解度参数,在333.15K时,采用IGC测得的四种咪唑基离子液体的溶解度参数分别为δt(EMIMOTF)=23.51 (J·cm-3)1/2,δt(BMIMOTF)=23.39 (J·cm-3)1/2,δt(HMIMOTF)=22.79 (J·cm-3)1/2,δt(OMIMOTF)=22.31 (J·cm-3)1/2;333.15 K时,使用HSPiP得出的四种咪唑基离子液体的溶解度参数分别为δt(EMIMOTF)=24.28 (J·cm-3)1/2,δt(BMIMOTF)=23.26 (J·cm-3)1/2,δt(HMIMOTF)=22.79 (J·cm-3)1/2,δt(OMIMOTF)=22.08 (J·cm-3)1/2,IGC与HSPiP得出的溶解度参数值一致。
HSPiP可直接观察到被测物与溶剂的溶解情况,该技术方便快捷有很强的实用性。IGC方法可以同时得到不同温度下的多种热力学数据,数据准确然而耗时间稍长。两种方法所得目标ILs的溶解度参数的数值一致。在具体研究过程中,如果能将两种方法综合运用,可以更加准确方便的为ILs相关研究及应用提供参考。
| [1] | Gogoi G, Hazarika S. Coupling of ionic liquid treatment and membrane filtration for recovery of lignin from lignocellulosic biomass[J]. Separation and Purification Technology , 2017, 173: 113-120. DOI:10.1016/j.seppur.2016.09.019. |
| [2] | Li X P, Wang Q, Li L, et al. Determination of the thermodynamic parameters of ionic liquid 1-hexyl-3-methylimidazolium chloride by inverse gas chromatography[J]. Journal of Molecular Liquids , 2014, 200: 139-144. DOI:10.1016/j.molliq.2014.10.015. |
| [3] | Schmarr H G, Slabizki P, Muntnich S, et al. Ionic liquids as novel stationary phases in gas liquid chromatography:Inverse or normal isotope effect[J]. Journal of Chromatography A , 2012, 1270: 310-317. DOI:10.1016/j.chroma.2012.11.010. |
| [4] | Deng L S, Wang Q, Chen Y L, et al. Determination of the solubility parameter of ionic liquid 1-octyl-3-methylimidazolium hexafluorophosphate by inverse gas chromatography[J]. Journal of Molecular Liquids , 2013, 187(1-2): 246-251. |
| [5] | Abro R, Gao S, Chen X, et al. Oxidative desulfurization of gasoline by ionic liquids voupled with rxtraction by organic solvents[J]. Journal of the Brazilian Chemical Society , 2016, 27(6): 998-1006. |
| [6] | Qu G F, He W W, Cai Y Y, et al. Catalytic pyrolysis of cellulose in ionic liquid[bmim]OTf[J]. Carbohydrate Polymers , 2016, 148: 390-396. DOI:10.1016/j.carbpol.2016.04.052. |
| [7] | Heydar K T, Nazifi M, Sharifi A, et al. Determination of activity coefficients at infinite dilution of solutes in new dicationic ionic liquids based on morpholine using gas-liquid chromatography[J]. Chromatographia , 2013, 76(3-4): 165-175. DOI:10.1007/s10337-012-2385-3. |
| [8] | Lin X H, Jiang G C, Wang Y G. Hansen solubility parameters of coal tar-derived typical PAHs using turbidimetric titration and an extended hansen approach[J]. Journal of Chemical and Engineering Data , 2017, 62(3): 954-960. DOI:10.1021/acs.jced.6b00740. |
| [9] | Malpani V, Ganeshpure P A, Munshi P. Determination of solubility parameters for the p-xylene oxidation products[J]. Industrial & Engineering Chemistry Research , 2011, 50(4): 2467-2472. |
| [10] | Weinberg V L, Yen T F. 'Solubility parameters' in coal and coal liquefaction products[J]. Fuel , 1980, 59(5): 287-289. DOI:10.1016/0016-2361(80)90210-0. |
| [11] | Chen Y L, Wang Q, Zhang Z F, et al. Determination of the solubility parameter of ionic liquid 1-hexyl-3-methylimidazolium hexafluorophosphate by inverse gas chromatography[J]. Industrial & Engineering Chemistry Research , 2012, 51(46): 15293-15298. |
| [12] | Demirelli K, Kaya İ, Coşkun M. 3, 4-Dichlorobenzyl methacrylate and ethyl methacrylate system:monomer reactivity ratios and determination of thermodynamic properties at infinite dilution by using inverse gas chromatography[J]. Polymer , 2001, 42(12): 5181-5188. DOI:10.1016/S0032-3861(01)00019-2. |
| [13] | Zhao L, Choi P. Determination of solvent-independent polymer-polymer interaction parameter by an improved inverse gas chromatographic approach[J]. Polymer , 2001, 42(3): 1075-1081. DOI:10.1016/S0032-3861(00)00412-2. |
| [14] | Cordeiroa N, Ornelas M, Ashori A, et al. Investigation on the surface properties of chemically modified natural fibers using inverse gas chromatography[J]. Carbohydrate Polymers , 2012, 87(4): 2367-2375. DOI:10.1016/j.carbpol.2011.11.001. |
| [15] | Kołodziejek J, Główka E, Hyla K, et al. Relationship between surface properties determined by inverse gas chromatography and ibuprofen release from hybrid materials based on fumed silica[J]. International Journal of Pharmaceutics , 2013, 441(1): 441-448. |
| [16] | De La P A, Toro-Vazquez J F, Rogers Ml A. Simplifying hansen solubility parameters for complex edible fats and oils[J]. Food Biophysics , 2016, 11(3): 283-291. DOI:10.1007/s11483-016-9440-9. |
| [17] | Lloyd D R, Ward T C, Schreiber H P, et al. Inverse gas chromatography:characterization of polymers and other materials[M].Washington, DC: American Chemical Society, 1989. |
| [18] | Mutelet F, Butet V, Jaubert J N. Application of inverse gas chromatography and regular solution theory for characterization of ionic liquids[J]. Industrial & Engineering Chemistry Research , 2005, 44(11): 4120-4127. |
| [19] | Wang J, Zhang Z, Yang X, et al. Determination of solubility parameter for dicationic ionic liquid by inverse gas chromatography[J]. Chineses Journal of Chromatography , 2009, 27(4): 480-483. |
| [20] | Kaya İ, İLter Z, Şenol D. Thermodynamic interactions and characterisation of poly[(glycidyl methacrylate-co-methyl, ethyl, butyl) methacrylate] by inverse gas chromatography[J]. Polymer , 2002, 43(24): 6455-6463. DOI:10.1016/S0032-3861(02)00554-2. |
| [21] | Niederer B, Le A, Cantergiani E. Thermodynamic study of two different chewing-gum bases by inverse gas chromatography[J]. Journal of Chromatography A , 2003, 996(1-2): 189-194. DOI:10.1016/S0021-9673(03)00613-7. |
| [22] | Ohta M, Oguchi T, Yamamoto K. Evaluation of solubility parameter to predict apparent solubility of amorphous and crystalline cefditoren pivoxil[J]. Pharmaceutica Acta Helvetiae , 1999, 74(1): 59-64. DOI:10.1016/S0031-6865(99)00018-7. |
| [23] | Yazici O, Sakar D, Cankurtaran O, et al. Thermodynamical study of poly (n-hexyl methacrylate) with some solvents by inverse gas chromatography[J]. Journal of Applied Polymer Science , 2011, 122(3): 1815-1822. DOI:10.1002/app.34288. |
| [24] | Boutboul A, Lenfant F, Giampaoli P, et al. Use of inverse gas chromatography to determine thermodynamic parameters of aroma-starch interactions[J]. Journal of Chromatography A , 2002, 969(1-2): 9-16. DOI:10.1016/S0021-9673(02)00208-X. |
| [25] | Price G J, Shillcock I M. Inverse gas chromatographic measurement of solubility parameters in liquid crystalline systems[J]. Journal of Chromatography A , 2002, 964(1): 199-204. |
| [26] | YAO Yun-bing(姚允斌), XIE Tao(解涛), GAO Ying-ming(高英敏). Handbook of physical chemistry(物理化学手册)[M].Shanghai(上海): Shanghai Science and Technology Press(上海科学技术出版社), 1985. |
| [27] | Uriarte C, Fdez-Berridi M J, Elorza J, et al. Determination of the interaction parameter g by inverse gas chromatography:an additional experimental test of the classic lattice model[J]. Polymer , 1989, 30(8): 1493-1497. DOI:10.1016/0032-3861(89)90222-X. |
| [28] | Adamska K, Voelkel A. Hansen solubility parameters for polyethylene glycols by inverse gas chromatography[J]. Journal of Chromatography A , 2006, 1132(1-2): 260-267. DOI:10.1016/j.chroma.2006.07.066. |
| [29] | Hansen C M. Hansen solubility parameters:a user's handbook[M].New York: CRC Press, 2007. |
| [30] | Hansen C M. 50 Years with solubility parameters-past and future[J]. Progress in Organic Coatings , 2004, 51(1): 77-84. DOI:10.1016/j.porgcoat.2004.05.004. |
| [31] | Jones J. The possible importance of solubility parameter in carbon dioxide sequestration in coal mines[J]. Fuel , 2010, 89(12): 4061. DOI:10.1016/j.fuel.2010.03.050. |
| [32] | Vay K, Scheler S, Frieß W. Application of Hansen solubility parameters for understanding and prediction of drug distribution in microspheres[J]. International Journal of Pharmaceutics , 2011, 416(1): 202-209. DOI:10.1016/j.ijpharm.2011.06.047. |
| [33] | Marciniak A. The hildebrand solubility parameters of ionic liquids-part 2[J]. International Journal of Molecular Sciences , 2011, 12(6): 3553-3575. |
| [34] | Mutelet F, Jaubert Jean-Noël. Measurement of activity coefficients at infinite dilution in 1-hexadecyl-3-methylimidazolium tetrafluoroborate ionic liquid[J]. Journal of Chemical Thermodynamics , 2007, 39(8): 1144-1150. DOI:10.1016/j.jct.2007.01.004. |
| [35] | Marciniak A. The solubility parameters of ionic liquids[J]. International Journal of Molecular Sciences , 2010, 11(5): 1973-1990. |
| [36] | Alavianmehr M M, Hosseini S M, Mohsenipour A A, et al. Further property of ionic liquids:Hildebrand solubility parameter from new molecular thermodynamic model[J]. Journal of Molecular Liquids , 2016, 218: 332-341. DOI:10.1016/j.molliq.2016.02.032. |




