2. 浙江大学 化学工程与生物工程学院,浙江 杭州 310027;
3. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023
2. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China;
3. School of Biological and Chemical Engineering, Zhejiang University of Science and Technology, Hangzhou 310023, China
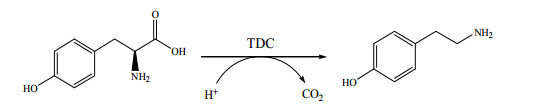
酪胺,又称4-羟基苯乙胺,是一种具有重要生理功能和工业价值的生物胺。在人体内,酪胺具有促进去肾上腺素分泌、收缩末梢神经及升高血压的生理作用[1, 2]。在医药化工领域,酪胺是许多药物如多巴胺、降血脂药苯扎贝特的合成前体[3~5]。此外,酪胺还被广泛的用于生物医用材料的制备,如透明质酸-酪胺水凝胶[6, 7],聚乙烯醇-酪胺水凝胶[8]、生物素-酪胺轭合物[9, 10]以及抗体纯化介质[11]等。目前,酪胺的主要制备方法为化学合成法[12, 13],如苯乙腈法、茴香醛法、对羟基苯甲醛法等,但这些方法普遍存在反应转化低、工艺复杂、成本高以及环境污染严重等问题。而利用酪氨酸脱羧酶(Tyrosine decarboxylase,TDC;EC 4.1.1.25)催化L-酪氨酸脱羧生成酪胺的生物制备方法(图 1)具有原料来源丰富、过程简单、转化效率高、条件温和以及环境友好的优点[13],因而更具应用前景。
|
图 1 酪氨酸脱羧酶催化反应示意图 Fig.1 Scheme of the reaction catalyzed by tyrosine decarboxylase |
利用全细胞催化是生物催化与转化实践中的一种重要方法。与酶催化相比,其可以避免繁琐的酶提取与纯化过程,从而显著降低生产成本[14, 15]。因此,开发具有高表观TDC催化活力的全细胞催化剂对于酪胺生产效率的提升和成本的降低都具有重要意义。为此,一些学者利用基因工程技术在菌体中强化了TDC的表达,并取得一定的成效[13]。虽然过表达TDC可以有效提高菌体酪胺的合成能力,但由于细胞被膜(细胞壁及细胞膜)对底物和产物的透性屏障作用,常导致胞内酶活难以充分发挥,从而使全细胞催化效率低下[14~16]。因此,有效改善细胞被膜的通透性对于制备高表观TDC催化活力的工程菌至关重要。细胞壁水解酶类如溶菌酶[17]、螯合剂如EDTA[18],表面活性剂如TritonX-100[19]、溴化十六烷基三甲胺(CTAB)[20]和有机溶剂如二甲苯等[21, 22]都能作为透性化试剂来改善细胞被膜对底物和产物的通透性。与其它透性化试剂相比,有机溶剂具有处理效果好、价格便宜、易于去除等优点,从而更易于工业化应用[14, 21]。因此本研究在构建TDC基因工程菌的基础上,采用有机溶剂对工程菌进行透性化处理来改善其表观TDC催化活力,以期为酪胺的生物制备提供具有高表观催化活力的菌体催化剂。
2 材料与方法 2.1 菌种及试剂表达宿主BL21(DE3)plysS和Origami(DE3)、Fast PfuDNA聚合酶、T4 DNA连接酶购于北京全式金生物科技有限公司;Lactobacillus brevisCGMCC 1306由本实验室筛选并诱变得到。限制性内切酶Nhe Ⅰ和XhoⅠ,Takara公司;酪胺、丹磺酰氯(DNS),日本TCI公司;酵母粉、胰蛋白胨,Oxoid公司;酪氨酸、磷酸吡哆醛(PLP)、氨苄青霉素(Amp)、卡那霉素(Kan)、氯霉素(Cm)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG),生工上海生物工程公司;乙腈(色谱纯),TEDIA公司;其它试剂均为国产分析纯。
2.2 酪氨酸脱羧酶工程菌的构建由于Lb. brevis CGMCC NO.1306与基因组序列已知的Lb. brevisATCC 367同源性为99%,因此本研究根据Lb. brevisATCC 367核酸序列(GeneBank登录号:CP000416.1)来设计引物,进行Lb. brevis CGMCC NO.1306 TDC基因的扩增,上游引物:5′-ATATGGCTAGCATGGAAAAAAGTAATCGCTCA-3′,下游引物:5′-GCCGCACTCGAGTTAAACATTTTCCTTTTGATTAACC-3′,下划线部分分别为限制性内切酶Nhe Ⅰ和Xho Ⅰ的酶切位点。提取L. brevis CGMCC 1306基因组DNA,通过PCR扩增获得TDC基因片段,PCR程序:94℃,5 min;(94℃,1 min;50℃,40 s;72℃,2 min)×32;72℃,10 min。将PCR产物和表达载体pET21a(+)用NheⅠ/Xho Ⅰ双酶切后,用T4 DNA连接酶进行连接,构建重组质粒pET21a-tdc。将pET21a-tdc质粒转化大肠杆菌Origami(DE3)和BL21(DE3)plysS感受态细胞,得到重组菌Origami(DE3)-pET21b-tdc和BL21(DE3)plysS-pET21b-tdc。
2.3 酪氨酸脱羧酶工程菌的培养挑取Origami(DE3)-pET21b-tdc单克隆菌体接入5 mL含Amp(100 µg·mL-1)、Kan(50 µg·mL-1)的LB液体培养基中,37℃、200 r·min-1振荡培养过夜。将种子液以2%接种量接种到含Amp(100 µg·mL-1)、Kan(50 µg·mL-1)的LB培养基,于37℃、200 r·min-1的条件下培养,当OD600在0.6~0.8时加入IPTG,使IPTG终浓度为0.5 mmol·L-1,28℃、150 r·min-1诱导培养6 h。当对BL21(DE3)plysS-pET21b-tdc进行培养时,抗生素为Amp(100 µg·mL-1)和Cm(30 µg·mL-1)。
2.4 细胞提取液的制备将收集的菌体用0.2 mol·L-1磷酸盐缓冲液(pH 7.5)洗涤两次后,用破胞缓冲液重悬菌体,超声波破碎细胞,超声破胞工作条件为:功率300 W,工作3 s,间歇6 s,循环90次。破碎后的菌体悬液于13 000 r·min-1、4℃条件下离心15 min,收集上清液,即得细胞提取液[23]。
2.5 有机溶剂的透性化处理菌体培养结束后,取一定量菌液于4℃、10000 r·min-1离心1 min收集菌体,用0.2 mol·L-1乙酸缓冲液(pH 5.0)清洗菌体1次,4℃备用。用正己烷、苯、甲苯、二甲苯、乙酸乙酯、吡啶、丙酮、甲醇、乙醇进行菌体透性化处理,向收集的菌体中加入一定含量的有机溶剂(0.5%~4%),使处理液中的菌体浓度为0.89 mg·mL-1 (细胞干重), 置于37℃下振荡反应一定时间(1~40 min),处理完毕后离心收集菌体,再用0.2 mol·L-1乙酸缓冲液(pH 5.0)清洗菌体1次,获得的菌体用于TDC活力测定。
2.6 TDC活力的测定通过测量酪胺生成量来计算TDC活力,以含5 mmol·L-1酪氨酸,0.1 mmol·L-1 PLP的乙酸缓冲液(0.2 mol·L-1,pH 5.0)为底物溶液,加入一定量处理好的菌体或细胞提取液,在37℃下振荡反应10 min,加入等体积的NaHCO3-NaHO溶液(0.5 mol·L-1,pH 9.5)来终止反应。将催化产物用0.5 mol·L-1 NaHCO3溶液稀释到一定浓度后测定酪胺的含量。一个酶活力单位定义为在37℃条件下,1 min生成1 µmol·L-1酪胺所需生物催化剂的量。TDC的比活力定义为每毫克干重细胞所具备的酶活力单位(U·mg-1 cells, dry weight)。
2.7 酪胺含量的测定采用HPLC法测定反应液中酪胺的含量[24]。首先对样品进行衍生化处理,具体操作方法:将100 µL样品稀释液,100 µL 0.5 mol·L-1 NaHCO3溶液,200 µL 8 g·L-1 DNS丙酮溶液混合后,置于40℃下避光反应1 h以上。将衍生样品过滤后进行HPLC分析。HPLC条件:色谱分离柱为Hypersil ODS2 C18 (250 mm×4.6 mm,5 μm),紫外检测波长为254 nm,流动相A为水,流动相B为乙腈,梯度洗脱(0~1 min,35%A;1~5 min,35%→20% A;5~6 min,20%→10% A;6~16 min,10%→8% A;16~20 min,8%→35% A),流量0.8 mL·min-1,进样量为10 µL。
2.8 菌体超微结构观察应用透射电镜观察透性化处理对菌体形态的影响[16]。
3 实验结果与讨论 3.1 酪氨酸脱羧酶工程菌的构建与功能验证利用2.2节中的引物从短乳杆菌Lb.brevisCGMCC 1306基因组中克隆出TDC基因(1881 bp),并将其连入pET21a(+)表达载体,进行序列测定。Blast分析结果表明,Lb.brevisCGMCC 1306与Lb.brevisATCC 367的TDC序列完全一致。将质粒pET21a-tdc导入表达宿主Origami(DE3)后,用IPTG诱导TDC表达,重组菌胞内酶活可达1.40 U·mg-1(细胞干重),为了避免培养初期TDC的泄露表达,造成酪胺对菌体生长的过早抑制,本研究也尝试采用BL21(DE3)plysS来表达TDC,但令人意外的是BL21(DE3)plysS-pET21b-tdc并没有展现出TDC催化活力(表 1),采用SDS-PAGE对BL21(DE3)plysS-pET21b-tdc的蛋白表达情况进行检测,发现该重组菌在IPTG诱导后并没有表达出目的蛋白,但目前还难以确定TDC在BL21(DE3)plysS中不表达的原因。因此,本研究选取OrigamiB(DE3)-pET21a-tdc进行酪胺的制备研究。
| 表 1 重组大肠杆菌的表观TDC催化活力和生物量 Table 1 Cell biomass and TDC activity of cell lysate of recombinant E. coli strains |
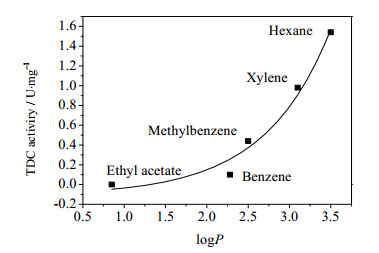
从表 2中可以看出,尽管OrigamiB(DE3)-pET21a-tdc胞内酶活高达1.40 U·mg-1,但其表观TDC催化活力却小于0.01 U·mg-1,因此有必要对菌体进行透性化处理来提高其表观催化活力。在各种透性化试剂中,有机溶剂由于其价格便宜、易于去除而备受人们青睐[14, 21]。有机溶剂主要是通过破坏细胞被膜中的脂类物质之间的疏水相互作用,增加细胞膜中脂类的流动性,来提高细胞被膜通透性[26]。由于不同菌种细胞被膜的成分和结构的不同,涉及催化反应酶的不同,以及底物和产物性质的不同,因此不同有机溶剂对不同催化体系催化活力改善效果也不尽相同[14, 21, 22]。本研究首先考察了不同有机溶剂透性化处理对菌体OrigamiB(DE3)-pET21a-tdc表观催化活力的影响,结果如表 2所示。在有机溶剂用量为2%,透性化处理10 min的条件下,己烷、二甲苯、甲苯、苯、乙酸乙酯都可以显著提高菌体的表观TDC活性,而吡啶、丙酮、甲醇和乙醇对菌体表观TDC活力并没有显著影响。由图 2可知,有机溶剂的疏水性(logP)与菌体表观TDC催化活力呈现出一定的相关性,表现为有机溶剂的疏水性越强,对菌体表观TDC催化活力改善程度越明显。本实验室在用有机溶剂对谷氨酸脱羧酶工程菌进行透性化处理时也发现了类似的现象[19]。其主要原因可能是:有机溶剂的疏水性越强,其液-膜分配系数越小[26],因此对于一定含量的有机溶剂来说,疏水性越高的有机溶剂越容易进入细胞被膜,引起细胞膜质结构的破坏[26, 27],从而可以更为有效地改善菌体表观TDC催化活力。在考察的有机溶剂中,己烷的疏水性最高,具有最好的透性化处理效果,因此本研究选取其进行下一步优化试验。此外,Choi等[28]对OchrobactrumanthropiSY509进行透性化处理时,发现高疏水性有机溶剂如甲苯、氯仿在低浓度下就使菌体达到良好的处理效果,而疏水性低的溶剂如乙醇和丙酮要在较高的浓度下才能达到相应的处理效果。该结果也说明高疏水性有机溶剂由于具有较高的膜液分配系数,更易于进入细胞被膜,引起细胞被膜结构的变化。虽然高疏水性更易于改善菌体被膜通透性,但由于不同酶对不同有机溶剂的敏感度不一样以及处理体系不同等因素,高疏水性有机溶剂也并不都有利于菌体表观催化活力的改善[22]。
| 表 2 有机溶剂透性化处理后菌体表观TDC催化活力的变化 Table 2 Cell-associated GAD activities of permeabilized Origami(DE3)-pET21b-tdc treated by organic solvents |
|
图 2 菌体表观TDC催化活性与有机溶剂疏水性之间的关系 Fig.2 Correlation of hydrophobicity (logP) of solvents with cell-bound TDC activity of Origami(DE3)-pET21b-tdc cells |
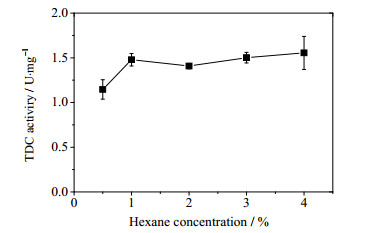
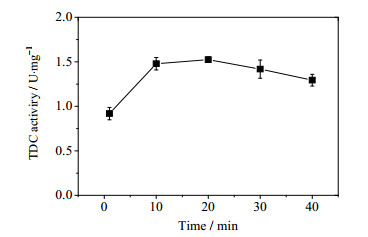
透性化处理对菌体表观催化活力的改善效果不仅受到菌体种类、涉及催化反应酶的性质和透性化试剂种类的影响,还与处理时间和透性化试剂浓度等因素密切相关[14]。为了在有机溶剂用量最小和处理时间最短的原则下,使OrigamiB(DE3)-pET21a-tdc表观催化活力达到最优,本研究对己烷的用量和处理时间进行了优化。己烷含量对OrigamiB(DE3)-pET21a-tdc菌体表观催化活力的影响如图 3所示,当己烷含量为1%时,菌体表观TDC催化活性便可达到最优值,随着己烷用量进一步增高,菌体表观TDC催化活性呈现饱和变化趋势。用1%的己烷处理菌体1~40 min,结果如图 4。菌体表观催化活力在处理10 min时可达最优值,当处理时间超过30 min时,菌体表观催化活力呈现下降趋势,原因可能是过长的处理时间会导致胞内TDC的催化活力下降。因此,采用己烷对OrigamiB(DE3)-pET21a-tdc进行透性化处理的最优条件为:1%的己烷处理菌体10 min,此时菌体表观催化活力为1.48 U·mg-1,这表明在该透性化处理条件下,OrigamiB(DE3)-pET21a-tdc菌体的催化效率已达到其破胞液的催化效率(1.40 U·mg-1)。
|
图 3 己烷用量对菌体表观TDC催化活性的影响 Fig.3 Effects of organic solvent amounts on cell-bound TDC activity of cells. (permeabilization time = 10 min) |
|
图 4 己烷处理时间对菌体表观TDC催化活性的影响 Fig.4 Effect of permeabilization time on cell-bound TDC activity of cells treated with 1% hexane |
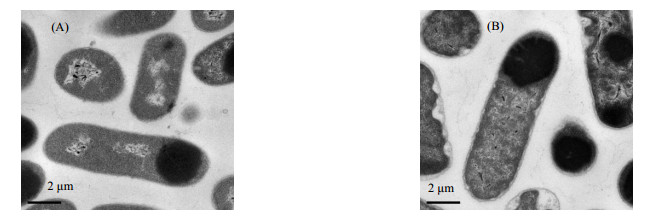
用透射电镜观察己烷透性化处理对OrigamiB(DE3)-pET21a-tdc的形态结构影响(图 5)。未处理的OrigamiB(DE3)-pET21a-tdc细胞形态完整,细胞外缘光滑,细胞液分布均匀。而菌体在经过1%己烷处理10 min后,菌体细胞被膜出现了轻微的皱起和细胞质收缩。细胞被膜的皱起说明在透性化处理过程中,细胞被膜结构发生了改变,对底物和产物的屏障作用降低。但OrigamiB(DE3)-pET21a-tdc细胞在透性化处理后其细胞形态仍然完整,没有出现明显的孔洞和细胞质泄露现象,说明在优化的处理条件下,己烷处理并没有造成细胞裂解。
|
图 5 菌体透性化处理后形态变化 Fig.5 Morphology changes of the cells after organic solvents treatment (A) control (B) 1% hexane for 10 min |
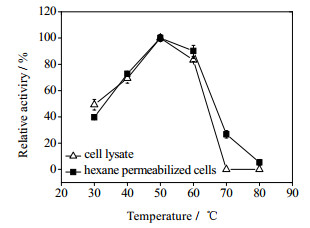
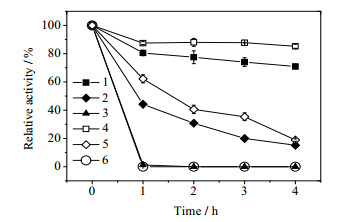
在30~80℃单位内考察温度对OrigamiB(DE3)-pET21a-tdc表观催化活力的影响,结果如图 6所示。当反应温度低于50℃时,随着温度的升高,菌体表观TDC活力逐渐增大。当反应温度高于50℃时,菌体催化活力明显下降,说明提高反应温度有利于提高反应速率,但温度过高会导致TDC热变性失活。此外,透性化OrigamiB(DE3)-pET21a-tdc菌体较细胞提取液表现出对高反应温度的耐受性(图 6),说明菌体细胞被膜透性化处理后仍可以起到对胞内酶的保护作用。将透性化OrigamiB(DE3)-pET21a-tdc细胞静置于pH 5.0的乙酸缓冲液中,于不同温度下处理一定时间,考察菌体的热稳定性。由图 7可知,随着反应温度的提高,菌体催化剂的热稳定性越差。虽然50℃时,菌体具有最大表观TDC催化活力,但在该温度下,菌体催化剂在1h后就完全失活,因此50℃并不适合作为酪胺制备的反应温度。综合考虑,选取40℃进行酪胺的制备。此外,透性化OrigamiB(DE3)-pET21a-tdc菌体与细胞提取液具有相似的热失活曲线,但失活速率相对较快(图 7),造成这种现象的原因可能是残留的有机溶剂长时间作用于胞内TDC,影响了其稳定性。尽管如此,由于透性化菌体较酶液在实际应用中能更好地耐受剪切作用,以及其制备相对简便,因此更具实际应用价值。
|
图 6 温度对己烷透性化菌体表观TDC催化的影响 Fig.6 Effects of temperature on cell-bound TDC activity of hexane permeabilized Origami(DE3)-pET21b-tdc |
|
图 7 己烷透性化菌体的热稳定性 Fig.7 Thermostability of hexane permeabilized Origami(DE3)-pET21b-tdc in different temperatures.(1~3) permeabilized cells at 30~50℃; (4~6) cell lysate at 30~50℃ |
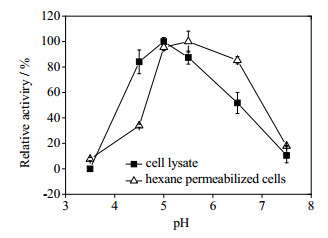
在pH3.5~8.5考察不同pH对透性化OrigamiB(DE3)-pET21a-tdc菌体表观催化活力的影响(图 8)。OrigamiB(DE3)-pET21a-tdc透性化菌体较其细胞提取液的最适反应pH值向碱性方向发生偏移,表现为透性化菌体在pH 5.5时的表观催化活力最高,且在pH 5.0~6.5能保持最高催化活力的84%以上,而细胞提取液则在pH 5.0时具有最高催化活力,说明胞内微环境对外界pH变化会起到一定的调节作用。故选取pH 5.5作为透性化菌体制备酪胺的最适pH值。
|
图 8 pH对己烷透性化菌体表观TDC催化活力的影响 Fig.8 Effects of pH on cell-bound TDC activity of hexane permeabilized Origami(DE3)-pET21b-tdc |
将0.47 g·L-1 (细胞干重)透性化细胞置于酪氨酸含量为18 g·L-1,pH 5.5的反应液中,在40℃的条件下进行酪胺转化实验(图 9)。虽然酪氨酸溶解度极低,加入酪氨酸后溶液便处于浑浊状态,但由于酪胺具有较高的溶解度,因此反应可以顺利进行。由于酪氨酸脱羧过程中需要不断消耗H+(图 1),产物酪胺也是弱碱,这些因素都将导致转化液的pH值不断升高,从而导致TDC催化活力急剧降低。为此,采用2 mol·L-1 HCl来维持反应处于pH 5.5。从图 9可以看出,0.47 g·L-1透性化菌体在4.5 h内便可将18 g·L-1的酪氨酸就完全转化为酪胺(转化率 > 99%),因此本研究制备的己烷透性化Origami(DE3)-pET21b-tdc菌体具有良好的工业应用前景。
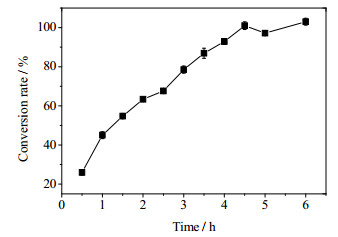
|
图 9 己烷透性化细胞催化酪氨酸生成酪胺的反应进程 Fig.9 Process of tyramine production from L-tyrosine catalyzed by hexane permeabilized Origami(DE3)-pET21b-tdc |
在构建TDC工程菌OrigamiB(DE3)-pET21a-tdc的基础上,采用有机溶剂对其进行透性化处理,以改善其表观TDC催化活力。结果表明,菌体表观TDC催化活力提高与有机溶剂的疏水性存在着相关性,高疏水性(logP > 2.28)的有机溶剂能有效提高菌体表观TDC催化活力。最有效的透性化溶剂己烷的最适处理条件为:1%己烷处理工程菌10 min,在此条件下菌体的表观TDC催化活力可达1.48 U·mg-1。在pH 5.5,40℃条件下,0.47 g·L-1透性化OrigamiB(DE3)-pET21a-tdc细胞在4.5 h内可将18 g·L-1酪氨酸完全转化为酪胺。
| [1] | Shalaby A R. Significance of biogenic amines to food safety and human health[J]. Food Research International , 1996, 29(7): 675-690. DOI:10.1016/S0963-9969(96)00066-X. |
| [2] | Khwanchuea R, Mulvany M J, Jansakul C. Cardiovascular effects of tyramine:adrenergic and cholinergic interactions[J]. European Journal of Pharmacology , 2008, 579(1-3): 308-317. DOI:10.1016/j.ejphar.2007.10.029. |
| [3] | Peter B. Process for the preparation of α-[4-(4-chlorobenzoylaminoethyl phenoxy)-isobutyric acid:US06/030798[P]. 1983-01-25. |
| [4] | Kim B, Lee S H, Choi K Y, et al. N-nicotinoyltyramine, a novel niacinamide derivative, inhibits melanogenesis by suppressing MITF gene expression[J]. European Journal of Pharmacology , 2015, 764: 1-8. DOI:10.1016/j.ejphar.2015.05.006. |
| [5] | Panufnik E, Kañska M. Enzymatic synthesis of isotopomers oftyramine labeled with deuterium and tritium[J]. Journal ofLabelled Compounds and Radiopharmaceuticals , 2007, 50(2): 85-89. DOI:10.1002/(ISSN)1099-1344. |
| [6] | Lee F, Chung J E, Kurisawa M. An injectable enzymatically crosslinked hyaluronic acid-tyramine hydrogel system with independent tuning of mechanical strength and gelation rate[J]. Soft Matter , 2008, 4(4): 880-887. DOI:10.1039/b719557e. |
| [7] | Xu K M, Narayanan K, Lee F, et al. Enzyme-mediated hyaluronic acid-tyramine hydrogels for the propagation of human embryonic stem cells in 3D[J]. ACTA Biomaterialia , 2015, 24: 159-171. DOI:10.1016/j.actbio.2015.06.026. |
| [8] | Lim K S, Ramaswamy Y, Roberts J J, et al. Promoting cell survival and proliferation in degradable poly(vinyl alcohol)-tyramine hydrogels[J]. Macromolecular Bioscience , 2015, 15(10): 1423-1432. DOI:10.1002/mabi.v15.10. |
| [9] | ReesJ S, Li X W, Perrett S, et al. Selective proteomic proximity labeling assay using tyramide (SPPLAT):a quantitative method for the proteomic analysis of localized membrane-bound protein clusters[J]. Current Protocols in Protein Science , 2015, 80: 11-18. |
| [10] | Yuan J L, Yu Y, Li C, et al. Visual detection and microplate assay for Staphylococcus aureus based on aptamer recognition coupled to tyramine signal amplification[J]. MicrochimActa , 2014, 181(3-4): 321-327. |
| [11] | Levashov P A, Ovchinnikova E D, Afanas'Eva M I, et al. Tyramine and tryptamine as ligands for medical and biotechnological affinity sorbents[J]. Russian Journal of Bioorganic Chemistry , 2015, 41(1): 19-25. DOI:10.1134/S1068162015010112. |
| [12] | Buck J S. Reduction of hydroxymandelonitriles-a new synthesis of tyramine[J]. Journal of the American Chemical Society , 1933, 55: 3388-3390. DOI:10.1021/ja01335a058. |
| [13] | Zhang H, Lu Y, Wu S, et al. Two-step enzymatic synthesis of tyramine from raw pyruvate fermentation broth[J]. Journal of Molecular Catalysis B-Enzymatic , 2016, 124: 38-44. DOI:10.1016/j.molcatb.2015.11.024. |
| [14] | Chen R R. Permeability issues in whole-cell bioprocesses and cellular membrane engineering[J]. Applied Microbiology and Biotechnology , 2007, 74(4): 730-738. DOI:10.1007/s00253-006-0811-x. |
| [15] | Cardenas-Fernandez M, Neto W, Lopez C, et al. Immobilization of Escherichia coli containing omega-transaminase activity in LentiKats[J]. Biotechnology Progress , 2012, 28(3): 693-698. DOI:10.1002/btpr.1538. |
| [16] | Zhao W R, Hu S, Huang J, et al. Permeabilization of Escherichia coli with ampicillin for a whole cell biocatalyst with enhanced glutamate decarboxylase activity[J]. Chinese Journal of Chemical Engineering , 2016, 24(7): 909-913. DOI:10.1016/j.cjche.2016.02.001. |
| [17] | Melanie D, Valerie L, Catherine G D, et al. Hen egg white lysozyme permeabilizesEscherichia coli outer and inner membranes[J]. Journal of Agricultural and Food Chemistry , 2013, 61(41): 9922-9929. DOI:10.1021/jf4029199. |
| [18] | Nikaido H, Vaara M. Stages of polymyxin B interaction with the Escherichia coli cell envelope[J]. Antimicrob Agents Chemother , 2000, 44(11): 2969-2978. DOI:10.1128/AAC.44.11.2969-2978.2000. |
| [19] | Zhao W R, Huang J, Peng C L, et al. Permeabilizing Escherichia coli for whole cell biocatalyst with enhanced biotransformation ability from L-glutamate to GABA[J]. Journal of Molecular Catalysis B-Enzymatic , 2014, 107: 39-46. DOI:10.1016/j.molcatb.2014.05.011. |
| [20] | Wei G Y, Li Y, Du G C, et al. Effect of surfactants on extracellular accumulation of glutathione by Saccharomyces cerevisiae[J]. Process Biochemistry , 2003, 38(8): 1133-1138. DOI:10.1016/S0032-9592(02)00249-2. |
| [21] | De Leon A, Garcia B, de la Rosa A, et al. Periplasmic penicillin G acylase activity in recombinant Escherichia coli cells permeabilized with organic solvents[J]. Process Biochemistry , 2003, 39(3): 301-305. DOI:10.1016/S0032-9592(03)00079-7. |
| [22] | Kumar A, Pundle A. Effect of organic solvents on cell-bound penicillin Ⅴ acylase activity of Erwiniaaroideae (DSMZ 30186):a permeabilization effect[J]. Journal of Molecular Catalysis B-Enzymatic , 2009, 57(1-4): 67-71. DOI:10.1016/j.molcatb.2008.06.018. |
| [23] | Fan E Y, Huang J, Hu S, et al. Cloning, sequencing and expression of a glutamate decarboxylase gene from the GABA-producing strain Lactobacillus brevis CGMCC 1306[J]. Annals of Microbiology , 2012, 62(2): 689-698. DOI:10.1007/s13213-011-0307-5. |
| [24] | LU Yong-mei(陆咏梅), DONG Ming-shen(董明盛), LÜ Xin(吕欣), et al. Biogenic amines contents in rice wine by HPLC(高效液相色谱法测定黄酒中生物胺的含量)[J]. Food Science(食品科学) , 2006, 27(1): 196-199. |
| [25] | Zhang K, Ni Y. Tyrosine decarboxylase from Lactobacillus brevis:soluble expressionand characterization[J]. Protein Expression and Purification , 2014, 94(2): 33-39. |
| [26] | Sikkema J, Debont J, Poolman B. Interactions of cyclic hydrocarbons with biological-membranes[J]. Journal of Biological Chemistry , 1994, 269(11): 8022-8028. |
| [27] | Osborne S J, Leaver J, Turner M K, et al. Correlation of biocatalytic activity in an organicaqueous 2-liquid phase system with solvent concentration in the cell-membrane[J]. Enzymeand Microbial Technology , 1990, 12(4): 281-291. DOI:10.1016/0141-0229(90)90100-5. |
| [28] | Choi K O, Song S H, Yoo Y J. Permeabilization of Ochrobactrumanthropi SY509 cells with organic solvents for whole cell biocatalyst[J]. Biotechnology and Bioprocess Engineering , 2004, 3(9): 147-150. |




