随着社会的发展与进步,人们对生活环境的要求不断提高,世界各国更加注重能源与环境问题。传统的煤、石油等能源体系由于不可再生性以及对环境的污染而受到制约,促使人们加快对新能源的探索和研究[1]。生物质因为具有可再生、清洁和易获得等优点受到广泛关注。通过生物质热解得到的生物质油因含水率高、热值低、黏度大、稳定性差等缺点而难以直接利用,因此需要进一步精制。对于生物质油的精制,工业上主要采取的方法为加氢脱氧(HDO)[2]。目前HDO催化剂的研究主要集中在贵金属催化剂[3]、硫化物催化剂[4]、过渡金属磷化物催化剂[5]、双金属催化剂[6]和其他催化剂[7-8]。
过渡金属氮化物作为新型的加氢催化剂引起了人们广泛关注。该化合物是由N原子插入金属晶格中形成的[9],是一种金属间充型化合物。当N原子插入金属晶格中形成化合物时,使它具有了独特的物理和化学特性[10]。由于氮化物的催化性能类似于Pt、Rh等贵金属,故被誉为“准铂催化剂”[11-12]。梁长海等[13]发现利用碳热法制备的Mo2C表现出了优良的催化特征。因此,本研究采取先碳化再氮化的方法制备了介孔碳负载的Mo2N催化剂。先碳化可以维持催化剂的形貌,同时产生较小的活性中心颗粒,后原位氮化可以在不破坏催化剂载体的情况下将Mo2C转变为Mo2N,实现Mo2N的原位合成,同时又可以使催化剂保持较大的比表面积。
作者以甲氧基苯酚为模型化合物进行加氢脱氧研究。因甲氧基苯酚分子中含有的C─O键(C─O、CAR─OH、CAR─OCH3和CARO─CH3)广泛存在于木质素热解产物中[10],所以研究甲氧基苯酚加氢脱氧对木质素的利用具有重要意义[12-16]。作者还对介孔碳负载的过渡金属氮化物催化剂的合成、表征及反应机理进行了研究。
2 实验部分 2.1 原料和试剂四水合钼酸铵((NH4)6Mo7O24·4H2O),AR,购自国药集团化学试剂有限公司;甲氧基苯酚(C7H8O2),AR,购自上海凌峰化学试剂有限公司;介孔碳(MC)载体,购自常州介孔催化材料有限公司;H2、NH3、N2,购自天鸿化工有限公司。
2.2 催化剂的制备分别称取适量的(NH4)6Mo7O24·4H2O溶解于4 mL去离子水中,搅拌形成均相透明溶液后,逐滴加入1 g介孔碳(MC)载体上,室温下静置12 h后在110 ℃烘箱中烘干,制得介孔碳负载的氮化钼催化剂的前驱体。将前驱体放入瓷舟中,采用先碳化后氮化的升温还原方法制备氮化钼催化剂:在氢气中以5 ℃·min-1的升温速率从室温升至350 ℃,再分别以0.5、1、3 ℃·min-1的不同升温速率从350升温至450 ℃,然后以3 ℃·min-1的升温速率从450升至700 ℃,此时将H2切换为NH3,700 ℃保持2 h后冷却至室温,在体积分数为0.5%的O2/Ar中钝化8 h,即得到xMo2N/MC催化剂(x为Mo2N的负载量)。
2.3 催化剂的表征N2物理吸附比表面积(Brunauer Emmett Teller,BET)催化剂的孔结构性质采用美国Quantachrome公司生产的Autosorb-iQ2-MP型低温氮气物理吸附仪,测试样品的比表面积、孔容及孔径分布曲线。测试前,样品在350 ℃、0.133 Pa压力下脱气4 h进行预处理。采用N2物理吸附BET法计算催化剂比表面积。基于Kelvin方程,采用BJH (Barrett-Joyner-Halenda)法计算催化剂的孔径分布。X射线多晶衍射(XRD)采用Rigaku D/Max2400衍射仪测定,样品扫描范围为5°~80°。X射线光电子能谱分析(XPS)采用Multilab 2000型X射线光电子能谱仪分析催化剂表面元素的组成和化合态,Mg Kα(1 253.6 eV)为射线光源,使用C 1s的结合能(284.8 eV)进行校准。透射电子显微镜(TEM)采用JEM-2100(日本电子株式会社)透射电子显微镜对催化剂的样貌、粒径及分散进行测试,将样品放在无水乙醇中超声分散20 min后,用滴管将悬浮液滴在铜网上,干燥后直接测试。
2.4 催化剂性能测定将0.2 g催化剂置于内径为6 mm的微型固定床反应器中段,两端用石英砂填充。反应压力为2 MPa,氢气体积流量为80 mL·min-1。利用高压泵将质量分数为3% 甲氧基苯酚的正十烷溶液以0.1 mL·min-1的速度输入固定床。反应前先用氢气在450 ℃温度下对催化剂进行原位还原3 h。反应温度为300~380 ℃,待反应稳定3 h后,收集反应产物并用GC分析(HP-5色谱柱,FID检测器)。
3 结果与讨论 3.1 催化剂的物理性质MC载体、Mo2C/MC及不同Mo2N负载量的催化剂的结构参数见表 1。表中SBET、Vp、Dp分别为各催化剂的比表面积、孔容、孔径,从表 1中可以看出,MC载体的比表面积、孔容、孔径分别为658 m2·g-1、0.82 cm3·g-1、5.02 nm,随着Mo2N负载量增加,Mo2N/MC催化剂的表面积、孔容均逐渐减小,说明Mo2N活性组分嵌入介孔碳中。
|
|
表 1 不同催化剂的比表面积及孔道结构 Table 1 Specific surface area and pore structure of different catalysts |
催化剂XRD谱图如图 1所示。结果显示催化剂前驱体在氢气中还原生成Mo2C,700 ℃下用氨气氮化后Mo2C转化成Mo2N,这是由于氨气在Mo2C的作用下分解成活性N而取代了Mo2C的C。负载量为10%,20%,30%,40%的催化剂在36.9°、43°和63.1°均出现了Mo2N的特征衍射峰,且随着Mo2N负载量增加衍射峰变强,通过Scherrer公式计算的Mo2N的平均粒径(表 1),可以看出Mo2N颗粒随着负载量的增加而变大[17-19]。
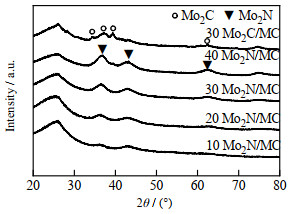
|
图 1 不同负载量的Mo2N/MC催化剂的XRD谱图 Fig.1 XRD patterns of Mo2N/MC catalysts with different loadings |
为了探究不同升温程序对催化剂的影响,设计了5个升温程序,如表 2所示。不同升温程序制备的催化剂的XRD谱图见图 2。
|
|
表 2 催化剂制备程序 Table 2 Preparation procedures of catalysts |
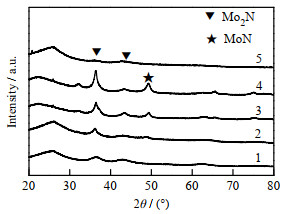
|
图 2 不同程序制备的Mo2N/MC催化剂的XRD谱图 Fig.2 XRD patterns of Mo2N/MC catalysts prepared by different procedures |
由图 2可知,5种升温程序制备的催化剂均在36.9°、43°处出现Mo2N特征衍射峰,说明通过这些升温程序都能成功地制备Mo2N[20]。但2、3、4升温程序制备的催化剂中均出现MoN(2θ=49.6°)特征衍射峰,形成了Mo2N/MoN混合物,说明升温程序是制备Mo2N的决定因素。有研究表明,生成Mo2N的关键是要保证反应能够进行“局部规整反应”[19]。然而局部规整反应受动力学因素的影响,要求低温(350~450 ℃)阶段升温速度缓慢,这样会使MoO3不断地生成HxMoO3,且此阶段为放热反应,也不宜提高升温速率;但是如果升温速度太慢对Mo2N的生成也是不利的。而高温阶段采用较快的升温速率则有利于HxMoO3转化为MoyN1-y。研究表明,低温阶段产生的水蒸气对反应物不会产生影响,所以采用缓慢的升温速率比较适合,反应生成的水在一定的气体空速下就可以及时排出整个体系外[21]。而在高温阶段,由于过渡态的中间产物的比表面积较大,这导致吸附在中间产物表面上的水分子不易排出(尤其是化学吸附态的水),所以在反应的第2阶段快速升温有利于将水分子排出体系外,加速中间产物向氮化钼转化。
如图 3所示为NH3体积流量为50和150 mL·min-1制备的Mo2N/MC催化剂的XRD谱图。所制备的催化剂均在36.9°和43°处出现Mo2N特征衍射峰,当NH3体积流量为50 mL·min-1时,出现了MoN特征衍射峰,而NH3体积流量为150 mL·min-1时,仅生成Mo2N,说明提高NH3体积流量有利于Mo2N生成。
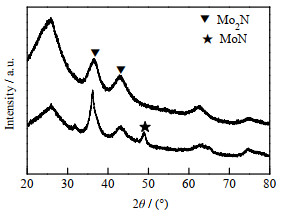
|
图 3 不同NH3流量下的Mo2N/MC催化剂XRD图 Fig.3 XRD patterns of Mo2N/MC catalysts under different NH3 flow rates |
为进一步了解Mo2N/MC催化剂中Mo、N元素的价态,对Mo2N/MC催化剂进行了XPS分析。不同负载量的Mo2N/MC催化剂中Mo 3d和N 1s的XPS谱图如图 4所示。由图 4可知,在229.5和232.8 eV处的两个峰可以归属为Mo2N中Mo元素[22],而位于235.9 eV处的结合能峰对应于催化剂表面钝化层MoO3中的Mo6+[18, 23-25]。图 4中N元素的XPS谱图显示,在398.4 eV处的峰可以归属为吡啶环“C─N”键中的N[26-28],表明了介孔碳载体中引入了氮元素,而395.3 eV处的峰归属于Mo2N中N的特征峰。根据XPS的价态显示,所制备的催化剂为Mo2N活性中心,并且随着负载量的增高,低价态组分的含量逐渐增加。同时,所制备的催化剂中N、Mo原子比(见表 3)远高于Mo2N中的理论原子比,可能是因为在氮化时介孔碳中引入N所致,增加了催化剂的活性。
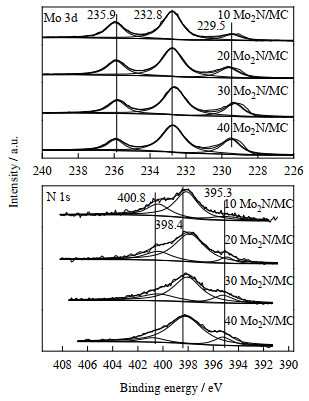
|
图 4 不同负载量Mo2N/MC催化剂中Mo 3d和N 1s的XPS谱图 Fig.4 XPS spectra of Mo 3d and N 1s in Mo2N/MC with different loadings |
|
|
表 3 不同负载量的催化剂的XPS数据 Table 3 XPS data for catalysts with different loadings |
如图 5所示为不同负载量催化剂的TEM图。由图 5可见,Mo2N纳米颗粒都均匀地分布在介孔碳上,尽管处理温度高达700 ℃,所制备的Mo2N纳米颗粒仍然很小,这可能是因为Mo2N纳米颗粒嵌入介孔碳中,阻碍了其团聚。图中还显示当负载量较低时,载体上的活性组分较少,随着负载量的提高,活性组分也增多。但随着负载量继续加大,Mo2N纳米颗粒逐渐变大,说明负载量较高时活性组分仍出现了一定程度的团聚[29-30]。

|
图 5 不同负载量催化剂的TEM图 Fig.5 TEM images of catalysts with different loadings |
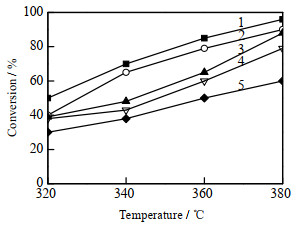
不同升温程序制备的Mo2N催化剂甲氧基苯酚加氢脱氧反应的效果如图 6所示。催化剂用量为0.2 g,氢气压力为2 MPa,体积流量为0.1 mL·min-1。在低温阶段采用较慢的升温速率且在高温阶段采用较快的升温速率时(升温程序1和2),所制备的催化剂对甲氧基苯酚的加氢脱氧反应效果较好,而升温程序3、4、5制备的催化剂的反应活性较低。因此,以5 ℃·min-1从室温升温至350 ℃后,以1 ℃·min-1升温至450 ℃,再以3 ℃·min-1升温至700 ℃,保持2 h的程序升温条件为最佳条件。
|
图 6 不同制备程序对催化剂加氢脱氧性能的影响 Fig.6 Effect of preparation procedures on the HDO performance of catalysts |
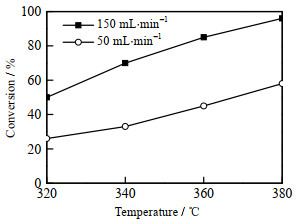
NH3体积流量对Mo2N催化剂甲氧基苯酚加氢脱氧反应效果的影响如图 7所示,催化剂用量为0.2 g,氢气压力为2 MPa,体积流量为0.1 mL·min-1。当NH3体积流量为50 mL·min-1时,Mo2N/MC催化剂活性较差,即使提高反应温度,反应转化率也较低。当NH3体积流量为150 mL·min-1时,催化剂的活性明显提高。这可能是由于NH3低流速时,催化剂前驱体在还原时生成了一部分MoN(如图 3所示),从而导致催化剂Mo2N活性组分含量较少,反应活性较低。
|
图 7 气体流速对催化剂加氢脱氧性能的影响 Fig.7 Effect of gas flow rate on the HDO performance of catalysts |
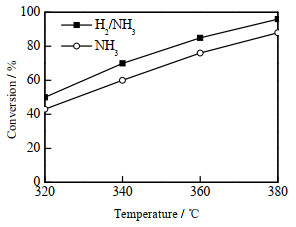
不同氮化气体对催化剂加氢脱氧效果的影响如图 8所示,结果表明使用H2/NH3气体制备的催化剂比单独使用NH3制备的催化剂加氢脱氧活性更高。
|
图 8 不同氮化气体对催化剂加氢脱氧性能的影响 Fig.8 Effect of different gases on the HDO performance of catalysts |
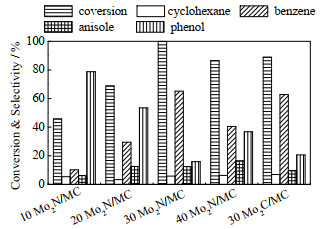
不同Mo2N负载量对催化剂加氢脱氧反应的影响如图 9所示,催化剂用量为0.2 g,氢气压力为2 MPa,体积流量为0.1 mL·min-1。当Mo2N的质量分数从10%增加到30%,甲氧基苯酚的转化率呈增大的趋势。当Mo2N的质量分数为30% 时,甲氧基苯酚已完全反应,且反应的主要产物是苯。当Mo2N的负载量继续增大时,主要产物苯的选择性下降。因此Mo2N的最佳质量分数为30%。从结果可知,Mo2N催化剂比Mo2C催化剂的活性高,催化效果更好,但二者对苯的选择性相当。
|
图 9 负载量对催化剂加氢脱氧性能的影响 Fig.9 Effect of loading on the HDO performance of catalysts |
反应温度对30 Mo2N/MC催化剂加氢脱氧性能的影响如图 10所示,催化剂用量为0.2 g,氢气压力为2 MPa,体积流量为0.1 mL·min-1。甲氧基苯酚转化率随着反应温度的升高而增加,低温时主要产物为苯酚。随着温度升高苯酚进一步转化为苯[31-33]。当温度升高到380 ℃时,主要产物苯的选择性大于60%。
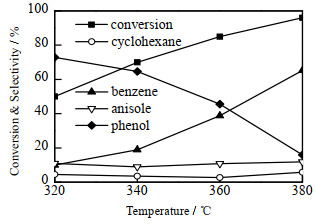
|
图 10 反应温度对30Mo2N/MC催化剂加氢脱氧性能的影响 Fig.10 Effect of reaction temperatures on the HDO performance of 30Mo2N/MC |
甲氧基苯酚因其分子中有酚羟基、甲氧基而作为木质素的模型化合物[34-36]。根据生成的产物,作者推测甲氧基苯酚加氢脱氧反应途径如图 11所示。酚类化合物可以通过逐步或者直接脱甲氧基、甲基和酚羟基得到精细化工产物苯和苯甲醚。
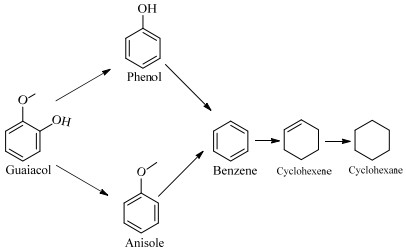
|
图 11 Mo2N催化剂上甲氧基苯酚加氢脱氧反应途径 Fig.11 HDO pathways of guaiacol on Mo2N catalysts |
本研究以介孔碳为载体、(NH4)6Mo7O24·4H2O为钼源,在氢气和氨气的环境下,经过先碳化后氮化的方法得到Mo2N/MC催化剂。该方法制备的Mo2N/MC催化剂中,活性组分Mo2N嵌入介孔碳孔壁中,提高了分散度。该催化剂表现出很高的甲氧基苯酚加氢脱氧活性,并且对苯具有很高的选择性。Mo2N/MC催化剂的最佳制备条件为:先在H2氛围下,以5 ℃·min-1从室温升至350 ℃后,以1 ℃·min-1升温至450 ℃,再以3 ℃·min-1升至700 ℃,然后在NH3气氛下,700 ℃保持2 h。在质量分数为30 %、反应温度为380 ℃、反应压力为2.0 MPa的条件下,甲氧基苯酚的转化率接近100%,主要产物苯的选择性达到65.2%。
| [1] |
魏昭彬, 赵秀阁, 辛勤. 双组分过渡金属氮化物催化剂: Ⅰ. 制备和表征[J]. 催化学报, 2000, 21(3): 225-228. WEI Z B, ZHAO X G, XIN Q. Bimetallic transition nitride catalyst: Ⅰ. Preparation and characterization[J]. Chinese Journal of Catalysis, 2000, 21(3): 225-228. DOI:10.3321/j.issn:0253-9837.2000.03.009 |
| [2] |
SEPULVEDA C, LEIVA K, GARCIA R, et al. Hydrodeoxygenation of 2-methoxyphenol over Mo2N catalysts supported on activated carbons[J]. Catalysis Today, 2011, 172(1): 232-239. DOI:10.1016/j.cattod.2011.02.061 |
| [3] |
MORTENSEN P M, GRUNWALDT J D, JENSEN P A, et al. Influence on nickel particle size on the hydrodeoxygenation of phenol over Ni/SiO2[J]. Catalysis Today, 2016, 259(2): 277-284. |
| [4] |
BUI V N, LAURENTI D, AFANASIEV P, et al. Hydrodeoxygenation of guaiacol with CoMo catalysts. part Ⅰ: Promoting effect of cobalt on HDO selectivity and activity[J]. Applied Catalysis B: Environmental, 2011, 101(4): 239-245. |
| [5] |
PEI Y, CHENG Y, CHEN J, et al. Recent developments of transition metal phosphides as catalysts in the energy conversion field[J]. Journal of Materials Chemistry A, 2018, 6(46): 23220-23243. DOI:10.1039/C8TA09454C |
| [6] |
HONG D Y, MILLER S J, AGRAWAL P K, et al. Hydrodeoxygenation and coupling of aqueous phenolics over bifunctional zeolite-supported metal catalysts[J]. Chemical Communications, 2010, 46(7): 1038-1040. DOI:10.1039/B918209H |
| [7] |
ZHANG W, ZHANG Y, ZHAO L, et al. Catalytic activities of NiMo carbide supported on SiO2 for the hydrodeoxygenation of ethyl benzoate, acetone, and acetaldehyde[J]. Energy & Fuels, 2010, 24(3): 34-89. |
| [8] |
张伟, 张晔, 赵亮富, 等. γ-Al2O3负载的Mo及Ni-Mo氮化物、碳化物的合成及其加氢脱氧性能[J]. 石油学报(石油加工), 2011, 27(1): 37-41. ZHANG W, ZHANG Y, ZHAO L F, et al. Synthesis and hydrodeoxygenation activity of Mo, Ni-Mo nitride and carbide supported on γ-Al2O3[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2011, 27(1): 37-41. DOI:10.3969/j.issn.1001-8719.2011.01.007 |
| [9] |
ZHANG X, WANG T, MA L, et al. Characterization and catalytic properties of Ni and NiCu catalysts supported on ZrO2-SiO2 for guaiacol hydrodeoxygenation[J]. Catalysis Communications, 2013, 33(4): 15-19. |
| [10] |
CHENG X, WANG D, LIU J, et al. Ultra-small Mo2N on SBA-15 as a highly efficient promoter of low-loading Pd for catalytic hydrogenation[J]. Nanoscale, 2018, 10(47): 22348-22356. DOI:10.1039/C8NR06916F |
| [11] |
ZHANG L, LIU R H, YIN R H, et al. Upgrading of bio-oil from biomass fast pyrolysis in China: A review[J]. Renewable and Sustainable Energy Reviews, 2013, 24(1): 66-72. |
| [12] |
CHEN Y X, ZHENG Y, LI M, et al. Arene production by W2C/MCM-41-catalyzed upgrading of vapors from fast pyrolysis of lignin[J]. Fuel Processing Technology, 2015, 134: 46-51. DOI:10.1016/j.fuproc.2014.12.017 |
| [13] |
LIANG C H, YING P L, LI C. Nanostructured beta-Mo2C prepared by carbothermal hydrogen reduction on ultrahigh surface area carbon material[J]. Chemistry of Materials, 2002, 14(7): 3148-3151. DOI:10.1021/cm020202p |
| [14] |
WU S K, LAI P C, LIN Y C, et al. Atmospheric hydrodeoxygenation of guaiacol over alumina-, zirconia-, and silica-supported nickel phosphide catalysts[J]. ACS Sustainable Chemistry & Engineering, 2013, 1(3): 349-358. |
| [15] |
GAO D, SCHWEITZER C, HWANG H T, et al. Conversion of guaiacol on noble metal catalysts: reaction performance and deactivation studies[J]. Industrial & Engineering Chemistry Research, 2014, 53(49): 18658-18667. |
| [16] |
GRACA I, LOPES J M, CERQUEIRA H S, et al. Bio-oils upgrading for second generation biofuels[J]. Industrial & Engineering Chemistry Research, 2013, 52(1): 275-287. |
| [17] |
MATSUMOTO R, NISHIZAWA Y, KATAOKA N, et al. Reproducibility of XPS analysis for film thickness of SiO2/Si by active Shirley method[J]. Journal of Electron Spectroscopy and Related Phenomena, 2016, 207: 55-59. DOI:10.1016/j.elspec.2015.12.008 |
| [18] |
ZHANG C, LAINE R M. Hydrosilylation of allyl alcohol with[HSiMe2OSiO1.5]8: octa (3-hydroxypropyldimethylsiloxy) octasilsesquioxane and its octamethacrylate derivative as potential precursors to hybrid nanocomposites[J]. Journal of the American Chemical Society, 2000, 122(29): 6979-6988. DOI:10.1021/ja000318r |
| [19] |
LEE J S, LEE K H, LEE J Y. Selective chemisorption of carbon monoxide and hydrogen over supported molybdenum carbide catalysts[J]. The Journal of Physical Chemistry, 1992, 96(1): 362-366. DOI:10.1021/j100180a067 |
| [20] |
CHENG R, HE H, PU Z, et al. Shrunken hollow Mo-N/Mo-C nanosphere structure for efficient hydrogen evolution in a broad pH range[J]. Electrochimica Acta, 2019, 298: 799-805. DOI:10.1016/j.electacta.2018.12.128 |
| [21] |
AFANASIEV P. New single source route to the molybdenum nitride Mo2N[J]. Inorganic chemistry, 2002, 41(21): 5317-5319. DOI:10.1021/ic025564d |
| [22] |
LEE Y, NGUGEN T, KHODAKOV A, ADESINA A. Physicochemical attributes of oxide supported Mo2N catalysts synthesised via sulphide nitridation[J]. Journal of Molecular Catalysis A: Chemical, 2004, 211(1/2): 191-197. |
| [23] |
WEI Z B Z, GRANGE P, DELMON B. XPS and XRD studies of fresh and sulfided Mo2N[J]. Applied Surface Science, 1998, 135(1-4): 107-114. DOI:10.1016/S0169-4332(98)00267-0 |
| [24] |
SHE X, LIU L, JI H, et al. Template-free synthesis of 2D porous ultrathin nonmetal-doped g-C3N4 nanosheets with highly efficient photocatalytic H2 evolution from water under visible light[J]. Applied Catalysis B: Environmental, 2016, 187: 144-153. DOI:10.1016/j.apcatb.2015.12.046 |
| [25] |
FRAPPER G, PELISSIER M, HAFNER J. CO adsorption on molybdenum nitride's γ-Mo2N(100) surface: Formation of NCO species: A density functional study[J]. The Journal of Physical Chemistry B, 2000, 104(50): 11972-11976. DOI:10.1021/jp0026179 |
| [26] |
CHEN X, QI J, WANG P, et al. Polyvinyl alcohol protected Mo2C/Mo2N multicomponent electrocatalysts with controlled morphology for hydrogen evolution reaction in acid and alkaline medium[J]. Electrochimica Acta, 2018, 273: 239-247. DOI:10.1016/j.electacta.2018.04.033 |
| [27] |
HADA K, NAGAI M, OMI S. XPS and TPR studies of nitridedmolybdena-alumina[J]. The Journal of Physical Chemistry B, 2000, 104(9): 2090-2098. DOI:10.1021/jp993631s |
| [28] |
SHI C, ZHU A, YANG X, et al. On the catalytic nature of VN, Mo2N, and W2N nitrides for NO reduction with hydrogen[J]. Applied Catalysis A: General, 2004, 276(1/2): 223-230. |
| [29] |
KIM G-T, PARK T-K, CHUNG H, et al. Growth and characterization of chloronitroaniline crystals for optical parametric oscillators: Ⅰ. XPS study of Mo-based compounds[J]. Applied Surface Science, 1999, 152(1/2): 35-43. |
| [30] |
MYUKULA A C, BO X, GUO L. Highly active non-precious metal electrocatalyst for the hydrogen evolution reaction based on nitrogen-doped graphene supported MoO2/WN/Mo2N[J]. Journal of Alloys and Compounds, 2017, 692: 614-621. DOI:10.1016/j.jallcom.2016.09.079 |
| [31] |
LU M, SUN Y, ZHANG P, et al. Hydrodeoxygenation of guaiacol catalyzed by high-loading Ni catalysts supported on SiO2-TiO2 binary oxides[J]. Industrial & Engineering Chemistry Research, 2019, 58(4): 1513-1524. |
| [32] |
董婷. Ni2P/SiO2催化剂上愈创木酚的加氢脱氧研究[D]. 大连: 大连理工大学, 2014. DONG T. Silica supported Ni2P catalysts for liquid phase hydrodeoxygenation of guaiacol[D]. Dalian: Dalian University of Technology, 2014. |
| [33] |
CHEN X, ZHANG T, YING P, et al. A novel catalyst for hydrazine decomposition: molybdenum carbide support on gamma-Al2O3[J]. Chemical Communications, 2002, 3(3): 288-289. |
| [34] |
MARGOLESE D, MELERO J A, CHRISTIANSEN S C, et al. Direct syntheses of ordered SBA-15 mesoporous silica containing sulfonic acid groups[J]. Chemistry of Materials, 2000, 12(8): 2448-2459. DOI:10.1021/cm0010304 |
| [35] |
TIAN C, LU C, WANG B, et al. Mesoporous carbon nitride as a basic catalyst in dehydrochlorination of 1, 1, 2-trichloroethane into 1, 1-dichloroethene[J]. Rsc Advances, 2015, 5(126): 103829-103833. DOI:10.1039/C5RA22214A |
| [36] |
WANG Y, WANG X, ANTONIETTI M. Polymeric graphitic carbon nitride as a heterogeneous organocatalyst: From photochemistry to multipurpose catalysis to sustainable chemistry[J]. Angewandte Chemie International Edition, 2012, 51(1): 68-89. DOI:10.1002/anie.201101182 |




