臭氧(O3)以其强氧化性[1]和不产生二次污染等优势,在饮用水消毒、去除异味和脱色方面得到广泛应用,但在含有毒、难降解有机物污水处理方面应用很少,主要是因为臭氧在水中相对低的溶解度和不稳定性及O3氧化的选择性限制了其应用范围[2]。分子O3对有机物的氧化选择性导致部分有机物不能被O3氧化,大多数有机物在臭氧化过程中降解为小分子醛、有机酸及酮等[3],不易矿化为CO2[4]。为了提高臭氧化效率及污水矿化度,研究者对开发臭氧高级氧化技术(如O3/H2O2、UV/O3、催化臭氧化等)给予了很大关注,目的是促进O3分解形成更多的羟基自由基(•OH),由于•OH比O3氧化能力更强,且对有机物的氧化无选择性,因此与大多数有机物反应更快,矿化能力更强。研究发现[5],过渡金属氧化物能催化O3产生•OH及其它自由基。在催化臭氧化体系中,污染物的去除有多种途径[6, 7],有分子O3直接氧化,更有自由基的间接氧化;有机污染物可以在催化剂表面被氧化,也可能被催化剂吸附后再被氧化。由于催化臭氧化技术的复杂性,到目前为止仍处于实验室研究阶段,为促进催化臭氧化技术的工业应用,需要进一步对催化剂的催化性能及机理进行研究。
水杨酸(Salicylic acid, SA)是一种重要的工业原料,广泛应用于农业、医药、精细化工等行业,同时也对环境造成了污染。SA与分子O3反应很慢(反应速率常数为600 L·mol-1·s-1),而易与•OH反应(反应速率常数为2.2×1010 L·mol-1·s-1)[6],故常被作为测定羟基自由基的探针。因此,研究以SA为模型化合物,用制备的四种负载型催化剂进行催化臭氧化实验,对催化剂进行了表征,考察了催化臭氧化降解效果及影响因素,分析了催化机理,以期为有毒、难降解有机污水的处理提供一种有应用前景的方法。
2 实验部分 2.1 材料与药品SA,天津市凯通化学试剂有限公司;硝酸铜(Cu(NO3)2·3H2O),上海迈瑞尔化学技术有限公司;硝酸钴(Co(NO3)2·6H2O)、硝酸镍(Ni(NO3)2·6H2O),江阴市通途商贸有限公司;50%硝酸锰(Mn(NO3)2)溶液,天津市东丽区天大化学试剂厂;纳米氧化铝(γ-Al2O3,颗粒尺寸10~20 nm,纯度≥99.99%),宣城晶瑞新材料有限公司。本实验所用试剂均为分析纯,实验用水为去离子水。
2.2 催化剂制备采用等体积浸渍法:将γ-Al2O3于110℃下干燥2 h。称取10 g干燥的γ-Al2O3于烧杯中,分别按10%(质量分数)的金属氧化物负载量称取Cu(NO3)2·3H2O、Co(NO3)2·6H2O、Ni(NO3)2·6H2O及50%Mn(NO3)2,用水配制成与γ-Al2O3等体积的水溶液加入烧杯中,先用磁力搅拌器搅拌4 h,再超声分散1 h,常温静置24 h。将所得浆体蒸发除去水分,110 ℃干燥6 h,再于马弗炉中550℃煅烧2 h,得γ-Al2O3负载Cu、Co、Ni和Mn氧化物的催化剂。
2.3 催化剂表征催化剂的相组成:采用布鲁克D8 QUEST型X射线单晶衍射仪进行测定,条件:Cu靶,Kα射线,管电压50 kV,管电流40 mA,光源波长0.15418 nm,扫描速率4°·min-1,步长0.02°,扫描范围20°~70°。
催化剂的比表面积:采用贝士德全自动氮吸附比表面积测试仪(3H-2000III)测定,条件:进气流量90 mL·min-1,脱气1 h,电流90 mA。
催化剂的金属氧化物含量:准确称取0.2~0.3 g催化剂样品于聚四氟乙烯消解罐中,加15 mL王水混匀,用美国CEM MARSX-press密闭微波消解仪消解。用电热板赶酸,定容至100 mL。采用日本岛津Varian 715-ES等离子体发射光谱仪对溶液中的金属离子进行定量分析。条件:功率1.00 kW,等离子气流量15.0 L·min-1,辅助气流量1.50 L·min-1,雾化气200 kPa,泵速15 r·min-1,读数三次。
催化剂的电荷零点:采用盐滴定法测定[9]。配制20 mmol·L-1的NaNO3溶液,用NaOH或H2SO4调pH为2,3,4,5,6,7,8,9,10,11;加入1.0%的催化剂;观察pH变化,稳定后记录pH,求△pH。
催化剂的吸附性能:分别准确称取0.5~2 g催化剂于四个干燥的具塞锥形瓶中,加入等体积不同浓度一定pH的SA溶液,将锥形瓶置于水浴恒温振荡器中振荡1 h,过滤, 测定滤液的SA浓度,计算平衡吸附量qe和平衡浓度Ce。
2.4 臭氧化实验反应器为圆柱体(φ50 mm×500 mm),总容积0.8 L,砂芯曝气板于反应器底部曝气,O3由山东绿邦NPF3W型臭氧发生器产生。实验前先用臭氧预处理反应器10 min。将600 mL一定浓度的SA水溶液置于反应器中,加入催化剂。启动臭氧发生器,调节氧气流量,由IDEAL-2000型臭氧在线检测仪测定O3含量,稳定后开始氧化反应,定时取样,过滤后进行UV或COD测定。溶液pH用磷酸盐调节。
2.5 分析方法UV296测定:采用日本UV-2450PC型紫外-可见分光光度计,在波长200~400 nm对SA及中间产物2, 3-二羟基水杨酸、2, 5-二羟基水杨酸及邻苯二酚等[10]的水溶液进行扫描,最大吸收波长均在296 nm附近,故测定试样在296 nm的吸光度。
COD测定:按《水质化学需氧量的快速测定方法》(HJ/T 399-2007)中比色皿分光光度法测定。
3 结果与讨论 3.1 催化剂的性质 3.1.1 催化剂的基本性质载体γ-Al2O3及制备的四种催化剂的比表面积、金属氧化物含量及电荷零点(PZC)见表 1。经过等体积浸渍后,催化剂的金属氧化物含量与理论值(10%)相差不大,相对偏差均在10%以内。经过浸渍和煅烧后,获得的催化剂的比表面积相对于载体γ-Al2O3要低得多,可能是由于金属氧化物晶体的形成对载体孔道的阻塞或占据吸附活性位点造成的。与载体γ-Al2O3的PZC相比,C1、C2、C3催化剂的PZC只有轻微变化,而负载MnO2的催化剂的PZC低于其它催化剂及载体γ-Al2O3的PZC。
| 表 1 催化剂种类及基本性质 Table 1 Structural and textural properties of the prepared catalysts |
对制备的C1、C2、C3、C4四种催化剂进行X射线单晶衍射,得催化剂的XRD图谱,如图 1所示。

|
图 1 催化剂的XRD图谱 Fig.1 X-ray powder diffraction patterns of the prepared catalysts |
由图 1可见,在C1,C2,C3,C4中,均有γ-Al2O3的衍射峰,且分别出现了NiO、CuO、Co3O4和MnO2的多个衍射峰,说明镍、铜、钴、锰四种金属氧化物催化剂均已负载在γ-Al2O3上,且分散性较好;四种催化剂的最大特征衍射峰强度从大到小的顺序为CuO > Co3O4 > NiO > MnO2,利用Scherrer公式对它们的特征衍射峰进行计算,得到催化剂的粒径分别为384 (NiO)、279 (CuO)、180 (Co3O4)和192 (MnO2),四种催化剂中MnO2特征衍射峰最低,粒径相对较小,表明其在载体上分散性最好。
3.1.3 催化剂的吸附性能为考察催化剂吸附能力对催化臭氧化的影响,对不同pH下催化剂吸附SA的性能进行了测定。吸附等温线见图 2。由图 2可知,pH相同时,四种催化剂与γ-Al2O3的吸附能力相差不大。但pH不同时,同种催化剂的吸附能力明显不同。随着pH的增大, 催化剂的吸附能力显著降低。相对来说, 同一pH时, C4吸附能力最大,C2最差。原因可能是:溶液的pH小于催化剂的PZC时,金属氧化物表面会形成Me-OH2+,导致其表面带正电,pH大于PZC时,金属氧化物表面形成Me-O-,带负电,溶液pH越小,催化剂表面带的正电荷越多,对SA-的静电引力越强,导致催化剂的吸附能力越大。

|
图 2 不同pH下催化剂的吸附等温线 Fig.2 Adsorption isotherms for the prepared catalysts at different pH |
图 3是不同pH的SA水溶液进行单独臭氧化的降解结果。其他条件相同时,在pH 2~8,UV296及COD去除率均随pH的增大呈现先升高后降低的关系。pH=6时,UV296去除效果最好,60 min去除率为51.1%,而pH=8时,COD去除率效果最好,60 min去除率为40.1%。在酸性条件下,以O3直接氧化为主,随着pH的增加,O3被OH-引发产生HO2•的能力增强,进一步产生的•OH量增多[9],故在低pH时,随着pH的增大,降解效果越来越好。当pH超过8时,O3在水中的分解速度变快,•OH之间及•OH与HO2-之间会产生链式反应,导致用于氧化SA及中间物的有效•OH减少,故pH超过8时,UV296及COD去除率反而下降。SA分子解离的pKa=2.98,当pH大于2.98时,SA分子解离形成SA-的数量增多,pH=6时, 99.9%的SA解离,虽然O3与SA反应速率常数很小,但与SA-的反应速率常数高达2.8×104 L·mol-1·s-1。故在pH=6时,水溶液中既有大量的O3存在,又产生了较多的•OH,而SA几乎全部解离为SA;综合作用的结果使得UV296在pH=6的去除率最高。pH=8时,O3分解产生•OH的速率增大,降解过程产生的小分子甲酸、乙酸等几乎不与O3反应[10],但容易被•OH矿化,因此, pH=8的COD去除率高于6。

|
图 3 pH对单独臭氧化降解SA效果的影响 Fig.3 Effects of pH on the ozonation degradation of SA (cO3=21.7 mg·L-1 VO3=0.4 L·min-1 c0=3 mmol·L-1 T=28℃) |
γ-Al2O3常作为催化剂载体,但本身也具有催化性能。图 4是γ-Al2O3催化臭氧化的实验结果。在实验条件下,UV296和COD去除率均呈先稍增大后降低的趋势,但在2.5 g·L-1时,与无催化剂的单独臭氧化相比,UV296和COD去除率均明显增大。这与Shahidi等[13]的研究结果一致。因为催化剂投加量增大,为催化臭氧化反应提供了更多的表面羟基基团和Lewis酸位作为表面活性位,加速O3在催化剂表面的吸附与分解,生成更多的•OH[14],从而促进SA的降解。而当催化剂投加量超过一定值后,一方面会造成催化剂颗粒的团聚,另一方面,对于一定量的O3所需要的表面活性位是有限的,所以催化剂投加量过多时,会加速O3的分解,导致降解效果变差[15]。本实验催化剂投加量取2.5 g·L-1。

|
图 4 γ-Al2O3投加量对UV296及COD去除率的影响 Fig.4 Effects of γ-Al2O3 dosage on UV296 and COD removal rates (cO3=15.7 mg·L-1 VO3=0.8 L·min-1 c0=3 mmol·L-1 T=28℃ pH=8 t=60 min) |
图 5是单独臭氧化(NC)与包括载体γ-Al2O3在内的五种催化剂催化臭氧效果的比较。相同条件下,与单纯臭氧化相比,五种催化剂均有较好的催化效果;其中,C4效果突出,催化臭氧化20 min(UV296和COD去除率分别为82.9%和59.7%)与单独臭氧化60 min(UV296和COD去除率分别为85.7%和60.7%)的结果几乎一致,而C1、C2、C3的催化效果相差不大,均好于γ-Al2O3。

|
图 5 不同催化剂对SA降解效果的影响 Fig.5 Effects of different catalysts on SA degradation (cO3=15.7 mg·L-1 VO3=0.8 L·min-1 c0=3 mmol·L-1 T=28℃ pH=8 dC=2.5 g·L-1) |
C4的高催化臭氧化活性可能是因为MnO2不仅可促使O3产生更多的·OH,而且本身可作为氧化剂,有氧化脱氢作用,可氧化醇类、酚类等有机物[16, 17]。而SA在•OH作用下,羧基被羟基取代发生脱羧反应会生成酚类物质。MnO2可将生成的酚类有机物先吸附在表面形成前躯体,通过电子转移形成自由基中间体后,进一步反应得醌类物质。生成的醌类物质可被•OH氧化开环,生成甲酸、乙酸等, 最后被氧化生成二氧化碳和水。在此过程中,形成前驱体或电子转移是反应速率的决定步骤[18],而C4催化剂较好的吸附性能为形成前驱体提供了有利条件。
3.2.2.3 pH对催化臭氧化的影响图 6为四种催化剂在不同pH下进行催化臭氧化SA的浓度变化曲线。可看出,对于C1、C2、C3三种催化剂来说,在其他条件相同时,SA浓度变化率与溶液pH的关系有相同趋势,即SA浓度变化依次减小的顺序为pH=8→pH=6→pH=4→pH=10。pH为8时,SA浓度变化最大,这与单独臭氧化pH=6时降解效果最好有所不同。而对于C4, pH在4、6、8时,SA浓度变化曲线基本重合,都有很好的降解效果,且比pH=10时的降解效果优异得多。
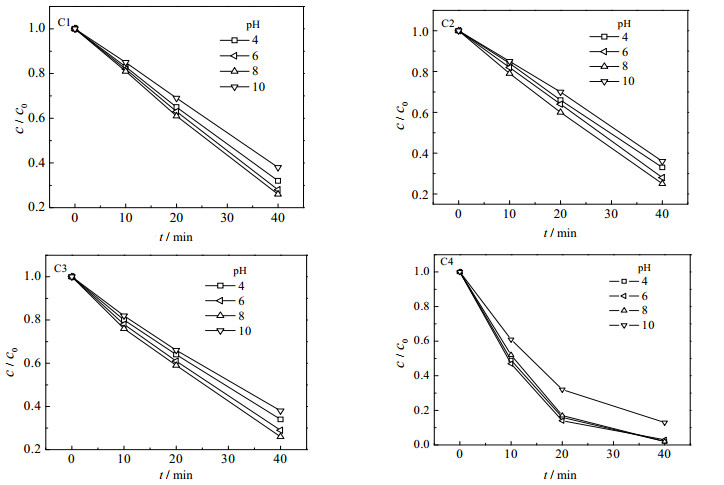
|
图 6 pH对催化臭氧化降解SA效果的影响 Fig.6 Effect of pH on catalytic ozonation degradation of SA (cO3=15.7 mg·L-1 VO3=0.8 L·min-1 c0=3 mmol·L-1 T=18℃ dC=2.5 g·L-1) |
对于多相催化臭氧化过程,溶液pH影响非常复杂。一方面,pH对水溶液中O3的反应方式和反应动力学有重要影响:pH比较低时,O3分子仅选择性地与化合物表面特定亲电子基团、亲质子基团和偶极加成基团进行反应[19],溶液为碱性时,O3分解产生•OH;另一方面,pH对金属氧化物表面性质影响很大:pH不同,金属氧化物表面羟基基团(Me-OH)反应方式也不同[20]:
| $ {\rm{Me}}-{\rm{OH}} + {{\rm{H}}^ + } \leftrightarrow {\rm{Me}}-{\rm{OH}}_2^ +, \;\;\;\;\;{\rm{PH}} < {\rm{PZC}} $ | (1) |
| $ {\rm{Me}}-{\rm{OH}} + {\rm{O}}{{\rm{H}}^-} \leftrightarrow {\rm{Me}}-{{\rm{O}}^ - } + {{\rm{H}}_2}O, \;\;\;\;\;{\rm{PH}} > {\rm{PZC}} $ | (2) |
在溶液pH低于催化剂PZC时,金属氧化物表面的活性基团为Me-OH2+,Me-OH2+能有效促进溶液中O3分解产生•OH[21];pH在低于催化剂PZC范围内升高,O3自身产生的•OH量也增大,故在pH低于PZC时,随着pH的增大催化效果逐渐变好。当pH超过催化剂的PZC时,金属氧化物表面的活性中心变为Me-O-,原活性中心消失。此外,pH增大,吸附能力减小,故在pH大于PZC时,随着pH的增大催化效果变差。
为考察C4催化剂稳定性,进行了多组重复性实验,结果表明SA初始浓度为3 mmol·L-1,MnO2投加量为2.5 g·L-1,溶液pH为4~8,O3投加量为12.56 mg·min-1时,反应60 min,溶液UV296去除率均在98.0%以上,而COD去除率也均超过88.0%。
3.3 催化机理分析催化臭氧化降解水中有机物的作用机理有以下两种[22]:(1)固体催化剂仅作为吸附剂,将水中的有机物富集到催化剂表面,O3及自身产生的•OH对有机物进行氧化降解;(2)催化剂促进O3产生•OH, •OH与吸附的有机物进行反应。
从实验吸附数据看,随着pH的增大,各催化剂吸附SA的能力均变差,同一pH, 吸附能力从大到小依次为:C4 > C1 > C3 > γ-Al2O3 > C2,但吸附能力差别不大;而各催化剂对SA的催化臭氧化降解效果在pH=8时最好,从大到小依次为:C4 > C1=C2=C3 > γ-Al2O3。可以看出,催化降解效果与吸附能力有一定关系,C4的吸附能力最大,催化降解效果也最好,但其它催化剂的催化降解效果与吸附能力之间没有明显的相关性。催化臭氧化降解效果也不是单独臭氧化与吸附作用的简单叠加,因为C4催化剂的吸附能力与其他催化剂差别不大,但催化降解效果却突出很多,故催化剂的较好吸附性能并不是降解率高的决定因素,这一结果与隋铭皓等的结论一致[23]。根据催化剂性质、吸附效果及pH的影响分析可以推断,本实验的五种催化剂均催化臭氧产生了更多的•OH,SA的降解效果是催化剂的吸附性能与催化O3产生•OH的能力共同作用的结果。
4 结论载体γ-Al2O3及分别负载镍、铜、钴、锰氧化物的4种催化剂对臭氧化降解模拟水中的SA均有较好的催化作用,且C4的催化降解效果最好。降解效果主要受催化剂种类及溶液pH的影响。SA初始浓度为3 mmol·L-1,C4投加量为2.5 g·L-1,溶液pH为4~8,O3投加量为12.56 mg·min-1,反应60 min,溶液UV296去除率达到98.0%以上,COD去除率超过88.0%。机理分析可知,SA的催化臭氧化降解效果与催化剂的吸附能力有一定关系,但不是单独臭氧化与吸附作用的简单叠加,而是催化剂的吸附性能与催化O3产生•OH的能力共同作用的结果。
| [1] | PAN Yan-bo(潘延波), LIU Jing-jun(刘敬军), HUANG Zhi-yu(黄志钰) . Kinetics study on the ozonation process of Ce3+(Ce3+的臭氧氧化动力学研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2014, 28 (5) : 998-1003 |
| [2] | Shiraga M, Kawabata T, Li D . Memory effect-enhanced catalytic ozonation of aqueous phenol and oxalic acid over supported Cu catalysts derived from hydrotalcite[J]. Appl Clay Sci , 2006, 33 (3) : 247-259 |
| [3] | LI Ying-zhi(李英芝), ZHAN Ya-li(詹亚力), ZHANG Hua(张华) . Research on organic compositions of reverse osmosis concentrates from ozonated oil refining(臭氧氧化炼厂反渗透浓水的有机组成及特性研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2014, 28 (3) : 665-670 |
| [4] | Rosal R, Gonzalo M S, Rodríguez A . Catalytic ozonation of atrazine and linuron on MnOx/Al2O3 and MnOx/SBA-15 in a fixed bed reactor[J]. Chem Eng J , 2010, 165 (3) : 806-812 DOI:10.1016/j.cej.2010.10.020 |
| [5] | Pocostales P, Álvarez P, Beltrán F J . Catalytic ozonation promoted by alumina-based catalysts for the removal of some pharmaceutical compounds from water[J]. Chem Eng J , 2011, 168 (3) : 1289-1295 DOI:10.1016/j.cej.2011.02.042 |
| [6] | Pera-Titus M, García-Molina V, Baños M A . Degradation of chlorophenols by means of advanced oxidation processes:a general review[J]. Appl Catal B:Environ , 2004, 47 (4) : 219-256 DOI:10.1016/j.apcatb.2003.09.010 |
| [7] | Rajeswari R, Kanmani S . A study on synergistic effect of photocatalytic ozonation for carbaryl degradation[J]. Desalination , 2009, 242 (1) : 277-285 |
| [8] | Jen J, Leu M-F, Yang T C . Determination of hydroxyl radicals in an advanced oxidation process with salicylic acid trapping and liquid chromatography[J]. J Chromatogr A , 1998, 796 (2) : 283-288 DOI:10.1016/S0021-9673(97)01019-4 |
| [9] | Avramescu S M, Mihalache N, Bradu C . Catalytic ozonation of acid red 88 from aqueous solutions[J]. Catal Lett , 2009, 129 (3-4) : 273-280 DOI:10.1007/s10562-008-9812-y |
| [10] | ZHANG Pei-long (张培龙). Study on the treatment of RO concentrated water from refinery by ozonation and influencing factors (臭氧化处理炼油厂反渗透浓水及·OH 生成影响因素的研究) [D]. Taian (泰安): Shandong Agricultural University (山东农业大学),2013 |
| [11] | Von Sonntag C, Von Gunten U . Chemistry of ozone in water and wastewater treatment[M]. London: IWA Publishing, 2012 : 22 -27. |
| [12] | ZHUANG Lin-yi(庄琳懿), MA Qian(马前), SONG Wei-feng(宋卫峰) . Study on the ultrasound-assisted electro-catalyticx xidation of salicylic acid in water(超声辅助电催化氧化降解水杨酸的研究)[J]. Sichuan Environment(四川环境) , 2006, 25 (5) : 4-8 |
| [13] | Shahidi D, Roy R, Azzouz A . Total removal of oxalic acid via synergistic parameter interaction in montmorillonite catalyzed ozonation[J]. J Environ Chem Eng , 2014, 2 (1) : 20-30 DOI:10.1016/j.jece.2013.11.020 |
| [14] | Muruganandham M, Wu J J . Synthesis, characterization and catalytic activity of easily recyclable zinc oxide nanobundles[J]. Appl Catal B:Environ , 2008, 80 (1-2) : 32-41 DOI:10.1016/j.apcatb.2007.11.006 |
| [15] | HE Guang-yu(何光裕), HOU Jing-hui(侯景会), HUANG Jing(黄静) . Preparation and visible-light driven photocatalytic properties of ZnO/graphene oxide composite(ZnO/氧化石墨烯复合材料的制备及其可见光催化性能)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2013, 27 (4) : 663-668 |
| [16] | Taylor R J, Reid M, Foot J . Tandem oxidation processes using manganese dioxide:discovery, applications, and current studies[J]. Acc Chem Res , 2005, 38 (11) : 851-869 DOI:10.1021/ar050113t |
| [17] | Ukrainczyk L, McBride M B . The oxidative dechlorination reaction of 2, 4, 6-trichlorophenol in dilute aqueous suspensions of manganese oxides[J]. Environ Toxicol Chem , 1993, 12 (11) : 2005-2014 DOI:10.1002/etc.v12:11 |
| [18] | XIAO Li-min (肖利民).Studies on preparation and selective oxidation characteristic of active manganese dioxide (活性二氧化锰的 制备及其选择性氧化性能的研究)[D].Changsha (长沙):Hunan Normal University (湖南师范大学),2012. |
| [19] | Staehelin J, Bühler R, Hoigné J . Ozone decomposition in water studied by pulse radiolysis. 2. hydroxyl and hydrogen tetroxide(HO4) as chain intermediates[J]. J Phys Chem , 1984, 88 (24) : 5999-6004 DOI:10.1021/j150668a051 |
| [20] | Naydenov A, Mehandjiev D . Complete oxidation of benzene on manganese dioxide by ozone[J]. Appl Catal A:Gen , 1993, 97 (1) : 17-22 DOI:10.1016/0926-860X(93)80063-V |
| [21] | Sui M H, Sheng L, Lu K X . FeOOH catalytic ozonation of oxalic acid and the effect of phosphate binding on its catalytic activity[J]. Appl Catal B:Environ , 2010, 96 (1-2) : 94-100 DOI:10.1016/j.apcatb.2010.02.005 |
| [22] | Legube B, Karpel Vel Leitner N . Catalytic ozonation:a promising advanced oxidation technology for water treatment[J]. Catal Today , 1999, 53 (1) : 61-72 DOI:10.1016/S0920-5861(99)00103-0 |
| [23] | SUI Ming-hao(隋铭皓), MA Jun(马军), SHENG Li(盛力) . Role of adsorption in heterogeneous catalytic ozonation process for degradation of organics in water(吸附在多相催化臭氧氧化降解有机物中的作用)[J]. China Water & Waste Water(中国给水排水) , 2007, 22 (23) : 99-102 |




