氯唑西林钠(cloxacillin sodium),为白色或类白色结晶性粉末,有引湿性。在临床上主要用于治疗耐青霉素酶的金黄色葡萄球菌所致的败血症、心内膜炎、呼吸道感染和皮肤软组织感染等[1]。目前,国产氯唑西林钠的澄清度不能达到中国药典对氯唑西林钠的要求,产品普遍存在纯度低、溶剂残留严重等质量问题。产生这一问题的根源在于工厂生产的氯唑西林钠产品外观形态不规则,晶习不完整。晶体产品的晶习至关重要[2],尤其对于医药产品而言,控制产品晶习不仅可以提高有效成分浓度[3-4],而且还会影响产品特性溶出速率[5]。晶体产品的晶习是由分子内部结构和外部因素共同决定的,在众多外部因素中,溶剂是主要的影响因素之一。比如KERALIYA等[6]研究了不同溶剂对甲苯磺丁脲晶习的影响,国内外一些学者也通过实验或理论研究了不同溶剂对晶习的影响[4, 7-11]。因此,研究不同溶剂体系对晶体晶习的影响具有重要意义。
为了研究氯唑西林钠产品晶习不完整导致产品质量不合格的问题,本文首先测定了氯唑西林钠在4种不同溶剂体系中的溶解度,通过氯唑西林钠的热力学分析,筛选出适用于氯唑西林钠结晶的溶剂体系。其次,在氯唑西林钠溶解度研究的基础上,研究了不同溶剂对氯唑西林钠晶习的影响,筛选出适合工业化生产的最优晶习。最后通过X射线粉末衍射(X-ray diffraction spectrum, XRD)分析,判定所得到的不同晶习产品的晶型,并通过热重分析(thermogravimetry and differential thermal analysis, TG-DTA)对氯唑西林钠晶体进行了热分析研究。上述研究不仅为进一步提高氯唑西林钠产品质量和工艺优化提供了基础数据,而且为性质和生产工艺与氯唑西林钠相似的氨苄西林钠、美洛西林钠等产品的研究提供了研究思路和数据参考。
2 实验部分 2.1 实验装置与药品 2.1.1 实验装置测量氯唑西林钠溶解度的实验装置如图 1所示。该实验装置主要由两部分组成:恒温溶解体系和激光辅助监测体系。利用激光辅助监测体系,可以监测实验过程中溶解度的溶解终点。上述设备的规格型号与精度等参数见表 1。
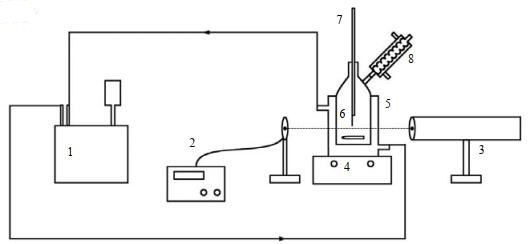
|
图 1 溶解度测定实验装置图 Fig.1 Schematic diagram of the experimental setup for solubility measurement 1. super thermostatic water bath 2. laser receiver and recorder 3. laser generator 4. magnetic stirrer 5. jacketed glass vessel 6. magnetic stir bar 7. mercury-in-glass thermometer 8. condenser |
|
|
表 1 氯唑西林钠溶解度测定实验设备一览表 Table 1 Equipment for the measurement of cloxacillin sodium solubility |
实验药品与试剂:氯唑西林钠(自己合成,纯度 > 99%),试剂(分析纯,西安化学试剂厂)。
2.2 实验方法与步骤 2.2.1 溶解度测定方法与步骤将一定量的溶剂准确称量后加入结晶器中,开启磁力搅拌,待体系温度恒定在预设温度30 min后,打开激光监视体系,由晶体管激光器产生的激光束从一侧进入结晶器,从另一侧透射后由光电转换器接收,并转换成电信号后由光强器显示光强数值。称量一定量的氯唑西林钠加入到结晶器中,待氯唑西林钠完全溶解后,向结晶器中加入少量精确称量的固体物质,悬浮于液体中的固体颗粒反射和遮蔽了入射激光的大部分甚至全部,光强显示器上的读数突然降低,随着固体粒子的逐渐溶解,光强又开始升高,当光强达到最大值时重复上述加料过程,直至光强读数稳定20 min且未能达到最大值,此时记录加入的溶质总量。为保证准确性,每个温度点的溶解度数据重复测定3次。氯唑西林钠在溶剂中的摩尔分率溶解度x采用式(1)计算得到:
| $ x = \frac{{m/M}}{{m/M + {m_{\rm{A}}}/{M_{\rm{A}}}}} $ | (1) |
式中:m为溶质氯唑西林钠的质量,M为溶质氯唑西林钠的摩尔质量,mA为溶剂(无水乙醇、丙醇、异丙醇或丙酮)的质量,MA为溶剂(无水乙醇、丙醇、异丙醇或丙酮)的摩尔质量。
2.2.2 晶习研究方法与步骤针对目前氯唑西林钠产品中存在的问题,为优化氯唑西林钠的生产工艺提供基础数据,本文考察了不同溶剂体系对氯唑西林钠晶体晶习的影响。实验所用的溶剂体系有:吡啶-乙酸丁酯,水-四氢呋喃,甲醇-无水乙醚,甲醇-乙酸丁酯,甲醇-乙酸乙酯,乙酸乙酯,乙醇。实验过程中,对于二元溶剂体系采用的是溶析结晶的方法,即把产品氯唑西林钠溶于相应溶剂中,待氯唑西林钠完全溶解后向其溶液中滴加溶析剂,随着溶析剂的加入氯唑西林钠在二元溶剂中的溶解度降低,最终析出氯唑西林钠固体。乙酸乙酯溶剂体系中采用的是反应结晶的方法,首先向氯唑西林钠的水溶液中加入乙酸乙酯,然后向其中滴加稀硫酸,经酸化萃取后得到氯唑西林酸的乙酸乙酯溶液,最后向氯唑西林酸的乙酸乙酯溶液中滴加异辛酸钠的乙酸乙酯溶液,反应得到氯唑西林钠固体。乙醇溶剂体系中采用的是冷却结晶的方法,即把产品氯唑西林钠加入到乙醇溶液中高温使其溶解,然后降低温度,随着温度的降低氯唑西林钠在乙醇中的溶解度降低,并析出氯唑西林钠固体。
实验结束后,对不同晶习氯唑西林钠产品进行XRD图谱分析,研究不同晶习产品的晶型,并进一步对其进行晶体热重分析(TG-DTA)。X-射线粉末衍射仪的扫描速率为1step/s,范围为3° ~40°(2θ)。TG-DTA分析控制氮气保护气的流速在85 mL·min-1,样品的质量为4.4 mg,测定温度范围在25~400 ℃,加热速率为10 ℃·min-1。
3 结果与讨论 3.1 氯唑西林钠的溶解度β-内酰胺抗生素在高温下容易降解[12-14],氯唑西林钠作为β-内酰胺抗生素的一种,其在298 K以下降解可以忽略不及,但是当温度高于298 K时,氯唑西林钠的降解不可忽略,且其降解随温度的升高而加速[15]。为了研究氯唑西林钠的溶解特性,并为筛选氯唑西林钠最优晶习提供基础溶剂数据,本文测定了278~298 K,氯唑西林钠在无水乙醇、丙醇、异丙醇及丙酮中的溶解度,如图 2所示。图中,xexp为氯唑西林钠在溶剂中的摩尔分数溶解度的实验值。
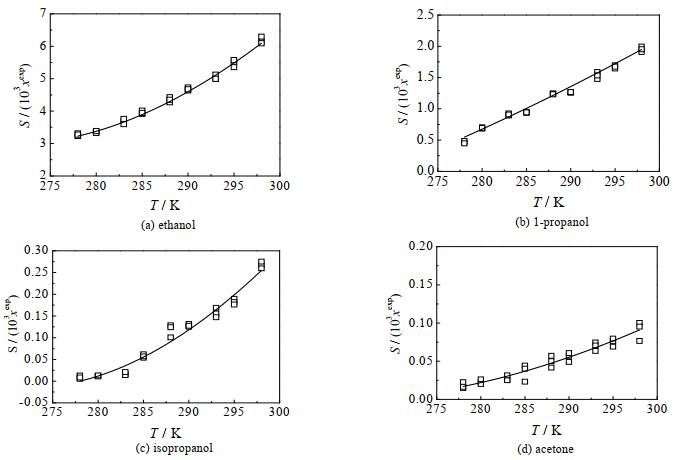
|
图 2 氯唑西林钠在溶剂中的溶解度 Fig.2 Solubility of cloxacillin sodium in pure solvents |
由图 2可以看出,氯唑西林钠在上述4种纯溶剂中的溶解度都随温度的升高而增大,在同一温度下,氯唑西林钠在这4种纯溶剂中的溶解度的大小顺序为:无水乙醇 > 丙醇 > 异丙醇 > 丙酮。对于大多数物质而言,溶解度应符合相似相溶原理,即极性溶质在溶剂中的溶解度随极性的降低而降低。查询数据手册可知[16],上述4种溶剂的极性大小为:乙醇 > 丙酮 > 丙醇 > 异丙醇。依据相似相溶原理,氯唑西林钠在乙醇、丙醇和异丙醇中的溶解度大小依次应为:乙醇 > 丙醇 > 异丙醇,在丙酮中的溶解度应在乙醇和丙醇之间。但是,实测溶解度数据显示丙酮中氯唑西林钠的溶解度最小,原因主要是溶解度除了遵循相似相溶原理外,还受到溶质溶剂物理化学性质、溶质与溶剂分子间作用力等因素的影响[17-18]。
为了便于预测其它温度下氯唑西林钠的溶解度数值,本文利用经验公式对实验测得的溶解度数据进行了数值拟合。结晶过程由于涉及固相,过程复杂,国内外许多学者通过研究大量的固液平衡基础数据提出了一些简化经验方程来预测固液平衡的溶解度数据。在这些简化经验方程中,Apelblat经验方程在拟合固液相的溶解度方面得到了广泛的应用[19-22]。因此,本文利用Apelblat经验方程[23-24]对氯唑西林钠在单溶剂中的溶解度进行数据拟合。Apelblat经验方程为:
| $ {\rm{ln}}{\kern 1pt} x = A + \frac{B}{T} + C{\kern 1pt} {\rm{ln}}{\kern 1pt} T $ | (2) |
式中:x为溶质的摩尔分数溶解度,A、B、C都为模型待定参数,T为热力学温度,单位为K。利用Apelblat经验方程,拟合氯唑西林钠在单溶剂中的溶解度,结果如图 2所示,拟合得到的模型参数和相关系数R2均列于表 2。由图 2可见,Apelblat经验方程可以很好地描述氯唑西林钠在无水乙醇、丙醇、异丙醇和丙酮4种溶剂中的溶解度。
|
|
表 2 氯唑西林钠在纯溶剂中经验方程溶解度曲线拟合参数 Table 2 Parameters of Equation 1 for cloxacillin sodium dissolution in pure solvents |
为了进一步检验Apelblat经验方程的拟合效果,利用log-logistic分布函数对Apelblat经验方程拟合结果的可靠性进行了分析。log-logistic分布函数可表示为[25-26]:
| $ F(z) = \frac{{{z^p}}}{{{a^p} + {z^p}}}, z > 0, a > 0, p \ge 1 $ | (3) |
式中:a为缩减因子,p为形状因子。log-logistic分布的概率密度函数为[25-26]:
| $ f(z) = \frac{{p{a^p}{z^{p - 1}}}}{{{{({a^p} + {z^p})}^2}}}, z > 0, a > 0, p \ge 1 $ | (4) |
将所研究的一组数据按照升序进行排列后,累积概率Pf可由平均秩法确定,即:
| $ {P_f} = \frac{i}{{I + 1}} $ | (5) |
式中:I为总的数据点数。
基于最小二乘法,利用氯唑西林钠在无水乙醇、丙醇、异丙醇和丙酮4种溶剂下溶解度预测值与实验值xpre/xexp的比值和累积概率Pf,对式(3)进行拟合,得到4种溶剂下缩减因子a、形状因子p和相关系数R2,拟合结果均列于表 2中。利用拟合得到的a和p的数值,由式(4)得到4种溶剂下Apelblat经验方程拟合结果与实验值比值xpre/xexp的概率密度函数曲线,如图 3所示。
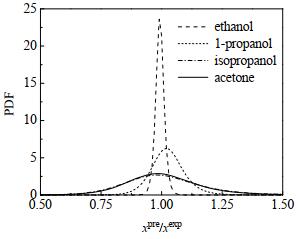
|
图 3 概率密度函数曲线 Fig.3 Curves of probability density function |
由表 2和图 3可见,Apelblat简化经验方程能很好地描述氯唑西林钠在纯溶剂中的溶解度。其中,Apelblat简化经验方程对乙醇溶剂的溶解度数据拟合效果最好,误差范围在±5%,丙醇溶剂中的溶解度数据拟合效果次之,误差在±15%,对异丙醇和丙酮溶剂中的溶解度数据拟合效果较差,误差在±25%。Apelblat简化经验方程对异丙醇和丙酮溶剂中的溶解度数据拟合效果较差原因在于,氯唑西林钠在这2种溶剂中的溶解度较小,现有仪器的测量精度带来的相对误差较大,导致实验测量数据分散性较大。
3.2 溶剂体系的选择氯唑西林钠溶解度的测定为研究其溶液结晶的方式、溶剂的选择、产品的晶习等提供了基础数据。本文根据氯唑西林钠在不同溶剂中的溶解度研究了氯唑西林钠结晶的溶剂体系的选择,并最终考察了不同溶剂体系对产品晶习等的影响。
结晶通常是指溶质从溶液中析出然后形成晶体的一个过程,不同的结晶方法选取的溶剂体系不同。对于溶析结晶,溶剂选择易于溶解氯唑西林钠的溶剂体系,溶析剂选择难以溶解氯唑西林钠的溶剂体系。此外,所选溶剂和溶析剂必须互溶。氯唑西林钠在甲醇、水和吡啶中易于溶,在乙酸丁酯、四氢呋喃、无水乙醚和乙酸乙酯中难以溶解。因此,甲醇、水和吡啶可以作为氯唑西林钠的溶剂,乙酸丁酯、四氢呋喃、无水乙醚和乙酸乙酯可以作为氯唑西林钠的溶析剂。考虑到溶析结晶还需分析溶剂和溶析剂的互溶性,将上述试剂的互溶性列于表 3。
|
|
表 3 试剂的互溶性 Table 3 Miscibility of solvents |
由表 3可知,氯唑西林钠溶析结晶的溶剂体系有:甲醇-乙酸丁酯、甲醇-四氢呋喃、甲醇-无水乙醚、甲醇-乙酸乙酯、水-四氢呋喃、吡啶-乙酸丁酯、吡啶-四氢呋喃、吡啶-无水乙醚和吡啶-乙酸乙酯。由溶析实验发现,氯唑西林钠在甲醇-四氢呋喃、吡啶-四氢呋喃、吡啶-无水乙醚和吡啶-乙酸乙酯的溶剂体系中加入约30倍的溶析剂仍然没有晶体析出。因此,上述4种溶剂体系不能作为氯唑西林钠溶析结晶的溶剂体系。基于此,本文考察了氯唑西林钠在另外5种溶剂体系(吡啶-乙酸丁酯,水-四氢呋喃,甲醇-无水乙醚,甲醇-乙酸乙酯,甲醇-乙酸丁酯)中的晶习。
工厂生产氯唑西林钠的结晶工艺是在乙酸乙酯溶剂体系中,由氯唑西林酸和异辛酸钠反应生成氯唑西林钠。由于氯唑西林钠在乙酸乙酯中不溶解,反应生成的氯唑西林钠产品作为固体析出。因此对于乙酸乙酯溶剂体系,本文考察了氯唑西林钠在乙酸乙酯体系中反应结晶的晶习。
冷却结晶应选择氯唑西林钠在溶剂中的溶解度随温度下降而明显减少的溶剂,且要求氯唑西林钠的溶解度在该溶剂中要尽可能的大,因此略溶、微溶和极微溶解的溶剂不适合做氯唑西林钠冷却结晶的溶剂。根据中国药典药物溶解度的级别[27]可知,氯唑西林钠在无水乙醇中溶解,在丙醇中略溶,在异丙醇中微溶,在丙酮中极微溶解。此外,氯唑西林钠在二元溶剂甲醇-乙酸乙酯和甲醇-乙酸丁酯中的溶解度随温度变化不大[28],不适宜采用冷却结晶的方式。由图 2可知,氯唑西林钠在乙醇中的溶解度随温度变化最为明显,溶解度较大,因此氯唑西林钠在乙醇中可以采取冷却结晶的方式。对于冷却结晶,本研究考察了氯唑西林钠在乙醇中冷却结晶的晶习。
3.3 溶剂体系对晶习的影响氯唑西林钠在上述不同溶剂体系中结晶得到的产品晶习如图 4所示。由图 4可以看出,氯唑西林钠晶体存在2种晶习——针状晶习和片状晶习。氯唑西林钠在吡啶-乙酸丁酯、甲醇-无水乙醚、水-四氢呋喃、乙酸乙酯体系中结晶得到的产品为针状晶习,见图 4。其中,水-四氢呋喃体系中的针状晶习,比较细小。甲醇-无水乙醚中的针状晶习,长径比较大,与水-四氢呋喃体系中的晶习相比,直径较大。吡啶-乙酸丁酯和乙酸乙酯中的针状晶习相似,均为类似纤维的针状。由于针状晶习的产品容易聚结和破碎,在过滤时容易堵塞滤布,使得过滤时间增大,此外容易产生溶剂包藏,使得产品溶剂残留严重,质量不能达标,因此吡啶-乙酸丁酯、甲醇-无水乙醚、水-四氢呋喃、乙酸乙酯体系都不适合作为氯唑西林钠结晶的溶剂体系。

|
图 4 氯唑西林钠不同溶剂体系下晶体的晶习 Fig.4 Crystal habit of cloxacillin sodium in different solvent systems |
氯唑西林钠在甲醇-乙酸乙酯、甲醇-乙酸丁酯和乙醇中结晶得到的产品均为片状晶习。其中,甲醇-乙酸乙酯体系中的片状晶习,产品厚度较小。甲醇-乙酸丁酯和乙醇体系中的片状产品呈长方体状,厚度相对较大。因此,优先选择甲醇-乙酸丁酯和乙醇体系作为氯唑西林钠结晶的溶剂体系。相对于针状晶习,片状晶习产品容易过滤和干燥,溶剂包藏要明显降低,利于工业化生产和提高产品质量。由此可知,氯唑西林钠的最优晶习为片状晶习。
3.4 晶体产品分析 3.4.1 晶型分析不同溶剂结晶时可能会产生多晶型[29],为了判断不同晶习的氯唑西林钠的晶型,本文对前面所得到的氯唑西林钠产品,进行XRD图谱分析,结果如图 5所示,图中XRD图谱自下而上对应的溶剂体系分别为(a)吡啶-乙酸丁酯、(b)甲醇-无水乙醚、(c)水-四氢呋喃、(d)乙酸乙酯、(e)乙醇、(f)甲醇-乙酸乙酯、(g)甲醇-乙酸丁酯。由图 5可以看出,氯唑西林钠在上述不同溶剂体系中得到的晶体产品的XRD图谱峰位置完全重合。由此可知,氯唑西林钠的上述晶习产品属于同一晶型,这一晶型产品XRD图谱的特征峰有6.9°、11.5°、13.0°和15.2°。
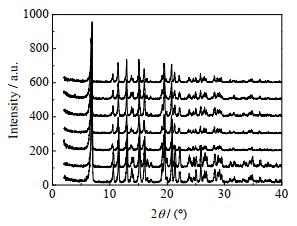
|
图 5 氯唑西林钠X-射线粉末衍射图谱 Fig.5 X-ray diffraction patterns of cloxacillin sodium |
氯唑西林钠分子中含有一个结晶水,为了研究结晶水与氯唑西林钠分子之间的关系,本文对氯唑西林钠产品进行了热重分析(TG-DTA),分析结果如图 6所示。在氯唑西林钠TG图谱中,在145~170 ℃出现了第1个失重台阶,失重量为3.6%,在163 ℃出现一个吸热峰。根据氯唑西林钠的分子式可知,氯唑西林钠中含结晶水量为3.78%。含水量与失重量两者基本相等,这表明在145~170 ℃为氯唑西林钠的脱水过程。由于脱水过程为吸热过程,需要吸收大量的热量,因此在163 ℃出现了一个吸热峰。在TG图谱中,大约189 ℃时出现了第2个失重台阶,氯唑西林钠的质量随着温度的升高急剧下降,说明该台阶为氯唑西林钠的分解失重过程,分解过程为放热过程,相应的TG图谱中在194 ℃出现一放热峰。
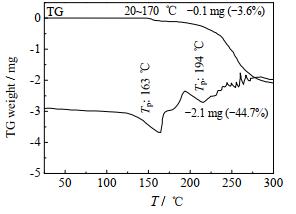
|
图 6 氯唑西林钠的TG-DTA曲线图 Fig.6 TG-DTA curves of cloxacillin sodium |
氯唑西林钠的脱水温度较高,在145~170 ℃,并且脱水后氯唑西林钠很快发生了降解,因此氯唑西林钠的结晶水为非游离态,其与氯唑西林钠分子之间结合紧密,很难除去。
4 结论(1) 氯唑西林钠在无水乙醇、丙醇、异丙醇及丙酮四种纯溶剂中的溶解度都随温度的升高而增大,利用Apelblat经验方程可以较好地拟合氯唑西林钠在上述4种溶剂中的溶解度。
(2) 不同的溶剂体系中氯唑西林钠存在2种晶习——片状晶习和针状晶习,这2种晶习的产品都属于同一种晶型。
(3) TG-DTA分析表明,氯唑西林钠的分解温度为194 ℃、脱水温度为163 ℃。
符号说明:
|
|
| [1] |
RBEUDA O, CHIAP P, LUBDA D, et al. Development and validation of a fully automated LC method for the determination of cloxacillin in human plasma using anion exchange restricted access material for sample clean-up[J]. Journal of Pharmaceutical and Biomedical Analysis, 2005, 36(5): 961-968. DOI:10.1016/j.jpba.2004.09.017 |
| [2] |
BENNEMA P, MEEKES H, BOERRIGTER SXM, et al. Crystal growth and morphology: new developments in an integrated Hartman-Perdok-connected net-roughening transition theory, supported by computer simulations[J]. Crystal Growth & Design, 2004, 4(5): 905-913. |
| [3] |
王静康, 黄向荣, 刘秉文, 等. 有机分子晶体晶习预测的研究进展[J]. 人工晶体学报, 2002, 31(3): 218-223. WANG J K, HUANG X R, LIU B W, et al. Research progress in predicting the habit of organic molecular crystals[J]. Journal of Synthetic Crystals, 2002, 31(3): 218-223. DOI:10.3969/j.issn.1000-985X.2002.03.006 |
| [4] |
YI Q H, CHEN J F, LE Y, et al. Crystal structure and habit of dirithromycin acetone solvate: A combined experimental and simulative study[J]. Journal of Crystal Growth, 2013, 372(1): 193-198. |
| [5] |
MODI S R, DANTULURI A K R, PERUMALLA S R, et al. Effect of crystal habit on intrinsic dissolution behavior of celecoxib due to differential wettability[J]. Crystal Growth & Design, 2014, 14(10): 5283-5292. |
| [6] |
KERALIYA R A, SONI T G, THAKKAR V T, et al. Effect of solvent on crystal habit and dissolution behavior of tolbutamide by initial solvent screening[J]. Dissolution Technologies, 2010, 17(1): 16-21. DOI:10.14227/DT170110P16 |
| [7] |
WINN D, DOHERTY M F. Modeling crystal shapes of organic materials grown from solution[J]. AIChE Journal, 2000, 46(7): 1348-1367. DOI:10.1002/aic.690460709 |
| [8] |
BHAT M N, DHARMAPRAKASH S M. Effect of solvents on the growth morphology and physical characteristics of nonlinear optical γ-glycine crystals[J]. Journal of Crystal Growth, 2002, 242(1/2): 245-252. |
| [9] |
NIE Q, WANG J K, WANG Y L, et al. Effects of solvent and impurity on crystal habit modification of 11α-hydroxy-16α, 17α-epoxyprogesterone[J]. Chinese Journal of Chemical Engineering, 2007, 15(5): 648-653. DOI:10.1016/S1004-9541(07)60140-2 |
| [10] |
ZHAO X, BAO Z Y, SUN C T, et al. Polymorphology formation of Cu2O: A microscopic understanding of single crystal growth from both thermodynamic and kinetic models[J]. Journal of Crystal Growth, 2009, 311(3): 711-715. |
| [11] |
杨洋, 王海生, 刘玉敏, 等. 二元混合溶剂对盐酸硫胺溶剂化物稳定性及晶习的影响[J]. 化工学报, 2018, 69(2): 570-577. YANG Y, WANG H S, LIU Y M, et al. Effect of binary solvent mixtures on stability and morphology of thiamine hydrochloride solvate[J]. CIESC Journal, 2018, 69(2): 570-577. |
| [12] |
ELMOLLA E S, CHAUDHURI M. Degradation of amoxicillin, ampicillin and cloxacillin antibiotics in aqueous solution by the UV/ZnO photocatalytic process[J]. Journal of Hazardous Materials, 2009, 173(1): 445-449. |
| [13] |
ELMOLLA E S, CHAUDHURI M. Degradation of the antibiotics amoxicillin, ampicillin and cloxacillin in aqueous solution by the photo-Fenton process[J]. Journal of Hazardous Materials, 2009, 172(2): 1476-1481. |
| [14] |
ASHNAGAR A, GHARIB N N. Analysis of three penicillin antibiotics (ampicillin, amoxicillin and cloxacillin) of several iranian pharmaceutical companies by HPLC[J]. E-Journal of Chemistry, 2007, 4(4): 536-545. |
| [15] |
ZHI M, WANG J K, WANG Y L, et al. Degradation kinetics and aqueous degradation pathway of cloxacillin sodium[J]. Chemical Engineering & Technology, 2012, 35(6): 986-990. |
| [16] |
刘光启, 马连湘, 刘杰. 化学化工物性数据手册[M]. 北京: 化学工业出版社, 2002. LIU G Q, MA L X, LIU J. Chemical and chemical physical properties data manual[M]. Beijing: Chemical Industry Press, 2002. |
| [17] |
任世宇, 陈敏, 李小兵, 等. 雄烯二酮在含大豆油的有机溶剂体系中溶解度的测定与关联[J]. 高校化学工程学报, 2018, 32(3): 507-513. REN S Y, CHEN M, LI X B, et al. Determination and correlation of androstenedione solubility in organic solvents containing soybean-oil[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(3): 507-513. DOI:10.3969/j.issn.1003-9015.2018.03.003 |
| [18] |
刘丹, 毛丽莉, 王海增. 六水氯化镁在醇类溶剂中溶解度的测定与关联[J]. 高校化学工程学报, 2018, 32(1): 24-29. LIU D, MAO L L, WANG H Z. Determination and correlation of magnesium chloride hexahydrate solubility in alcohol solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 24-29. |
| [19] |
ZHOU L N, DU S C, WANG T, et al. Measurement and correlation of solubility of meropenem trihydrate in binary (water+acetone/tetrahydrofuran) solvent mixtures[J]. Chinese Journal of Chemical Engineering, 2017, 25(10): 1461-1466. DOI:10.1016/j.cjche.2017.05.002 |
| [20] |
HONG M H, WANG K, GUO S, et al. Solubility of Pranlukast in isopropanol and isopropanol-N, N-dimethylformamide binary solvents at different temperatures[J]. Journal of Engineering and Manufacturing Technology, 2018, 6(3): 38-45. |
| [21] |
SHEKAARI H, ZAFARANI-MOATTAR M T, MOKHTARPOUR M. Comparison of the solubility of acetaminophen in some choline based deep eutectic solvents at T = (298.15 to 313.15) K[J]. Journal of Advanced Chemical and Pharmaceutical Materials, 2018, 1(2): 34-37. |
| [22] |
HUANG Y R, LAN T, ZHANG J N, et al. Determination and correlation of the solubility and thermodynamic parameters of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside in pure organic solvents[J]. Journal of Molecular Liquids, 2018, 256: 344-351. DOI:10.1016/j.molliq.2018.02.046 |
| [23] |
ACREE W E. Comments concerning model for solubility estimation in mixed solvent system[J]. International Journal of Pharmaceutics, 1996, 127(1): 27-30. DOI:10.1016/0378-5173(95)04109-5 |
| [24] |
ACREE W E. Mathematical representation of thermodynamic properties. Ⅱ: Derivation of the combined nearly ideal binary solvent(NIBS)/Redlich-Kister mathematical representation from a two-body and three-body interactional mixing model[J]. Thermochimica Acta, 1992, 198(1): 71-79. DOI:10.1016/0040-6031(92)85059-5 |
| [25] |
ASHKAR F, MAHDI S. Fitting the log-logistic distribution by generalized moments[J]. Journal of Hydrology, 2006, 328(3): 694-703. |
| [26] |
LESITHA G, THOMAS P Y. Estimation of the scale parameter of a log-logistic distribution[J]. Metrika, 2013, 76(3): 427-448. DOI:10.1007/s00184-012-0397-5 |
| [27] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China [S]. Beijing: China Medical Science Press, 2015. |
| [28] |
ZHI M J, WANG J K, JIA C Y, et al. Solubility of cloxacillin sodium in different binary solvents[J]. Journal of Chemical & Engineering Data, 2009, 54(3): 1084-1086. |
| [29] |
MEIRZADEH E, DISHON S, WEISSBUSH I, et al. Solvent-induced crystal polymorphism as studied by pyroelectric measurements and impedance spectroscopy: alcohols as tailor-made inhibitors of α-glycine[J]. Angewandte Chemie, 2018, 57(18): 4965-4969. DOI:10.1002/anie.201800741 |




