离子液体(Ionic liquids, ILs)作为一种新型的绿色溶剂,具有独特的物理化学性质,包括溶解能力强、热稳定性好、电导性能好、蒸汽压极低、结构可控等优点,在许多工艺中都有着良好的表现[1-2]。近年来,在反应精馏酯化反应体系中,离子液体用作催化剂的效果远优于传统固体酸催化剂。董颜箔[3]、He[4]、徐浩[5]、Li[6]等将离子液体应用到酯化反应中,取得了非常好的催化效果。
由于涉及多组分的化学反应和汽液平衡,反应精馏的工艺设计过程非常复杂[7]。作为新型催化剂的离子液体的加入对原反应体系汽液平衡的影响同样会影响反应动力学模拟。因此,需要补充合适的汽液平衡数据以优化反应精馏设计。酯化反应中包含许多含有乙酸的体系,乙酸具有强烈的缔合效应,会引起不容忽视的汽相偏差。探究离子液体对水+乙酸体系影响的研究较少,目前仅有Peng等[8-9]测定了水+乙酸+[BMIM][DBP]体系与水+乙酸+[EMIM][DEP]体系的汽液平衡数据,辛华等[10]测定了水+乙酸+[N2, 2, 2, H][Ac]体系的汽液平衡数据。Shen等[11]基于量子化学计算和分子动力学模拟分析了萃取精馏水+乙酸体系的机理,得到了[BMIM][DBP]做夹带剂效果最好的结论。相关文献屈指可数,在这个方向上仍需要补充大量的汽液平衡数据。
本课题组之前的工作[5]选用了1-磺酸丁基-2-甲基吡啶硫酸氢盐([HSO3-BMPy][HSO4])离子液体作为催化剂在减压条件下进行反应精馏酯化反应制备三乙酸甘油酯。为补充所需要的热力学数据,本工作探究不同离子液体摩尔分数与不同压力对水+乙酸体系汽液平衡的影响。
2 实验(材料与方法) 2.1 原料冰醋酸(分析纯,质量分数≥99.5%,广东光华科技股份有限公司);去离子水(广西大学化学化工学院自制);1-磺酸丁基-2-甲基吡啶硫酸氢盐离子液体(质量分数≥99%,上海成捷化学有限公司)。
2.2 实验装置及条件采用如图 1所示的以Dvorak-Boublik汽液冷凝双循环平衡釜[12-13]为核心的装置测定汽液平衡数据。
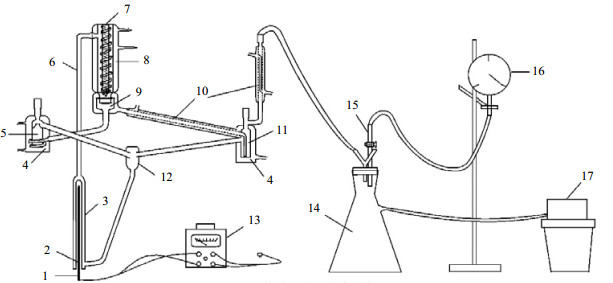
|
图 1 汽液平衡测定实验装置 Fig.1 Schematic diagram of the experimental setup for vapor-liquid equilibrium measurement 1. heater 2. heating well 3. boiling chamber 4. water-cooling jacket 5. liquid phase storage bottle 6. riser 7. thermometer well 8. vacuum jacket 9. vapor-liquid separator 10. condenser 11. vapor phase storage bottle 12. mixing chamber 13. contact voltage regulator 14. accumulator bottle 15. two-way valve 16. vacuum meter 17. circulating water pump |
在加热阱2中插入电热棒,溶液沸腾后,沸腾室3中的液体通过提升管6经由真空夹套8进入汽液分离器9。液相流入液相贮瓶5,汽相通过冷凝器10进入汽相贮瓶11;当瓶中溶液液位高于溢流口时,汽相贮瓶和液相贮瓶内的液体溢流进混合室12,再回到沸腾室重新沸腾,开始新一轮的循环。循环数次,当温度不再变化时,即可判断达到平衡。待平衡40 min后,由汽相贮瓶和液相贮瓶瓶口取样,并通过插入温度计阱7的精密温度计读取温度,空盒气压表读取大气压数据。进行减压实验时,需在平衡釜右侧冷凝管10的出口处连接减压装置。实验时,打开真空泵抽真空,一边观察真空表的读数,一边由二通控制真空度,直到读数为所需压力,其他步骤与常压实验相同。
温度由精密水银温度计(已校正,精度0.1 ℃,衡水精创仪器仪表有限公司)测出,并对其进行露颈校正;电热棒加热温度由接触调压器(TDGC2-2,浙江正泰电器股份有限公司)控制;大气压由空盒气压表(DYM3型,精度0.1 kPa,天津凤洋仪器仪表工贸有限公司)测定;由循环水式真空泵(SHZ-D(Ⅲ),巩义市予华仪器有限责任公司)抽取真空;真空度由精密压力表(YB-150B,精度0.5 kPa,西安自动化仪表一厂)测定;样品由安捷伦7820A(安捷伦科技(中国)有限公司)气相色谱仪测出。
因为离子液体饱和蒸气压极低,故可假设其不挥发,仅存在于液相中。因此可近似地认为其质量不变,即离子液体在液相中的摩尔分数与加入时相同。汽相及液相中的挥发性物质由安捷伦GC-7820A气相色谱仪测出,色谱条件为:HP-INNOWAX毛细管色谱柱(30 m×320 μm×0.5 μm);热导检测器(TCD);柱箱温度采用程序升温,初始温度为120 ℃,保持1 min,升温速率为10 ℃·min−1,升至140 ℃,保持1 min,升温速率为10 ℃·min−1,升至160 ℃,保持2 min(汽相样品);初始温度为120 ℃,保持1 min,升温速率为20 ℃·min−1,升至160 ℃,保持5 min(液相样品);进样器和检测器温度均为170 ℃,载气为氢气;载气体积流量为30 mL·min−1;进样量为0.2 μL;分流比为40:1。每个样品测3次,取平均值,测量误差由水的汽相摩尔分数y1的绝对偏差ADy表示,5个二元体系的平均绝对偏差在0.002 1~0.004 4,8个三元体系的平均绝对偏差在0.004 9~0.011 3。
2.3 温度修正由于实验过程中气压不能始终维持稳定,在进行露颈校正后,应就压力对温度再进行一次修正。修正公式[14]如式(1)。
| $ T = {T_{{\text{exp}}}} + \frac{1}{{\sum\limits_{i{\text{ = 1}}}^N {\frac{{{B_i}{x_i}}}{{{{({T_{{\text{exp}}}} + {C_i})}^2}}}} }}\frac{{{p_{{\text{obj}}}} - {p_{{\text{exp}}}}}}{{{p_{{\text{exp}}}}}} $ | (1) |
式中:T为热力学温度,K;Texp为热力学实验温度,K;pexp为实验压力,kPa;N为组分数;i为组分;
|
|
表 1 水和乙酸的Antoine常数表① Table 1 Antoine constants of water and acetic acid |
为了检验实验数据的可靠性,测定了水(1)+乙酸(2)体系在常压下的汽液平衡数据,并与文献值[16]进行比较;实验测定结果见表 2,与文献值的对照图见图 2。表中,y1为水的汽相摩尔分数;x1为不计入离子液体时水的液相摩尔分数。
|
|
表 2 水(1)+乙酸(2)汽液平衡实验数据 Table 2 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) binary system |
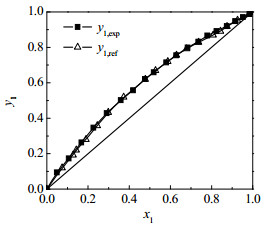
|
图 2 水(1)+乙酸(2)体系实验值与文献值的y1- x1图 Fig.2 y1- x1 diagram of experimental and literature values of the water(1) + acetic acid(2) system |
对于在相同温度和压力下汽相摩尔体积与理想气体产生负偏差的物质,如乙酸,可以产生两分子形成二聚体的化学平衡[17]。此时,用来表示与理想气体偏差程度的逸度系数无法满足精度要求,需要根据缔合体系的特点进行相应的调整。Hayden-O′Connell(HOC)方法[18]常被用来校正由乙酸缔合现象引起的汽相非理想性的偏差。本研究使用Aspen Plus进行Herington面积检验,输入汽液平衡实验数据T、xi和yi值,通过NRTL-HOC模型[19]进行回归,得出的热力学一致性检验结果D−J=−3.45 < 10,符合热力学一致性检验。从图 2可以看出,实验值y1, exp与文献值y1, ref吻合较好;结合热力学一致性检验结果可知,测得的实验数据是可靠的。
3.2 减压条件下水(1)+乙酸(2)二元体系的汽液平衡数据测定了91.3、81.3、71.3、61.3 kPa下水(1)+乙酸(2)二元体系的汽液平衡数据,结果如表 3~6所示。
|
|
表 3 91.3 kPa下水(1)+乙酸(2)二元体系体系汽液平衡实验数据 Table 3 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) binary system at 91.3 kPa |
|
|
表 4 81.3 kPa下水(1)+乙酸(2)二元体系体系汽液平衡实验数据 Table 4 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) binary system at 81.3 kPa |
|
|
表 5 71.3 kPa下水(1)+乙酸(2)二元体系体系汽液平衡实验数据 Table 5 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) binary system at 71.3 kPa |
|
|
表 6 61.3 kPa下水(1)+乙酸(2)二元体系体系汽液平衡实验数据 Table 6 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) binary system at 61.3 kPa |
使用Aspen Plus中的NRTL-HOC模型对减压条件下的水(1)+乙酸(2)体系进行热力学一致性检验,结果如表 7所示,均符合热力学一致性检验,测得的结果合理。
|
|
表 7 减压条件下水(1)+乙酸(2)二元体系热力学一致性检验结果 Table 7 Thermodynamic consistency results of the water (1)+ acetic acid (2) binary system at reduced pressures |
选择徐浩等[5]酯化反应动力学实验的最优配比,经计算,加入离子液体的摩尔分数应为乙酸摩尔分数的0.003。测定了101.3、91.3、81.3、71.3、61.3 kPa下水(1)+乙酸(2)+0.003[HSO3-BMPy][HSO4](3)体系的汽液平衡数据,结果如表 8~12所示。表中x1'表示计入离子液体时水的液相摩尔分数,x'2表示计入离子液体时液相中乙酸的摩尔分数,x3表示离子液体的摩尔分数。
|
|
表 8 101.3 kPa下水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 8 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system at 101.3 kPa |
|
|
表 9 91.3 kPa下水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 9 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system at 91.3 kPa |
|
|
表 10 81.3 kPa下水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 10 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system at 81.3 kPa |
|
|
表 11 71.3 kPa下水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 11 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system at 71.3 kPa |
|
|
表 12 61.3 kPa下水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 12 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system at 61.3 kPa |
测定了[HSO3-BMPy][HSO4]摩尔分数为1%、3%、5%时,水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系的汽液平衡数据,结果如表 13~15所示。
|
|
表 13 水(1)+乙酸(2)+1%[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 13 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + 1%[HSO3-BMPy][HSO4](3) system |
|
|
表 14 水(1)+乙酸(2)+3%[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 14 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + 3%[HSO3-BMPy][HSO4](3) system |
|
|
表 15 水(1)+乙酸(2)+5%[HSO3-BMPy][HSO4](3)体系汽液平衡实验数据 Table 15 Vapor-liquid equilibrium experimental data of the water(1) + acetic acid(2) + 5%[HSO3-BMPy][HSO4](3) system |
从图 3二元体系的y1-x1对比图和图 4二元体系的T-y1-x1对比图可知,随压力降低,水在富酸区汽相中的平衡组成增加,在富水区液相中的平衡组成略有下降,说明压力对水的影响更大一些。
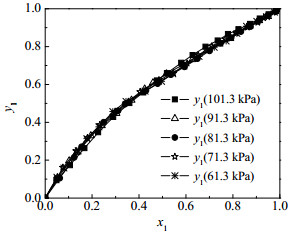
|
图 3 101.3、91.3、81.3、71.3、61.3 kPa下测得水(1)+乙酸(2)体系汽液平衡实验值y1-x1对比图 Fig.3 y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) system measured at 101.3, 91.3, 81.3, 71.3, 61.3 kPa |
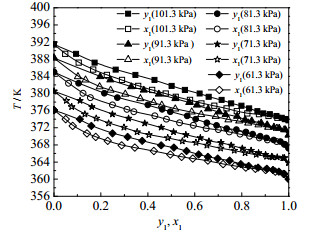
|
图 4 101.3、91.3、81.3、71.3、61.3 kPa下测得水(1)+乙酸(2)体系汽液平衡实验值T-y1-x1对比图 Fig.4 T-y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) system measured at 101.3, 91.3, 81.3, 71.3, 61.3 kPa |
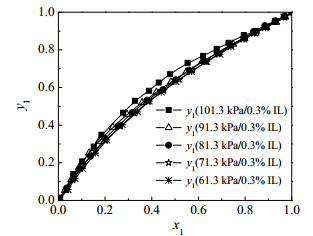
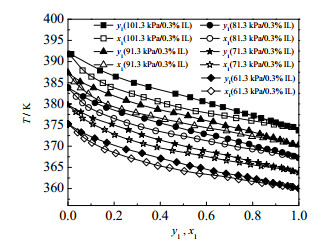
图 5为三元体系的y1-x1对比图,图 6为三元体系的T-y1-x1对比图。图 5、6表明加入离子液体摩尔分数为乙酸摩尔分数0.003的水+乙酸+[HSO3-BMPy][HSO4]体系在减压条件下的汽液平衡线对比与水+乙酸体系大体相似。与减压条件下水+乙酸体系的五组数据对比,发现在同样的压力下,加入少量的离子液体会使原体系平衡温度略有降低。
|
图 5 101.3、91.3、81.3、71.3、61.3 kPa下测得水(1)+乙酸(2)+ 0.003[HSO3-BMPy][HSO4](3)体系汽液平衡实验值y1-x1对比图 Fig.5 y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) + 0.003[HSO3-BMPy][HSO4](3) system measured at 101.3, 91.3, 81.3, 71.3, 61.3 kPa |
|
图 6 101.3、91.3、81.3、71.3、61.3 kPa下测得水(1)+乙酸(2) + 0.003[HSO3-BMPy][HSO4](3)体系汽液平衡实验值T-y1-x1对比图 Fig.6 T-y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) + 0.003[HSO3-BMPy][HSO4](3) system measured at 101.3, 91.3, 81.3, 71.3, 61.3 kPa |
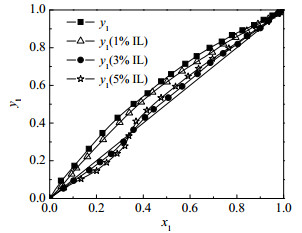
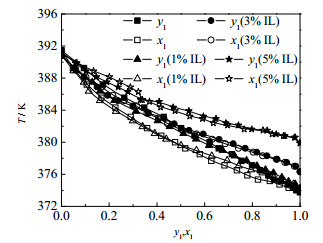
图 7三元体系的y1-x1对比图显示逐渐增大[HSO3-BMPy][HSO4]的摩尔分数会使水与乙酸产生共沸点;从图 8三元体系的T-y1-x1对比图可知,加入[HSO3-BMPy][HSO4]后对原体系平衡温度有显著的提升,因此在含水+乙酸混合物体系的反应精馏过程计算中,必须对离子液体对汽液平衡的影响效应予以校正。其中,离子液体对水平衡温度的影响比对乙酸的影响更为明显。程新炎等[20]经过FT-IR谱图分析得到,几种含吡啶的离子液体均有分子间氢键形成的O─H伸缩振动峰,说明2-甲基吡啶类离子液体极易吸水。由此得出结论,由于离子液体的强亲水性,使其与水结合得更紧密,更难达到沸腾状态,因此水的平衡温度明显提高。
|
图 7 101.3 kPa下测得水(1)+乙酸(2) +[HSO3-BMPy][HSO4](3)体系在IL摩尔分数为1%、3%、5%时的汽液平衡实验值y1-x1对比图 Fig.7 y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system measured at 101.3 kPa when mole fraction of IL is 1%, 3%, 5%, respectively |
|
图 8 101.3 kPa下测得水(1)+乙酸(2) +[HSO3-BMPy][HSO4](3)体系在IL摩尔分数为1%、3%、5%时的汽液平衡实验值T-y1-x1对比图 Fig.8 T-y1-x1 diagram of vapor-liquid equilibrium of the water(1) + acetic acid(2) + [HSO3-BMPy][HSO4](3) system measured at 101.3 kPa when mole fraction of IL is 1%, 3%, 5%, respectively |
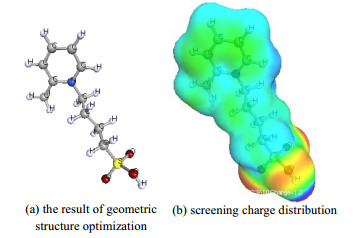
通过COSMOlogic软件计算水、乙酸、[HSO3-BMPy]+阳离子以及[HSO4]−阴离子的屏蔽电荷密度σ。为计算ILs中阳离子的电荷密度,通过TURBOMOLE量化计算模块对IL的几何结构进行了优化。在该软件中构建了IL的三维结构,并进行预优化。为在COSMOtherm中进行后续计算,原子的“Basis Set”设定为def-TZVP。给定对应电荷数生成分子轨道,使用DFT密度泛函方法,选择B3-LYP泛函开始计算,优化结果及分子表面屏蔽电荷分布如图 9所示,图中,ρ(σ)为屏蔽电荷密度函数。
|
图 9 [HSO3-BMPy]+阳离子 Fig.9 Structural diagram of [HSO3-BMPy]+ cation |
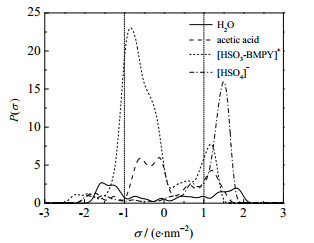
σ-Profile图分为3个区:在σ < −1 e·nm−2区域为氢键供体区,该物质具有较强的提供氢键的能力;在−1 e·nm−2 < σ < 1 e·nm−2区域,为非极性区分子,对称性较好;在σ > 1 e·nm−2区域为氢键受体区,该物质具有较强的氢键接受能力[21-23]。σ-Profile曲线峰离σ = ±1 e·nm−2线越远,峰面积越大,则对应的性质越强[24]。
计算得到的σ-Profile图如图 10所示。水和[HSO3-BMPy]+既具有提供氢键的能力,也具有接受氢键的能力;乙酸和[HSO4]−则主要作为氢键受体存在。乙酸和水均具有一定的与[HSO3-BMPy][HSO4]结合的能力,使水与乙酸不易分离,汽液平衡线更靠近对角线。水在氢键供体区的峰比乙酸高,提供氢键的能力更强。因此相较于乙酸,[HSO3-BMPy][HSO4]更易与水紧密结合,在富水区对汽液平衡曲线的影响更大。从σ-Profile图分析得到的结论与实验结果一致,说明了实验结果的可靠性。
|
图 10 水、乙酸、[HSO3-BMPy]+和[HSO4]−的σ-Profile图 Fig.10 σ-Profiles of water, acetic acid, [HSO3-BMPy]+ cation and [HSO4] − anion |
用改进的Dvorak-Boublik平衡釜测定了101.3、91.3、81.3、71.3、61.3 kPa下水(1)+乙酸(2)体系,101.3、91.3、81.3、71.3、61.3 kPa下在离子液体摩尔分数为乙酸0.003的水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)体系以及101.3 kPa下离子液体摩尔分数为1%、3%、5%时的水(1)+乙酸(2)+[HSO3-BMPy][HSO4](3)三元体系汽液平衡数据。基于化学理论和HOC方法对汽相中的乙酸缔合效应进行校正,水+乙酸二元体系的汽液平衡数据通过了Herington热力学一致性检验。减压条件下,压力对水的影响更大;常压下,离子液体摩尔分数增加,水+乙酸+离子液体体系的平衡温度显著增加。优化了[HSO3-BMPy]+阳离子的几何结构,σ-Profile图分析得知,相较于乙酸,[HSO3-BMPy][HSO4]离子液体更易与水紧密结合,在富水区对汽液平衡曲线的影响更大。实验得到的汽液平衡数据补充了含离子液体体系在酯化反应精馏模拟计算中需要的热力学基础数据,提高了反应精馏塔模拟优化的准确性。
| [1] |
孙铖, 刘凡, 沈丽, 等. [N1111][Lys]水溶液吸收二氧化碳的机理与动力学[J]. 高校化学工程学报, 2020, 34(5): 1135-1142. SUN C, LIU F, SHEN L, et al. Mechanism and kinetics of CO2 absorption with aqueous solution of [N1111][Lys][J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(5): 1135-1142. DOI:10.3969/j.issn.1003-9015.2020.05.006 |
| [2] |
梁金花, 徐玥, 任晓乾, 等. 磺酸功能化咪唑类离子液体催化丁二酸与丁二醇预聚酯化的过程研究[J]. 高校化学工程学报, 2012, 26(5): 829-834. LIANG J H, XU Y, REN X Q, et al. The studies of the process in esterification of succinate with butanediol over sulfonic functionalized imidazolium ionic liquids catalysts[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(5): 829-834. |
| [3] |
董颜箔, 何瑞宁, 牟春霞, 等. 离子液体催化反应精馏合成乙酸乙酯工艺模拟[J]. 化工进展, 2018, 37(2): 468-474. DONG Y B, HE R N, MOU C X, et al. Process simulation of synthesis of ethyl acetate by ionic liquid catalytic reactive distillation[J]. Chemical Industry and Engineering Progress, 2018, 37(2): 468-474. DOI:10.16085/j.issn.1000-6613.2017-0719 |
| [4] |
HE R N, ZOU Y, DONG Y B, et al. Kinetic study and process simulation of esterification of acetic acid and ethanol catalyzed by [HSO3-bmim][HSO4][J]. Chemical Engineering Research and Design, 2018, 137: 235-245. DOI:10.1016/j.cherd.2018.07.020 |
| [5] |
徐浩, 李洋, 夏成康, 等. 吡啶硫酸氢盐离子液体催化甘油与乙酸酯化反应动力学[J]. 化工学报, 2020, 71(11): 5174-5183. XU H, LI Y, XIA C K, et al. Kinetics of esterification of glycerol with acetic acid catalyzed by pyridine bisulfate ionic liquid[J]. CIESC Journal, 2020, 71(11): 5174-5183. |
| [6] |
LI Y, ZOU Y, XU H, et al. Preparation of n-amyl acetate via esterification of acetic acid and n-amyl alcohol using [HSO3-pmim][HSO4]/SiO2 as catalyst: Catalyst preparation, characterization and reaction kinetics [J/OL]. Chemical Engineering Journal, 2020 [2022-01-30]. http://dx.doi.org/10.1016/2020/128282.
|
| [7] |
MANDAGARAN B A, CAMPANELLA E A. Correlation of vapor - liquid equilibrium data for acetic acid - isopropanol - water - isopropyl acetate mixtures[J]. Brazilian Journal of Chemical Engineering, 2006, 23(1): 93-103. DOI:10.1590/S0104-66322006000100010 |
| [8] |
PENG Y, FU J, LU X Y. Isobaric vapor–liquid equilibrium for water+acetic acid+1-butyl-3- methylimidazolium dibutylphosphate at 101.32 kPa[J]. Fluid Phase Equilibrium, 2014, 363: 220-227. DOI:10.1016/j.fluid.2013.11.036 |
| [9] |
PENG Y, LU X Y. Isobaric vapor–liquid equilibrium for water + acetic acid + 1-ethyl-3-methylimidazolium diethylphosphate at 101.32 kPa[J]. Journal of Chemical and Engineering Data, 2014, 59(2): 250-256. DOI:10.1021/je400282h |
| [10] |
辛华, 李青松. 含离子液体水-醋酸物系等压汽液平衡[J]. 化学工程, 2013, 41(11): 30-47. XIN H, LI Q S. Isobaric vapor liquid equilibrium of water - acetic acid system containing ionic liquid[J]. Chemical Engineering (China), 2013, 41(11): 30-47. |
| [11] |
SHEN Y Y, CHEN Z R, QI H Q, et al. Mechanism analysis of extractive distillation for separation of acetic acid and water based on quantum chemical calculation and molecular dynamics simulation [J/OL]. Journal of Molecular Liquids, 2021 [2022-01-30]. http://dx.doi.org/10.1016/2021/115866.
|
| [12] |
李国安, 乔迁, 宋彤, 等. 含甲酸三元物系汽液平衡的研究[J]. 高校化学工程学报, 1991, 5(3): 196-202. LI G A, QIAO Q, SONG T, et al. Study on vapor liquid equilibrium of ternary system containing formic acid[J]. Journal of Chemical Engineering of Chinese Universities, 1991, 5(3): 196-202. DOI:10.3321/j.issn:1003-9015.1991.03.001 |
| [13] |
童张法, 王坤, 孙丽霞, 等. α-蒎烯+对伞花烃和β-蒎烯+对伞花烃体系减压汽液平衡数据的测定与关联[J]. 高校化学工程学报, 2011, 25(5): 734-739. TONG Z F, WANG K, SUN L X, et al. Measurement and correlation of VLE data for α-pinene + p-cymene and β-pinene + p-cymene systems at reduced pressures[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(5): 734-739. |
| [14] |
HIAKI T, KAWAI A. Vapor-liquid equilibria determination for a hydrofluoroether with several alcohols[J]. Fluid Phase Equilibrium, 1999, 158-160: 979-989. DOI:10.1016/S0378-3812(99)00064-3 |
| [15] |
李玲. 乙酸仲丁酯萃取—共沸精馏回收废水中乙酸过程基础研究[D]. 福州: 福州大学, 2014. LI L. The basic research on extraction- azeotropic distillation process for recover acetic acid from acetic acid wastewater by sec-butyl acetate [D]. Fuzhou: Fuzhou University, 2014. |
| [16] |
畅伟贤, 徐欣荣, 李新利, 等. 水-乙酸-乙酸戊酯体系的等压汽液平衡[J]. 化工学报, 2005, 56(8): 1379-1384. CHANG W X, XU X R, LI X L, et al. Isobaric vapor liquid equilibrium of water acetic acid amyl acetate system[J]. Journal of Chemical Industry and Engineering(China), 2005, 56(8): 1379-1384. |
| [17] |
NOTHNAGEL K H, ABRAMS D S, PRAUSNITZ J M. Generalized correlation for fugacity coefficients in mixtures at moderate pressures. Application of chemical theory of vapor imperfections[J]. Industrial & Engineering Chemistry Research, 1973, 12(1): 25-35. |
| [18] |
HAYDEN J G, O'CONNELL J P. A generalized method for predicting second virial coefficients[J]. Industrial & Engineering Chemistry Research, 1975, 14(3): 209-216. |
| [19] |
万辉, 谢强, 管国锋. 甲乙酮-水-醋酸体系等压汽液平衡研究[J]. 高校化学工程学报, 2009, 23(4): 547-552. WAN H, XIE Q, GUAN G F. Isobaric vapor-liquid equilibrium for methyl ethyl ktone + water + acetic acid system[J]. Journal of Chemical Engineering of Chinese Universities, 2009, 23(4): 547-552. |
| [20] |
程新炎, 王志远, 江梅珍, 等. 2-甲基吡啶类离子液体结构与酸性关联及其酯化催化活性[J]. 南昌大学学报(理科版), 2017, 41(3): 236-240. CHENG X Y, WANG Z Y, JIANG M Z, et al. Relationship between structure and acidity of 2-methylpyridine ionic liquids and their catalytic activity for esterification[J]. Journal of Nanchang University(Natural Science), 2017, 41(3): 236-240. |
| [21] |
LIU S L, WANG Z H, ZHU R S, et al. as an entrainer for the extractive distillation of methanol-ethanol-water system[J]. Green Energy & Environment, 2021, 6(3): 363-370. |
| [22] |
李婷婷, 杨青, 彭昌军, 等. 基于COSMO-RS模型研究基团修饰的离子液体对乙腈-水汽液平衡的影响[J]. 化工学报, 2016, 67(2): 425-434. LI T T, YANG Q, PENG C J, et al. Study on the effect of group modified ionic liquid on acetonitrile vapor-liquid equilibrium based on COSMO-RS model[J]. CIESC Journal, 2016, 67(2): 425-434. |
| [23] |
JANAKEY DEVI V K P, BALAKRISHNAN P S T S, BALAKRISHNAN A R. Screening of ionic liquids as entrainers for the separation of 1-propanol+water and 2-propanol+water mixtures using COSMO-RS model[J]. Chemical Engineering Communications, 2018, 205(6): 772-788. |
| [24] |
李进龙, 李佳书, 杨青, 等. 乙腈+水+离子液体等压汽液平衡测定与计算[J]. 化工学报, 2019, 70(6): 2110-2116. LI J L, LI J S, YANG Q, et al. Measurement and calculation of isobaric vapor-liquid equilibrium of acetonitrile + water + ionic liquid[J]. CIESC Journal, 2019, 70(6): 2110-2116. |




