天然植物苦荞富含芦丁及山奈酚-3-O-芸香糖苷2种活性组分,二者具有独特的药理作用[1-3]。芦丁组分能够降低毛细血管脆性、改善微循环,临床上用于高血压、糖尿病等病症的辅助治疗;山奈酚-3-O-芸香糖苷组分具有增加乙酰胆碱及单胺类神经递质质量分数等作用,对防治老年痴呆症及心血管疾病疗效显著[4]。除含有芦丁及山奈酚-3-O-芸香糖苷等有效成份外,苦荞还含有其他无效甚至有毒成份,采用现代提取技术使有效成分进一步浓缩纯化,生产保健品或医药单体,成为目前苦荞高附加值利用的研究重点。其传统的提纯方法主要有碱提酸沉法[5]、大孔吸附树脂法[6-7]及高速逆流色谱法[8]等,一般要求苦荞活性组分产品纯度≥90%[5],存在工序繁琐、收率低及溶剂残留多等问题[9]。
超临界流体-模拟移动床(supercritical fluid - simulated moving bed, SF-SMB)是近年发展起来的一种新型工业色谱分离技术,具有分离效率高、制备条件温和、溶剂残留少及绿色环保等优势,在食品安全、药品及制剂质量控制及天然产物制备等领域得到了广泛的应用[10-12]。制备型超临界色谱(supercritical fluid chromatography,SFC)是具有产品制备功能的生产装置,在中草药医药单体产品制备领域具有良好的应用前景。本文拟以苦荞粗提物为原料,开展基于超临界流体制备色谱技术的苦荞活性组分提纯工艺研究,考察夹带剂、CO2流量、压力、温度及进样量等工艺条件对苦荞活性组分分离度及保留因子的影响规律,确定适宜的工艺条件,建立保留因子模型,为采用SF-SMB技术生产苦荞活性组分产品提供工程化设计基础工艺数据。
2 实验材料、设备及方法 2.1 实验材料苦荞粗提物(天津普拉德生物科技有限公司),芦丁标准品(纯度98.0%,大连美仑生物技术有限公司),山奈酚-3-O-芸香糖苷标准品(纯度98.0%,大连美仑生物技术有限公司),二氧化碳(纯度99.9%,天津浩伦气体有限公司),无水甲醇(分析纯,科密欧化学试剂有限公司),乙腈(色谱纯,Merck公司),磷酸(色谱纯,科密欧化学试剂有限公司),蒸馏水(电阻率1.6×107 Ω·cm-1,实验室自备)。
2.2 实验装置及方法苦荞活性组分超临界流体制备色谱提纯工艺实验采用SFC-200型制备型超临界色谱装置,采用的色谱柱为Zorbax SB-CN(9.4 mm×250 mm),填料采用粒径5 μm的涂敷型硅胶,硅胶表面键合氰基基团。图 1为超临界流体制备色谱提纯工艺实验装置流程图。
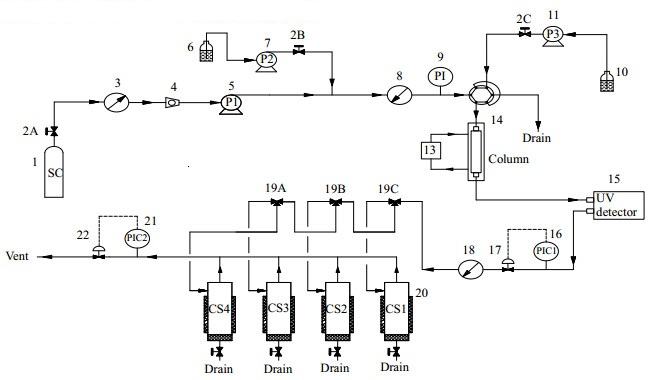
|
图 1 超临界流体制备色谱提纯工艺实验装置流程图 Fig.1 Experimental flow chart of purification by supercritical fluid preparation chromatography 1. CO2 tank 2A, 2B, 2C. switch valve 3. pre-heater 4. CO2 flow meter 5. CO2 feeding pump 6. modifier jar 7. modifier feeding pump 8. feeding flow meter 9. pre-column manometer 10. sample jar 11. automatic feeding pump 12. six-way valve 13.heat exchanger 14. taylor dispersion tube 15. detector 16. post-column manometer 17. pressure regular valve 18. product cooler 19A, 19B, 19C. procedure control valve 20. product collecting tank 21. system manometer 22. back pressure valve |
实验步骤:配制质量浓度为10 g·L-1的苦荞粗提物甲醇溶液,采用0.45 μm的微孔滤膜过滤溶液至澄清状态,置于4 ℃下冷冻备用;开启紫外检测器,设定检测波长,排空夹带剂泵,设置水浴温度;待水浴温度达到设定值,开启自动背压阀,启动仪器工作站,设定CO2质量流量及色谱柱压力等参数,打开CO2钢瓶,待系统压力稳定后,开启CO2泵;色谱基线稳定后,开启夹带剂泵;色谱基线重新稳定后,手动进样10 μL的苦荞粗提物溶液,记录各组分在SFC的保留行为,每次改变实验参数后平衡20 min。
产品分析:采用Agilent-1100型高效液相色谱仪分析芦丁及山奈酚-3-O-芸香糖苷组分,分析柱采用ZorBax SB-C18柱(4.6 mm×250 mm I.D,5 μm)。分析条件:流动相(90%乙腈+0.4%磷酸水溶液)体积流量1 mL·min-1、柱箱温度40 ℃、进样量20 μL及紫外检测器波长360 nm。
实验方法:以分离度和保留因子等参数作为分离性能[13]的评价指标,研究夹带剂、CO2质量流量、温度、压力及进样量等工艺条件对活性组分分离度及保留因子的影响。实验条件:CO2质量流量14~22 g·min-1、夹带剂体积流量3~5 mL·min-1、温度308.15~323.15 K、压力8~16 MPa及进样量15~25 μL。芦丁与山奈酚-3-O-芸香糖苷组分的分离度计算公式见式(1)[14],保留因子计算公式见式(2)。
| $ R = \frac{{2\left( {{t_{R1}} - {t_{R2}}} \right)}}{{{W_1} + {W_2}}} $ | (1) |
式中:R为分离度;W1、W2分别为两组分的色谱峰底宽,tR1、tR2分别为芦丁和山奈酚-3-O-芸香糖的保留时间。
| $ {k_i} = \frac{{{t_{Ri}} - {t_0}}}{{{t_o}}} $ | (2) |
式中:ki为不同组分的保留因子,k1、k2分别为芦丁、山奈酚-3-O-芸香糖苷保留因子;tRi为不同溶质保留时间,min,t0为色谱柱死保留时间,min。
为保证得到的实验结果的准确性,要求每组实验数据进行至少3组平行实验,允许实验结果误差≤±5%。
3 实验结果及讨论 3.1 夹带剂的影响芦丁与山奈酚-3-O-芸香糖苷属于黄酮类化合物,极性较大,非极性的超临界二氧化碳(SC-CO2)对极性溶质的溶解度较小,一般通过加入甲醇或乙醇作为夹带剂提高流动相对溶质的溶解能力[12]。此外,对于黄酮类化合物,在夹带剂中加入质量分数为0.2%的磷酸,可以有效改善色谱峰峰形,提高组分分离度[15]。在温度313.15 K、压力12 MPa、CO2质量流量20 g·min-1及夹带剂体积流量3~5 mL·min-1的条件下,考察夹带剂甲醇-0.2%磷酸、乙醇-0.2%磷酸,以及不同夹带剂流量对活性组分分离度的影响,实验结果如图 2所示。
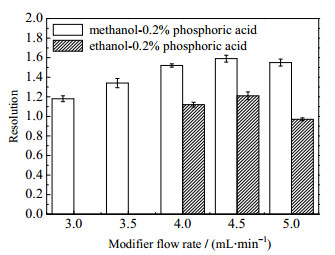
|
图 2 不同夹带剂及流量对苦荞活性组分分离度的影响 Fig.2 Effects of entrainers and flow rates on separation resolution of tartary buckwheat active components |
从图 2中可以看出,甲醇-0.2%磷酸的分离效果优于乙醇-0.2%磷酸,在甲醇-0.2%磷酸体积流量大于4 mL·min-1时,两组分的分离度R>1.5;另外,随着夹带剂体积流量的增大,芦丁与山奈酚-3-O-芸香糖苷活性组分的分离度先增大后减小,即随着夹带剂在流动相中的质量分数的增大,流动相对各个活性组分的洗脱能力也增大,但当夹带剂的体积流量达到一定值后,流动相的洗脱能力过强,减弱了对各组分洗脱能力的差别,反而使活性组分的分离度降低。因此确定适宜的夹带剂(甲醇-0.2 %磷酸)体积流量为4.5 mL·min-1。
3.2 CO2质量流量的影响CO2质量流量变化会影响各组分在流动相与固定相之间的分配,进而影响组分的分离效果。图 3为在温度313.15 K、压力12 MPa、夹带剂体积流量4.5 mL·min-1及CO2质量流量14~22 g·min-1的条件下,CO2质量流量对苦荞活性组分分离度的影响。
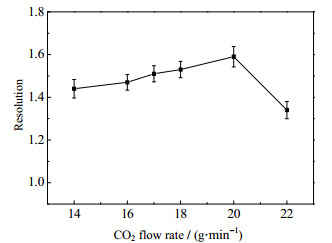
|
图 3 CO2质量流量对苦荞活性组分分离度影响 Fig.3 Effects of CO2 flow rate on separation resolution of tartary buckwheat active components |
如图 3所示,分离度随着CO2质量流量的增加先增大后减小,CO2质量流量在18~20 g·min-1内,分离度均大于1.5,达到分离效果。考虑到CO2流量过大易导致色谱柱压降过大,操作费用增大,影响色谱柱的使用寿命。因此,在保证各活性组分能够有效分离的前提下,选择较低的CO2质量流量,确定适宜的CO2质量流量为18 g·min-1。
3.3 压力的影响色谱操作压力的变化会对流动相密度产生影响,进而影响组分在流动相及固相表面的分配[16]。本文考察了压力对苦荞活性组分分离度及保留因子的影响,实验条件:夹带剂体积流量4.5 mL·min-1、CO2质量流量18 g·min-1、温度308.15~323.15 K及压力8~16 MPa。图 4、5分别为压力对苦荞活性组分分离度及保留因子的影响。
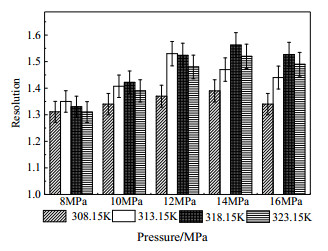
|
图 4 压力对苦荞活性组分分离度影响 Fig.4 Effects of pressure on separation resolution of tartary buckwheat active components |
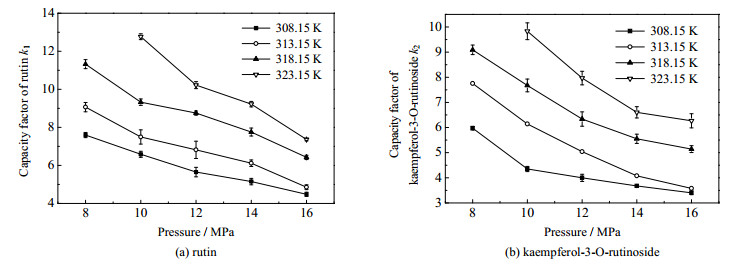
|
图 5 压力对芦丁及山奈酚-3-O-芸香糖苷组分保留因子的影响 Fig.5 Effects of pressure on the retention factors of rutin and kaempferol-3-O-rutinoside |
从图 4中可以看出,不同温度下,分离度均随着压力的增高先增大后减小。一方面,压力增加直接导致流动相密度增加,溶剂化能力增强,由于流动相对芦丁及山奈酚-3-O-芸香糖苷活性组分溶解能力的影响程度不同,使得分离度有所增加;另一方面,当压力增加至一定程度时,流动相对各组分的溶解能力趋于相同,反而导致分离度降低。在压力为14 MPa时,山奈酚-3-O-芸香糖苷与芦丁组分的分离度达到最大,因此选择14 MPa作为适宜的操作压力。
如图 5所示,当温度保持恒定时,k1及k2均随着压力的升高而减小。压力升高使流动相的密度增加,增强溶质组分在流动相中的溶解度,溶质分子在色谱柱中的保留时间减少,因而保留因子k1及k2减小。此外,由于在低压区内物质密度对压力的变化更加敏感,使得溶质保留因子在低压区内受压力的影响更加显著。因此,在低压区芦丁及山奈酚-3-O-芸香糖苷组分的保留因子随着压力的升高其降低程度比较显著。
3.4 温度的影响色谱操作温度的变化会引起流动相密度的改变,从而影响各组分在流动相与固定相表面的分配。本文进一步研究了温度对活性组分分离度及保留因子的影响,实验条件:夹带剂流量4.5 mL·min-1、CO2流量18 g·min-1、压力8~16 MPa及温度308.15~323.15 K,具体见图 6、7。
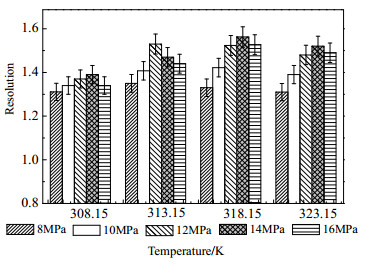
|
图 6 温度对苦荞活性组分分离度的影响 Fig.6 Effects of temperature on retention factor of tartary buckwheat active components |
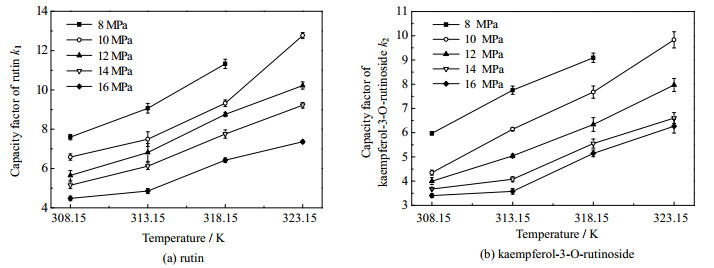
|
图 7 温度对芦丁及山奈酚-3-O-芸香糖苷组分保留因子的影响 Fig.7 Effects of temperature on the retention factors of rutin and kaempferol-3-O-rutinoside |
从图 6中可以看出,在压力一定时,分离度随温度的升高呈先增大后减小的趋势,温度升高一方面增强传质过程,使色谱峰宽减小;另一方面,温度的升高使流动相的密度降低,减弱了其对溶质分子的束缚作用,使轴向扩散效应增强,造成色谱峰弥散程度增强[17]。在这2种相反结果的共同作用下,导致分离度在温度为318.15 K时出现最大值,由此确定SFC分离的适宜温度为318.15 K。
如图 7所示,当压力一定时,保留因子k1及k2均随着温度升高而增大。一方面,温度升高,流动相密度减小,使流动相的洗脱强度降低,溶质组分的保留时间增加[18];另一方面,温度的升高也会使溶质组分芦丁及山奈酚-3-O-芸香糖苷的扩散能力增强,在固定相上的吸附能力减弱,保留时间减小;在实验条件下,流动相对活性组分的洗脱能力的影响程度大于流动相对于溶质组分扩散行为的影响,因而随着温度的升高,两组分在流动相中的溶解分配量降低,即流动相对组分的洗脱能力降低,保留因子k1及k2增大。
3.5 活性组分的产品制备通过3.1~3.4节的实验研究,得到了SFC提纯苦荞活性组分的适宜工艺条件:CO2质量流量18 g·min-1、夹带剂体积流量4.5 mL·min-1、温度318.15 K及压力14 MPa。对于芦丁及山奈酚-3-O-芸香糖活性组分产品制备过程,除满足活性组分产品纯度要求,还应最大程度提高原料处理负荷。图 8为不同的进样量下苦荞活性组分的SFC分离谱图。
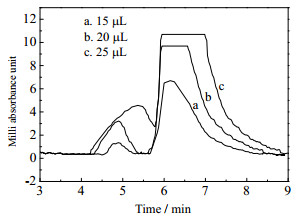
|
图 8 不同进样量下苦荞活性组分的SFC分离谱图 Fig.8 Chromatograms of tartary buckwheat active component by SFC separation at different volumes |
由图 8中可以得出,当进样量由15、20到25 μL不断增加,芦丁及山奈酚-3-O-芸香糖苷组分的色谱峰的响应值逐渐增大,分离度不断减小。当进样量增大到20 μL时,芦丁与山奈酚-3-O-芸香糖苷组分的色谱峰的基线分离达到临界状态,勉强实现两组分色谱峰的基线分离,当进样量继续增大到25 μL时,两组分的色谱峰出现重合现象,不能完全分离;另外,对收集的活性组分产品进行了纯度分析,结果表明,当进样量为20 μL时,芦丁活性组分产品纯度92.7%,山奈酚-3-O-芸香糖苷活性组分产品纯度90.71 %,两活性组分产品纯度均≥90%,而当进样量增加到25 μL时,活性组分产品纯度<90%,故确定活性组分的产品制备过程的适宜的最大进样量为20 μL。在以上适宜的工艺条件下,获得的芦丁活性组分产品纯度为92.7 %,保留时间范围4.3~5.3 min,收率60.14%;山奈酚-3-O-芸香糖苷活性组分产品纯度为90.71 %,保留时间范围5.6~8.0 min,产品收率35.85%,满足活性组分产品要求。
3.6 建立保留因子模型保留因子是描述溶质在固定相和流动相中分配特性的参数,常用的保留因子模型有平均晶格场模型、溶解度参数方程、统计热力学点阵模型及van't Hoff方程等,其中,MARTIRE等[19]提出的平均晶格场模型,考虑了体系的膨胀性和压缩性,能够直接体现温度及密度对溶质保留因子的影响,较好地描述SFC分离过程中溶质组分在液固两相中的分配行为。因此,本文采用该模型对SFC体系中芦丁保留因子k1及山奈酚-3-O-芸香糖苷保留因子k2进行模型拟合,建立相应的保留因子模型,通过保留因子的计算值和实验值的相对平均误差(relative average error, ARE)评价模型的拟合结果。平均晶格场模型的基本表达见式(3):
| $ \ln K = \ln {K^0} + F({T_r}, {\rho _r}) + \Delta $ | (3) |
式中:K为分配系数,ln K0为固定相对保留过程的贡献,K0为当超临界流体密度无限接近于0时的分配系数。F(Tr, ρr)为超临界流体对ln K的贡献,∆为固定相在溶涨和外压作用下对ln K的修正项。∆较小,在实际应用中可以忽略。
K与保留因子k的关系式见式(4):
| $ K = k(\frac{{{V_m}}}{{{V_s}}}) $ | (4) |
将式(4)代入式(3)并整理,得到一个五参数的方程:
| $ \ln K = A + \frac{B}{T} + C\rho - D(\frac{\rho }{T}) + E(\frac{{{\rho ^2}}}{T}) $ | (5) |
式中:Vm、Vs为流动相和固定相的体积,mL;ρ为SC-CO2的密度,g·cm-3;T为温度,K。
在压力8~16 MPa、温度308.15~323.15 K的条件下,计算超临界流体的密度,将k1及k2与密度、温度进行关联,得到模型方程如下:
| $ \ln {k_1} = 23 - \frac{{{6_{}}721.6}}{T} - 26.6\rho + {9_{}}558.4(\frac{\rho }{T}) - {1_{}}753.4(\frac{{{\rho ^2}}}{T}) $ | (6) |
| $ \ln {k_2} = 14.8 - \frac{{{4_{}}067.6}}{T} - 10.1\rho + {3_{}}798.5(\frac{\rho }{T}) - {1_{}}288.1(\frac{{{\rho ^2}}}{T}) $ | (7) |
采用式(6)及(7)的保留因子模型,对SFC提纯芦丁及山奈酚-3-O-芸香糖苷活性组分过程的保留因子进行计算预测,两组分保留因子的ARE分别为2.56%及1.66%,说明模型拟合计算结果良好。
4 结论通过对芦丁和山奈酚-3-O-芸香糖苷活性组分的超临界流体工业色谱提纯工艺的研究,得到主要结论如下:
(1) 获得了夹带剂、CO2质量流量、压力、温度及进样量等超临界工艺条件对苦荞活性组分分离度及保留因子的影响规律,确定了采用SFC提纯芦丁和山奈酚-3-O-芸香糖苷活性组分产品的适宜工艺条件:CO2质量流量18 g·min-1、夹带剂(甲醇-0.2 %磷酸)体积流量4.5 mL·min-1、温度318.15 K、压力14 MPa及进样量20 μL,对应的芦丁、山奈酚-3-O-芸香糖苷活性组分的纯度分别为92.7%、90.71%,满足两活性组分产品要求;
(2) 在压力8~16 MPa,温度308.15~323.15 K的超临界工艺条件下,芦丁和山奈酚-3-O-芸香糖苷活性组分的保留因子随着温度的升高而增加,随着压力的升高而下降;
(3) 采用简化平均晶格场模型,分别建立了芦丁及山奈酚-3-O-芸香糖苷活性组分的保留因子模型:
| $ \ln {k_1} = 23 - \frac{{{6_{}}721.6}}{T} - 26.6\rho + {9_{}}558.4(\frac{\rho }{T}) - {1_{}}753.4(\frac{{{\rho ^2}}}{T}) $ |
| $ \ln {k_2} = 14.8 - \frac{{{4_{}}067.6}}{T} - 10.1\rho + {3_{}}798.5(\frac{\rho }{T}) - {1_{}}288.1(\frac{{{\rho ^2}}}{T}) $ |
得到的2组分保留因子的计算值与实验值的ARE分别为2.56%、1.66%,说明模型拟合计算结果良好。
| [1] |
濮生财, 鲁璐, 焦威, 等. 不同品种苦荞中的4种活性黄酮含量[J]. 应用与环境生物学报, 2015, 21(3): 470-476. PU S C, LU L, JIAO W, et al. Contents of four active flavonoids in different species of buckwheat[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(3): 470-476. |
| [2] |
杨永涛.罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D].广州: 华南理工大学, 2018. YANG Y T. Study on extraction, purification and antioxidant activity of total flavonoids from apocynumvenetum[D]. Guangzhou: South China University of Technology, 2018. |
| [3] |
黄丽芸, 邓鼎森, 陈小兵. 黄酮类化合物常用提取方法研究[J]. 中国药物经济学, 2014, 9(S1): 57-58. HANG L Y, DENG D S, CHEN X B. Study on common extraction methods of flavonoids[J]. Chinese Journal of Pharmaceutical Economics, 2014, 9(S1): 57-58. |
| [4] |
姜远英, 张磊, 郭美丽, 等.山萘酚-3-O-芸香糖苷用于制备防治老年痴呆药物的用途: CN, 200510023526.2[P]. 2005-10-12. JIANG Y Y, ZHANG L, GUO M L, et al. The use of kaempferol-3-O-rutinoside for preparing medicament for preventing and treating senile dementia: CN, 200510023526.2[P]. 2005-10-12. |
| [5] |
韩雪梅.苦荞叶总黄酮提取纯化及其功能性研究[D].晋中: 山西农业大学, 2017. HAN X M. Extraction, purification and functionality of total flavonoids from leaves of fagopyrumtataricum(L.) gaerth[D]. Jinzhong: Shanxi Agricultural University, 2017. |
| [6] |
于智峰, 王敏, 张家峰. 大孔树脂精制苦荞总黄酮工艺条件的优化研究[J]. 农业工程学报, 2007, 23(4): 253-257. YV Z F, WANG M, ZHANG J F. Optimization of purifying technology of tartary buckwheat total flavonoids with macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(4): 253-257. DOI:10.3321/j.issn:1002-6819.2007.04.050 |
| [7] |
曹晓慧.高纯度芦丁制备工艺研究[D].新乡: 河南师范大学, 2018. CAO X H. Study on the preparation of high-purity rutin[D]. Xinxiang: Henan Normal University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10476-1018240143.htm |
| [8] |
朱琳, 任清, 徐笑颖. 高速逆流色谱分离纯化苦荞中芦丁、槲皮素[J]. 食品科学, 2014, 35(2): 47-50. ZHU L, REN Q, XU X Y. Isolation and preparation of flavones from the bran of tartary buckwheat using high speed counter current chromatography[J]. Food Science, 2014, 35(2): 47-50. |
| [9] |
JIANG X, JIANG S, LIU Q, et al. Separation of five flavonoids from tartary buckwheat (fagopyrumtataricum (L.) gaertn) grains via off-line two dimensional high-speed counter-current chromatography[J]. Food Chemistry, 2015, 186: 153-159. DOI:10.1016/j.foodchem.2014.08.120 |
| [10] |
YIP S H, WU D, LI P, et al. Separation of bruton's tyrosine kinase inhibitor atropisomers by supercritical fluid chromatography[J]. Journal of Chromatography A, 2019, 1586: 106-115. DOI:10.1016/j.chroma.2018.12.006 |
| [11] |
苏立强. 色谱分析法[M]. 北京: 清华大学出版社, 2009. SU L Q. Chromatographic analysis[M]. Beijing: Tsinghua University Press, 2009. |
| [12] |
庞斐.超临界流体色谱提纯青蒿素的实验研究[D].天津: 天津大学, 2007. PANG F. Experimental study on the purification of artemisinin by supercritical fluid chromatography[D]. Tianjin: Tianjin University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10056-2008186751.htm |
| [13] |
王学军, 许振良, 赵锁奇. 银杏叶提取物中槲皮素和芦丁的超临界流体色谱法测定[J]. 中国医药工业杂志, 2005, 36(7): 415-417. WANG X J, XV Z L, ZHAO S Q. Determination of quercetin and rutin in ginkgo biloba extract by supercritical fluid chromatography[J]. China Pharmaceutical Industry Journal, 2005, 36(7): 415-417. DOI:10.3969/j.issn.1001-8255.2005.07.014 |
| [14] |
JIANG C W, REN Q L, WU P D. Study on retention factor and resolution of tocopherols by supercritical fluid chromatography[J]. Journal of Chromatography A, 2003, 1005(1/2): 155-164. |
| [15] |
吕惠生, 周锦怡, 耿中峰, 等. 基于超临界流体色谱技术的赤芍活性组分分离工艺[J]. 高校化学工程学报, 2018, 32(2): 295-301. LYU H S, ZHOU J Y, GENG Z F, et al. Separation of active components from rradixpaeoniaerubra by supercritical fluid chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 295-301. DOI:10.3969/j.issn.1003-9015.2018.02.007 |
| [16] |
朱虎刚, 田宜灵, 陈丽, 等. 超临界CO2+CH3OH及C2H5OH二元系的气液平衡[J]. 高等学校化学学报, 2002, 23(8): 1588-1591. ZHU H G, TIAN Y L, CHEN L, et al. Studies on vapor-liquid phase equilibria for SCF CO2+CH3OH and SCF CO2+C2H5OH systems[J]. Chemical Journal of Chinese Universities, 2002, 23(8): 1588-1591. DOI:10.3321/j.issn:0251-0790.2002.08.025 |
| [17] |
SONG J, PARK H, KIM J, et al. Modified simulated moving bed chromatography with two pumps for sugar separation[J]. Korean Journal of Chemical Engineering, 2019, 36(1): 109-114. |
| [18] |
RYU Y K, KIM K L, LEE C H. Adsorption and desorption of n-hexane, methyl ethyl ketone, and toluene on an activated carbon fiber from supercritical carbon dioxide[J]. Industrial & Engineering Chemistry Research, 2000, 39(7): 2510-2518. |
| [19] |
MARTIRE D E, BOEHM R E. Unified molecular theory of chromatography and its application to supercritical fluid mobile phases. 1. Fluid-liquid (absorption) chromatography[J]. Journal of PhysicalChemistry, 2002, 91(9): 2433-2446. |




