由于重金属具有毒性大、不可生物降解且易在生物体内富集、代谢缓慢[1]等特点,即使低浓度的重金属也会对人类健康和动植物的生存带来严重威胁。因此,2011年国务院正式批复《重金属污染综合防治“十二五”规划》,对汞、铬、镉、铅和类金属砷等重金属污染进行重点防控以有效控制重金属污染。在这些重金属中,铅和铬是环境污染中常见的2种有毒重金属。其中铅及其化合物被广泛地应用于蓄电池制造、涂料颜料、汽车和航空等领域[2]。Pb(Ⅱ)在环境中难以降解,一旦进入环境后会长期持久地保持毒性,对许多生命组织造成严重的潜在性威胁,所以铅一直在强污染物范围名单中。在另一方面,铬及其化合物被广泛地应用于电镀、皮革鞣制、金属表面处理和纺织工业等领域[3]。在水溶液中,金属铬主要以Cr(Ⅵ)和Cr(Ⅲ) 2种稳定的氧化态存在,并且Cr(Ⅵ)的毒性远远高于Cr(Ⅲ)。另外,强毒性的Cr(Ⅵ)非常容易进入人体细胞内,诱导基因突变并具有致癌性[4]。综上所述,如何高效去除环境中的铅、铬重金属离子已经成为目前亟待解决的重要问题。近年来,纳米零价铁(nanoscale zero-valent iron, nZVI)因其高比表面积、优异的吸附性和反应活性等优点被广泛应用于重金属污染物的去除。但是由于其本身的磁性和较高的表面能,使新合成的nZVI在实际反应条件下极易自发团聚和被氧化,导致其快速失活。在另一方面,nZVI的制备需要使用硼氢化钠/钾等强还原剂,从而提高了制备成本并对环境造成一定的影响[5-6]。以上这些缺点限制了nZVI材料在环境污染物原位修复领域中的大规模应用。通过采用植物提取液[7]作为还原剂代替化学还原剂或对nZVI材料进行改性[8-9]可在一定程度上抑制nZVI的自发团聚和氧化现象,并减轻材料制备过程中对环境的污染,所以绿色合成和nZVI的改性工作引起了人们的高度关注。因此,本文首先综述了nZVI材料的结构以及近期在绿色合成和nZVI改性领域的最新进展。在此基础上,重点介绍了nZVI材料对水中铅、铬重金属离子的去除研究。
2 纳米零价铁的结构通常,nZVI内层是由致密的Fe0核心组成,外层由薄的无定形壳层组成。外壳层的化学组成通常被认为是混合的Fe(Ⅱ)/Fe(Ⅲ)氧化物相[10],该核-壳双重结构不可避免地影响nZVI对污染物的去除性能。在nZVI合成期间,就可以观察到粒子表面的腐蚀和氧化反应。因此,新合成的nZVI材料在用于环境污染物修复之前就已经具有氧化物外壳结构[11],所以该铁氧化物壳层被认为是纳米零价铁“与生俱来”的,即在合成时就会形成该外层结构,其结构如图 1所示。
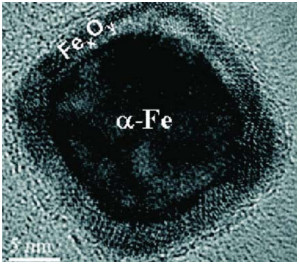
|
图 1 nZVI材料的核壳结构[10] Fig.1 Core-shell structure of nZVI material[10]. Reprinted with permission from ref 10. Copyright American Chemical Society |
MU等[12]综述了nZVI合成过程中外壳层的形成机理,并讨论了其结构和化学组成及其对重金属去除性能的影响。当在水溶液中合成nZVI时,水中溶解氧或水是氧化nZVI的主要组分,而Fe2+是主要产物,然后其进一步被氧化形成Fe3+。Fe3+可与OH-反应生成Fe(OH)3,Fe(OH)3可进一步脱水形成FeOOH。这些Fe(OH)3和FeOOH产物可优先沉淀在nZVI的表面上;当在无溶剂条件下合成时,暴露于空气的“裸露”nZVI易于被氧化,其表面氧化物相以FeO、Fe3O4和Fe2O3的顺序形成。
通过透射电子显微镜(transmission electron microscope,TEM)和高分辨透射电子显微镜(high resolution transmission electron microscope, HR-TEM)表征可以进一步确定nZVI氧化物壳层的厚度通常在2~4 nm [13]。在去除污染物过程中,该氧化物外壳具有双重作用:存在氧化物外壳不利于Fe0与金属离子之间的直接相互作用,抑制了nZVI与金属离子之间的电子转移;但另一方面,氧化物壳层的存在为金属离子的初始吸附提供了反应位点[12]。ZHANG等[14]研究发现在制备nZVI的过程中,通过限制Fe(OH)3的脱水过程,可以获得由45.5%的Fe(OH)3和54.5%的FeOOH组成的一个独特的壳层,具有该壳层的nZVI表现出较高的从溶液中去除Pb2+的效率。这是因为虽然氧化壳中存在的Fe(OH)3抑制了Pb(Ⅱ)的还原,但极大地促进了Pb(Ⅱ)的共沉淀和吸附。通过TEM的对比可以发现反应后一部分纳米颗粒中的Fe0核被耗尽,留下空的氧化铁壳。这表明该铁氧化物壳层能够促进电荷流,而溶液中的Fe(Ⅱ)则来自Fe0核[15]。
综上所述,nZVI的核壳结构在重金属去除过程中表现出独特、优越的性能。这种核壳结构赋予nZVI以下特性:1)金属Fe0核作为电子供体提供还原特性,铁氧化物外壳则通过静电相互作用或表面络合作用吸附溶质,以促进或抑制Fe0核到外壳的电子转移[16];2)外壳层的存在可以阻止内层Fe0核的进一步氧化,但是不可避免地降低了nZVI的氧化还原性能。
3 纳米零价铁的合成方法虽然nZVI作为一种高效的还原剂和吸附剂,在污染物处理方面具有诸多优势。然而,由于nZVI存在易团聚、反应过程易失活等缺点,从而导致nZVI在环境修复过程中难以保持高活性[6]。因此,如何提高nZVI的分散性和稳定性是解决其实际应用的关键问题之一。目前,通过绿色合成和改性[7-9]这2种方法都可以抑制nZVI的团聚和氧化,以增强其用于环境修复时的稳定性和有效性。
3.1 纳米零价铁的绿色合成植物提取液中的有机成分例如茶多酚可以作为稳定剂,并且这些植物提取物对生物体无毒,且环境友好,不存在二次污染的风险[17]。因此,与其他纳米颗粒合成技术相比,以植物提取液为还原剂来制备nZVI的合成方法具有绿色、环保的特点,近年来已引起越来越多的关注。例如:XIAO等[18]用15种不同植物提取物来合成铁纳米粒子(Fe NPs),并测定了制备过程中还原物质的含量。结果表明,各种还原物质的含量因植物而异,其中多酚是参与Fe NPs合成中最活跃的生物分子。
茶叶在绿色合成法中的应用最为普遍。我国是茶叶的发源地,茶叶资源丰富,取材和使用都十分方便。茶叶提取物具有高水溶性、低毒性和可生物降解性等优点,其含有的丰富的茶多酚或咖啡因可直接作为还原剂。茶多酚中的表儿茶素还原电位是0.57 eV,足以直接还原Fe2+为Fe0 (E0(Fe2+/ Fe0) = -0.44 eV)[19]。WANG等[19]以茶多酚为还原剂,通过还原FeSO4来制备纳米零价铁(TP-Fe)。茶多酚中含量丰富的表儿茶素作为还原剂、分散剂和封端剂,整个制备过程没有额外的提取步骤和保护气氛。通过场发射扫描电子显微镜(field emission scanning electron microscope,FE-SEM)表征比较了TP-Fe与液相还原法制备的纳米零价铁(BH-Fe)的表面形貌。观察结果表明,BH-Fe粒子表面粗糙,发生了严重的铁纳米粒子团聚;而TP-Fe粒子表面光滑,分散性与BH-Fe相比明显增强。
由于桉树种植成本低以及含有丰富的多酚,桉树叶提取物也被用于还原Fe2+或Fe3+合成nZVI材料。LIU等[20]发现以桉树叶提取物为还原剂合成的nZVI材料在一定条件下对Cr(Ⅵ)的去除率可以达到100%;通过对提取物进行分子鉴定研究,发现其中的醇酚类和烷基醛主要作为还原剂,醇酸、烷醇、植物醇、乙酸酯和芳香酮主要充当封端剂,其中醛、酚和醇化合物在合成nZVI过程中起主导作用。另外,该方法所制备的nZVI具有类似核-壳结构的特征,其中微量Fe0和Fe氧化物组成核,生物分子构成“壳”。尽管使用绿色合成法制备的纳米零价铁具有诸多优点,但也存在着植物提取液不能将Fe离子完全还原为Fe(0)[21]、在还原过程中容易生成氧化铁和氢氧化铁等问题。
3.2 纳米零价铁的改性为了提高nZVI的稳定性,减小nZVI颗粒团聚和氧化能力,通过负载或对其表面进行修饰改性也是制备nZVI的常见方法。
3.2.1 负载型纳米零价铁的制备负载型纳米零价铁是以某种材料为载体,将nZVI颗粒负载在材料表面,以制备高比表面和性能独特的nZVI材料。这样可以减少nZVI的团聚,增强其在环境中的迁移能力[22]。
CHEN等[23]以羟基铝柱撑膨润土为载体,用NaBH4还原Fe2+制备了羟基铝柱撑膨润土负载的纳米零价铁(NZVI/Al-PILC)。载体的存在有效地克服了nZVI的团聚现象,使Fe0粒子呈现出良好的分散状态。将其用于合成废水中Pb(Ⅱ)的去除,结果表明NZVI/Al-PILC对Pb2+的去除效率远高于含铁量相同的nZVI,且表现出良好的重复使用性。
膨润土来源丰富,并具有化学和机械稳定性高、结构性能稳定和吸附能力高等特点,所以是一种低成本、高效的吸附剂;另外,由于膨润土具有较高的阳离子交换能力和比表面积[24],从而在去除废水中重金属污染方面具有巨大的应用潜能。在此基础上,以多孔膨润土为载体可有效减少nZVI粒子的聚集,以提高反应活性、耐久性。例如:SHI等[25]通过硼氢化钠还原法合成了膨润土负载的纳米零价铁(B-nZVI)材料,并将其用于水溶液中Cr(Ⅵ)的去除。研究表明,膨润土负载降低了Fe0的聚集,从而提高了Cr(Ⅵ)的去除效率。
3.2.2 纳米零价铁的表面修饰通过在nZVI表面进行化学修饰(共价或非共价官能化)或附加稳定剂(如表面活性剂[26-29])的方法可以合成不同种类的表面修饰型nZVI材料。该方法可防止nZVI的团聚,以提高其分散性,增强nZVI与目标污染物的相互作用。
LI等[30]先用瓜尔胶表面改性nZVI微球,再通过与浮石复合和聚乙烯醇絮凝制得改性nZVI (PPG-nZVI)微球,并将其用于除去水中Pb2+的实验。PPG-nZVI可以克服nZVI在应用于原位修复中所面临的主要挑战:迁移率、团聚和氧化。通过实验可以证明,PPG-nZVI微球可作为原位Pb2+修复的有效材料。PENG等[31]将纳米零价铁用正硅酸乙酯(tetraethyl orthosilicate,TEOS)和十六烷基三甲氧基硅烷(hexadecyltrimethoxysilane,HDTMOS)改性,从而制备得到了高度稳定的纳米零价铁复合物(HS-nZVI)。所制备的HS-nZVI的比表面积为65.9 m2·g-1,在水溶液中具有较高的稳定性。另外,HS-nZVI具有易于制备、稳定性优异、可重复使用、Cr(Ⅵ)去除能力高以及可磁回收性能的优点,所以HS-nZVI在修复Cr(Ⅵ)污染水域方面具有显著的应用前景。表 1中总结了绿色合成和nZVI改性的优缺点。
|
|
表 1 不同方法制备nZVI的优缺点 Table 1 Advantages and disadvantages of methods used for preparing nZVI |
纳米零价铁由于粒径小、比表面积高,与普通铁粉相比可以更有效地去除重金属离子。nZVI中的Fe0核可提供电子发生氧化还原反应,而氧化铁/氢氧化铁壳层具有吸附能力,可以吸附溶液中的重金属离子。但是,nZVI材料对于不同重金属的去除机理以及相互作用机制仍然存在争议。一般认为,nZVI去除重金属的机理主要与金属离子的标准氧化还原电位(Eh0)有关。Fe2+/Fe0的标准氧化还原电位为-0.44 eV,Eh0比Fe0高的金属(例如,Cr6+和Cu2+)在被氧化物壳吸收后优先还原为较低价态,然后与铁氧化物/氢氧化物共沉淀。另外,这些金属离子也可以通过被铁腐蚀产物吸附或形成表面复合物而除去。对于Eh0比Fe0低的金属(例如,Zn2+和Cd2+),它们通过被吸附到铁氧化壳上而被除去;而Eh0与Fe2+/Fe0接近的金属(例如,Pb2+和Ni2+)则首先被吸附于Fe0表面,随着反应的进行,Fe0与重金属发生还原反应,直至平衡[12, 32]。
Pb(Ⅱ)标准氧化还原电位为-0.13 eV,略高于Fe2+/Fe0标准氧化还原电位[32],所以金属铁/氧化铁导带中的电子能量比Pb2+/Pb0的标准电位更负,从而为电子由Fe0到被固定的Pb2+转移提供了有效驱动力[33],因此使用nZVI去除Pb(Ⅱ)的机理主要是吸附和还原。LUO等[33]通过对反应前后样品的X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)表征发现,反应后nZVI的XPS谱图中出现了2个新的光电子峰,通过分析证明该光电子峰可归属于Pb(Ⅱ),但是该Pb2+的形成过程尚未明晰。
一般认为,Pb(Ⅱ)的去除反应可表示为[34]:
| $ {\rm{2F}}{{\rm{e}}^{\rm{0}}}{\rm{ + 3P}}{{\rm{b}}^{{\rm{2 + }}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{3P}}{{\rm{b}}^{\rm{0}}}{\rm{ + 2FeOOH + 6}}{{\rm{H}}^{\rm{ + }}} $ | (1) |
FAN等[35]通过化学沉积法制备了还原氧化石墨烯负载的纳米零价铁(nZVI/rGO)复合材料。实验结果表明,(nZVI/rGO)复合材料去除Pb(Ⅱ)的主要机制是基于nZVI/rGO复合物的物理吸附,只有一小部分Pb(Ⅱ)被nZVI还原为Pb(0)。因此,吸附在该Pb(Ⅱ)的去除过程中占主要作用。
Cr6+/Cr3+的标准氧化还原电位为1.36 eV,远高于Fe2+/Fe0,所以nZVI对Cr(Ⅵ)还原作用非常有效[32]。在反应过程中,Cr(Ⅵ)被瞬间吸附在nZVI的氧化物壳上。然后被吸附的Cr(Ⅵ)可被还原为Cr(Ⅲ)并进一步形成Cr(OH)3沉淀,该Cr(OH)3可结合入FeOOH氧化壳层中形成(CrxFe1-x)(OH)3或CrxFe1-xOOH化合物,从而逐渐降低了还原速度[36]。JIA等[37]通过离子交换和原位还原反应使nZVI嵌入聚丙烯酸钠(poly(sodium acrylate),PSA)冷冻凝胶中,从而合成了新型超大孔PSA-nZVI复合材料。通过对PSA-nZVI与Cr(Ⅵ)反应后固体颗粒的X射线衍射(X-ray diffraction,XRD)和XPS表征推断出Cr(Ⅵ)的去除机理:Cr(Ⅵ)从本体溶液扩散至PSA-nZVI表面并被吸附,Fe0或Fe2+将Cr(Ⅵ)还原为Cr(Ⅲ)。同时,Fe0被氧化成Fe2+,然后Fe2+继续参与还原反应并最终被氧化成Fe3+,之后Cr(Ⅲ)和Fe3+转移到Cr(OH)3或Cr3+/Fe3+共沉淀物中,共沉淀方程为[37]:
| $ {\rm{(1}} - x{\rm{)F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}x{\rm{C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{r}}_x}{\rm{F}}{{\rm{e}}_{{\rm{1}} - x}}{{\rm{(OH)}}_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}^{\rm{ + }}} $ | (2) |
| $ \left( {{\rm{1}} - x} \right){\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}x{\rm{C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{r}}_x}{\rm{F}}{{\rm{e}}_{{\rm{1}} - x}}{\rm{OOH + 3}}{{\rm{H}}^{\rm{ + }}} $ | (3) |
QU等[38]合成了活性炭纤维负载型纳米零价铁(ACF-nZVI)复合物,并用于地下水中Cr(Ⅵ)的去除。实验结果证明,nZVI是复合材料中的活性相,充当还原剂;活性炭纤维(activated carbon fiber,ACF)仅充当电子转移介体和吸附负载材料,他们提出2步相互作用的去除机制,包括在ACF-nZVI复合物的表面或内层上物理吸附Cr(Ⅵ),随后通过nZVI将Cr(Ⅵ)还原为Cr(Ⅲ)。
综上所述,纳米零价铁的核壳结构以及与重金属标准氧化还原电位的差异,使nZVI与重金属反应过程存在不同机理。另外,由于nZVI合成方法或载体性能的差异,使得nZVI在去除同一重金属时也可能存在不同机理,并且去除过程易受nZVI投加量、pH值、温度以及共存离子等因素影响。
4.2 纳米零价铁去除铅、铬的效能研究nZVI的投加量是影响重金属去除的重要参数,影响铅、铬去除平衡。WU等[39]发现在Cr(Ⅵ)去除过程中,随着nZVI投加量的增加,Cr(Ⅵ)的去除效率显著增加。当投加量达到某一值时,Cr(Ⅵ)的去除效率达到100%。Cr (Ⅵ)的去除效率随着nZVI剂量增加而增加可归因于在反应过程中更多可用的重金属结合位点。FU等[40]发现随着海泡石负载的纳米零价铁(S-nZVI)投加量的增加,Kobs增加,所以Cr(Ⅵ)和Pb(Ⅱ)的去除效率或速率常数也随之增加。其中Cr(Ⅵ)和Pb(Ⅱ)的最高去除能力为609.5 mg Cr·(g Fe)-1和756.7 mg Pb·(g Fe)-1,高于其他文献所报道的Cr(Ⅵ)和Pb (Ⅱ)的去除能力[41-42]。当投加量超过最佳值时,继续增加nZVI的量,Kobs值不会受到直接影响,因此没有必要使用更高的nZVI剂量。MA等[43]结合水热法和液相还原法首次制备出磁性碳/Fe3O4负载的纳米零价铁复合材料(nZVI@CM)。在用于溶液中Pb(Ⅱ)去除过程中,他们发现由于吸附位点数量较多,Pb(Ⅱ)的去除效率随着nZVI@ CM用量的增加而增加。当材料投加量超过最佳范围时,继续增加用量并未提高去除效率。这是由于投加量较低时,nZVI在溶液中具有更好的分散性,即nZVI颗粒表面的所有活性位点都完全未被覆盖,这可以加速Pb(Ⅱ)离子向nZVI表面大量活性位点的接近,表面活性位点上的吸附迅速饱和,所以具有较高的去除能力。另一方面,当超过最佳投加量时,具有较高能量的吸附活性位点可及性降低,而较多比例的低能量活性位点被占据,从而使吸附量下降。同时,过高材料用量会增加纳米颗粒之间碰撞的机率,从而产生颗粒聚集,导致总表面积下降和扩散路径长度增加,这两者都导致该材料对Pb(Ⅱ)的去除能力不会增加[44]。因此,采用最佳范围的nZVI投加量既可以保证重金属的高去除率又可以节省材料。
溶液的pH值被认为是重金属铅和铬去除过程中最重要的影响参数。WANG等[45]比较了nZVI和广泛使用的金属沉淀剂石灰对Pb(Ⅱ)和Zn(Ⅱ)的去除能力,发现加入少量的石灰后,由于其强碱性和快速溶解能力使溶液的pH值瞬间从6增加至12,而去除Pb(Ⅱ)和Zn(Ⅱ)的最佳pH值低于12[46],所以反应后溶液中Pb(Ⅱ)和Zn(Ⅱ)的最低浓度高于重金属的排放标准[47],而使用nZVI可以轻易地得到低浓度的Pb(Ⅱ)和Zn(Ⅱ)。由于nZVI固有的pH稳定作用,为工业废水的处理带来了系统操作的便利。ARSHADI等[44]通过在不同pH值下进行平衡吸附实验,研究了pH值对sineguelas废弃物修饰的nZVI(S-NaOH-nZVI)去除Pb(Ⅱ)的影响。其他变量保持不变,在pH = 1.0~9.0研究发现,当pH在5.0左右时,Pb(Ⅱ)去除率最高。原因是在低pH值下,H+与Pb(Ⅱ)阳离子之间会竞争空置吸附位点,使得去除率降低;当pH > 5.0以后,吸附容量保持恒定,Pb(Ⅱ)浓度的降低主要归因于Pb(OH)2的沉淀,因为Pb(Ⅱ)在pH=7.0~10.0时可形成铅氢氧化物,从而在溶液中沉淀出来[48]。LUO等[33]使用Fe和Ca作为交联阳离子合成藻酸盐微胶囊固定的纳米零价铁(M-nZVI),在pH = 1.0~6.0范围内研究了pH值对M-nZVI去除Pb(Ⅱ)的影响。实验结果表明,在pH为1.0~2.0时Pb(Ⅱ)的去除效率较低,在pH=3.0时吸收量迅速增加,在pH = 4.0~6.0则保持稳定水平。与其他报道结果类似[49],强酸性条件不利于Pb(Ⅱ)的去除,而弱酸性条件更有利于M-nZVI去除Pb(Ⅱ)。
在去除过程中影响pH的主要因素是溶液中Pb(Ⅱ)的种类。研究结果表明,铅在溶液中可以以Pb2+,Pb(OH)+、Pb(OH)20、Pb(OH)3-的形式存在[33]。在酸性介质中,特别是低于等电点电荷的pH,铅主要以Pb2+的形式存在,当pH接近6.0时,仅存在小部分Pb(OH)+[50]。在强酸性条件下,Pb2+去除率低部分归因于H+和Pb2+对表面活性位点的竞争。此外,nZVI和溶液之间Fe(Ⅱ)和Pb(Ⅱ)氢氧化物层厚度的增加也可以降低Pb(Ⅱ)的去除能力。在弱酸性pH范围内,随着pH值的增加,nZVI颗粒表面官能团去质子化越来越强,使nZVI表面负电荷增加,即nZVI与Pb2+之间的静电吸引力随着酸性介质中pH值的增加而增加,所以弱酸性条件下Pb(Ⅱ)的去除率达到最大值并几乎保持恒定[33]。
WU等[39]在研究多层材料涂覆的纳米零价铁(SBC-nZVI)从水中去除Cr(Ⅵ)的反应时也发现Cr(Ⅵ)的去除效率高度依赖于pH值。通过比较pH值为3.0~8.0时的去除效果可以发现,当pH为3.0时去除效率最高,pH为6.0时可观察到最小去除率,这说明低pH值有利于Cr(Ⅵ)的去除。PENG等[31]发现Cr(Ⅵ)在溶液中有2种存在形式,HCrO4-存在于低pH值条件下(例如pH=3),随着pH值的增加,HCrO4-逐步变为CrO42-。根据以下去除反应,可以发现酸性环境有利于去除Cr(Ⅵ)[51]:
| $ {\rm{2HCr}}{{\rm{O}}_{\rm{4}}}^ - {\rm{ + 3F}}{{\rm{e}}^{\rm{0}}}{\rm{ + 14}}{{\rm{H}}^{\rm{ + }}} \to {\rm{3F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 8}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (4) |
| $ {\rm{HCr}}{{\rm{O}}_{\rm{4}}}^ - {\rm{ + 3F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 7}}{{\rm{H}}^{\rm{ + }}} \to {\rm{3F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (5) |
| $ {\rm{2Cr}}{{\rm{O}}_{\rm{4}}}^{2 - }{\rm{ + 3F}}{{\rm{e}}^{\rm{0}}}{\rm{ + 16}}{{\rm{H}}^{\rm{ + }}} \to {\rm{3F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 8}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (6) |
| $ {\rm{2Cr}}{{\rm{O}}_{\rm{4}}}^{2 - }{\rm{ + 3F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 8}}{{\rm{H}}^{\rm{ + }}} \to {\rm{3F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 2C}}{{\rm{r}}^{{\rm{3 + }}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (7) |
相比较而言,HCrO4-由于具有低吸附自由能从而比CrO42-更容易吸附[52]。此外,高pH值使得nZVI表面存在更多的负电荷,加强了nZVI和Cr(Ⅵ)之间的静电排斥,使得Cr(Ⅵ)在nZVI表面上的吸附变得困难[31]。ZHOU等[53]发现酸性条件下,大量的H+可以提高nZVI的腐蚀速率,同时增加活性Fe(Ⅱ),而H+和Fe(Ⅱ)物种都可以加速Cr(Ⅵ)的还原。相反,氧化物和Fe(Ⅲ)-Cr(Ⅲ)氢氧化物很容易在较高的pH值下生成并覆盖在nZVI颗粒的表面,从而起到物理屏障作用并减少颗粒的反应位点,阻止Cr(Ⅵ)进入nZVI颗粒表面。
温度也是影响nZVI与Pb(Ⅱ)和Cr(Ⅵ)化学反应速率和还原效率的因素之一。ZHANG等[14]发现升高温度可逐渐增加Pb(Ⅱ)吸附能力,根据计算发现Fe释放的速度几乎等于理论Fe浓度。在确保不会发生Pb(Ⅱ)沉淀的基础上,为了更好地理解nZVI对Pb(Ⅱ)阳离子的吸附,通过使用Freundlich等温线去拟合数据可以获得较高的R2值。吸附等温线是经典的L型等温线,表示是化学吸附,这反映了Pb(Ⅱ)和nZVI之间的高亲和力以及吸附过程是吸热的。CHENG等[54]研究了温度对Cr(Ⅵ)去除的影响,发现当温度超过50 ℃时,Cr(Ⅵ)的去除效率明显增加,当温度达到70 ℃时Cr(Ⅵ)去除率增加到79.18%。同时,nZVI和Cr(Ⅵ)之间的反应是吸热反应。ZHU等[55]证实随着温度的升高,Cr(Ⅵ)的还原速度增加。在303 K时,Cr(Ⅵ)的还原率可达到99.84 %,而在297和293 K时,反应10 min后还原率分别为89.14 %和68.66 %,这表明高温有利于反应过程。随着温度的升高,还原反应达到平衡时间缩短。
实际废水中存在的其他离子对nZVI去除Pb(Ⅱ)和Cr(Ⅵ)的效率也有一定影响。LI等[30]发现离子强度对PPG-nZVI去除Pb(Ⅱ)的适度影响是由于nZVI表面的双电层压缩,Pb(Ⅱ)的去除效率随着溶液中NO3-浓度增加而降低。MA等[43]研究发现,在nZVI@CM去除Pb(Ⅱ)的过程中,当Cl-和Pb2+的摩尔比高于某一值时,过量的Cl-与Pb2+易结合形成PbCl3-和PbCl42-,Pb电极电位的降低以及Cl-对nZVI与Pb(Ⅱ)反应的抑制,都会降低Pb(Ⅱ)的去除率。ZHANG等[56]发现Zn2+和Cu2+的存在大大降低了nZVI对Cr(Ⅵ)去除效率,这是因为Cu2+具有比Fe2+更高的Eh0,更容易被还原为Cu0。而Zn2+由于其Eh0低于Fe2+,所以对Cr6+还原的抑制作用可归因于表面活性位点的竞争。除此以外,PO43-、SO42-、NO3-和CO32-的存在都对Cr(Ⅵ)去除存在一定的阻碍作用。CO32-和PO43-可以吸附在nZVI的表面,通过形成内球体表面复合物,消耗铁离子并占据反应位点。SO42-是纯竞争吸附阴离子,可以减少Cr(Ⅵ)在nZVI反应位点的富集,导致Cr(Ⅵ)还原率降低。NO3-是竞争性氧化还原阴离子,NO3-在nZVI还原反应中作为反应物和钝化剂可降低Cr(Ⅵ)的去除效率。
综上所述,在重金属Pb(Ⅱ)和Cr(Ⅵ)的去除过程中,增加nZVI投加量有利于提高Pb(Ⅱ)和Cr(Ⅵ)的去除效率,当投加量超过最佳范围时,继续增加nZVI用量则不能有效提高去除效率,所以采用最佳nZVI投加量可以提高去除过程的成本效益;由于H+和Pb2+对表面活性位点的竞争,使得弱酸性条件更有利于Pb(Ⅱ)的去除,而由于不同pH值时Cr6+存在状态的差异以及反应过程中消耗H+,使得强酸性条件下Cr(Ⅵ)的去除能力最大;升高温度可以加速nZVI与重金属的反应过程,缩短反应达到平衡的时间;废水中存在的其他离子可能会降低nZVI去除目标离子的能力。nZVI与重金属反应过程中,选择最佳反应条件可以快速、高效去除目标污染物。
5 展望纳米零价铁作为一种环境友好型材料,在污染物的去除和环境原位修复领域颇具应用潜力。由于nZVI本身易团聚和氧化的问题,所以需要改进合成方法以提高nZVI的稳定性和分散性,延长使用寿命。绿色合成和改性是目前常用的可以有效改善nZVI自身缺陷,提高使用性能的方法,但也存在着绿色还原剂不能完全将铁离子还原形成零价铁等问题。探寻具有较强还原性能,并能同时修饰纳米粒子表面结构的绿色还原剂是需要进一步研究的重要问题。同时,亟需深入研究重金属离子在环境介质中的迁移规律和相互作用机理,并明晰nZVI与不同重金属离子的相互作用机理和吸附行为。在此基础上,获得nZVI材料对重金属离子的去除机理,这将有利于选择最佳反应条件和nZVI材料的再生条件。最后,虽然nZVI材料为环境污染的修复和整治注入了新的活力,但是如何进一步降低材料成本和可能存在的二次污染以及nZVI处理后重金属的分离和回收利用等问题也是今后需要加强研究的内容。
| [1] |
李钰婷, 张亚雷, 代朝猛, 等. 纳米零价铁颗粒去除水中重金属的研究进展[J]. 环境化学, 2012, 31(9): 1349-1354. LI Y T, ZHANG Y L, DAI C M, et al. The advance on removal of heavy metals in water by nanoscale zero-valent iron[J]. Environmental Chemistry, 2012, 31(9): 1349-1354. |
| [2] |
LALHRUAITLUANGA H, JAYARAM K, PRASAD M N, et al. Lead(Ⅱ) adsorption from aqueous solutions by raw and activated charcoals of melocanna baccifera roxburgh (bamboo)-a comparative study[J]. Journal of Hazardous Materials, 2010, 175(1/2/3): 311-318. |
| [3] |
BHAUMIK M, MAITY A, SRINIVASU V V, et al. Enhanced removal of Cr(Ⅵ) from aqueous solution using polypyrrole/Fe3O4 magnetic nanocomposite[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 381-390. |
| [4] |
LV X S, XU J, JIANG G M, et al. Removal of chromium(Ⅵ) from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes[J]. Chemosphere, 2011, 85(7): 1204-1209. DOI:10.1016/j.chemosphere.2011.09.005 |
| [5] |
ZHU F, MA S Y, LIU T, et al. Green synthesis of nano zero-valent iron/Cu by green tea to remove hexavalent chromium from groundwater[J]. Journal of Cleaner Production, 2018, 174: 184-190. DOI:10.1016/j.jclepro.2017.10.302 |
| [6] |
EZZATAHMADI N, AYOKO G A, MILLAR G J, et al. Clay-supported nanoscale zero-valent iron composite materials for the remediation of contaminated aqueous solutions:A review[J]. Chemical Engineering Journal, 2017, 312: 336-350. DOI:10.1016/j.cej.2016.11.154 |
| [7] |
RANA A, KUMARI N, TYAGI M, et al. Leaf-extract mediated zero-valent iron for oxidation of Arsenic (Ⅲ):Preparation, characterization and kinetics[J]. Chemical Engineering Journal, 2018, 347: 91-100. DOI:10.1016/j.cej.2018.04.075 |
| [8] |
BHOWMICK S, CHAKRABORTY S, MONDAL P, et al. Montmorillonite-supported nanoscale zero-valent iron for removal of arsenic from aqueous solution:Kinetics and mechanism[J]. Chemical Engineering Journal, 2014, 243: 14-23. DOI:10.1016/j.cej.2013.12.049 |
| [9] |
宋珍霞, 张继梅, 巨梦蝶, 等. 抗坏血酸稳定纳米零价铁的制备及其在含Cd(Ⅱ)废水处理中的应用[J]. 化工进展, 2018, 37(8): 3231-3237. SONG Z X, ZHANG J M, JU M D, et al. Preparation of L-ascorbic acid-stabilized nanoscale zerovalent iron and its application in Cd(Ⅱ) wastewater treatment[J]. Chemical Industry and engineering progress, 2018, 37(8): 3231-3237. |
| [10] |
WANG C M, BAER D R, AMONETTE J E, et al. Morphology and electronic structure of the oxide shell on the surface of iron nanoparticles[J]. Journal of the American Chemical Society, 2009, 131(25): 8824-8832. DOI:10.1021/ja900353f |
| [11] |
CRANE R A, SCOTT T B. Nanoscale zero-valent iron:Future prospects for an emerging water treatment technology[J]. Journal of Hazardous Materials, 2012, 211/212: 112-125. DOI:10.1016/j.jhazmat.2011.11.073 |
| [12] |
MU Y, JIA F L, AI Z H, et al. Iron oxide shell mediated environmental remediation properties of nano zero-valent iron[J]. Environmental Science:Nano, 2017, 4(1): 27-45. DOI:10.1039/C6EN00398B |
| [13] |
MARTIN J E, HERZING A A, YAN W L, et al. Determination of the oxide layer thickness in core-shell zerovalent iron nanoparticles[J]. Langmuir, 2008, 24(8): 4329-4334. DOI:10.1021/la703689k |
| [14] |
ZHANG Y L, SU Y M, ZHOU X F, et al. A new insight on the core-shell structure of zerovalent iron nanoparticles and its application for Pb(Ⅱ) sequestration[J]. Journal of Hazardous Materials, 2013, 263: 685-693. DOI:10.1016/j.jhazmat.2013.10.031 |
| [15] |
YAN W L, LIEN H L, KOEL B E, et al. Iron nanoparticles for environmental clean-up:Recent developments and future outlook[J]. Environmental Science:Processes & Impacts, 2013, 15(1): 63-77. |
| [16] |
DICKINSON M, SCOTT T B. The effect of vacuum annealing on the remediation abilities of iron and iron-nickel nanoparticles[J]. Journal of Nanoparticle Research, 2011, 13(9): 3699-3711. DOI:10.1007/s11051-011-0291-5 |
| [17] |
MARKOVA Z, NOVAK P, KASLIK J, et al. Iron(Ⅱ, Ⅲ)-polyphenol complex nanoparticles derived from green tea with remarkable ecotoxicological impact[J]. ACS Sustainable Chemistry & Engineering, 2014, 2(7): 1674-1680. |
| [18] |
XIAO Z L, YUAN M, YANG B, et al. Plant-mediated synthesis of highly active iron nanoparticles for Cr (Ⅵ) removal:Investigation of the leading biomolecules[J]. Chemosphere, 2016, 150: 357-364. DOI:10.1016/j.chemosphere.2016.02.056 |
| [19] |
WANG X Y, WANG A Q, MA J, et al. Facile green synthesis of functional nanoscale zero-valent iron and studies of its activity toward ultrasound-enhanced decolorization of cationic dyes[J]. Chemosphere, 2017, 166: 80-88. DOI:10.1016/j.chemosphere.2016.09.056 |
| [20] |
LIU Y, JIN X Y, CHEN Z L. The formation of iron nanoparticles by Eucalyptus leaf extract and used to remove Cr(Ⅵ)[J]. Science of the Total Environment, 2018, 627: 470-479. DOI:10.1016/j.scitotenv.2018.01.241 |
| [21] |
MYSTRIOTI C, SPARIS D, PAPASIOPI N, et al. Assessment of polyphenol coated nano zero valent iron for hexavalent chromium removal from contaminated waters[J]. Bulletin of Environmental Contamination and Toxicology, 2015, 94(3): 302-307. |
| [22] |
庞龙, 周庆祥, 苏现伐. 纳米零价铁修饰技术研究进展[J]. 化工进展, 2011, 30(6): 1361-1368. PANG L, ZHOU Q X, SU X F. Progress of in-situ modification techniques of nanoscale zero-valent iron[J]. Chemical Industry and Engineering Progress, 2011, 30(6): 1361-1368. |
| [23] |
陈亚, 李益民, 曹玉廷. 羟基铝柱撑膨润土负载纳米零价铁去除Pb(Ⅱ)[J]. 高校化学工程学报, 2016, 30(1): 195-200. CHEN Y, LI Y M, CAO Y T. Removal of Pb(Ⅱ) by Al-pillared bentonite supported nanoscale zero-valent iron[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(1): 195-200. |
| [24] |
SHI L N, ZHANG X, CHEN Z L. Removal of chromium (Ⅵ) from wastewater using bentonite-supported nanoscale zero-valent iron[J]. Water Research, 2011, 45(2): 886-892. |
| [25] |
SHI L N, LIN Y M, ZHANG X, et al. Synthesis, characterization and kinetics of bentonite supported nZVI for the removal of Cr(Ⅵ) from aqueous solution[J]. Chemical Engineering Journal, 2011, 171(2): 612-617. DOI:10.1016/j.cej.2011.04.038 |
| [26] |
JIANG Z M, LV L, ZHANG W M, et al. Nitrate reduction using nanosized zero-valent iron supported by polystyrene resins:Role of surface functional groups[J]. Water Research, 2011, 45(6): 2191-2198. DOI:10.1016/j.watres.2011.01.005 |
| [27] |
KANEL S R, CHOI H. Transport characteristics of surface-modified nanoscale zero-valent iron in porous media[J]. Water Science & Technology, 2007, 55(1/2): 157-162. |
| [28] |
TIAN H F, LIANG Y, ZHU T L, et al. Surfactant-enhanced PEG-4000-NZVI for remediating trichloroethylene-contaminated soil[J]. Chemosphere, 2018, 195: 585-593. DOI:10.1016/j.chemosphere.2017.12.070 |
| [29] |
WEI Y T, WU S C, YANG S W, et al. Biodegradable surfactant stabilized nanoscale zero-valent iron for in situ treatment of vinyl chloride and 1, 2-dichloroethane[J]. Journal of Hazardous Materials, 2012, 211/212: 373-380. DOI:10.1016/j.jhazmat.2011.11.018 |
| [30] |
LI H Y, GE Y, ZHANG X R. High efficient removal of lead from aqueous solution by preparation of novel PPG-nZVI beads as sorbents[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017, 513: 306-314. DOI:10.1016/j.colsurfa.2016.10.059 |
| [31] |
PENG Z L, XIONG C M, WANG W, et al. Facile modification of nanoscale zero-valent iron with high stability for Cr(Ⅵ) remediation[J]. Science of the Total Environment, 2017, 596/597: 266-273. DOI:10.1016/j.scitotenv.2017.04.121 |
| [32] |
HUANG P P, YE Z F, XIE W M, et al. Rapid magnetic removal of aqueous heavy metals and their relevant mechanisms using nanoscale zero valent iron (nZVI) particles[J]. Water Research, 2013, 47(12): 4050-4058. DOI:10.1016/j.watres.2013.01.054 |
| [33] |
LUO S, LU T T, PENG L, et al. Synthesis of nanoscale zero-valent iron immobilized in alginate microcapsules for removal of Pb(ii) from aqueous solution[J]. Journal of Materials Chemistry A, 2014, 2(37): 15463-15472. DOI:10.1039/C4TA02920H |
| [34] |
ZHANG X, LIN S, LU X Q, et al. Removal of Pb(Ⅱ) from water using synthesized kaolin supported nanoscale zero-valent iron[J]. Chemical Engineering Journal, 2010, 163(3): 243-248. DOI:10.1016/j.cej.2010.07.056 |
| [35] |
FAN M, LI T J, HU J W, et al. Synthesis and characterization of reduced graphene oxide-supported nanoscale zero-valent iron (nZVI/rGO) composites used for Pb(Ⅱ) removal[J]. Materials, 2016, 9(8): 687. DOI:10.3390/ma9080687 |
| [36] |
LI X Q, CAO J S, ZHANG W X. Stoichiometry of Cr(Ⅵ) immobilization using nanoscale zerovalent iron (nZVI):A study with high-resolution X-ray photoelectron spectroscopy (HR-XPS)[J]. Industrial & Engineering Chemistry Research, 2008, 47(7): 2131-2139. |
| [37] |
JIA Z Z, SHU Y H, HUANG R L, et al. Enhanced reactivity of nZVI embedded into supermacroporous cryogels for highly efficient Cr(Ⅵ) and total Cr removal from aqueous solution[J]. Chemosphere, 2018, 199: 232-242. DOI:10.1016/j.chemosphere.2018.02.021 |
| [38] |
QU G Z, KOU L Q, WANG T C, et al. Evaluation of activated carbon fiber supported nanoscale zero-valent iron for chromium (Ⅵ) removal from groundwater in a permeable reactive column[J]. Journal of Environmental Management, 2017, 201: 378-387. DOI:10.1016/j.jenvman.2017.07.010 |
| [39] |
WU B, PENG D H, HOU S Y, et al. Dynamic study of Cr(Ⅵ) removal performance and mechanism from water using multilayer material coated nanoscale zerovalent iron[J]. Environmental Pollution, 2018, 240: 717-724. DOI:10.1016/j.envpol.2018.04.099 |
| [40] |
FU R B, YANG Y P, XU Z, et al. The removal of chromium (Ⅵ) and lead (Ⅱ) from groundwater using sepiolite-supported nanoscale zero-valent iron (S-NZVI)[J]. Chemosphere, 2015, 138: 726-734. DOI:10.1016/j.chemosphere.2015.07.051 |
| [41] |
FAZLZADEH M, RAHMANI K, ZAREI A, et al. A novel green synthesis of zero valent iron nanoparticles (NZVI) using three plant extracts and their efficient application for removal of Cr(Ⅵ) from aqueous solutions[J]. Advanced Powder Technology, 2017, 28(1): 122-130. DOI:10.1016/j.apt.2016.09.003 |
| [42] |
JABEEN H, KEMP K C, CHANDRA V. Synthesis of nano zerovalent iron nanoparticles-graphene composite for the treatment of lead contaminated water[J]. Journal of Environmental Management, 2013, 130: 429-435. DOI:10.1016/j.jenvman.2013.08.022 |
| [43] |
MA K X, WANG Q, RONG Q Y, et al. Preparation of magnetic carbon/Fe3O4 supported zero-valent iron composites and their application in Pb(Ⅱ) removal from aqueous solutions[J]. Water Science & Technology, 2017, 76(9/10): 2680-2689. |
| [44] |
ARSHADI M, SOLEYMANZADEH M, SALVACION J W, et al. Nanoscale zero-valent iron (NZVI) supported on sineguelas waste for Pb(Ⅱ) removal from aqueous solution:Kinetics, thermodynamic and mechanism[J]. Journal of Colloid and Interface Science, 2014, 426: 241-251. DOI:10.1016/j.jcis.2014.04.014 |
| [45] |
WANG W, HUA Y L, LI S L, et al. Removal of Pb(Ⅱ) and Zn(Ⅱ) using lime and nanoscale zero-valent iron (nZVI):A comparative study[J]. Chemical Engineering Journal, 2016, 304: 79-88. DOI:10.1016/j.cej.2016.06.069 |
| [46] |
ARSHADI M, ABDOLMALEKI M K, MOUSAVINIA F, et al. Nano modification of NZVI with an aquatic plant Azolla filiculoides to remove Pb(Ⅱ) and Hg(Ⅱ) from water:Aging time and mechanism study[J]. Journal of Colloid and Interface Science, 2017, 486: 296-308. DOI:10.1016/j.jcis.2016.10.002 |
| [47] |
环境保护总局, 中华人民共和国国家质量监督检验检疫总局.铅、锌工业污染物排放标准: GB 25466-2010[S].北京: 中国环境科学出版社, 2010. General Administration of Environmental Protection, General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Emission standard of pollutants for lead and zinc industry: GB 25466-2010[S]. Beijing: China Environmental Science Press, 2010. |
| [48] |
XU D, TAN X L, CHEN C L, et al. Removal of Pb(Ⅱ) from aqueous solution by oxidized multiwalled carbon nanotubes[J]. Journal of Hazardous Materials, 2008, 154(1/2/3): 407-416. |
| [49] |
ARANCIBIA-MIRANDA N, BALTAZAR S E, GARCÍA A, et al. Lead removal by nano-scale zero valent iron:Surface analysis and pH effect[J]. Materials Research Bulletin, 2014, 59: 341-348. DOI:10.1016/j.materresbull.2014.07.045 |
| [50] |
MACHIDA M, YAMAZAKI R, AIKAWA M, et al. Role of minerals in carbonaceous adsorbents for removal of Pb(Ⅱ) ions from aqueous solution[J]. Separation and Purification Technology, 2005, 46(1/2): 88-94. |
| [51] |
DONG H R, DENG J M, XIE Y K, et al. Stabilization of nanoscale zero-valent iron (nZVI) with modified biochar for Cr(Ⅵ) removal from aqueous solution[J]. Journal of Hazardous Materials, 2017, 332: 79-86. DOI:10.1016/j.jhazmat.2017.03.002 |
| [52] |
LIU W F, ZHANG J, ZHANG C G, et al. Preparation and evaluation of activated carbon-based iron-containing adsorbents for enhanced Cr(Ⅵ) removal:Mechanism study[J]. Chemical Engineering Journal, 2012, 189/190: 295-302. DOI:10.1016/j.cej.2012.02.082 |
| [53] |
ZHOU X B, LV B H, ZHOU Z M, et al. Evaluation of highly active nanoscale zero-valent iron coupled with ultrasound for chromium(Ⅵ) removal[J]. Chemical Engineering Journal, 2015, 281: 155-163. DOI:10.1016/j.cej.2015.06.089 |
| [54] |
CHANG D Y, CHEN T H, LIU H B, et al. A new approach to prepare ZVI and its application in removal of Cr(Ⅵ) from aqueous solution[J]. Chemical Engineering Journal, 2014, 244: 264-272. DOI:10.1016/j.cej.2014.01.095 |
| [55] |
ZHU F, LI L W, REN W T, et al. Effect of pH, temperature, humic acid and coexisting anions on reduction of Cr(Ⅵ) in the soil leachate by nZVI/Ni bimetal material[J]. Environmental Pollution, 2017, 227: 444-450. DOI:10.1016/j.envpol.2017.04.074 |
| [56] |
ZHANG S H, WU M F, TANG T T, et al. Mechanism investigation of anoxic Cr(Ⅵ) removal by nano zero-valent iron based on XPS analysis in time scale[J]. Chemical Engineering Journal, 2018, 335: 945-953. DOI:10.1016/j.cej.2017.10.182 |




