补骨脂是豆科植物补骨脂Psoralea corylifolia L.的干燥成熟果实[1],具有抗菌、抗肿瘤、抗氧化和治疗白癜风等功效[2-3]。补骨脂素和异补骨脂素属于香豆素类成分[4-6],是补骨脂中的两个重要成分[7-8]。药理及临床实验研究发现,补骨脂素可以有效地抑制肿瘤[9],治疗骨质疏松、抑郁症、帕金森病、注意力缺陷等疾病[10]。异补骨脂素可以有效改善更年期综合症[9],另外异补骨脂素和补骨脂素可用于牙周炎的治疗和预防[11]。因此,从补骨脂中分离异补骨脂素和补骨脂素具有重要的意义。目前从补骨脂中分离异补骨脂素和补骨脂素的方法主要有高速逆流色谱法[12]和硅胶柱层析法[13]。在高速逆流色谱法中,两相溶剂系统的选择由于缺乏理论指导而较为困难,硅胶柱层析法操作步骤冗长,工艺繁琐,且二者在分离纯化中均消耗大量有机溶剂,造成产品中溶剂残留严重。
近年来由于超临界流体色谱(supercritical fluid chromatography, SFC)兼有气相和液相色谱的优点,且具有快速、高效、灵敏和绿色环保等优点[14-15],在天然产物相关成分分离纯化及制备中得到了较广泛的应用[16-17]。本文采用SFC技术从补骨脂中同时分离制备补骨脂素和异补骨脂素单体,鉴定其结构,并对色谱分离过程的热力学规律进行探究。
2 实验仪器与材料 2.1 仪器Mercury Plus 400 NMR核磁共振仪(美国瓦里安公司);Thermofisher UltiMate3000 HPLC色谱仪(美国戴安公司);Agilent Technologies 6460 Triple Quad LC/MS联用仪(美国安捷伦科技有限公司);SFC系统为本实验室组装,包括用来输送改性剂的Newstyle NP7000高压输液泵(江苏汉邦科技有限公司)、用来输送CO2的Supercritical 24恒流泵(美国SSI公司)及Hanbon NU3000紫外-可见检测器(江苏汉邦科技有限公司);色谱柱:YMC-C18柱、YMC-Diol柱、YMC-NH2柱(日本YMC有限公司)。
2.2 试剂与药材HPLC和SFC所用试剂为色谱纯(美国Sigma公司),其余试剂均为分析纯,高纯CO2(聊城市东昌气体有限公司)。补骨脂药材购于聊城市利民大药店,经山东中医药大学张永清教授鉴定为正品药材。
2.3 补骨脂中香豆素类成分的提取称取100 g补骨脂药材,经高速药物粉碎机粉碎至约40目,用3倍量甲醇回流提取3次,每次2 h,合并回流提取液浓缩得浸膏。将浸膏分散于300 mL水中,用等体积的石油醚萃取3次。将石油醚层合并,浓缩得浸膏约9.8 g,冷藏备用。
2.4 HPLC条件采用SPHERIGEL ODS C18色谱柱(250 mm×4.6 mm I.D., 5 μm),流动相为甲醇-水(50:50, v/v)等度洗脱,流速为1.0 mL·min-1,检测波长为254 nm,进样量为10 μL。
2.5 实验条件实验对3种色谱柱(C18柱、氨基柱、二醇基柱)、4种改性剂(甲醇、乙腈、乙醇、异丙醇)、在改性剂(甲醇)比例为1%~5%(v/v)、流动相流速2~6 mL·min-1、温度300~325 K、压力10~14 MPa,对SFC分离补骨脂中两个目标成分的影响进行探究,并对其分离过程的热力学规律进行探究。通过NMR和MS对分离出的目标成分进行结构鉴定。
3 实验结果与讨论 3.1 补骨脂提取物的HPLC图在2.4节条件下进行操作,各成分分离效果如图 1所示。由图 1可见,补骨提取物的分离效果良好。

|
图 1 补骨脂提取物的HPLC图 Fig.1 HPLC chromatogram of the crude extract from Psoralea corylifolia L. 1. isopsoralen 2. psoralen |
色谱柱对分离效果有重要影响,在流动相为SC-CO2,压力12 MPa,温度313 K,流速3 mL·min-1,检测波长254 nm的条件下,探究了3种不同色谱柱(C18柱、氨基柱、二醇基柱)对补骨脂中两种目标成分分离效果的影响,结果如图 2。由图 2可知,两种目标成分在C18柱上分离度大,保留时间较长,峰较宽;在氨基柱和二醇基柱上的保留时间基本一致,但二醇基柱的分离度大,且峰形对称尖锐,故选择二醇基柱。
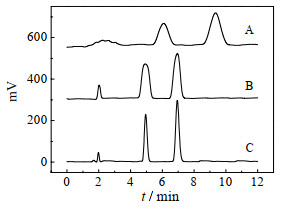
|
图 2 色谱柱的类型对分离效果的影响 Fig.2 Effects of column type on separation A: C18 column; B: amino column; C: diol column |
改性剂的主要目的是调节流动相的极性,从而优化目标成分的分离效果。在二醇基柱的基础上,考察了4种不同的改性剂(甲醇、乙腈、乙醇、异丙醇)对分离效果的影响(其他色谱条件同3.2.1节),结果如图 3所示。由图 3-A可见甲醇作为改性剂时,保留时间短且峰形对称尖锐,故优选甲醇为改性剂。
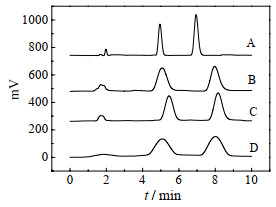
|
图 3 改性剂对分离效果的影响
Fig.3 Effects of modifier on separation
A: methanol B: ethanol C: isopropanol D: acetonitrile |
k'为分配比,用来评价目标成分的保留时间[17];Rs为分离度,用来评价分离效果[17]。故以k'和Rs为指标来优化SFC条件。
其他试验条件同3.2.2节,仅改变流动相中甲醇的比例,探究了甲醇的用量对k'和Rs的影响,结果如图 4所示。由图 4可知,随着甲醇比例的提高,两个目标成分的k'均减小,Rs则是先增大后降低。这是因为随着甲醇比例的提高,流动相的极性增大,目标组分在流动相的溶解度增大,因此k'降低,Rs提高。但是当甲醇比例超过2%,两个目标成分在固定相上的吸附脱附会趋向于平衡,这又导致Rs降低。因此选择甲醇比例为2%。
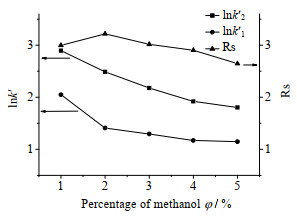
|
图 4 甲醇的比例对分配比和分离度的影响 Fig.4 Effects of methanol contents on distribution ratio and resolution subscript 1: isopsoralen subscript 2: psoralen |
固定甲醇体积比为2%,考察了流动相的流速对k'和Rs的影响,结果如图 5所示。由图 5可知,随着流速的提高,目标成分的k'和Rs均下降。这是因为提高流速,可以提高单位时间内CO2的流量,导致CO2对两成分的溶解能力增强,故k'减小。虽然在流量为2 mL·min-1时,Rs达到了最大值,但是保留时间过长。为了提高分离速度,选择流速为3 mL·min-1。

|
图 5 流动相的流速对分配比和分离度的影响 Fig.5 Effects of mobile phase flow rate on distribution ratio and resolution |
在流速为3 mL·min-1(其他实验条件同3.2.4节)的条件下,探究了温度和压力对k'和Rs的影响,结果如图 6和图 7所示。由图 6和图 7可知,随着温度上升(或压力下降),两种目标成分的k'均逐渐增大。这是因为温度上升(或压力下降)使SC-CO2的密度下降,对目标成分的溶解能力也随之减弱;同时流动相的黏度也会随之下降,扩散能力提高,这会使目标成分的传质效率增加。在该过程中,目标成分在SC-CO2的溶解度下降的幅度要大于传质效率上升的幅度。因此随着温度升高(或压力降低),k'逐渐增大。

|
图 6 温度对分配比及分离度的影响 Fig.6 Effects of temperature on distribution ratio and resolution |

|
图 7 压力对分配比及分离度的影响 Fig.7 Effects of pressure on distribution ratio and resolution |
由图 6和图 7可知,当压力一定时,随着温度的升高,Rs是先增大后减小,在313 K时达到最大值,故优选313 K为分离温度;当温度一定时,随着压力的升高,Rs持续减小,在10 MPa时,Rs达到最大值,此时保留时间过长,因此综合考虑分离度和分离时间,选择12 MPa为分离压力。
3.3 最佳分析型SFC条件综上所述,优选出的分析型SFC条件为:色谱柱为二醇基柱(250 mm×4.6 mm I D., 5 μm),甲醇作为改性剂,甲醇体积比为2%,流动相的流速为3.0 mL·min-1,分离压力为12 MPa,分离温度为313 K。在上述条件下的分离效果如图 8所示。由图 8可知,目标组分在较短的时间内获得了良好的分离效果。

|
图 8 补骨脂提取物的SFC图 Fig.8 SFC chromatogram of the crude extract from Psoralea corylifolia L. 1: isopsoralen 2: psoralen |
在分析型色谱参数的基础上,通过式(1)计算[18],可以得到制备型色谱参数:
| $ {{F}_{\rm{P}}}={{F}_{\rm{A}}}{{(\frac{{{D}_{\rm{P}}}}{{{D}_{\rm{A}}}})}^{2}} $ | (1) |
其中,FP和DP为制备型HPLC的流动相流速和色谱柱内径[18];FA和DA分别为分析型HPLC的流动相流速和色谱柱内径[18]。根据式(1)计算得到半制备型SFC的流速FP为14 mL·min-1,其他实验条件同分析型SFC条件相同,故确立半制备型SFC条件如下:色谱柱为二醇基柱(250 mm×10 mm I.D., 5 μm),流动相为SC-CO2,2%甲醇为改性剂,流速为14 mL·min-1,检测波长为254 nm,压力为12 MPa,温度为313 K,进样量为1 mL。在上述条件下的分离结果如图 9所示。由图 9可知,目标组分可以获得良好的分离效果。

|
图 9 补骨脂提取物的半制备型SFC图 Fig.9 Semi-preparative SFC chromatogram of the crude extract from Psoralea corylifolia L. 1: isopsoralen 2: psoralen |
将2.3节下获得的9.8 g补骨脂浸膏溶于30 mL甲醇中,使用3.4.1节下的制备型SFC条件进行制备,经过15次重复进样,手动收集目标组分,目标组分1和2的质量分别为31.1 mg和40.7 mg。
3.5 纯度检验和结构鉴定利用HPLC对两目标组分进行了测定,二者的HPLC及UV图如图 10所示。采用峰面积归一化法计算其纯度,二者的纯度均在98%以上。

|
图 10 两种目标组分的HPLC和UV图 Fig.10 HPLC and UV spectra of the two target compounds |
使用1H-NMR、13C-NMR及MS对目标组分的化学结构进行了鉴定,数据列于表 1中。将数据与已发表文献[19-20]对比,目标组分1和2分别与异补骨脂素和补骨脂素的数据一致,故化合物1为异补骨脂素,化合物2为补骨脂素,化学结构式见图 11。
|
|
表 1 SFC制备得到的两种化合物的NMR和MS数据 Table 1 NMR and MS data of two compounds prepared by SFC |

|
图 11 异补骨脂素和补骨脂素的分子结构式 Fig.11 Molecular structures of isopsoralen and psoralen |
研究色谱过程的热力学具有重要意义。在色谱分离过程中,分配比的自然对数lnk'和温度的倒数1/T满足Van't Hoff方程[15, 21]:
| $ \ln {k}'=-\frac{\Delta {{H}^{\theta }}}{RT}+\frac{\Delta {{S}^{\theta }}}{R}+\ln \beta $ | (2) |
式(1)中,k'为分配比,∆Hθ和∆Sθ分别是溶质从流动相传质到固定相所需的焓变和熵变,T为热力学温度,R为摩尔气体常数,β为两相体积比[15, 21]。在研究的温度范围内,焓变(∆Hθ)和熵变(∆Sθ)均为常数,当相比β也为常数时,lnk'对1/T的Van't Hoff曲线应为一直线[15, 21]。在压力分别为10、11、12、13、14 MPa时,两种目标组分的lnk'与1/T的关系如图 12所示。
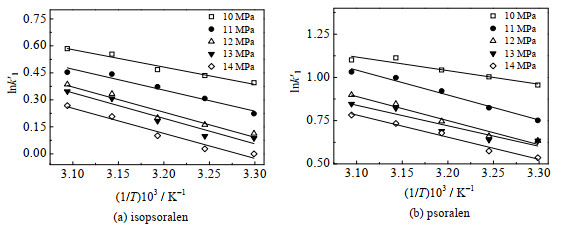
|
图 12 异补骨脂素和补骨脂素的lnk'与1/T的关系 Fig.12 Relationship between lnk' and 1/T of isopsoralen and psoralen |
利用式(2)和图 12计算不同压力下的∆Hθ、|∆1, 2∆Hθ|、|∆1, 2∆Sθ|值,结果列于表 2。其中,|∆1, 2∆Hθ|是∆H(1)θ与∆Hθ(2)的差值的绝对值,|∆1, 2∆Sθ|是∆S(1)θ与∆S(2)θ的差值的绝对值。
|
|
表 2 不同压力下的∆Hθ、|∆1, 2∆Hθ|、|∆1, 2∆Sθ| Table 2 ∆Hθ, |∆1, 2∆Hθ|, |∆1, 2∆Sθ| measured under different pressures |
由表 2可知,在压力为10、11、12、13、14 MPa时,均有|∆1, 2∆Hθ| > |∆1, 2∆Sθ|,由此可知本实验条件下的SFC分离过程为焓控过程。另外,由色谱图可以看出在SFC分离过程中出峰顺序与反相HPLC相反,说明SFC在此色谱条件下为正相色谱过程。
4 结论(1) 通过对色谱柱、改性剂及其比例、流动相的流速、分离压力和温度进行筛选,确立了最佳SFC条件。
(2) 在优选SFC条件下对补骨脂中的补骨脂素和异补骨脂素进行了分离纯化,其纯度均在98%以上,对其化学结构进行了鉴定。对SFC分离过程的热力学规律进行了研究,确定了SFC分离过程是焓控过程。
(3) 与传统分离方法相比,本文的方法具有高效、快速、便捷、绿色环保的优点,值得推广。
符号说明:
| DA | —分析型HPLC的色谱柱内径,mm | Rs | —补骨脂素与异补骨脂素的分离度 |
| DP | —制备型HPLC的色谱柱内径,mm | ∆Sθ | —溶质从流动相传质到固定相所需的熵变 |
| FA | —分析型HPLC的流动相流速,mL·min-1 | T | —温度,K |
| FP | —制备型HPLC的流动相流速,mL·min-1 | β | —两相的体积比 |
| ∆Hθ | —溶质从流动相传质到固定相所需的焓变 | 下标 | |
| k' | —分配比(容量因子) | 1 | —异补骨脂素 |
| P | —压力,MPa | 2 | —补骨脂素 |
| [1] |
中华人民共和国药典[M].北京: 化学工业出版社, 2000年版第1部. Chinese pharmacopoeia [M]. Beijing: Chemical Industry Press, 2000, part 1. |
| [2] |
BHAT T M, ANSARI M Y K, ALK A, et al. Sodium azide (NaN3) induced genetic variation of Psoralea corylifolia L. and analysis of variants using RAPD markers[J]. The Nucleus, 2012, 55(3): 149-154. DOI:10.1007/s13237-012-0069-x |
| [3] |
王天晓, 尹震花, 张伟, 等. 补骨脂抗氧化、抑制α-葡萄糖苷酶和抗菌活性成分研究[J]. 中国中药杂志, 2013, 38(14): 2328-2333. WANG T X, YIN Z H, ZHANG W, et al. Chemical constituents from Psoralea corylifolia L. and their antioxidant α-glucosidase inhibitory and antimicrobial activities[J]. China Journal of Chinese Materia Medica, 2013, 38(14): 2328-2333. |
| [4] |
JAN S, PARWEEN T, SIDDIQI T O, et al. Enhancement in furanocoumarin content and phenylalanine ammonia lyase activity in developing seedlings of Psoralea corylifolia L. in response to gamma irradiation of seeds[J]. Radiation and Environmental Biophysics, 2012, 51(3): 341-347. DOI:10.1007/s00411-012-0421-1 |
| [5] |
宋潇, 戚爱棣, 王跃飞, 等. 不同炮制方法对补骨脂中4类化学成分的影响[J]. 中国中药杂志, 2011, 36(15): 2071-2075. SONG X, QI A D, WANG Y F, et al. Variation of four kinds of compounds in Psoralea corylifolia processed by different methods[J]. China Journal of Chinese Materia Medica, 2011, 36(15): 2071-2075. |
| [6] |
李凯, 许梦莹, 周宁, 等. 炮制时间对盐补骨脂中10种化学成分的影响[J]. 中草药, 2017, 48(4): 710-713. LI K, XU M Y, ZHOU N, et al. Determination of 10 components in stir-frying Psoralea fructus with salt solution by different processing time[J]. Chinese Traditional and Herbal Drugs, 2017, 48(4): 710-713. |
| [7] |
GAO Q Q, YAN C P, XU Z S, et al. Evaluation of the influence of salt processing on pharmacokinetics of psoralen and isopsoralen in Psoralea corylifolia L.[J]. Biomedical Chromatography, 2016, 30(4): 528-535. DOI:10.1002/bmc.3578 |
| [8] |
ZHAO G H, YAN C P, XU Z S, et al. The effect of salt-processed psoralea corylifolia on generative organ targeting[J]. Journal of Analytical Methods in Chemistry, 2016, 2016(12): 1-12. |
| [9] |
颜翠萍, 吴育, 翁泽斌, 等. 盐制对补骨脂中主要化学成分的影响[J]. 中成药, 2013, 35(11): 2470-2474. YAN C P, WU Y, WENG Z B, et al. Chemical compositions of Psoralea corylifolia L. before and after salt-roast processing[J]. Chinese Traditional Patent Medicine, 2013, 35(11): 2470-2474. DOI:10.3969/j.issn.1001-1528.2013.11.036 |
| [10] |
赵婷, 朱汀滢, 吴斌, 等. 补骨脂中补骨脂素和异补骨脂素测定[J]. 中成药, 2015, 37(5): 1036-1040. ZHAO T, ZHU T Y, WU B, et al. Improvement in determination of psoralen and sopsoralen from Psoralea corylifolia L.[J]. Chinese Traditional Patent Medicine, 2015, 37(5): 1036-1040. DOI:10.3969/j.issn.1001-1528.2015.05.024 |
| [11] |
李笑甜, 周薇, 宋忠臣, 等. 补骨脂素和异补骨脂素对人牙周膜细胞的抗炎作用[J]. 上海交通大学学报(医学版)), 2018, 38(2): 128-132. LI X T, ZHOU W, SONG Z C, et al. Anti-inflammatory effects of psoralen and isopsoralen on human periodontal ligament cells[J]. Journal of Shanghai Jiaotong University: Medical Science, 2018, 38(2): 128-132. |
| [12] |
白鸽, 曹学丽, 谭莉, 等. 高速逆流色谱法对补骨脂中补骨脂素和异补骨脂素的分离纯化研究[J]. 世界科学技术-中医药现代化, 2009, 11(6): 864-867. BAI G, CAO X L, TAN L, et al. Preparative isolation and purification of psoralen and isopsoralen from Psoralea Corylifolia by high-speed counter-current chromatography[J]. Word Science And Technology-Modernization of Traditional Chinese Medicine, 2009, 11(6): 864-867. DOI:10.3969/j.issn.1674-3849.2009.06.020 |
| [13] |
范菊娣. 从补骨脂中分离鉴定补骨脂素和异补骨脂素[J]. 贵阳医学院学报, 2003, 28(2): 171-172. FAN J D. Isolation and identification of psoralen and isopsoralen from psoralen[J]. Journal of Guiyang Medical College, 2003, 28(2): 171-172. DOI:10.3969/j.issn.1000-2707.2003.02.030 |
| [14] |
EISATH N G, STURM S, STUPPNER H. Supercritical fluid chromatography in natural product analysis – An update[J]. Planta Medica, 2017, 84(06/07): 361-371. |
| [15] |
莫绪飞, 吕惠生, 张敏华, 等. 超临界流体色谱纯化Z-藁本内酯的研究[J]. 高校化学工程学报, 2013, 27(5): 737-742. MO X F, LÜ H S, ZHANG M H, et al. The study on purification of Z-ligustilide by supercritical fluid chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(5): 737-742. DOI:10.3969/j.issn.1003-9015.2013.05.002 |
| [16] |
庞斐, 吕惠生, 张敏华, 等. 超临界流体色谱纯化青蒿素的研究[J]. 高校化学工程学报, 2010, 24(4): 569-573. PANG P, LÜ H S, ZHANG M H, et al. The study on purification of artemisinin by supercritical fluid chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 569-573. DOI:10.3969/j.issn.1003-9015.2010.04.004 |
| [17] |
吕惠生, 周锦怡, 李永辉, 等. 基于超临界流体色谱技术的赤芍活性组分分离工艺[J]. 高校化学工程学报, 2018, 32(2): 295-301. LÜ H S, ZHOU J Y, LI Y H, et al. Separation of active components from radix paeoniae rubra by supercritical fluid chromatography[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 295-301. DOI:10.3969/j.issn.1003-9015.2018.02.007 |
| [18] |
JOSE L M, LUIZ A D. Chromatographic models as tools for scale-up of isolation of natural products by semi-preparative HPLC[J]. Journal of Liquid Chromatography & Related Technologies, 2003, 26(2): 177-193. |
| [19] |
陈德昌. 中药化学对照品工作手册[M]. 北京: 中国医药科技出版社, 2000. CHEN D C. Chinese medicine chemistry reference work manual[M]. Beijing: China Medical Science and Technology Press, 2000. |
| [20] |
李晶晶, 鹿秀梅, 李发美, 等. 补骨脂的化学及代谢成分的超高效液相色谱串联质谱法鉴定[J]. 时珍国医国药, 2010, 21(9): 2235-2238. LI J J, LU X M, LI F M, et al. Identification of chemical and metabolic components of psoralen by ultra performance liquid chromatography-tandem mass spectrometry[J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(9): 2235-2238. DOI:10.3969/j.issn.1008-0805.2010.09.051 |
| [21] |
孙艺梦, 于泓, 李朦, 等. 离子排斥色谱中色谱柱温度对有机酸保留的影响[J]. 分析测试学报, 2013, 32(4): 508-513. SUN Y M, YU H, LI M, et al. Effect of column temperature on the retention of organic acids in ion-exclusion chromatography[J]. Journal of Instrumental Analysis, 2013, 32(4): 508-513. DOI:10.3969/j.issn.1004-4957.2013.04.022 |




