天然气水合物(natural gas hydrate,NGH)是一种在适当温度、压力、气体饱和度、水的盐度、pH值等条件下[1]由水和天然气在高压、低温下[2]混合组成的类冰的、非化学计量的、笼形结晶化合物,在自然界以结晶状固体形式存在于海底或永久冻土区[3]。目前,基于水合物的生成特性及其理化性质,主要用于天然气固态储运以及混合气体分离[4-5]。但水合物生成速率低、诱导时间长且无法在现有条件下大规模生产,这些阻碍了这些技术的工业化应用,因此水合物的快速生成是目前解决水合物工业应用的关键。传统的水合物生成强化方法主要有机械搅拌、气体鼓泡及喷雾等,但因存在能耗高、投资大、运行费用高等问题,限制了这些方法的大规模发展[6-7]。而新兴的化学方法是通过在溶液中加入适当表面活性剂[8]改变水的性质,从纳米尺度和分子尺度层面强化水气接触,促进水合物的成核生长。KALOGERAKIS等[9]首次发现表面活性剂对甲烷水合物生成有促进作用,并研究了不同类型表面活性剂对甲烷水合物生成动力学的影响,发现低浓度的表面活性剂不影响水合物热力学性质,但可加快水合物的生成速率并提高气体在溶液中的溶解度。张琳等[7]认为表面活性剂在作用过程中可以形成胶束,形成胶束时的最高浓度称为临界胶束浓度(CMC),通常当表面活性剂浓度超过临界胶束浓度时,表面活性剂的作用才会充分发挥出来。目前对表面活性剂的实验研究虽然取得了一定成果,但是很少有人研究外在因素对表面活性剂促进水合物生成的影响,因此本文关于pH值对表面活性剂促进甲烷水合物的影响进行了研究。为了探讨溶液的酸碱性对表面活性剂促进机理的影响设立了多组对比实验,分别选用脂肪醇聚氧乙烯醚硫酸钠(AES)、烷基多糖苷(APG1214)两种表面活性剂在强酸和强碱溶液中对甲烷水合物进行促进生成实验研究,并对实验数据进行分析,针对实验现象从机理上进行研究,得出相应实验结论,为考察表面活性剂对甲烷水合物的促进生成的实验研究提供参考。
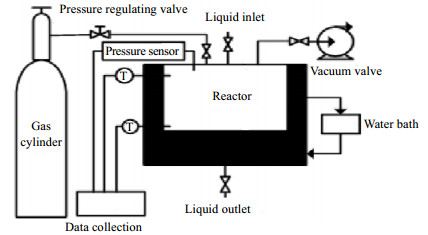
2 实验装置与方法 2.1 实验装置实验采用仪器是KDSD-II型水合物动力学实验装置,如图 1。装置分为6个主要功能模块:(1)水合物动力学模块(反应釜),(2)取样分析模块,(3)稳压供气模块,(4)温度控制模块,(5)压力控制模块,(6)数据采集模块。该装置的反应釜材质为不锈钢,有效容积为500 mL,最大承受压力为25 MPa。反应釜温度由恒温水浴控制,温度调节范围为-10~90 ℃,控温精度为0.1 ℃。稳压供气可控压力范围0~30 MPa,精度0.02 MPa。反应釜中的压力由精度为0.1%的压力传感器测定。实验温度由2个安装在反应釜内的Pt100/ Φ3,精度为0.2 ℃的铂电阻温度器测量,测试点分别位于反应釜的上下两端,同时监测反应体系中气相与液相(水合物相)的温度。装置外观如图 2所示。
|
图 1 KDSD-II型水合物动力学实验装置 Fig.1 Schematic diagram of the KDSD-II type setup for hydrate kinetic measurement |

|
图 2 天然气水合物合成装置外观 Fig.2 Experimental device for gas hydrate synthesis |
实验使用的甲烷(CH4)气体由沈阳科瑞特种气有限公司提供,纯度为99.9%。使用的阴离子表面活性剂脂肪醇聚氧乙烯醚硫酸钠(AES)由广东省精细化学品工程技术研究开发中心研制,纯度≥70%;使用的非离子表面活性剂烷基多糖苷(APG1214),由山东优索化工有限公司提供,纯度≥75%。实验室自制氢氧化钠溶剂、醋酸溶剂,实验中使用的纯水均为去离子水由实验室自制。
2.3 实验过程(1) 实验之前首先配置可以调节溶液pH值的氢氧化钠溶剂与醋酸溶剂。
(2) 分别配置同浓度的不同表面活性剂溶液并调节已配表面活性剂溶液的pH值。将pH值测量仪的探头用去离子水冲洗干净,擦干后,将探头悬挂并浸没在表面活性剂溶液中,防止探头与烧杯内壁接触。待pH值显示稳定时,根据实验需要用胶头滴管滴入氢氧化钠溶剂或醋酸溶剂,边滴入边搅拌溶液,当pH值达到所需实验pH值时,停止滴入。本实验所需不同酸碱性溶液如表 1所示。
|
|
表 1 不同酸碱性表面活性剂溶液 Table 1 Different acid-base surfactant solutions |
(3) 用实验室自制的去离子水对反应釜进行反复清洗;反应釜晾干后将反应釜安装好,然后用真空泵将反应釜及管路内气体抽空,使之处于真空状态,将75 mL已配好的表面活性剂溶液(AES、APG1214)经由进液阀注入到反应釜中。将反应釜置于恒温水浴中,通过恒温浴槽降低反应釜温度,使之保持本实验要求的2 ℃,并在本实验过程中保持温度恒定不变。温度稳定后打开进气阀向反应釜内注入甲烷气体同时进行数据采集并记录。当反应釜内压力在2~3 h内保持稳定或变化微小时结束实验。
2.4 数据处理天然气水合物的储气能力一般以一定条件下的储气密度或含气率(Vg/V)表示,本实验采用了99.9%纯度的甲烷气体,所以生成的是I型甲烷水合物,其理论值为173.14,其计算式如下:
(1) 气体消耗量计算式[10]:
| $ {n_{{\text{C}}{{\text{H}}_{\text{4}}}{\text{(HYT)}}}} = \frac{{\frac{{{p_0}{V_0}}}{{{z_0}RT}} - \frac{{{p_{\text{t}}}{V_0}}}{{{z_{\text{t}}}RT}}}}{{{\text{1}} - \frac{{{p_{\text{t}}}\Delta VM}}{{{z_{\text{t}}}RT}}}} $ | (1) |
式中,p0和pt分别为实验初始压强和t时刻压强,Pa;V0为初始时刻气体体积;Tt = 275.15 K (实验温度保持在2 K恒定不变);z0和zt分别为初始和t时刻的气体压缩因子,天然气的压缩因子通过Soave-Redlich-Kwong状态方程迭代求得。
(2) 储气密度计算式[10]:
| $ {C_{\text{S}}} = \frac{{\frac{{{p_0}{V_0}}}{{{{\text{z}}_0}RT}} - \frac{{{p_{\text{t}}}{V_0}}}{{{z_{\text{t}}}RT}}}}{{{\text{1}} - \frac{{{p_{\text{t}}}\Delta VM}}{{{z_{\text{t}}}RT}}}} \times \frac{{{V_{{\text{mg}}}} \times {V_{{\text{mw}}}}}}{{{V_{\text{w}}} \times ({V_{{\text{mw}}}} + \Delta V)}} $ | (2) |
式中,Vmg,Vmw分别为气体和水的摩尔体积,m3·mol-1;Vw表示生成水合物水的体积m3;ΔV表示水合物相与液相中水的摩尔体积差,m3·mol-1。
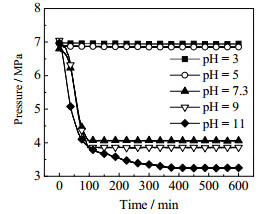
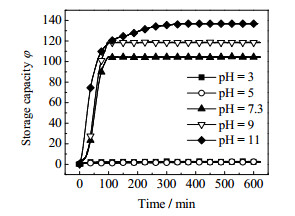
3 实验结果及其分析 3.1 不同pH值溶液体系对AES促进效果的影响本实验在T = 277.35K,p = 7 MPa条件下,研究了不同pH值情况下浓度为1 200 mg·L-1 AES水溶液对水合物生长过程的影响。图 3为1 200 mg·L-1 AES水溶液在不同pH值下釜内压强的变化,图 4为1 200 mg·L-1 AES水溶液在不同pH值条件下水合物生长过程的储气密度随时间变化曲线图,从这2个图中可以看出不同酸碱性对应的甲烷水合物生成的不同状况。
|
图 3 1 200 mg·L-1 AES水溶液不同pH值釜内压强的变化 Fig.3 Pressure profiles under different pH values of 1 200 mg·L-1 AES aqueous solution |
|
图 4 1 200 mg·L-1 AES溶液体系中不同pH值的储气密度变化 Fig.4 Profiles of gas storage density under different pH values of 1 200 mg·L-1 AES solution |
1 200 mg·L-1不添加任何氢氧离子的AES水溶液pH值为7.3,从图中可看出,pH = 7.3 AES水溶液促进效果明显,100~150 min釜内压强基本稳定,压强降至4.04 MPa,储气密度达到φ= 104.36。
当pH=3、pH=5时,曲线斜率接近为0,压降变化不明显,350 min时储气密度分别为φ = 2.83和2.05,可以看出AES溶液体系在酸性条件下水合物生成量极少,生成速率极其缓慢,与pH = 7.3的普通AES溶液相比,可看出酸性条件下抑制了AES表面活性剂的促进效果,同时也降低了甲烷水合物的储气能力。
当溶液呈碱性时,.较酸性条件下相比有大量水合物生成,pH = 11时促进效果最为明显,曲线斜率与原溶液相比较大,即水合物生成速率较高,从图 4可看出350 min时储气密度最大达到约φ = 141,与pH = 7.3体系相比储气密度提高了35%,可见在强碱性的条件下可以增强AES表面活性剂的促进效果并提高水合物的储气能力,能更有效地促进水合物的生成。其次是pH=9的反应条件,水合物生成速率仅次与pH=11的体系,350 min时储气密度达到φ= 118.5,较pH = 7.3体系提高了13.5%。
由以上可以得出,在1 200 mg·L-1的AES溶液在酸性条件下,会抑制表面活性剂AES的促进效果,仅有极微量的水合物生成,抑制了水合物的生成速率。相比于酸性条件,碱性条件下的水合物体系更利于水合物的生成,增强AES溶液的碱性到pH = 11时,促进效果大幅度增强,水合物生成速率大幅度提高,储气密度达到最大。图 5为pH = 3、5、11体系水合物生成形态。

|
图 5 pH=3、pH=5、pH=11体系水合物生成形态 Fig.5 Pictures of hydrate formed in pH=3, 5 and 11 solutions |
图 5(a)、(b)是pH=3和5酸性条件下水合物的生成状况,从图中可以看出,只在气-液界面形成了一层非常薄的水合物,取出水合物薄层,反应釜内依然存有大量的水溶液,因此可以推断在该体系中水合物首先在气-液界面形成晶核。在气-液界面先形成的水合物薄层起到了“固封”作用,阻隔了甲烷气体与水溶液的接触,从而阻碍了水合物的生成,直观表现为压强变化微小。
图 5(c)是pH = 11碱性条件下AES促进水合物生成的状态,可见与酸性条件相比,水合物大量生成,且中间为空心,反应釜贴壁处生成的水合物结构致密,这可推理出,水合物首先在反应釜内壁成核。因此本实验可得出结论:在1 200 mg·L-1的AES水溶液体系中,强酸条件下水合物成核位置发生变化,使水合物晶核首先在气-液界面处成核,阻碍了甲烷气体与溶液继续接触;在pH = 11强碱条件下不会改变水合物成核位置,仍然在反应釜内壁固-液界面处首先成核,而且可以加强表面活性剂AES的促进效果。
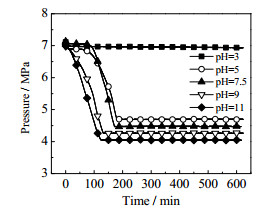
3.2 不同pH值溶液体系对APG1214促进效果的影响为了避免实验出现的偶然性,在T = 277.35 K,p = 7 MPa条件下,研究了不同pH值情况下浓度为1 200 mg·L-1 APG1214水溶液对水合物生长过程的影响。图 6为1 200 mg·L-1 APG1214水溶液不同pH值釜内压力的变化图,图 7为1 200 mg·L-1 APG1214水溶液在不同PH值条件下水合物生长过程的储气密度随时间变化曲线图。
|
图 6 1 200 mg·L-1 APG1214水溶液不同pH值釜内压强的变化 Fig.6 Pressure profiles under different pH values of 1 200 mg·L APG1214 aqueous solution |
|
图 7 1 200 mg·L-1 APG1214溶液体系中不同pH值的储气密度变化 Fig.7 Profiles of gas storage density under different pH values of 1 200 mg·L-1 APG1214 solution |
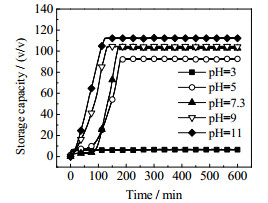
如图所示:溶液不同酸碱性对应的甲烷水合物生成状况也有所不同,1 200 mg·L-1的APG1214水溶液pH值为7.5,从图中可看出,pH = 7.5时促进效果明显,伴有一段诱导期,150~200 min釜内压强基本稳定,压强降到4.47 MPa,储气密度达到φ= 102.92。
当pH=3时,曲线斜率极小,压降变化不明显,400 min时储气密度分别为φ= 9.01,即APG1214溶液体系在强酸性条件下水合物生成量极少,生成速率极其缓慢,与pH = 7.5的APG1214溶液做对比,可看出强酸性条件下抑制了APG1214表面活性剂的促进效果,也抑制了甲烷水合物的储气能力。pH = 5时,虽伴有一段诱导期,生长速率弱于未加氢氧离子时,但相比于强酸条件pH = 3时仍能促进水合物生成,400 min时储气密度达到φ= 92.57,低于pH = 7.5体系。
当溶液呈碱性时,与较强酸性条件下相比有大量水合物生成,pH = 11时促进效果更加明显,200 min时储气密度最大,即水合物储气能力最强,达到约φ= 112.9,与pH = 7.5体系相比储气密度有所提高,可见在强碱性的条件下可以加强APG1214表面活性剂的促进效果提高水合物的储气能力,更有效地促进水合物的生成。pH = 9的反应体系,水合物生成速率高于pH = 7.5的体系,200 min时储气密度达到φ=104.55,略高于pH = 7.5体系储气密度。
由以上可以得出,1 200 mg·L-1的APG1214溶液在强酸条件下,会抑制表面活性剂APG1 214的促进效果,仅有极微量水合物生成,抑制了水合物的生成速率。而强碱性条件下的水合物体系更利于水合物的生成,增强APG1 214溶液的碱性到pH = 11时,促进效果大幅度增强,水合物生成速率较pH = 7.3体系有所提高,储气密度达到最大。图 8为pH = 3、5、11体系水合物生成形态。

|
图 8 pH=3、pH=5、pH=11体系水合物生成形态 Fig.8 Pictures of hydrate formed in pH=3, pH=5 and pH=11 solutions |
图 8(a)为pH = 3体系中水合物的生成状态,与3.1节强酸体系pH = 3时水合物生成状态类似,首先成核位置同样是在气液接触面上,在气-液界面处仅有一层薄薄的水合物生成,这层薄层阻碍了气体与水的连续接触,从而阻碍了水合物继续生成,抑制了APG1214表面活性剂的促进能力。
图 8(b)是pH = 5弱酸条件下水合物的生成状态,从现象可知,与AES表面活性剂实验体系有所不同,在APG1214表面活性剂实验体系中弱酸条件下虽抑制了本有的促进效果,但也有少部分的水合物生成,相比于pH = 7.5的体系,水合物生成量较少,结构比较稀疏。
图 8(c)为pH = 11强碱实验体系下水合物生成的状态,中间空心,水合物贴壁生成,与pH = 7.5的实验体系相比,水合物的生成量明显增加,结构更加致密。
与3.1节AES表面活性剂实验体系做对比,可以得出共同的结论,即在pH = 3强酸条件下,抑制了表面活性剂的促进能力,同时也改变了水合物晶核的最初成核位置,在气-液界面处首先成核,阻碍了水合物的连续生成,降低了水合物的储气能力;在pH = 11的强碱性条件下,在固-液界面处成核,优化了表面活性剂的促进效果,既可以加快水合物的生成速率,缩短不必要的诱导期,又可以提高水合物的储气能力,使水合物的生成结构更加致密。
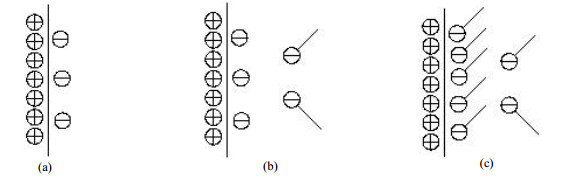
4 机理分析在任何界面,电荷总是非均匀的分布在两相之间。这种电荷非均匀分布致使一侧获得一个特殊号的电荷,而另一侧则获得相反符号的净电荷,且界面两侧电荷符号相反数量相同,使界面整体保持电中性。本实验采用的是316不锈钢材质反应釜,金属壁面的电荷分布如图 9(a)所示,金属壁面带正电荷,另一侧聚集负电荷,使界面保持电中性。AES为离子表面活性剂,可电离出正电性Na离子与带有负电性的表面活性剂离子疏水基团[11],负电性的表面活性剂离子会逐渐向带有正电性的金属壁面贴近,并逐渐取代另一侧负电性的电荷,或占据没有被负电性电荷占据的位点如图 9(b)(c)所示。
|
图 9 表面活性剂吸附界面示意图 Fig.9 Schematic diagram of surfactant adsorption interface |
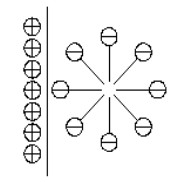
当表面活性剂的疏水基团之间的相互吸引作用以及他们逃离水环境的趋势变得足够大的时候,使其通过烷基链的连接而聚集并吸附到反应釜金属壁面上,形成表面活性剂聚集体,如图 10所示。表面活性剂分子在固-液界面处的吸附作用[12],促使水合物晶核在界面处形成了多孔介质[13]的环境,使水溶液由于多孔介质的毛细作用,增大了气液接触面积,降低了传热传质过程所需要的活化能,提高了水合物的生成速率,达到了促进水合物的生成的效果。
|
图 10 表面活性剂聚体示意图 Fig.10 Schematic diagram of surfactant micelle |
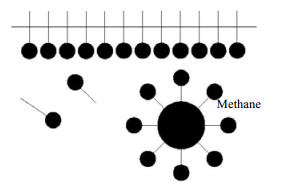
由酸性AES表面活性剂溶液体系生成的水合物现象可观察到仅仅在气-液界面形成一层薄薄的水合物,可推论,强酸性条件影响了AES表面活性剂正常的促进能力,改变了AES表面活性剂的吸附特性,使其在带有正电性电荷位点上的强烈吸附的特性转变为只能通过表面活性剂的头部亲水性与尾部疏水性的作用在气-液界面处形成胶束[14](如图 11),但随着水合物的生长,会阻碍液相中的水分子与气相中的气体分子的接触,减少了气液接触面积,从而抑制了水合物的大量生成[15]。在强碱条件下,水溶液中存在大量的OH-阴离子,同时也分布在气-液界面处,由于AES表面活性剂分子电离出的阴离子与OH-离子电性相同,均带有负电荷,这使得它们之间具有排斥作用,迫使大量阴离子疏水基团向金属壁面靠拢,增强了疏水基团在固-液界面的吸附作用,从而提高了水合物的成核速率,促进水合物大量生成,因此出现了本实验在pH = 11强碱性条件下增强了AES表面活性剂的促进能力,使水合物在贴壁处生成致密,储气密度达到最大。
|
图 11 球体胶束模型[14] Fig.11 Schematic diagram of the spherical micelle model |
烷基多糖苷APG1214虽然属于非离子表面活性剂,但未加氢氧离子的φ=1 200 mg·L-1 APG1214表面活性剂溶液体系中一样有大量水合物生成且中间空心,反应釜贴壁处水合物结构致密,可见,该体系中水合物首先成核位置也是在固-液界面,因此可推断烷基多糖苷APG1214可产生带有负电荷的基团,与AES表面活性剂促进机理相同,在金属壁面处有强烈的吸附性,从而提高水合物的生成速率,达到促进的效果。
5 结论实验在不同pH值下分别研究了1 200 mg·L-1 AES与APG1214水溶液对甲烷水合物的生成促进效果的影响,并利用表面活性剂固-液界面吸附理论对影响水合物生成机理进行了分析,得出以下结论:
(1) 不同酸碱性的实验体系中AES水溶液对甲烷水合物的生成促进效果不同,酸性条件下抑制了水合物的生成,碱性条件下均有促进效果,pH = 11强碱性条件下促进效果最佳,储气密度最大,达到约φ= 141。
(2) 不同酸碱性的实验体系中APG1214水溶液对甲烷水合物的生成促进效果不同,强酸性条件下(pH=3)抑制了水合物的生成,其中,pH = 11强碱性条件下促进效果最佳,储气密度最大,达到约φ= 112.9。
(3) 溶液的酸碱性可以改变表面活性剂的吸附性,改变水合物的成核位置。不同的表面活性剂的耐酸性不同,但pH值降至一定程度时,都会改变水合物的成核位置,使其在气-液界面成核;而强碱环境更利于水合物在固-液界面成核,并能增强表面活性剂的促进效果,提高水合物的储气密度。
符号说明:
| p | —反应釜压强,Pa | z | —气体压缩因子 |
| R | —气体常数,8.314 | ΔV | —水与水合物的摩尔体积差,m3·mol-1 |
| Vmg | —气体摩尔体积,m3·mol-1 | 下标 | |
| Vmw | —水摩尔体积,m3·mol-1 | 0 | —实验初始时刻 |
| Vw | —水的容积,m3 | t | —实验进行至t时刻 |
| [1] |
SLOAN E D. Fundamental principles and applications of natural gas hydrates[J]. Nature, 2003, 426(6964): 353-359. DOI:10.1038/nature02135 |
| [2] |
SLOAN E D, KOH C. Clathrate hydrates of natural gases[M]. 3rd ed. New York: CRC Pres, 2007.
|
| [3] |
李明川, 樊栓狮. 天然气水合物注热水分解径向数学模型[J]. 高校化学工程学报, 2013, 27(5): 761-766. LI M C, FAN S S. Radial mathematical model for hot water dissociation frontal brim of natural gas hydrates[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(5): 761-766. DOI:10.3969/j.issn.1003-9015.2013.05.006 |
| [4] |
ZHONG D L, ENGLEZOS P. Methane separation from coal mine methane gas by tetra-n-butyl ammonium bromide semiclathrate hydrate formation[J]. Energy & Fuels, 2012, 26(4): 2098-2106. |
| [5] |
陈广印, 孙强, 郭绪强, 等. 水合物法连续分离煤层气实验研究[J]. 高校化学工程学报, 2013, 27(4): 561-566. CHEN G Y, SUN Q, GUO X Q, et al. Experimental study on the continuous separation process of coal bed methane via forming hydrate[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(4): 561-566. DOI:10.3969/j.issn.1003-9015.2013.04.003 |
| [6] |
薛鹏吃, 刘世会. 天然气水合物储运技术[J]. 中国石油和化工标准与质量, 2011, 31(4): 71-72. XUE P Q, LIU S H. Natural gas hydrate storage and transportation technology[J]. China Petroleum and Chemical Standards and Quality, 2011, 31(4): 71-72. DOI:10.3969/j.issn.1673-4076.2011.04.059 |
| [7] |
张琳, 王树立, 周诗岽, 等. 表面活性剂用于促进气体水合物生成研究的进展[J]. 应用化学, 2014, 31(5): 505-512. ZHANG L, WANG S L, ZHOU S D, et al. Progress in surfactants for promoting gas hydrate generation[J]. Chinese Journal of Applied Chemistry, 2014, 31(5): 505-512. |
| [8] |
李玉星, 朱超, 王武昌. 表面活性剂促进CO2水合物生成的实验及动力学模型[J]. 石油化工, 2012, 41(6): 699-703. LI Y X, ZHU C, WANG W C. Experimental and kinetic model of surfactants promoting CO2 hydrate formation[J]. Petrochemical Technology, 2012, 41(6): 699-703. DOI:10.3969/j.issn.1000-8144.2012.06.015 |
| [9] |
KALOGERAKIS N, JAMALUDDIN A K M, BISHNOI P R, et al. Effect of surfactants on hydrate formation kinetics[J]. SPE International Symposium on Oilfield Chemistry, 1993, 45(1/2): 41-46. |
| [10] |
WANG F, JIA Z Z, LUO S J, et al. Improved methane hydrate formation and dissociation with nanosphere-based fixed surfactants as promoters[J]. Sustainable Chemistry Engineering, 2016, 4(4): 2107-2113. DOI:10.1021/acssuschemeng.5b01557 |
| [11] |
李果, 毛华军, 巩宗强, 等. 几种表面活性剂对柴油及多环芳烃的增溶作用[J]. 环境科学研究, 2011, 24(7): 775-780. LI G, MAO H J, GONG Z Q, et al. Solubilization of diesel and polycyclic aromatic hydrocarbons by several surfactants[J]. Research of Environmental Sciences, 2011, 24(7): 775-780. |
| [12] |
周诗岽, 余益松, 张晓萍, 等. 表面活性剂对气体水合物反应液表面张力的影响[J]. 天然气化工, 2013, 38(1): 42-45. ZHOU S D, YU Y S, ZHANG X P, et al. Effect of surfactants on surface tension of gas hydrate reaction solution[J]. Natural Gas Chemical Industry, 2013, 38(1): 42-45. |
| [13] |
BOTIMER J D, DUNN-RANKIN D, TABOREK P. Evidence for immobile transitional state of water in methane clathrate hydrates grown from surfactant solutions[J]. Memory & Cognition, 2015, 18(3): 329-329. |
| [14] |
LEVITZ P E. Adsorption of non ionic surfactants at the solid/water interface[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2002, 205(1): 31-38. |
| [15] |
LINGA P, DARABOINA N, RIPMEESTERJ A, et al. Enhanced rate of gas hydrate formation in a fixed bed column filled with sand compared to a stirred vessel[J]. Chemical Engineering Science, 2012, 68(1): 617-623. DOI:10.1016/j.ces.2011.10.030 |




