2. 中国科学院重庆绿色智能技术研究院 重庆市高分辨三维动态成像检测工程技术研究中心,重庆 400714;
3. 吉林大学 仪器科学与电气工程学院,吉林 长春 130000;
4. 浙江大学 工程力学系,浙江 杭州 310027;
5. 中国科学院微观界面物理与探测重点实验室,上海 201800
2. Chongqing Institute of Green and Intelligent Technology, The Chinese Academy of Sciences, Chongqing Engineering Research Center of High-Resolution and Three-Dimensional Dynamic Imaging Detection Technology, Chongqing 400714, China;
3. College of Instrumentation and Electrical Engineering, Jilin University, Changchun 130000, China;
4. Department of Engineering Mechanics, Zhejiang University, Hangzhou 310027, China;
5. Key Laboratory of Interfacial Physics and Technology, Chinese Academy of Sciences, Shanghai 201800, China
细胞的生物学机制及功能可以通过生物学、化学、物理学、力学或交叉学科等手段来进行研究。膜片钳技术是一种基于电工学和电化学原理的分析手段,可以通过检测细胞的电信号(电生理性质)来研究化学物质、电、机械力等刺激因素对细胞功能的影响,从而帮助揭示细胞在生命活动中的化学和生物学机制。细胞的电生理性质检测是生命科学研究的一个重要领域,对揭示细胞生理功能具有非常重要的意义[1]。Neher和Sakmann[2]在1976年发明了可用于检测细胞电生理特性的膜片钳技术。经过四十年的发展,膜片钳技术不但在细胞电生理研究领域得到了广泛应用,而且在技术上也得到了显著提升,比如出现了全自动膜片钳系统[3, 4]和膜片钳与其他现代生物检测技术结合应用的设备[5, 6]。
近年来已有一些关于膜片钳技术的综述文章,但是这些文章的内容主要集中在膜片钳技术的操作、记录模式及该技术自身的应用方面[7~9]。迄今为止,对膜片钳技术原理进行清晰介绍的文献较少,对最近五年来膜片钳技术的最新应用以及膜片钳技术与其它技术结合应用的综述性报道也比较匮乏,这些因素在一定程度上制约了膜片钳技术在生物检测领域中的应用和发展。
为了促进膜片钳技术的发展和应用,针对以上问题,本文首先清晰地介绍了膜片钳技术的基本工作原理,接着综述了该技术在细胞的电生理研究中的最新进展,最后介绍了膜片钳与其他设备结合使用的前沿技术及应用。
2 膜片钳技术 2.1 膜片钳技术的基本原理利用膜片钳技术检测细胞的原理可以通过图 1来进行说明。膜片钳主要包括放大电路和微电极两部分,根据检测模式的需要,可以选择将微电极后端与电压钳模式放大电路(图 1(a))或电流钳模式放大电路(图 1(b))连接。微电极包括玻璃微吸管、电极内液和测试电极三个部分。检测时,利用微电极的玻璃微吸管吸附浴液中的细胞,吸管内部的测试电极与放大器连接(图 1(c)),这样就将细胞接入到了膜片钳检测系统中。为便于分析,通常采用电学模型将细胞进行等效[9~11] (图 1(d)),具体为:(1)细胞膜的脂质双分子层是电的不良导体,可以将其对离子跨膜运动的阻碍效应等效为膜电阻Rm;(2)细胞外液-细胞膜-细胞内液构成的结构体系的电容效应可以等效为细胞膜电容Cm。下面以细胞检测为例,对两种测量模式的工作原理进行分析说明。
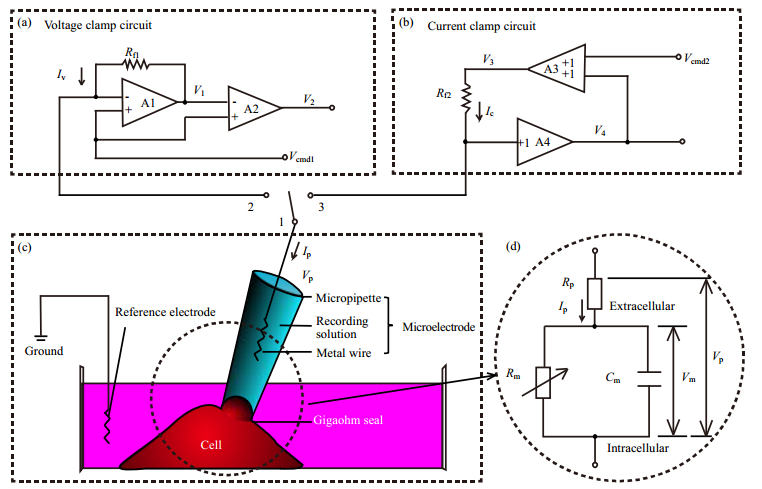
|
图 1 膜片钳技术原理示意图 Fig.1 Schematic diagram of thepatch-clamp technique (a) voltage clamp circuit. (b) current clamp circuit. (c) schematic diagram of cell membrane patched with a microelectrode. (d) equivalent circuit of the cell and microelectrode. The voltage clamp and the current clamp recording modes can be realized by the change over switches 1-2 and 1-3, respectively. Vcmd1, Vcmd2, Rf1 and Rf2 are command voltages and feedback resistances in the feedback circuit of the two recording modes. Iv and Ic are currents flowing through Rf1 and Rf2, respectively. V1- V4 are the output voltage of amplifier A1-A4, correspondingly.Vp is the total voltage applied on the cell and microelectrode, and Ip is the current passing through the electrode.Im, Vm, Rm and Cm are the transmembrane current, membrane potential, membrane resistance and membrane capacitance of cell, respectively. In the voltage clamp recording mode, the feedback circuit, the amplifiers A1 and A2 form an I-V converter. Since the input resistance of A1 is infinite, Ip is equal to Iv. In addition, the negative feedback circuit is connected to A1 to ensure Vp=Vcmd1, therefore V1 can be expressed as V1=Vcmd1 + ImRf1, from which Im can be calculated.In the current clamp mode, A3 is a summing amplifier used for injecting current into the cell and A4 a unity-gain operational amplifier with infinite input resistance. As a result, the voltage applied on Rf2 is equal to Vcmd2, regardless of Vp, and the current passing through Rf2 can be given by Ic=Vcmd2/ Rf2. Since Ic equals Ip and Vp equals V4, the membrane potential changes caused by Ic can be characterized by measuring the V4. |
电压钳模式工作原理是用命令电压钳制细胞膜电位,使其和命令电压的变化保持一致,并在此条件下检测细胞的电流信号。如图 1(a)所示,在电压钳工作模式下,将命令电压Vcmd1从放大器A1正向输入端输入,在负向输入端通过开关2和开关1与微电极连接。由于放大器A1具有负反馈特性(通过将电阻Rf1连入A1的负输入端和输出端之间,使得A1正、负两端电压几乎相等),可以认为电极后端的电压Vp与Vcmd1相等,因此通过微电极可以将命令电压施加给细胞膜。细胞膜电位Vm可表示为:
| ${V_{\rm{m}}} = {V_{\rm{p}}} - {I_{\rm{m}}}{R_{\rm{p}}}$ | (1) |
| ${V_{\rm{m}}} = {V_{{\rm{cmd}}1}} - {I_{\rm{m}}}{R_{\rm{p}}}$ | (2) |
式(1)、(2)中,Rp为电极电阻(其值约为2~5 MΩ,可通过计算命令电压与微电极刚入液且未接触细胞时电流的比值获得),Im为细胞的跨膜电流。从式(2)可以得知,由于Rp的存在,Vcmd1与Vm之间存在一定的偏置压降ImRp。另外,需要说明的是:除电极电阻之外,电极刺激细胞膜而产生的膜碎片,以及细胞内液、浴液等因素也会产生电阻效应,会进一步导致Vcmd1与Vm之间的偏置压降。为了达到钳制膜电位的目的,研究人员在膜片钳放大器的电路中设计了补偿电路,可以对上述因素产生的偏置压降进行补偿,使Vm≈ Vcmd1。
根据图 1(d)细胞等效电路可知,Im与Vm之间的关系为:
| ${I_{\rm{m}}} = \frac{{{V_{\rm{m}}}}}{{{R_{\rm{m}}}}} + {C_{\rm{m}}}\frac{{{\rm{d}}{V_{\rm{m}}}}}{{{\rm{d}}t}}$ | (3) |
因为在电压钳模式下有Vm≈Vcmd1,所以可以将式(3)表述为:
| ${I_{\rm{m}}} = \frac{{{V_{{\rm{cmd}}1}}}}{{{R_{\rm{m}}}}} + {C_{\rm{m}}}\frac{{{\rm{d}}{V_{{\rm{cmd1}}}}}}{{{\rm{d}}t}}$ | (4) |
根据图 1可知,施加命令电压后,图 1(d)中的RmCm电路首先会有快速充电过程,充电完成以后,Cm支路电流为零,由式(4)可知,此时有
| ${I_{\rm{m}}} = \frac{{{V_{{\rm{cmd}}1}}}}{{{R_{\rm{m}}}}}$ | (5) |
即可根据Im得知Rm的变化。
由于细胞跨膜电流Im一般很微弱,通常为pA~nA量级,所以在电压钳制模式中利用两个运算放大器A1、A2和负反馈电路构成的I-V转换器对信号进行处理,最终将Im转换成电压V2,实现信号的放大输出。I-V转换器工作原理为:由于A1具有高输入阻抗的特点,A1的输入端电流近似为零,可以认为流过反馈电阻Rf1的电流Iv与流向微电极的电流相等,所以Iv=Ip=Im。根据图 1(a)中所示电压关系可得A1输出端电压V1:
| ${V_1} = {V_{{\rm{cmd}}1}} + {I_{\rm{m}}}{R_{{\rm{f}}1}}$ | (6) |
V1与Vcmd1经过差分放大器A2(设其放大倍数为k)后,得到输出端电压V2:
| ${V_2}=k({V_{{\rm{cmd}}1}} - {V_1})$ | (7) |
由式(6)和(7)得出:
| ${V_2}= - k{R_{{\rm{f}}1}}{I_{\rm{m}}}$ | (8) |
由式(8)得知,电流信号被I-V电路放大,检测最终输出的V2就可获得Im的变化情况[12]。
2.1.2 电流钳工作模式电流钳工作原理是由命令电压产生恒定或时变的电流,并通过电极将此电流注入到细胞,检测该电流所引起的细胞膜电位的变化情况。如图 1(b)所示,在电流钳工作模式下,首先将开关1与3连接,然后把命令电压Vcmd2与A4的输出电压V4输入A3,经过增益为1的加法器A3处理后得到A3的输出电压V3。因为A4为单位放大器,其增益为1,所以A4的输入电压Vp与输出电压V4相等,进而可得V3的电压值:
| ${V_3}={V_{{\rm{cmd}}2}} + {V_4}$ | (9) |
| ${V_3}={V_{{\rm{cmd}}2}} + {V_{\rm{p}}}$ | (10) |
根据欧姆定律可得通过反馈电阻Rf 2的电流Ic:
| ${I_{\rm{c}}}=\frac{{{V_3} - {V_{\rm{p}}}}}{{{R_{{\rm{f}}2}}}}$ | (11) |
| ${I_{\rm{c}}}=\frac{{{V_{{\rm{cmd}}2}}}}{{{R_{{\rm{f}}2}}}}$ | (12) |
由于A4的高输入阻抗特性,A4输入端的输入电流几乎为零,可认为Ic通过电极后全部输入给了细胞(Im=Ic),从而实现了通过命令电压控制细胞电流的目的。根据公式(3),Im与Vm存在一定的变化关系,因此在电流钳模式下,通过微电极检测获得的Vp (V4)就可以得知Vm的变化情况。
由上述介绍可知,利用膜片钳两种工作模式可以分别对细胞跨膜电流或电压变化的相关参数进行定量检测。细胞的电生理信号(膜电压和跨膜电流)变化即反映细胞的细胞膜性质、细胞膜上离子通道的构象以及通道开闭状态等随时间或外界刺激(电压、机械压迫或药物等)变化的情况,故利用膜片钳技术可以对细胞的这些生理性能进行有效研究[9, 10, 13]。
2.2 膜片钳技术在细胞电生理研究中的优势细胞的电生理测定技术先后经历了电压钳技术和膜片钳技术两个阶段:在电压钳技术中,测定时需要将电极刺入细胞内部进行电流注入,进而钳制细胞电压,以达到研究细胞电信号的目的[14, 15]。该技术局限于测定全细胞离子电流,而且背景噪声较大,不能满足单离子通道测定的要求。在膜片钳技术中,经过处理的微电极从细胞外部与细胞膜紧密接触形成高阻封接状态,不但大大降低了背景噪声,而且具有测量单离子通道和全细胞离子电流的功能[16, 17]。与电压钳技术相比,膜片钳技术是一种具有更高灵敏度、更高精度和集成化的分析方法,具有更多的钳制细胞的工作模式,成为细胞电生理研究应用中不可或缺的测定手段[8]。下面分别阐述了膜片钳技术的两种记录技术及其相对于电压钳技术的优势。
2.2.1 单离子通道记录技术及优势单离子通道记录根据通道电流的变化情况获知离子通道的开放概率、开关时间,或通过分析施加给离子通道的电压与离子通道电流之间的关系获得细胞离子通道的电导(G,G=1/Rm),进而研究细胞膜上特定离子通道的表型、功能及门控机制等对细胞生物学功能的影响[18~21]。在单离子通道记录中(图 2),人们较多采用细胞贴附式、内面向外式和外面向外式三种经典的膜片吸附模式[22]。当微吸管与细胞膜接触时,通过吸吮对微吸管施加负压,从而使得微吸管尖端下方的细胞膜进入微吸管内,即形成细胞贴附式吸附模式(图 2(a))。该模式不会破坏细胞膜,极大地保证了细胞的近生理状态。在细胞贴附式吸附模式的基础上将微电极迅速提起,此时吸附的膜片仍然会保留在微吸管内,但是被吸附的膜片会与细胞分离并形成囊泡,暴露在空气中一段时间后该囊泡破裂,即形成内面向外式吸附模式(图 2(b))。在细胞贴附式吸附模式的基础上,通过对微吸管施加负压或对被吸附的细胞膜施加瞬间脉冲电压以打破吸到微吸管内的细胞膜,然后在液面以下缓慢提起微电极,被吸附的膜片在拉力作用下缓慢从细胞表面断裂并与细胞分离,随后膜片在断裂处会迅速融合,从而形成新的膜片,即形成外面向外式吸附模式(图 2(c))。后两种吸附模式中研究对象只有微吸管撕下来的膜片,因此研究者可以容易地对膜片上的离子通道进行调控和研究。
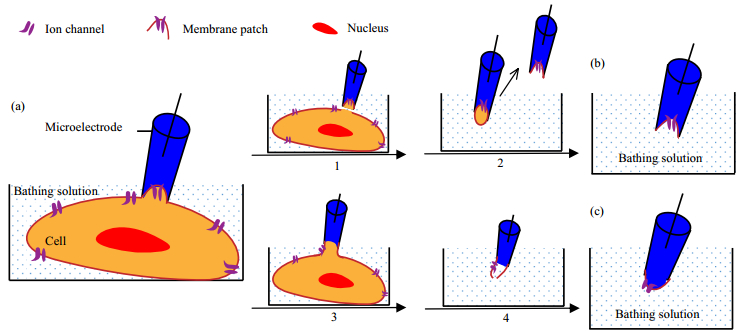
|
图 2 单离子通道记录中不同的膜片吸附模式示意图[22] Fig.2 Schematic diagram of different recording configurations of single ion channels[22] (a) cell attached configuration. (b) inside-out patch configuration. (c) outside-out patch configuration. For the inside-out recording mode, after forming the configuration (a), the cell membrane sucked by the micropipette is separated from the cell after lifting the electrode quickly (process 1). Afterwards, the microelectrode is lifted continuously until the attached patch being pulled out of the bathing solution and the trapped membrane in the micropipette will reassemble to a vesicle that will break after exposing in air for a short period of time (process 2). For the outside-out recording mode, after forming the configuration (a), a negative pressure is exerted on the trapped membrane or an instantaneous current pulse is applied on the microelectrode, to break the trapped membrane (process 3). Afterward, the electrode is lifted slowly to pulled off the trapped membrane from cell surface (process 4) |
Lee等[20]通过膜片钳的贴附式吸附测定了细胞核膜上单个hTPC2通道的K+电流和Cs+电流,利用直线拟合分别获得了K+和Cs+通过该通道时的通道电导。Ridone等[23]采用内面向外式吸附模式检测了心磷脂(存在于E. coli细胞的内膜)对机械敏感离子通道(Msc)的门控特性的影响。他们制备了含不同浓度心磷脂的人工生物膜,然后在膜片中嵌入Msc通道构建了模拟E. coli细胞膜性质的单通道膜片,并利用膜片钳记录Msc通道电流;通过分析Msc通道所受压力和通道开放概率的关系曲线,获得了离子通道对压力刺激的敏感度和使离子通道开放50%时所对应的压力值,这两个参数可以作为评估心磷脂影响Msc通道门控特性的指标。由此可见,膜片钳技术可以实现对细胞膜上特定离子通道的电学特性的研究,克服了电压钳技术只能进行全细胞电信号测定的局限性。
2.2.2 全细胞记录技术及优势全细胞记录可以获得细胞膜上所有离子通道的综合特性,能够揭示细胞的电生理状态,进而为研究单细胞功能变化或细胞之间信号传递提供有力的参考信息[24, 25]。全细胞膜片钳吸附模式的操作过程如下:当微电极开始接触细胞时,对微吸管施加负压使尖端只有几微米的微吸管与细胞膜形成高阻封接,然后继续增大负压值或施加电脉冲将被吸附的细胞膜打破,使细胞内液与电极内液在电学上导通,其最终状态如图 3所示[22],该模式极大地降低了测定时对细胞的损伤。而采用电压钳技术进行全细胞记录时,通常需要将两根电极刺入细胞内,对细胞损伤大。膜片钳技术中的高阻封接技术也使全细胞记录信号的信噪比更高。
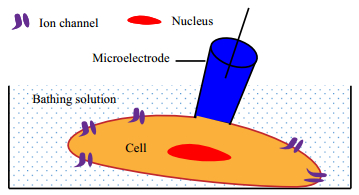
|
图 3 全细胞吸附模式示意图[22] Fig.3 Schematic diagram of the whole-cell patch configuration[22] In the whole-cell recording configuration, the cell membrane needs to be broken by applying a negative pressure on the membrane or an instantaneous current pulse to the microelectrode to shock the membrane. In the experiment, the osmotic pressure and pH value of electrode solution (blue) filled in the microelectrode are equal to the intracellular solution (brown) to reduce the effect of electrode solution on cell physiological properties |
膜片钳的全细胞记录模式中除了采用电压钳模式检测细胞外,还可以在电流钳模式下,给予细胞电流刺激,进而研究电流刺激所引起的细胞电位的变化对细胞生理功能的影响。Wu等[26]在垂体腺苷酸环化酶激活肽(PACAP)对小鼠结肠间质细胞(ICC)起搏活性的影响的研究中,在电流钳模式下直接记录到了受不同浓度PACAP刺激的ICC起搏电位和自发放电频率的变化规律。
3 基于膜片钳技术的细胞电生理研究 3.1 单细胞离子通道活动的研究离子通道活动是细胞电生理功能得以正常发挥的基础。近年来,随着与离子通道相关疾病的陆续发现,基于膜片钳技术对离子通道活动的研究报道越来越广泛,这些研究对于人们了解细胞的离子选择性、细胞膜电位的极化作用以及离子通道的靶向特性等具有重要意义。
利用膜片钳技术可以对离子通道的离子选择性进行研究。离子选择性是离子通道活动的基本功能之一,是维持细胞内外离子稳态的重要因素。由于利用膜片钳技术可以直接检测细胞特定离子通道的电流,所以最近几年,膜片钳在离子通道的离子传递机制的研究中应用较多并取得了一些突破[27~29]。其中,Li等[29]利用全细胞膜片钳技术在电压钳模式下测量了细胞的嘌呤能P2X2受体离子通道电流,根据通道反转电位的变化探究了该通道选择性传导Na+和NMDG+的机制。在研究中他们首先通过转染使HEK-293细胞表达高密度的嘌呤能P2X2受体通道(该通道可由ATP激活),然后利用全细胞膜片钳技术测定了NMDGout+ / Nain+双离子溶液(细胞外是NMDG+溶液,细胞内是Na+溶液)环境中细胞被ATP刺激前后的P2X2受体离子通道的反转电位,对比ATP刺激前后的实验结果,他们发现通道受ATP持续刺激后其反转电位明显变大了。为探究这一变化的原因,Li等又进行了进一步研究:他们首先对Naout+ / Nain+的离子溶液中的细胞施加短暂ATP刺激,检测到通道的反转电位为零,表明此时细胞内外的钠离子浓度相等;随后将外液换成NMDG+溶液,构成NMDGout+ / Nain+双离子溶液环境,在此条件下用ATP持续刺激P2X2受体通道一段时间后,再将外液重新换成Na+溶液,并在短暂的ATP刺激下检测到通道的反转电位为20 mV,说明此时细胞内外钠离子浓度不相等。综合以上实验结果,证明当外液中含有NMDG+时,P2X2受体通道长时间打开会使细胞内的钠离子浓度随时间变化,进而引起了反转电位的变化。该课题组的研究工作对于离子通道的离子传递机制的研究以及细胞电生理研究的实验设计方案具有指导作用。
利用膜片钳技术可以研究细胞膜极化作用的生理功能。离子通道活动可以通过维持细胞的静息膜电位进而维持细胞生理功能的稳定。研究表明肿瘤细胞膜静息电位去极化程度更强,膜电位去极化程度增强可能会激活电压门控型钙离子通道,从而使钙离子流入细胞内导致细胞内钙浓度过高,最终促进肿瘤细胞的增殖和转移[30]。为明确这一机制,Berzingi等[31]探究了乳腺癌细胞的电压门控型钙离子通道特性与癌细胞增殖的相关性,他们利用电流钳检测了正常人乳腺上皮细胞以及两种不同的乳腺癌细胞株MCF7和MDA-MB-231的静息膜电位。结果显示,与正常人乳腺上皮细胞相比,MCF7和MDA-MB-231细胞的静息膜电位去极化程度更强。当对这两种乳腺癌细胞施加钙通道阻滞剂维拉帕米后,发现两种癌细胞的增殖都被抑制了。随后他们对两种癌细胞进行了蛋白免疫印迹检测,发现在MDA-MB-231细胞中,维拉帕米上调了凋亡信号传导过程中的关键分子caspase-3的表达水平,从而加速了细胞凋亡;在MCF7细胞中,凋亡信号传导过程中的关键分子caspase-9的表达水平也被维拉帕米上调,致使了细胞凋亡加速。该研究揭示了细胞膜电位去极化诱导的钙离子内流与人类乳腺癌细胞的增殖相关,而维拉帕米可阻断钙通道进而上调转导癌细胞凋亡信号的蛋白酶表达水平,诱导乳腺癌细胞死亡。该研究工作为乳腺癌的治疗提供了一种新的潜在解决方案。
利用膜片钳技术可以研究细胞离子通道的靶向特性。离子通道还能作为各种信号分子的靶向作用位点,传递具有靶向特性的电生理信号以维持细胞生理稳态,所以在离子通道与药物相互作用的研究方面,膜片钳技术起着非常重要的作用。瞬时受体电位(transient receptor potential,TRP)通道是细胞膜上一类重要的阳离子通道,可以作为多种药物的靶向作用位点。Oehler等[32]利用膜片钳技术证实了TRP通道是氧化磷脂传递炎性疼痛信号的作用靶点。他们用氧化1-棕榈酰-2-花生四烯酰基甘油-3-磷酸胆碱(OxPAPC,氧化磷脂的一种)分别刺激通过转染表达TRPA1通道的HEK-293细胞(HEK-293TRPA1)和野生型HEK-293细胞(HEK-293W),并记录了以上两种细胞在电压钳模式下的全细胞电流,研究发现HEK-293TRPA1具有明显的电流信号,而HEK-293W则没有明显的电流信号。当施加TRPA1通道阻断剂后,HEK-293TRPA1细胞的通道电流被阻断了,证明TRPA1通道是OxPAPC的靶向作用位点,两者的相互作用传递了炎症疼痛信号,通过靶向抑制该通道的激活,可以缓解一定的炎性疼痛。TRP通道不仅与炎性疼痛信号的传递有关,还与肝细胞损伤机制相关。研究表明常用药物扑热息痛服用过量会使肝细胞膜上一种瞬时受体电位离子通道(transient receptor potential melastatin 2,TRPM2)异常激活,造成过量的Ca2+内流,进而导致肝细胞损伤。根据报道姜黄素可以有效地治疗扑热息痛导致的肝损伤疾病[33, 34],为了研究姜黄素的肝保护机制是否与TRPM2相关,Kheradpezhouh等[35]利用全细胞膜片钳技术研究了姜黄素与肝细胞TRPM2通道的相互作用。在研究中他们分别对取自Wistar大鼠的肝细胞进行了三种方式的处理:姜黄素与扑热息痛共同处理、扑热息痛单独处理以及无药物处理。他们首先利用钙成像技术证实了姜黄素确实可以抑制扑热息痛导致的细胞内Ca2+浓度升高;然后利用全细胞膜片钳技术分别检测了以上三种方式处理后的肝细胞的TRPM2通道钙电流,结果显示,用姜黄素与扑热息痛共同处理的肝细胞和未用药物处理的对照组肝细胞都没有产生明显的TRPM2通道钙电流,而用扑热息痛单独处理的肝细胞有明显的TRPM2通道钙电流,证明了姜黄素可以通过抑制扑热息痛诱导的TRPM2通道的异常激活,维持细胞内Ca2+浓度稳定,从而保护肝细胞免受损伤。该研究为肝脏疾病的离子通道靶向治疗方法提供了重要的借鉴。
3.2 细胞间电信号传递机制的研究膜片钳技术是一种研究细胞间电信号传递的有效手段,尤其在神经突触电信号方面的研究中具有重要作用。神经细胞之间信号的传递依赖于突触的功能,当神经细胞受到外界刺激时,突触前膜和后膜上的受体、突触后膜的离子通道、神经递质成分等结构或物质会发生改变,神经细胞的电生理状态就会随之发生改变,进而影响细胞的生理功能。因此,利用膜片钳技术研究神经细胞间电信号的传递可以有效地建立起细胞生理状态与各种刺激因素之间的联系[36]。在过去几年里,科研人员在利用膜片钳技术研究外界刺激因素相关的神经系统疾病和神经行为学调节机制方面取得了一些进展。下面以几个典型的例子介绍该方面的进展情况。
多巴胺神经元分泌的内源性大麻素2-AG(2-arachidonoylglycerol,2-AG)可以作为一种逆行信使,调控多巴胺神经元的兴奋[37],但人们对于2-AG的作用机制了解并不多。最近Gantz等[38]利用膜片钳技术探究了2-AG对小鼠中脑多巴胺神经元的影响机制。他们首先在神经元的培养液中添加了100 nM的2-AG,然后在电流钳模式下观察2-AG对神经元的影响,经过实验得知2-AG可以增大神经元的自发放电频率;为了分析这一效应的影响,他们在电压钳模式下观察了2-AG刺激下的A型钾电流(IA),实验发现2-AG对IA具有明显的抑制作用。为了验证该抑制作用是否与大麻素受体CB1、CB2相关,他们用阻断剂阻断了受体CB1、CB2的介导效应后,再利用膜片钳检测IA,结果观察到2-AG仍对IA具有明显的抑制作用。该研究揭示了2-AG直接调控了神经元的通道特性进而抑制了IA,该抑制效应并不依赖于大麻素受体的介导作用。这一研究工作使研究者对于2-AG调控神经元兴奋的机制有了进一步认识。
利用膜片钳技术还可以研究神经的抑制性调节机理,这对于治疗与此机理相关的神经系统疾病具有重要的意义。研究表明脊髓神经元的甘氨酸能抑制性突触后电流(glycinergic inhibitory postsynaptic currents,glycinergic IPSCs)受到抑制后会引起炎性疼痛[39],而加强IPSCs可以有效地镇痛,这一结论也得到了研究证实[40~43]。为了寻求更加有效的炎性疼痛治疗手段,基于以上思路,Islam等[43]用化学遗传学技术构建了一种对伊维菌素具有高敏感性的人源甘氨酸受体(α1Y279F, A288G GlyR),然后通过膜片钳检测该受体介导的IPSCs变化情况,来验证该受体是否具有镇痛作用。实验中他们分别将α1Y279F, A288G GlyR和野生型α1 GlyR转染到HEK293细胞上,并对其施加甘氨酸模拟突触活动以诱导IPSCs,然后利用膜片钳监测细胞受到30 nM伊维菌素刺激前后的IPSCs。结果显示,对于表达α1Y279F, A288G GlyR的细胞,伊维菌素刺激后的IPSCs明显大于刺激前的IPSCs;对于表达野生型α1 GlyR的细胞,伊维菌素刺激后的IPSCs相对于刺激前增加幅度并不明显。他们随后又将α1Y279F, A288G GlyR转染到体外培养的脊髓神经元上,并施加10 nM伊维菌素刺激,检测发现刺激之后的IPSCs与刺激之前相比,电流的幅值明显升高,并且频率和持续时间也都明显增加了。以上结果表明α1Y279F, A288G GlyR对伊维菌素具有高敏感性,并可以促进伊维菌素对IPSCs的增强作用,从而起到镇痛作用。尤其需要指出的是α1Y279F, A288G GlyR为人源性构建体,具有良好的生物相容性,其有望用于治疗人类慢性炎性疼痛,这对于解决人类慢性炎性疼痛难题具有现实的指导意义。
膜片钳也是研究神经行为学的有效工具。研究证实:脑内的腹侧被盖区(ventral tegmental area,VTA)神经元向伏隔核区(accumbens nucleus,NAc)神经元传递多巴胺可以诱导奖赏寻求行为[44]。最近的研究表明,VTA神经元向NAc神经元传递信号时释放的神经递质除了多巴胺之外,还同时释放了抑制性神经递质γ-氨基丁酸(gamma-aminobutyric acid,GABA)[45],而目前人们对于GABA在奖赏寻求行为调控机制中所起的作用尚不清晰。因此,Berrios等[46]利用膜片钳技术研究了GABA在奖赏寻求行为中的调控作用。他们建立了一种Ube3aFLOX/p+小鼠模型(条件性基因敲除小鼠,敲除神经元的Ube3a基因),观察发现Ube3aFLOX/p+小鼠与野生型小鼠(Ube3a正常表达的小鼠)相比,表现出更积极的奖赏寻求行为。为探究这一现象的原因,他们分别取了Ube3aFLOX/p+小鼠和野生型小鼠的脑片,并用光脉冲刺激两组脑片中的VTA-NAc信号传递通路,使通路末端的突触前膜释放多巴胺和GABA。随后他们测定了这两组小鼠脑片VTA神经元的多巴胺释放情况,发现两组脑片的多巴胺信号无区别,这说明Ube3a缺失不会影响多巴胺的释放。于是他们又利用膜片钳分别检测了两种小鼠脑片中VTA-NAc信号通路末端的GABA能IPSCs,发现Ube3aFLOX/p+小鼠脑片中神经元的GABA能IPSCs幅度明显低于野生型小鼠,实验证明Ube3a的缺失会抑制VTA-NAc信号通路末端的GABA释放,从而增强了奖赏寻求行为。该研究揭示了一种新的与奖赏寻求行为相关的神经信号传递模式,这对深入认识神经信号的传递具有重要意义。
4 膜片钳与其他生物检测技术结合应用随着膜片钳技术的广泛应用,科研工作者们不断开发出将膜片钳与原子力显微镜(atomic force microscopy,AFM)、激光扫描共聚焦显微镜、双光子显微镜、荧光探针等其他检测技术结合应用的细胞生理检测技术。这些技术不仅提高了细胞电生理探测的分辨率及灵敏度,还可以同时获取细胞的电生理信息和各种与之相对应的力学或分子生物学信息,极大地弥补了膜片钳技术检测信号单一的缺点。
4.1 膜片钳与原子力显微镜结合应用将膜片钳和AFM结合使用的技术可以提高细胞电生理检测的分辨率和灵敏度;而且,在获得细胞电生理信息的同时,还能获取细胞的生物力学性质,从而更全面地研究细胞的生理功能。最近,Ossola等[47]设计了如图 4所示的膜片钳与AFM结合使用装置。他们将AFM的探针设计成可填充液体的微吸管,该微吸管可以作为膜片钳系统的微电极,并在AFM的液相接触模式下,通过AFM力反馈系统控制微吸管与细胞膜进行封接。具体操作中,他们在培养皿中选定目标细胞后,将探针置于细胞的顶部,设定约1 nN的驱动力下针与细胞接触并吸住细胞,而后向微吸管内施加负压使探针尖端孔中的膜片破裂,形成全细胞吸附模式,继而用膜片钳放大器检测细胞的电生理信息。上述过程通过Z方向的压电致动器来调节探针的偏转,既能及时补偿微吸管与细胞膜间的封接作用,又能避免测定时微吸管对细胞的压力过大,从而提高检测质量。该技术与传统膜片钳技术相比,其优势在于当细胞体积变化时,微吸管与细胞膜的封接间隙可以通过AFM的力反馈系统迅速补偿,维持微吸管尖端与细胞始终稳定接触,解决了微吸管尖端和细胞之间封接不稳定的问题。该技术在可兴奋细胞的检测中具有明显的较好封接效果。例如,心肌细胞的自发收缩会使微电极的尖端和细胞膜之间的封接不稳定,利用传统膜片钳技术很难成功获得该细胞的电生理数据,Ossola等利用该技术成功测量了心肌细胞的离子电流,同时还获得了相应的细胞所受压力的信息。
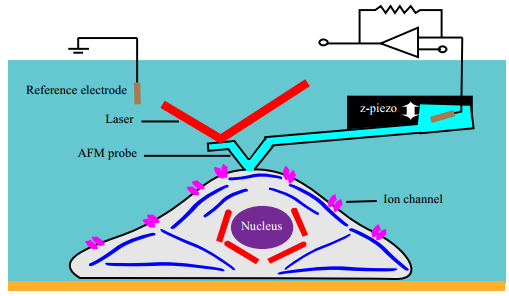
|
图 4 与AFM结合使用的力控全细胞膜片钳装置示意图[47] Fig.4 Schematic diagram of force-controlled whole-cell patch-clamp combined with AFM[47] The cell membrane trapped in the aperture of AFM probe is ruptured to connect the electrode inside of the pipette with the cytosol. The patch-clamp electronics (schematized with an inverting operational amplifier) clamp the transmembrane potential. Changing the transmembrane potential modifies the activity of voltage-gated ion channels as reflected in ionic current. The contact/force between the AFM probe and cell membrane can be regulated by controlling the deflection of AFM cantilever via the movement of the z-piezo to sustain the seal between the AFM probe and cell membrane |
除了上述技术,Zhang等[48]设计了如图 5所示的基于平面芯片电极的膜片钳与AFM结合使用的检测系统。该系统具有自动封接、纳米级操作、准确定位、多样化刺激和同步信号记录等优点。其检测包括三部分:(1)利用AFM技术对细胞进行力刺激和力检测(图 5(a));(2)通过倒置显微镜观察捕捉细胞形貌(图 5(b));(3)由平面膜片钳记录细胞电信号(图 5(c))。基于平面芯片电极的膜片钳技术[49, 50]可通过对芯片微孔下方的液体腔施加负压对细胞底部进行封接,执行细胞电生理记录,通过这种方式可以在细胞上方留出足够的空间以便于AFM测定时的操作。基于该技术,Zhang等首次同时记录了神经母细胞瘤细胞(Neuro2 A)所受机械压力及其诱发的机械门控型离子通道电流,揭示了Neuro2 A机械门控型离子通道的门控机制。
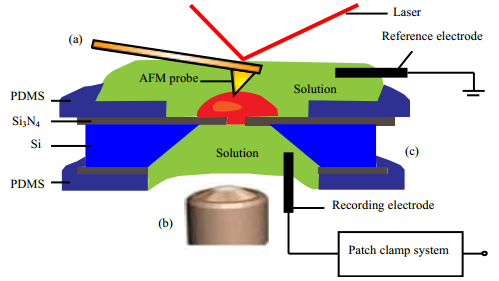
|
图 5 平面芯片式膜片钳与AFM结合使用的装置示意图[48] Fig.5 Schematic diagram of a planar chip patch-clamp combined with AFM[48] (a) AFM probe used for stimulating the cell, mechanically. (b) inverted microscope platform.(c) recording system of the planar patch-clamp module. PDMS stands for polydimethylsiloxane |
利用激光扫描共聚焦显微镜、双光子显微镜、荧光显微镜等技术可以对细胞进行实时成像研究,将膜片钳技术与光学显微成像技术结合使用不但可以检测细胞的电流变化情况,而且还可以对细胞的电信号传递活动进行成像观察。
Sheng等[51]利用膜片钳与激光扫描共聚焦显微镜结合应用的技术实时、同步地观察了心肌细胞钙离子的释放过程。他们用钙荧光指示剂(Fluo-3)对心肌细胞孵育后,对心肌细胞施加去极化的电压刺激,激活了膜上L-型钙离子通道。在此过程中利用膜片钳检测心肌细胞的钙电流,并同时利用激光扫描共聚焦显微镜对细胞内游离钙离子的移动进行实时定位。利用膜片钳-激光扫描共聚焦显微镜同步记录系统,他们在检测到离子通道电流的同时还观察到胞浆内荧光标记的钙离子聚集在一起,这揭示了心肌细胞去极化激活的L-型钙通道开放会引起胞内局部钙释放的现象。该技术最大的优势是可以直观地观察到心肌细胞生理活动过程中的钙离子释放方式,有助于加深对心肌细胞钙离子通道功能的理解。
Zheng和Zagotta[52]利用膜片钳与共聚焦荧光显微镜结合应用技术检测了卵母细胞上离子通道电流和离子通道构象的变化情况。他们在该研究中将Alexa488荧光标记的马来酰亚胺修饰到环核苷酸门控(CNG)通道蛋白上的半胱氨酸(胞内C端环核苷酸结合域的C481位点)特异位点实现荧光探针定位,在记录CNG通道被激活的过程中离子通道电流的同时还得到了该通道蛋白结构变化的情况。在该类技术中,通过利用荧光探针技术、荧光成像技术和图像分析技术等手段,可以将通过膜片钳技术得到的电流信号与离子通道的构象变化关联起来,为研究细胞离子通道门控机制提供了有用信息[53~55]。
Ebina等[56]利用膜片钳与双光子钙离子成像结合应用技术成功地研究了小鼠脑片的皮质神经元的突触电流,并通过图像3D重构技术分析了神经元的空间排列。该技术使活体和脑组织切片的细胞钳制程序可视化,极大地简化了生物化学手段(如组织免疫法等)识别目标细胞的程序,已成为直接测量脑神经网络的最佳选择,并且被成功应用到多种模型动物的电生理测定中[57]。
5 结语多学科领域的融合和交叉是当今科学研究的发展趋势,电生理学的研究也涉及到了化学、神经科学、药理学、细胞生物学、生理学和生物分子学等多个学科和领域;可以肯定的是,膜片钳技术在这些跨学科研究中发挥着无可替代的作用。但是目前传统膜片钳技术也有其自身的缺点:a.目前国内市场上主流的膜片钳检测通道仍然偏少,对细胞进行测量时,实验效率还比较低,而多检测通道的膜片钳价格较昂贵;b.利用主流膜片钳技术检测仅能获得细胞的电信号,难以获得更加全面的细胞生物物理特性,而目前的多种技术结合应用还需进一步改进和拓展。针对以上缺点,开发低成本、高通量、自动化的膜片钳技术以及与更多新兴生物检测设备结合使用的技术将成为膜片钳技术的发展趋势。
| [1] | Chen P H, Zhang W, Zhou J, et al. Development of planar patch clamp technology and its application in the analysis of cellular electrophysiology[J]. Progress in Natural Science, 2009, 19(2): 153-160. DOI:10.1016/j.pnsc.2008.06.012. |
| [2] | Neher E, Sakmann B. Single-chanel currents recorded from membrane of denervated frog muscle-fibers[J]. Nature, 1976, 260(5554): 799-802. DOI:10.1038/260799a0. |
| [3] | Farre C, Stoelzle S, Haarmann C, et al. Automated ion channel screening:patch clamping made easy[J]. Expert Opinion Therapeutic Targets, 2007, 11(4): 557-565. DOI:10.1517/14728222.11.4.557. |
| [4] | Shieh C C. Automated high-throughput patch-clamp techniques[J]. Drug Discovery Today, 2004, 9(13): 551-552. DOI:10.1016/S1359-6446(04)03113-7. |
| [5] | Yue J F, Qiao G H, Liu N, et al. Novel KCNQ2 channel activators discovered using fluorescence-based and automated patch-clamp-based high-throughput screening techniques[J]. Acta Pharmacologica Sinica, 2016, 37(1): 105-110. DOI:10.1038/aps.2015.142. |
| [6] | Almers W, Neher E. The Ca signal from fura-2 loaded mast-cells depends strongly on the method of dye-loading[J]. FEBS Letters, 1985, 192(1): 13-18. DOI:10.1016/0014-5793(85)80033-8. |
| [7] | LIN Yan-fei(林燕飞), OUYANG-Shou (欧阳守). Recent progress and aplication of pathch clamp techniques(膜片钳技术研究进展及其应用)[J]. Strait Pharmaceutical Journal(海峡药学), 2008, 20(9): 8-11. DOI:10.3969/j.issn.1006-3765.2008.09.003. |
| [8] | Zhang D. Patch clamp: a powerful technique for studying the mechanism of acupuncture[J/OL]. Journal of Evidence-Based Complementary & Alternative Medicine, 2012[2018-01-05]. http://dx.doi.org/10.1155/2012/534219. |
| [9] | Wilson J R, Clark R B, Banderali U, et al. Measurement of the membrane potential in small cells using patch clamp methods[J]. Channels, 2011, 5(6): 530-537. DOI:10.4161/chan.5.6.17484. |
| [10] | Janve V S, Hernandez C C, Verdier K M, et al. Epileptic encephalopathy de novo GABRB mutations impair gamma-aminobutyric acid type a receptor function[J]. Annals of Neurology, 2016, 79(5): 806-825. DOI:10.1002/ana.24631. |
| [11] | Sherman A J, Shrier A, Cooper E. Series resistance compensation for whole-cell patch-clamp studies using a membrane state estimator[J]. Biophysical Journal, 1999, 77(5): 2590-2601. DOI:10.1016/S0006-3495(99)77093-1. |
| [12] | Xiong J, Hu G, Qu A L. Automatic calibration of frequency compensation system in computer-controlled patch-clamp amplifier[J]. Journal of Computer Science, 2007, 3(9): 765-772. |
| [13] | Machtens J P, Kovermann P, Fahlke C. Substrate-dependent gating of anion channels associated with excitatory amino acid transporter 4[J]. Journal of Biological Chemistry, 2011, 286(27): 23780-23788. DOI:10.1074/jbc.M110.207514. |
| [14] | Adrian R H, Costantin L L, Peachey L D. Radial spread of contraction in frog muscle fibres[J]. Journal of Physiology-London, 1969, 204(1): 231-257. DOI:10.1113/jphysiol.1969.sp008910. |
| [15] | Ursu D, Schuhmeier R P, Melzer W. Voltage-controlled Ca2+ release and entry flux in isolated adult muscle fibres of the mouse[J]. Journal of Physiology-London, 2005, 562(2): 347-365. DOI:10.1113/jphysiol.2004.073882. |
| [16] | Karmazinova M, Lacinova L. Measurement of cellular excitability by whole cell patch clamp technique[J]. Physiological Research, 2010, 59: S1-S7. |
| [17] | Jurkat-Rott K, Lehmann-Hom F. The patch clamp technique in ion channel research[J]. Current Pharmaceutical Biotechnology, 2004, 5(4): 387-395. DOI:10.2174/1389201043376715. |
| [18] | Nikolaev Y A, Dosen P J, Laver D R, et al. Single mechanically-gated cation channel currents can trigger action potentials in neocortical and hippocampal pyramidal neurons[J]. Brain Research, 2015, 1608: 1-13. DOI:10.1016/j.brainres.2015.02.051. |
| [19] | QIAO Xiao-yan(乔晓艳), WU Jin-zhi(吴晋芝), GENG Xiao-yong(耿晓勇), et al. Computer simulation of cunent restoration for ionic sengle-channel(细胞膜离子单通道电流重构的计算机仿真)[J]. Computer Engineering and Appalication(计算机工程与应用), 2011, 47(16): 218-220. DOI:10.3778/j.issn.1002-8331.2011.16.066. |
| [20] | Lee C S K, Tong B C K, Cheng C W H, et al. Characterization of two-pore channel 2 by nuclear membrane electrophysiology[J/OL]. Scientific Reports, 2016[2018-01-05]. https://doi.org/10.1038/srep20282. |
| [21] | LIU Zhen-wei(刘振伟). Pratical patch clamp techniques(实用膜片钳技术)[M].Beijing(北京): Military Medical Science Press(军事医学科学出版社), 2006: 90-119. |
| [22] | Neher E. Ion channels for communication between and within cells[J]. Science, 1992, 256(5056): 498-502. DOI:10.1126/science.1373906. |
| [23] | Ridone P, Nakayama Y, Martinac B, et al. Patch clamp characterization of the effect of cardiolipin on MscS of E-coli[J]. European Biophysics Journalwith Biophysics Letters, 2015, 44(7): 567-576. DOI:10.1007/s00249-015-1020-2. |
| [24] | LOU Xue-lin(娄雪林), ZHOU Zhuan(周专), KANG Hua-huang(康华光). Single channel and whole cell recordings using patch clamptechnique(单通道和全细胞记录技术)[J]. Chinese Journal of Medical Instrumentation(中国医疗器械杂志), 2000, 24(4): 221-226. DOI:10.3969/j.issn.1671-7104.2000.04.012. |
| [25] | Malboubi M, Jiang K. Gigaseal formation in patch clamping with applications of nanotechnology[M]. Berlin, Heidelberg: Springer, 2014: 3-7. |
| [26] | Wu M J, Kee K H, Na J, et al. Pituitary adenylate cyclase-activating polypeptide inhibits pacemaker activity of colonic interstitial cells of cajal[J]. Korean Journal of Physiology and Pharmacology, 2015, 19(5): 435-440. DOI:10.4196/kjpp.2015.19.5.435. |
| [27] | Lolicato M, Arrigoni C, Mori T, et al. K2P2.1(TREK-1)-activator complexes reveal a cryptic selectivity filter binding site[J]. Nature, 2017, 547(7663): 364-368. DOI:10.1038/nature22988. |
| [28] | Hamilton N B, Kolodziejczyk K, Kougioumtzidou E, et al. Proton-gated Ca2+-permeable TRP channels damage myelin in conditions mimicking ischaemia[J]. Nature, 2016, 529(7587): 523-527. DOI:10.1038/nature16519. |
| [29] | Li M F, Toombes G E S, Silberberg S D, et al. Physical basis of apparent pore dilation of ATP-activated P2X receptor channels[J]. Nature Neuroscience, 2015, 18(11): 1577-1583. DOI:10.1038/nn.4120. |
| [30] | Azimi I, Roberts-Thomson S J, Monteith G R. Calcium influx pathways in breast cancer:opportunities for pharmacological intervention[J]. British Journal of Pharmacology, 2014, 171(4): 945-960. DOI:10.1111/bph.12486. |
| [31] | Berzingi S, Newman M, Yu H G. Altering bioelectricity on inhibition of human breast cancer cells[J/OL]. Cancer Cell International, 2016[2018-01-05]. https://doi.org/10.1186/s12935-016-0348-8. |
| [32] | Oehler B, Kistner K, Martin C, et al. Inflammatory pain control by blocking oxidized phospholipid-mediated TRP channel activation[J/OL]. Scientific Reports, 2017[2018-01-05]. https://doi.org/10.1038/s41598-017-05348-3. |
| [33] | Kheradpezhouh E, Ma L L, Morphett A, et al. TRPM2 channels mediate acetaminophen-induced liver damage[J]. Proceeding of the National Academy Sciences of the United States of America, 2014, 111(8): 3176-3181. DOI:10.1073/pnas.1322657111. |
| [34] | Kheradpezhouh E, Panjehshahin M R, Miri R, et al. Curcumin protects rats against acetaminophen-induced hepatorenal damages and shows synergistic activity with N-acetyl cysteine[J]. European Journal of Pharmacology, 2010, 628(1-3): 274-281. DOI:10.1016/j.ejphar.2009.11.027. |
| [35] | Kheradpezhouh E, Barritt G J, Rychkov G Y. Curcumin inhibits activation of TRPM2 channels in rat hepatocytes[J]. Redox Biology, 2016, 7: 1-7. DOI:10.1016/j.redox.2015.11.001. |
| [36] | GE Man-ling(葛曼玲), ZHAO Quan-ming(赵全明), GUO Hong-yong(郭鸿涌), et al. The present patch-clamp technique in neuron electrical signal test(膜片钳技术在神经元电信号测试中的进展)[J]. Chinese Journal of Scientific Instrument(仪器仪表学报), 2002, 23(3): 70-71. |
| [37] | Lu H C, Mackie K. An introduction to the endogenous cannabinoid system[J]. Biological Psychiatry, 2016, 79(7): 516-525. DOI:10.1016/j.biopsych.2015.07.028. |
| [38] | Gantz S C, Bean B P. Cell-autonomous excitation of midbrain dopamine neurons by endocannabinoid-dependent lipid signaling[J]. Neuron, 2017, 93(6): 1375-1387. DOI:10.1016/j.neuron.2017.02.025. |
| [39] | Zeilhofer H U, Wildner H, Yevenes G E. Fast synaptic inhibition in spinal sensory processing and pain control[J]. Physiological Reviews, 2012, 92(1): 193-235. DOI:10.1152/physrev.00043.2010. |
| [40] | Lynch J W, Callister R J. Glycine receptors:A new therapeutic target in pain pathways[J]. Current Opinion in Investigational Drugs, 2006, 7(1): 48-53. |
| [41] | Acuna M A, Yevenes G E, Ralvenius W T, et al. Phosphorylation state-dependent modulation of spinal glycine receptors alleviates inflammatory pain[J]. Journal of Clinical Investigation, 2016, 126(7): 2547-2560. DOI:10.1172/JCI83817. |
| [42] | Xiong W, Cui T X, Cheng K J, et al. Cannabinoids suppress inflammatory and neuropathic pain by targeting alpha 3 glycine receptors[J]. The Journal of Experimental Medicine, 2012, 209(6): 1121-1134. DOI:10.1084/jem.20120242. |
| [43] | Islam R, Zhang Y, Xu L, et al. A chemogeneticreceptor that enhances the magnitude and frequency of glycinergic inhibitory postsynaptic currents without inducing a tonic chloride flux[J]. ACS Chemical Neuroscience, 2017, 8(3): 460-467. DOI:10.1021/acschemneuro.6b00382. |
| [44] | Yun I A, Wakabayashi K T, Fields H L, et al. The ventral tegmental area is required for the behavioral and nucleus accumbens neuronal firing responses to incentive cues[J]. Journal of Neuroscience, 2004, 24(12): 2923-2933. DOI:10.1523/JNEUROSCI.5282-03.2004. |
| [45] | Zhang S L, Qi J, Li X P, et al. Dopaminergic and glutamatergic microdomains in a subset of rodent mesoaccumbens axons[J]. Nature Neuroscience, 2015, 18(3): 386-392. DOI:10.1038/nn.3945. |
| [46] | Berrios J, Stamatakis A M, Kantak P A, et al. Loss of UBE3A from TH-expressing neurons suppresses GABA co-release and enhances VTA-NAc optical self-stimulation[J/OL]. Nature Communications, 2016[2018-01-05]. https://doi.org/10.1038/ncomms10702. |
| [47] | Ossola D, Amarouch M Y, Behr P, et al. Force-controlled patch clamp of beating cardiac cells[J]. Nano Letters, 2015, 15(3): 1743-1750. DOI:10.1021/nl504438z. |
| [48] | Zhang C L, Li P, Liu L Q, et al. Development of mechanostimulated patch-clamp system for cellular physiological study[J]. IEEE/ASME Transactions on Mechatronics, 2014, 19(4): 1138-1147. DOI:10.1109/TMECH.3516. |
| [49] | Fertig N, Blick R H, Behrends J C. Whole cell patch clamp recording performed on a planar glass chip[J]. Biophysical Journal, 2002, 82(6): 3056-3062. DOI:10.1016/S0006-3495(02)75646-4. |
| [50] | Schmidt C, Mayer M, Vogel H. A chip-based biosensor for the functional analysis of single ion channels[J]. Angewandte Chemie International Edition, 2000, 39(17): 3137-3140. |
| [51] | SHEN Ya-feng(沈亚峰), LIANG Wen(梁文), LEI Chang-hai(雷长海), et al. Synchronous observation of Ca2+ release in cardiac myocytes by patch clamp and confocal microscope(利用膜片钳-激光扫描共聚焦显微镜同步实时系统观察心肌细胞浆内钙离子的释放)[J]. Journal of Chinese Electron Microscopy Society(电子显微镜学报), 2008, 27(2): 127-130. |
| [52] | Zheng J, Zagotta W N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry[J]. Neuron, 2000, 28(2): 369-374. DOI:10.1016/S0896-6273(00)00117-3. |
| [53] | Kusch J, Biskup C, Thon S, et al. Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels[J]. Neuron, 2010, 67(1): 75-85. DOI:10.1016/j.neuron.2010.05.022. |
| [54] | Mony L, Berger T K, Isacoff E Y. A specialized molecular motion opens the Hv1 voltage-gated proton channel[J]. Nature Structural & Molecular Biology, 2015, 22(4): 283-290. |
| [55] | CHENG Wei(程为), LI Mei(李玫), DU Sha(杜莎), et al. Development and application of patch-clamp fluorometryin life scienceresearch(荧光膜片钳新技术的应用及进展)[J]. Progress in Biochemistry and Biophysics(生物化学与生物物理进展), 2016, 43(2): 187-192. |
| [56] | Ebina T, Sohya K, Imayoshi I, et al. 3D clustering of GABAergic neurons enhances inhibitory actions on excitatory neurons in the mouse visual cortex[J]. Cell Reports, 2014, 9(5): 1896-1907. DOI:10.1016/j.celrep.2014.10.057. |
| [57] | Tao C, Zhang G W, Xiong Y, et al. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience[J/OL]. Frontiers in Neural Circuits, 2015[2018-01-05]. https://doi.org/10.3389/fncir.2015.00023. |




