溶液的超额性质一直是化工热力学研究中的重要课题,它反映了混合过程中分子间相互作用力的变化,是溶液非理想性的主要标志之一,也是化工生产过程的开发和设计中重要的热力学基础数据。
甲酰胺(FA)是很多化学反应和工艺过程中常用溶剂。甲酰胺分子具有很高的极性,有良好的氢键供体-受体性质(-NH2基和C=O基),分子间存在强烈缔合,自身形成立体的氢键网络结构[1]。由于酰胺的结构特点,在生物领域常常被选作研究蛋白质-水、蛋白质-溶剂相互作用和DNA结构的模型分子[2~7]。为了更好地理解甲酰胺在溶液中结构与性质的关系,近年来许多研究者对甲酰胺在溶液中的行为做了大量的研究[8~13]。Bako等[1]利用拓扑学方法详细考察了甲酰胺-水体系的氢键网络结构;Almasi等[14]用热力学方法研究了甲酰胺-异烷醇体系的黏度和密度,分析了超额性质随组成、温度及碳链长度的变化;Nain[8, 9, 12, 15]等研究了甲酰胺-醇二元系的声速、密度和黏度性质,分析了分子间力的强弱,分子大小和形状对混合液性质的影响;Kondaiah等[16]研究了乙二醇-酰胺在308.15 K时的黏度和密度及过量性质;Awasthi[17, 18]通过测定甲酰胺-2-甲氧基乙醇/2-乙氧基乙醇二元系密度和黏度研究了体系的溶液行为。
含甲酰胺二元系的应用非常广泛,但未见甲酰胺-异丙醇/乙酸乙酯二元系的密度和黏度报道。为进一步理解含FA二元系的分子相互作用及对溶液性质的影响,本文在常压下测定FA分别与乙醇、丙醇、异丙醇和乙酸乙酯形成的二元系在293.15~318.15 K全浓度范围内的密度和黏度,计算超额摩尔体积和黏度偏差,利用半经验的黏度模型对实验黏度数据进行关联和预测,分析过量性质的变化及FA二元系中分子相互作用的差异。
2 实验部分 2.1 试剂甲酰胺(FA,>99.5%,国药试剂),乙醇(>99.8%,Aladdin试剂),丙醇(>99.0%,汕头西陇化工厂),异丙醇(>99.7%,杭州双林化工试剂厂),乙酸乙酯(>99.5%,杭州双林化工试剂厂),实验用水为石英亚沸蒸馏水。
2.2 密度和黏度测定密度用10 mL的密度瓶(德国ISOLAB)在恒温条件下称重测量。密度瓶在不同温度下的空瓶体积用蒸馏水校正。循环式超级恒温槽,控温精度为±0.05 K。电子天平(称量精度±1×10-4g)。密度测量精度为±0.05%。
黏度利用乌氏黏度计测定,毛细管内径0.57 mm, 温控精度±0.05 K,秒表计时精度0.01 s。计算式为η = η0ρt/(ρ0t0), 其中η、ρ和t分别为待测液体黏度、密度和流经毛细管时间,η0、ρ0和t0分别代表蒸馏水的相应变量。重复读数5次以上,每次相差不超过0.05 s,取平均值。黏度测量精度为±0.2%。
利用上述方法常压下测定了试剂在298.15 K时的黏度和密度,与文献值相比较,两者吻合甚好(表 1),说明本实验所用仪器和测定方法可靠。
| 表 1 298.15 K时试剂的密度和黏度 Table 1 Densities and viscosities of pure liquids at 298.15 K |
实验测定四个二元系FA(1)+乙醇(2)、FA(1)+丙醇(2)、FA(1)+异丙醇(2)和FA(1)+乙酸乙酯(2)在293.15~318.15 K的密度和黏度分别列于表 2和表 3。
| 表 2 FA与乙醇、丙醇、异丙醇和乙酸乙酯二元系在不同温度下的密度 Table 2 Densities of binary mixtures containing formamide and ethanol, propanol, isopropanol or ethyl acetate from 293.15 to 318.15 K |
| 表 3 FA与乙醇、丙醇、异丙醇和乙酸乙酯二元系在不同温度下的黏度 Table 3 Viscosities of binary mixtures containing formamide and ethanol, propanol, isopropanol or ethyl acetate from 293.15 to 318.15 K |
二元混合物超额摩尔体积VE、黏度偏差Δη及过量黏滞性活化自由能ΔG*E分别利用下式计算[18~20]:
| ${V^{\rm{E}}} = ({x_1}{M_1} + {x_2}{M_2})/\rho - x{}_1{M_1}/{\rho _1} - {x_2}{M_2}/{\rho _2}$ | (1) |
| $\Delta \eta = \eta - {x_1}{\eta _1} - {x_2}{\eta _2}$ | (2) |
| $\Delta {G^{*{\rm{E}}}} = RT\left[ {{\rm{ln}}\left( {\eta V} \right) - {x_1}{\rm{ln}}\left( {{\eta _1}{V_1}} \right) - {x_2}{\rm{ln}}\left( {{\eta _2}{V_2}} \right)} \right]$ | (3) |
式中x为摩尔分数,η为混合液黏度,ρ为密度,V为混合液摩尔体积,M为摩尔质量,下标1和2分别表示组分1和组分2的相应性质。VE计算结果见图 1~图 4,Δη见图 5~图 8,ΔG*E见图 9。

|
图 1 不同温度下FA(1)+乙醇(2)二元系的VE~x1图 Fig.1 Profiles of VE against x1 for the FA(1) + ethanol(2) binary mixture at different temperatures |

|
图 2 不同温度下FA(1)+丙醇(2)二元系的VE~x1图 Fig.2 Profiles of VE against x1 for the FA(1) + propanol(2) binary mixture at different temperatures |

|
图 3 不同温度下FA(1)+异丙醇(2)二元系的VE~x1图 Fig.3 Profiles of VE against x1 for the FA(1) + isopropanol(2) binary mixture at different temperatures |
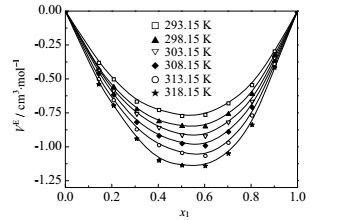
|
图 4 不同温度下FA(1)+乙酸乙酯(2)二元系的VE~x1图 Fig.4 Profiles of VE against x1 for the FA(1) + ethyl acetate(2) binary mixture at different temperatures |
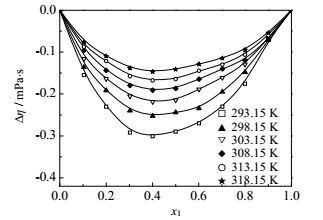
|
图 5 不同温度下FA(1)+乙醇(2)二元系的Δη~x1图 Fig.5 Profiles of Δη against x1 for the FA(1) + ethanol(2) binary mixture at different temperatures |
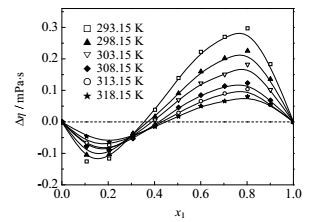
|
图 6 不同温度下FA(1)+丙醇(2)二元系的Δη~x1图 Fig.6 Profiles of Δη against x1 for the FA(1) + propanol(2) binary mixture at different temperatures |
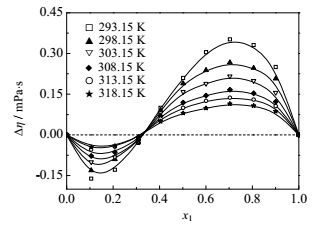
|
图 7 不同温度下FA(1)+异丙醇(2)二元系的Δη~x1图 Fig.7 Profiles of Δη against x1 for the FA(1)+ isopropanol(2) binary mixture at different temperatures |
|
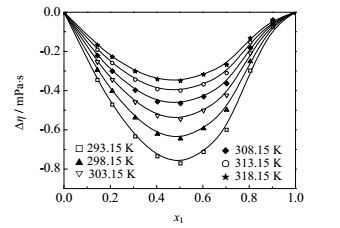
图 8 不同温度下FA(1)+乙酸乙酯(2)二元系的Δη~x1图 Fig.8 Profiles of Δη against x1 for the FA(1) + ethyl acetate(2) binary mixture at different temperatures |
|
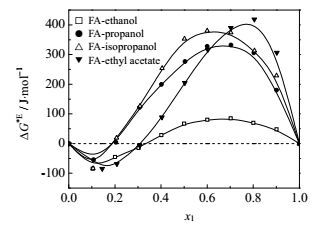
图 9 298.15 K时各体系的ΔG*E~x1图 Fig.9 Profiles of ΔG*E against x1 for various binary mixtures at 298.15 K |
四个二元系的VE均为负值,并都随温度升高偏差增大。纯组分的FA和烷醇分子由于有强烈的质子给体和质子受体而通过氢键缔合,当两者混合以后会导致这种纯态时的氢键解离形成新的氢键,比如,FA分子中的C=O的质子受体O原子(带两个孤电子对)和烷醇分子中-OH基团的H原子之间形成新的氢键(C=O…H-O),而FA分子中的-NH2基团上的H原子和烷醇分子中的-OH基团的O原子之间形成的另一种新的氢键(N-H…O-H)。不同种分子间的氢键发生更强烈的缔合,从而导致体积压缩,VE为负值。
另一个导致VE为负值的因素是由于分子形状与大小不同引起的几何填充效应。298.15 K时,FA的摩尔体积为39.9,乙醇、丙醇、异丙醇和乙酸乙酯摩尔体积分别是58.7、75.1、76.9和98.5 cm3·mol-1,因此较小的FA分子易于填入较大的另一组分分子空隙中,导致混合体积缩小。FA-乙醇体系的超额摩尔体积比FA-丙醇的更负,是因为氢键强度随烷醇碳链增长而下降。这与Nain[8]实验结果吻合。FA-乙酸乙酯体系的VE比其它体系更负,一个因素是乙酸乙酯摩尔体积的大小与FA差异最大,几何填充效应最显著,因而体积收缩效应最强;二是由于乙酸乙酯具有两个氢键受体,与FA能形成更稳定的氢键网络结构,其分子间的相互作用力也更强。
四个体系的VE均随温度升高而偏差更大。温度较高时,分子体积随之膨胀,这样较小的FA分子更有利于填充到因膨胀而导致的较大的空隙中,因而体积缩小效应更明显。
FA-乙醇和FA-乙酸乙酯二元系的黏度偏差均为负值。黏度偏差的负值常常是由于分子形状和大小以及形成聚集体的能力等引起,而较大的黏度偏差值表明分子间存在强的作用力,如偶极-偶极相互作用,醇分子之间的氢键,醇分子和甲酰胺分子之间的氢键等。从纯物质的黏度值来看,FA的黏度是乙醇的3倍,是乙酸乙酯的8倍,形成混合物以后破坏了FA分子的有序结构,导致黏度减小。FA-丙醇/异丙醇两个二元系的黏度偏差随组成呈‘S’形变化,先是负值,随后变为正值,这与Almasi[14]实验结果相一致。纯物质FA的黏度与丙醇和异丙醇的黏度值相差不大。甲酰胺在低浓度区,由于不同种分子间氢键的形成,其分子结构被破坏导致流动性增强,黏度下降;随甲酰胺浓度增大,甲酰胺将以自身缔合的形式为主,醇分子与其新建立的氢键有利于增强甲酰胺的结构,因而黏度增大。
四个体系的黏度偏差均随温度升高而偏差减小。FA、醇和酯都是极性分子,分子间的偶极-偶极作用,会导致混合时形成溶剂-助溶剂加合物,而随温度的升高,参与形成加合物的分子振动频率加快,分子间作用力变得松弛和减弱[5],因此,温度较高时,偏离理想的程度会有所下降。
图 9是298.15 K时四个体系的过量黏滞性活化自由能ΔG*E随组成变化,在甲酰胺低浓度区为负值,而在FA高浓度区为正值。一般来说,负的ΔG*E归因于色散力和弱的偶极-偶极相互作用,正的ΔG*E是化学作用、氢键以及其它复合物的形成的结果。
3.2 二元系黏度的关联与预测为预测二元系任一组成下的黏度,拟用下列半经验的黏度方程对实验数据进行关联:
Frenkel方程[21]:
| ${\rm{ln}}\eta = x_1^2{\rm{ln}}{\eta _1} + x_2^2{\rm{ln}}{\eta _2} + 2{x_1}{x_2}{\rm{ln}}{A_{12}}$ | (4) |
| ${\rm{ln}}\eta = x_1^{}{\rm{ln}}{\eta _1} + x_2^{}{\rm{ln}}{\eta _2} + {x_1}{x_2}{G_{12}}$ | (5) |
| ${\rm{ln}}(\eta V) = {x_1}{\rm{ln}}({V_1}{\eta _1}) + {x_2}{\rm{ln}}({V_2}{\eta _2}) + {x_1}{x_2}{W_{{\rm{vis}}}}/RT$ | (6) |
| $\begin{array}{l} {\rm{ln}}\nu = x_1^3{\rm{ln}}{\nu _1} + 3x_1^2{x_2}{\rm{ln}}{Z_{12}} + 3{x_1}x_2^2{\rm{ln}}{Z_{21}} + x_2^3{\rm{ln}}{\nu _2} - {\rm{ln}}({x_1} + {x_2}{M_2}/{M_1})\\ + 3x_1^2{x_2}{\rm{ln}}(2/3 + {M_2}/3{M_1}) + 3{x_1}x_2^2{\rm{ln}}(1/3 + 2{M_2}/3{M_1}) + x_2^3{\rm{ln}}({M_2}/{M_1}) \end{array}$ | (7) |
式(4)~(7)中η为动力黏度,ν运动黏度,M为摩尔质量,x为摩尔分数,V为混合液摩尔体积,下标1和2分别表示组分1和组分2的相应性质。A12,G12,Wvis,Z12,Z21分别是各黏度方程的调节参数,通过拟合实验数据得到。
| $d = {\left[ {\frac{1}{{n - p}}\sum {{{\left( {\frac{{{\eta _{\exp }} - {\eta _{{\text{cal}}}}}}{{{\eta _{\exp }}}}} \right)}^2}} } \right]^{\frac{1}{2}}}$ | (8) |
式中n为实验数据点个数,p为黏度模型调节参数个数,ηexp和ηcal分别为黏度实验值和计算值。四个黏度模型的调节参数和相对标准偏差见表 4。可以看出,其中三元体相互作用模型McAllister方程的预测结果最佳。对FA-乙酸乙酯体系而言,McAllister模型的平均相对标准偏差小于2%,而其它三个黏度方程的平均相对标准偏差接近10%。因为乙酸乙酯具有两个氢键受体,与FA形成二元混合物时,可以形成多种氢键类型,其分子间的相互作用更为复杂。活化流动过程中,一个分子越过势垒与不同组分的分子作用,并随局部浓度而改变,活化分子在分子层之间跃迁时经历着不同类型的相互作用。因此,建立在三元体相互作用模型上的MicAllister方程,能更准确地解释不同类型的相互作用对混合物活化自由能的贡献。
| 表 4 不同温度下四个半经验方程的调节参数和相对标准偏差 Table 4 Adjustable parameters and standard deviation of four semi-empirical equations at different temperatures |
黏滞性活化自由能ΔG*可通过Eyring黏度方程计算[8, 18, 24]:
| $\eta = \frac{{hN}}{V}{\rm{exp}}\left( {\frac{{\Delta {G^*}}}{{RT}}} \right)$ | (9) |
式中h为Planck常数,N为Avogadro常数,V为摩尔体积。
黏滞性活化自由能ΔG*的物理意义表示一个分子从基态到运动过渡态的能量势垒。从分子热力学和Eyring的黏度理论可知,热力学和传递性质的过量能量,都来源于混合过程中分子间相互作用力的变化,也就是分子间势垒的变化。正是由于分子间作用力在混合过程中的变化,使得表征溶液非理想性的过量热力学函数和溶液传递性质之一的黏度相联系[24]。结合热力学关系式
| $R{\rm{ln}}\left( {\frac{{\eta V}}{{hN}}} \right) = \frac{{\Delta {H^*}}}{T} - \Delta {S^*}$ | (10) |
式中ΔH*和ΔS*分别为活化焓和活化熵。以Rln(ηV/hN)对1/T作图,发现四个二元系均有良好的线性关系(相关系数达0.999),这说明在实验温度范围内组成一定时活化焓和活化熵有定值。ΔH*和ΔS*计算结果列于表 5。
| 表 5 黏滞性活化自由能、活化焓和活化熵 Table 5 Activation free energy, enthalpy and entropy of viscous flow |
四个体系的ΔG*和ΔH*都是正值,由数值可以看出,ΔG*主要是由焓效应决定,说明活化流动过程主要是焓驱动[25]。随x1增加,FA-异丙醇体系的ΔS*略有下降,其它三个体系均是增大趋势,其中FA-乙酸乙酯体系的ΔS*随x1的增加由负值变为正值。负的ΔS*值说明流动过程中形成的活化态结构性增强。FA和乙酸乙酯分子都具有负极性的氧原子,这些负电荷孤电子对的完全暴露,使得两种分子会被非常强地溶剂化,同时这些氧原子也是最好的氢键受体,两者混合极易形成更有序的氢键网络结构。这也与超额摩尔体积、黏度偏差结论相吻合。
4 结论(1) 常压下测定了FA分别与乙醇、丙醇、异丙醇和乙酸乙酯形成的二元系在293.15~318.15 K全浓度范围内的密度和黏度, 计算了超额摩尔体积和黏度偏差。四个二元系的超额摩尔体积均为负值,且都随温度升高偏差增大;FA-乙醇和FA-乙酸乙酯两个体系的黏度偏差为负值,都随温度降低偏差增大。而FA-丙醇和FA-异丙醇两个体系的黏度偏差随组成呈‘S’形变化,也均随温度降低而偏差增大,在富醇区由负值变为正值。
(2) 采用四个半经验的黏度模型对实验数据进行关联,结果表明McAllister模型的关联结果最好,预测值与实验值的平均相对偏差最小。
(3) 黏滞性活化自由能ΔG*和活化焓ΔH*均为正值;活化熵ΔS*随x1的增加,FA-异丙醇体系略有下降,其它三个体系均是增大趋势,其中FA-乙酸乙酯体系的ΔS*随x1的增加由负值变为正值。活化流动过程中焓驱动起主导作用。
符号说明:
| A12 | -Frenkel方程调节参数 | Wvis | — Katti-Chaudhari方程调节参数 |
| d | -相对标准偏差 | x1 | -甲酰胺的摩尔分数 |
| G12 | -Grunberg-Nissan方程调节参数 | Z12, Z21 | -McAllister方程调节参数 |
| ΔG*E | -过量黏滞性活化自由能,J· mol-1 | Δη | -黏度偏差,mPa·s |
| ΔG* | -黏滞性活化自由能,kJ· mol-1 | η | -黏度,mPa·s |
| ΔH* | -活化焓,kJ·mol-1 | ρ | -密度,g·cm-3 |
| M | -摩尔质量,g· mol-1 | 下标 | |
| ΔS* | -活化熵,J·K-1· mol-1 | 1, 2 | —组份 |
| V | -摩尔体积,cm3·mol-1 | cal | -计算值 |
| VE | —过量摩尔体积,cm3·mol-1 | exp | -实验值 |
| [1] | Bako I, Olah J, Labas A, et al. Water-formamide mixtures:topology of the hydrogen-bonded network[J]. Journal of Molecular Liquids , 2017, 228: 25-31. DOI:10.1016/j.molliq.2016.10.052. |
| [2] | Nain A K. Densities, ultrasonic speeds, viscosities and excess properties of binary mixtures of methyl methacrylate with N, Ndimethylformamide and N, N-dimethylacetamide at different temperatures[J]. Journal of Chemical Thermodynamics , 2013, 60(5): 105-116. |
| [3] | Uddin M H, Khan M Z H, Rahman M H, et al. Volumetric and viscometric properties observed for the mixtures of DMF (N, Ndimethyl formamide) and other alcohols (butanol and 1-propanol)[J]. Physics and Chemistry of Liquids , 2014, 52(2): 251-261. DOI:10.1080/00319104.2013.812021. |
| [4] | Choudhary D S, Ladole C A, Aswar A S. Interaction of 5-chloro-2-hydroxy-3-nitroacetophenone in N, N-dimethylformamide at various temperatures:a viscometric, volumetric and ultrasonic study[J]. Proceedings of the National Academy of Science of India, Section A:Physical Sciences , 2015, 85(2): 221-226. DOI:10.1007/s40010-014-0191-z. |
| [5] | Venkatesu P. Thermophysical contribution of N, N-dimethylformamide in the molecular interactions with other solvents[J]. Fluid Phase Equilibria , 2010, 298(2): 173-191. DOI:10.1016/j.fluid.2010.07.010. |
| [6] | Shokouhi M, Jalili A H, Hosseine-Jenab M, et al. Thermo-physical of aqueous solutions of N, N-dimethylformamide[J]. Journal of Molecular liquids , 2013, 186: 142-146. DOI:10.1016/j.molliq.2013.07.005. |
| [7] | Jozwiak M, Tyczynska M, Bald A. The physicochemical properties and viscosity behavior of crown ether 18C6 in the mixture of water with N, N-dimethylformamide[J]. Journal of Molecular Liquids , 2017, 229: 520-529. DOI:10.1016/j.molliq.2016.12.055. |
| [8] | Nain A K. Ultrasonic and viscometric studies of molecular interaction in binary mixtures of formamide with ethanol, 1-propanol, 1, 2-ethanediol and 1, 2-propanediol at different temperatures[J]. Journal of Molecular Liquids , 2008, 140(1-3): 108-116. DOI:10.1016/j.molliq.2008.01.016. |
| [9] | Nain A K. Densities and volumetric properties of (formamide + ethanol, or 1-propanol, or 1, 2-ethanediol, or 1, 2-propanediol) mixtures at temperatures between 293.15 K and 318.15 K[J]. Journal of Chemical Thermodynamics , 2007, 39(3): 462-473. DOI:10.1016/j.jct.2006.07.021. |
| [10] | Rani M, Gahlyan S, Guar A, et al. Ultrasonic study on molecular interactions in binary mixtures of formamide with 1-propanol or 2-propanol[J]. Chinese Journal of Chemical Engineering , 2015, 23(4): 689-698. DOI:10.1016/j.cjche.2014.12.003. |
| [11] | Rani M, Maken S. Excess molar enthalpies and excess molar volumes of formamide +1-proanol or 2-propanol and thermodynamic modeling by Prigogine-Flory-Patterson theory and Treszczanowicz-Benson association model[J]. Thermochimica Acta , 2013, 559(5): 98-106. |
| [12] | Nain A K. Densities and volumetric properties of binary mixtures of formamide with 1-butanol, 2-buanol, 1, 3-butanol and 1, 4-butanol at different temperatures between 293.15 and 318.15 K[J]. Journal of Solution Chemistry , 2007, 36(4): 497-516. DOI:10.1007/s10953-007-9122-9. |
| [13] | Saleh M A, Begum S, Uddin M H. Excess molar volume of 1-propanol + formamide, + N-methylformamide, + N, N-dimethylformamide at 303.15 K[J]. Journal of Molecular Liquids , 2001, 94(2): 155-161. DOI:10.1016/S0167-7322(01)00265-3. |
| [14] | Almasi M. Densities and viscosities of the mixtures (formamide +2-alkanol):experimental and theoretical approaches[J]. Journal of Chemical Thermodynamics , 2014, 69(2): 101-106. |
| [15] | Nain A K. Molecular interaction in binary mixtures of formamide with 1-butanol, 2-buanol, 1, 3-butanol and 1, 4-butanol at different temperatures:an ultrasonic and viscometric study[J]. Fluid Phase Equilibria , 2008, 265(1-2): 46-56. DOI:10.1016/j.fluid.2007.12.007. |
| [16] | Kondaiah M, Sreekanth K, Sravana K D, et al. Densities, viscosities, and excess properties for binary mixtures of ethylene glycol with amide at 308.15 K[J]. Journal of Thermal Analysis and Calorimetry , 2014, 118(1): 475-483. DOI:10.1007/s10973-014-4019-5. |
| [17] | Awasthi A, Awasthi A. Acoustic, volumetric, and spectroscopic studies of formamide with 2-alkoxyethanol at different temperatures[J]. Journal of Chemical Thermodynamics , 2012, 53(10): 144-151. |
| [18] | Awasthi A, Awasthi A. Intermolecular interaction in formamide +2-alkoxyethanols:viscometric study[J]. Thermochimica Acta , 2012, 537(6): 57-64. |
| [19] | LING Jin-long(凌锦龙), LI Ling(李灵), YANG Jia-lin(杨佳琳). Excess volumes and viscosities of binary mixtures composed of 1, 2-propanediol with butanol, pentanol or hexanol(1, 2-丙二醇+丁醇/戊醇/己醇二元系的过量体积和黏度)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(2): 268-275. |
| [20] | XU Ying-jie(许映杰), YU Chao-hong(俞超红), LU Yue-qing(鲁越青). Volumetric and viscosity properties of 1-butylimidazolium acetate ionic liquid/methanol, ethanol, or 1-propanol binary mixtures([Bim]Ac离子液体+醇二元混合体系的体积和黏度性质研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(5): 1038-1044. |
| [21] | Oswal S L, Dave J P, Patel I N. Viscosity of binary mixture of alkyl acetate with hexane, tetrachloromethane, and trichlomethane[J]. International Journal of Thermophysics , 1999, 20(5): 1449-1465. DOI:10.1023/A:1021441122016. |
| [22] | Shukla R K, Kumar A, Awasthi N, et al. Density, viscosity and refractive index of binary liquid mixtures at 293.15, 298.15, 303.15, 308.15 and 313.15 K[J]. Experimental Thermal and Fluid Science , 2012, 37(2): 1-11. |
| [23] | Mohammad A A, Alkhaldi K H A E, Altuwaim M S, et al. Effect of temperature and chain length on the viscosity and surface tension of binary systems of N, N-dimethylformamide with 1-octanol, 1-nonanol and 1-decanol[J]. Journal of Chemical Thermodynamics , 2014, 74(7): 7-15. |
| [24] | Das D, Salhi H, Dallel M, et al. Viscosity Arrhenius activation energy and derived partial molar properties in isobutyric acid + water binary mixtures near and far away from the critical temperature, 302.15 to 313.15 K[J]. Journal of Solution Chemistry , 2015, 44(1): 54-66. DOI:10.1007/s10953-014-0289-6. |
| [25] | LI Dan(李丹), FANG Wen-jun(方文军), LIU Li(刘莉), et al. Volumetric and viscous properties for binary mixtures of N-methylpiperazine with ethyl acetate or butyl acetate from 298.15 to 313.15 K(N-甲基哌嗪与乙酸乙酯、乙酸丁酯二元混合体系在298.15~313.15 K的体积及黏度性质)[J]. Chemical Journal of Chinese Universities(高等学校化学学报) , 2013, 34(8): 1924-1928. DOI:10.7503/cjcu20130182. |




