近年来,硝基/硝胺基取代的氮杂环含能化合物及高氮含能离子盐衍生物的合成及性能研究,受到国内外含能材料研究者的关注[1-3],其中唑类化合物以高氮含量、高生成焓、高产气量和爆轰产物清洁等特点成为含能材料领域的研究热点[4-11],三唑和四唑类含能化合物的研究主要集中在单环衍生物、偶氮键相连的双环衍生物及其含能离子盐等方面[12-14]。研究发现,相连的联唑类化合物相比于传统单环衍生物具有更小的偶极矩以及更紧密的分子空间排布,对降低感度和提高堆积密度有促进作用。这使得唑类化合物未来在高能混合炸药、低特征信号推进剂和气体发生剂等领域具有潜在的应用价值[15-16]。
德国Fischer等[17]于2015年设计并合成了新型高能量密度化合物—1, 5-二硝胺基四唑(DNAT),国内西安近代化学研究所Li等[18]也开展了相关研究工作。1, 5-二硝胺基四唑的质量密度为1.93 g·cm-3,氮氧质量分数高达92.62%,理论爆速为9.41 km·s-1,理论爆压为41.9 GPa,计算生成热为486.3 kJ·mol-1,爆轰能量水平与六硝基六氮杂异伍兹烷(CL-20)相当;5, 5'-偶氮双(1-硝胺基四唑)(ABNAT)也是一种新型硝胺高能材料,理论密度为1.92 g·cm-3,氮氧质量分数高达90.90%,爆速为9.511 km·s-1,爆压42.5 GPa,生成热为1 106.3 kJ·mol-1,能量水平明显优于奥克托金(HMX)。DNAT和ABNAT作为综合性能优异的新型高能化合物,未来在高性能含能材料领域具有潜在的应用前景。
5, 5′-偶氮双(1-甲氧基甲酰胺基四唑) (ADMCAT)是制备高能含能化合物5, 5′-偶氮双(1-硝胺基四唑)的关键中间体。Fischer等[19]报道了以1, 5-二氨基四唑为原料,经缩合、氧化偶联、酸解等反应得到1, 1′-二氨基-5, 5′-偶氮双四唑,Li等[20]以1, 1′-二氨基-5, 5′-偶氮双四唑为原料,经五氧化二氮硝化、氢氧化钾成盐,然后酸化合成ABNAT,总收率为22.2%;而以1-甲氧基甲酰基-1, 5-二氨基四唑(MCDAT)经偶氮化、硝化、氢氧化钾成盐、酸化合成ABNAT,总收率为33.5%。因此,本研究以甲氧基甲酰肼为原料,合成了ABNAT的关键中间体ADMCAT,对"一锅法"合成MCDAT反应机理进行了初步探讨;培养了ADMCAT的单晶,并进行了单晶X-射线衍射测试及晶体结构解析。
2 实验部分 2.1 仪器和试剂仪器:1H-NMR和13C-NMR用瑞士BRUKER公司的AV500型(500 MHz)超导核磁共振仪测定;红外光谱(IR)用美国热电尼高力公司的NEXUS 870型傅里叶变换红外光谱仪测定;元素用德国EXEMENTAR公司的VARIO-EL-3型元素分析仪测定;差示扫描量热(DSC)用德国NETZSCH公司的DSC-204差示扫描量热仪测定;单晶用德国Bruker公司的SMART APE Ⅱ CCD X-射线单晶衍射仪测定。
试剂:叠氮氰的乙腈溶液,自制;甲氧基甲酰肼,分析纯,北京百灵威科技有限公司;乙腈,色谱纯,上海飞世尔科技有限公司;高锰酸钾,分析纯,成都市科龙化工试剂厂;浓盐酸(质量分数为36%~38%),分析纯,洛阳市化学试剂厂。
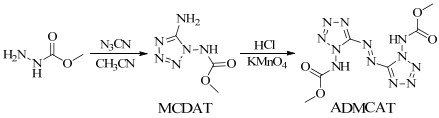
2.2 合成路线以甲氧基甲酰肼为原料,经加成-环化,再经偶氮化反应合成了ADMCAT,合成路线如图 1所示。
|
图 1 ADMCAT的合成路线 Fig.1 Synthetic route of ADMCAT |
冰水浴降温至0~5 ℃,将50.0 mL含1.52 g(22.3 mmol)叠氮氰的乙腈液加入反应瓶中,滴加10.0 mL含1.65 g(18.1 mmol)甲氧基甲酰肼水溶液,室温反应20 h,减压蒸除乙腈,过滤、冰水洗、干燥得2.26 g白色固体,收率为79.3%,纯度为98%。1H-NMR(DMSO-d6, 500 MHz), 化学位移δ:3.73(s, 3H, CH3),7.05(s, 2H, NH2),11.21(s, 1H, NH);13C-NMR(DMSO-d6, 125 MHz),δ:53.59、155.05、155.14;IR(KBr, cm-1),波数υ:3 373、3 263、3 200、3 104、2 867、1 743、1 655、1 580、1 485、1 451、1 326、1 198、1 119、1 069、987;元素分析C3H6N6O2(质量分数wB/%):理论值:C 22.79,H 3.82,N 53.15;实测值:C 22.86,H 3.76,N 53.34。
2.3.2 5, 5′-偶氮双(1-甲氧基甲酰胺基四唑)(ADMCAT)的合成冰水浴搅拌下,依次将12.9 mL浓盐酸、0.79 g(5 mmol)MCDAT加入烧瓶中,搅拌溶解后,滴加14.0 mL含0.79 g(5 mmol)高锰酸钾水溶液,加完后升温至50~55 ℃反应5 h,过滤、水洗、干燥得0.7 g黄褐色固体,收率为89.7%。1H-NMR(DMSO-d6, 500 MHz),δ:3.81(s, 6H, 2CH3),12.84(s, 2H, 2NH);13C-NMR(DMSO-d6, 125 MHz),δ:54.473,155.24,158.00;IR(KBr, cm-1),υ:3 242,3 024,2 968,1 767,1 638,1 536,1 504,1 467,1 437,1 309,1 248,1 147,1 074,1 049,964;元素分析C6H8N12O4(wB/%):理论值:C 23.08,H 2.58,N 53.84;实测值:C 23.16,H 2.52,N 53.91。
2.4 ADMCAT的单晶培养取ADMCAT黄褐色固体1.0 g溶解于热的10 mL蒸馏水中,自然冷却至室温,过滤除去不溶物,滤液置于干净锥形瓶中,在20~25 ℃下缓慢挥发10 d,析出黄色针状晶体,挑选合适尺寸的单晶颗粒进行晶体结构测试。
2.5 ADMCAT晶体结构测定选取尺寸为0.31 mm × 0.28 mm × 0.14 mm的单晶,放置于Bruker SMART APE Ⅱ CCD的X-射线单晶衍射仪上,用经过石墨单色器单色化的MoKα射线(波长λ=0.071 073 nm)为光源,以ω-θ扫描方式,θ为衍射角,在室温(296±2) K,2.12°≤θ≤25.10°内共收集2 979个衍射点,其中独立衍射点1 144[R(int)=0.026 4]个,所有计算由SHELXL97程序包解出,非氢原子坐标和各向异性温度因子经全矩阵最小二乘法修正,数据经Lp因子及经验吸收校正。
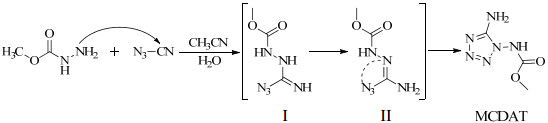
3 结果与讨论 3.1 "一锅法"合成MCDAT机理探讨以叠氮氰和甲氧基甲酰肼为原料,合成MCDAT的主要过程为:首先以溴化氰和叠氮化钠反应制备叠氮氰的乙腈溶液,然后向上述体系中加入甲氧基甲酰肼水溶液,甲氧基甲酰肼分子结构中氨基进攻叠氮氰的氰基碳,发生亲核加成反应,经过中间体Ⅰ、Ⅱ,最后经环化反应生成MCDAT,推测机理过程如下。
|
图 2 1-甲氧基甲酰基-1, 5-二氨基四唑(MCDAT)的合成机理 Fig.2 Synthetic route of 1-methoxy methylamide-1, 5-diamino tetrazole (MCDAT) |
甲氧基甲酰肼与叠氮氰"一锅法"合成MCDAT的实验过程中,为了得到更高的收率,分别考察了叠氮氰与甲氧基甲酰肼的量比(料比)、反应温度等因素对产物收率的影响,实验结果如表 1所示。
|
|
表 1 反应条件对MCDAT收率的影响 Table 1 Effect of reaction conditions on yield of MCDAT |
从表 1的实验结果可见,随着叠氮氰与甲氧基甲酰肼的量比增加,收率增大;当量比为1.2:1时,收率为79.3%;再继续增加量比,收率基本不变化。因此,此反应的最适宜的量比为1.2:1。同时随着反应温度的升高,收率逐渐增大,当温度为25 ℃,收率升高到79.3%;继续升高温度至30 ℃时,收率反而较大幅度的下降,为64.6%,这可能是由于叠氮氰在低温条件下,反应速率过慢;而在较高温度下不太稳定、快速分解所致。因此,合成MCDAT最适宜的反应温度为25 ℃。
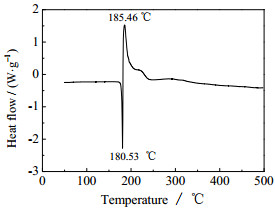
3.3 MCDAT和ADMCAT的热性能 3.3.1 MCDAT的热性能采用DSC方法研究了MCDAT的热稳定性(实验条件:动态氮气气氛,压力为0.1 MPa,温度为25~500 ℃,升温速率为5 ℃·min-1,试样量约0.5 ~1.0 mg,试样皿为铝盘),实验结果如图 3所示。由图 3可知,MCDAT存在一个吸热熔化峰,一个放热分解峰,表明该化合物的热分解是经历吸热熔化的过程,吸热峰为180.53 ℃。
|
图 3 MCDAT的DSC曲线 Fig.3 DSC curve of MCDAT |
MCDAT只在185.46 ℃存在热分解峰,表明该化合物的热分解只经历一个分解过程。
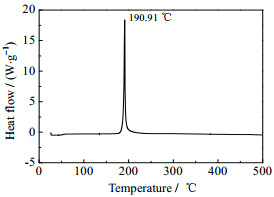
3.3.2 ADMCAT的热性能采用DSC方法研究了ADMCAT的热稳定性(实验条件:动态氮气气氛,压力为0.1 MPa,温度为25~500 ℃,升温速率5 ℃·min-1,试样量为0.5 ~1.0 mg,试样皿为铝盘),实验结果如图 4所示。
|
图 4 ADMCAT的DSC曲线 Fig.4 DSC curve of ADMCAT |
由图 4可知,ADMCAT不存在吸热熔化峰,只存在放热分解峰,表明该化合物的热分解是没有经历吸热熔化相变过程,而是由固相状态直接分解。ADMCAT只在190.91 ℃存在热分解峰,表明该化合物的热分解只经历一个分解过程。
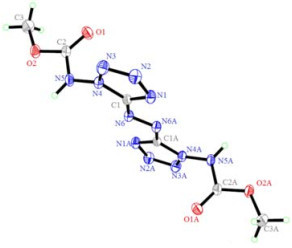
3.4 ADMCAT的单晶结构ADMCAT晶体的结构及堆积图如图 5、6所示。测试结果表明,该化合物为单斜晶系,空间群为P2(1)/c,晶体学参数为:a=(0.989 5±0.000 8) nm,b=(0.593 4±0.000 5) nm,c=(1.146 7±0.000 9) nm,α= 90°,β=(103.798±0.011)°,γ= 90°,V=(0.653 9±0.000 9) nm3,Z= 2,Dc= 1.586 g·cm-3,μ= 0.134 mm-1,F(000)= 320,其中,a、b、c分别为晶胞的3个单位向量的长度,β为a和c之间的夹角,V为晶胞体积,Z为晶胞中分子数,Dc为晶体密度,μ为线性吸收系数,F(000)为晶胞中的电子数。该晶体结构由Patterrson直接法解出,原子位置均由差值Fourier合成法得到。经全矩阵最小二乘法对F2进行修正。最终偏差因子R1=0.051 6,wR2=0.198 6,最佳拟合度s=1.011,精修参数为102个,最终差值在Fourier上最大残余峰为307 e·nm-3,最小残余峰为-338 e·nm-3。
|
图 5 ADMCAT的分子结构 Fig.5 Molecular structure of ADMCAT |
|
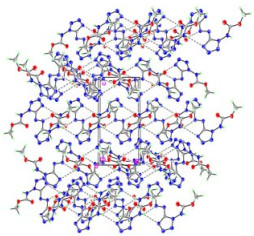
图 6 ADMCAT的晶胞堆积图 Fig.6 Cell packing diagram of ADMCAT |
如图 5、6和表 2中的键长数据所示,ADMCAT分子中四唑环和偶氮键的所有键长均处于标准的单键和双键之间,表明彼此间存在着较强的离域共轭效应,亚氨基N原子也参与了四唑环和偶氮键的共轭作用,上述各部分处于同一平面;晶体结构解析表明,甲氧基甲酰基所在平面近乎垂直于四唑环与偶氮键所在的平面。晶胞堆积图和氢键数据(见表 3)可以看出,晶体中氮氢原子间存在一定的氢键作用。
|
|
表 2 ADMCAT的部分键长和键角 Table 2 Bond lengths and angles of ADMCAT |
|
|
表 3 ADMCAT的氢键键长和键角 Table 3 Hydrogen bond lengths and angles of ADMCAT |
(1) 以甲氧基甲酰肼为原料,经加成、环化和偶氮化等反应合成了ADMCAT,该合成方法具有较强的普适性和推广性。
(2) 对MCDAT和ADMCAT的热性能进行研究,其热分解峰温度分别为185.46和190.91 ℃。
(3) 培养了ADMCAT的单晶,并进行了结构解析,发现该化合物为单斜晶系,空间群为P2(1)/c,晶体学参数为:a=(0.989 5±0.000 8) nm,b= (0.593 4±0.000 5) nm,c= (1.146 7±0.000 9) nm,α= 90°,β= (103.798±0.011)°,γ= 90°,V=(0.653 9±0.000 9) nm3,晶体密度为1.586 g·cm-3。
| [1] |
GAO H X, SHREEVE J M. Azole-based energetic salts[J]. Chemical Reviews, 2011, 111(11): 7377-7436. DOI:10.1021/cr200039c |
| [2] |
ZHANG Q H, SHREEVE J M. Energetic ionic liquids as explosives and propellant fuels: A new journey of ionic liquid chemistry[J]. Chemical Reviews, 2014, 114(20): 10527-10574. DOI:10.1021/cr500364t |
| [3] |
黄晓川, 郭涛, 刘敏, 等. 联唑类含能化合物及其含能离子盐研究进展[J]. 含能材料, 2015, 23(3): 291-301. HUANG X C, GUO T, LIU M, et al. Review on bis-azoles and its energetic ion derivatives[J]. Chinese Journal of Energetic Materials, 2015, 23(3): 291-301. |
| [4] |
WANG R H, GUO R, ZENG Z, et a1. Furazan-functionalized tetrazolate-based salts: A new family of insensitive energetic materials[J]. Chemistry-A European Journal, 2009, 15(11): 2625-2634. DOI:10.1002/chem.200802160 |
| [5] |
HIMO F, DEMKO Z P, NOODLEMAN L, et a1. Why is tetrazoleformation by addition of azide to organicnitriles catalyzed by zinc(Ⅱ) salts[J]. Journal of American Chemical Society, 2003, 125(33): 9983-9987. DOI:10.1021/ja030204q |
| [6] |
HIMO F, DEMKO Z P, NOODLEMAN L, et a1. Mechanisms of tetrazole formation by addition of azide to nitriles[J]. Journal of American Chemical Society, 2002, 124(1): 2210-2216. |
| [7] |
李志敏, 张建国, 张同来, 等. 硝基四唑及其高氮化合物[J]. 化学进展, 2010, 22(4): 639-647. LI Z M, ZHANG J G, ZHANG T L, et al. Nitrotetrazole and its high nitrogen-contented compounds[J]. Progress in Chemistry, 2010, 22(4): 639-647. |
| [8] |
李冠琼, 李玉川, 马巧丽, 等. 富氮唑环类化合物的环加成合成研究进展[J]. 有机化学, 2010, 30(10): 1431-1440. LI G Q, LI Y C, MA Q L, et al. Research progress in synthesis of nitrogen-rich zole-ring compounds by cycloaddition reaction[J]. Chinese Journal of Organic Chemistry, 2010, 30(10): 1431-1440. |
| [9] |
李亚南, 唐婷, 廉鹏, 等. 1, 4-二氨基-3, 6-二硝基吡唑[4, 3-c]并吡唑的合成, 热性能及量子化学研究[J]. 有机化学, 2012, 32(3): 580-588. LI Y N, TANG T, LIAN P, et al. Synthesis, thermal performance and quantum chemistry study on 1, 4-diamino-3, 6-dinitropyrazolo[4, 3-c] pyrazole[J]. Chinese Journal of Organic Chemistry, 2012, 32(3): 580-588. |
| [10] |
ZHANG Q H, SHREEVE J M. Growing catenated nitrogen atom chains[J]. Angewandte Chemie-International Edition, 2013, 52(34): 8792-8794. DOI:10.1002/anie.201303297 |
| [11] |
李亚南, 胡建建, 常佩, 等. 3-偕二硝甲基-1, 2, 4-三唑的合成及表征[J]. 高校化学工程学报, 2019, 33(1): 141-145. LI Y N, HU J J, CHANG P, et al. Synthesis and characterization of 3-dinitromethyl-1, 2, 4-triazole[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 141-145. DOI:10.3969/j.issn.1003-9015.2019.01.018 |
| [12] |
GÖBEL M, KARAGHIOSOFF K, KLAPÖTKE T M, et al. Nitrotetrazolat-2N-oxides and the strategy of N-oxide introduction[J]. Journal of American Chemical Society, 2010, 132(48): 17216-17226. DOI:10.1021/ja106892a |
| [13] |
LI Y C, QI C, LI S H, et al. 1, 1'-Azobis-1, 2, 3-triazole: A high-nitrogen compound with stable N8 structure and photochromism[J]. Journal of American Chemical Society, 2010, 132(35): 12172-12173. DOI:10.1021/ja103525v |
| [14] |
LI S H, SHI H G, SUN C H, et al. Synthesis and crystal structure of nitrogen-rich compound: 2, 5, 2'-triazido-1, 1'-azo-1, 3, 4-triazole[J]. Journal of Chemical Crystallography, 2009, 39(1): 13-16. DOI:10.1007/s10870-008-9411-1 |
| [15] |
FISCHER N, IZSAK D, KLAPÖTKE T M, et al. The chemistry of 5-(tetrazol-1-yl)-2H-tetrazole: An extensive study of structural and energetic properties[J]. Chemistry-A European Journal, 2013, 19(27): 8948-8957. DOI:10.1002/chem.201300691 |
| [16] |
DIPPOLD A A, KLAPÖTKE T M, OSWALD M. Asymmetrically substituted 5, 5'-bistriazoles-nitrogen rich materials with various energetic functionalities[J]. Dalton Transactions, 2013, 42(31): 11136-11145. DOI:10.1039/c3dt51205c |
| [17] |
FISCHER D, KLAPÖTKE T M, STIERSTORFER J. 1, 5-Di(nitramino)tetrazole: High sensitivity and superior explosive performance[J]. Angewandte Chemie-International Edition, 2015, 54(35): 10299-10302. DOI:10.1002/anie.201502919 |
| [18] |
LI Y N, BI F Q, WANG B Z, et al. Synthesis and properties of high energy materials based on 1, 5-di(nitramino)tetrazole[J]. Chinese Journal of Explosives & Propellants, 2015, 38(6): 16-20. |
| [19] |
FISCHER D, KLAPÖTKE T M, STIERSTORFER J, et al. 1, 1'-Nitramino-5, 5'-bitetrazoles[J]. Chemistry-A European Journal, 2016, 22(14): 4966-4970. DOI:10.1002/chem.201600177 |
| [20] |
LI F, CONG X M, DU Z M, et al. 1, 1'-Diamino-5, 5'-azotetrazole: a nitrogen rich compound[J]. New Journal of Chemistry, 2012, 36(10): 1953-1956. DOI:10.1039/c2nj40109f |




