2. 煤科集团杭州环保研究有限公司,浙江 杭州 311201
2. Hangzhou Environmental Protection Research Institute of China Coal Technology & Engineering Group, Hangzhou 311201, China
四氢呋喃(tetrahydrofuran,THF)是一种重要的有机合成原料和性能优良的有机溶剂,特别适用于溶解聚氯乙烯、聚偏氯乙烯和丁苯胺等,有“万能溶剂”之称[1]。但是由于THF易挥发,在生产和使用过程中,有大量THF以废气形式进入环境中,对生物和环境形成危害[2]。为此,国内外对THF的排放进行了严格限制[3]。水溶液吸收法是处理挥发性有机气体最便宜和安全的方法,其缺点是容易吸收饱和且吸收后的饱和溶液需要进一步处理,因此吸收法需与其他技术联合用于废气中THF的去除。通常,液相氧化方法有Fenton氧化法[4]、TiO2光催化氧化法[5]、电化学氧化法[6-10]等,其中Fenton氧化法和TiO2光催化氧化法都能产生强氧化性的羟基自由基,具有氧化能力强,处理效率高等优点,但Fenton氧化法需要大量亚铁盐以及双氧水等耗材,增加了试剂成本和运行费用;TiO2光催化氧化法存在催化剂制备过程复杂、使用寿命较短、更换成本较高等问题,限制了其工业化应用;电化学氧化法因其优势,如反应器简单、占地面积小、副产物少、运行费用较低等,已成为发展前景良好的环境友好型应用技术之一。
本文研究电化学氧化与水溶液吸收相结合的方法去除和降解废气中的THF。以钌钛电极棒为阳极,探讨电解液类型、氯离子浓度、溶液初始pH值等参数对THF吸收和降解效果影响,进一步研究紫外光照射强化电化学氧化吸收的效果。研究结果表明该阳极材料对废水中有机污染物的氧化有较好活性,尤其是在溶液中氯含量较高情况下,具有更佳的THF降解效果[8]。
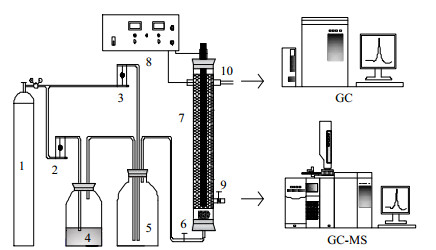
2 实验 2.1 实验装置实验流程如图 1所示,由模拟气供应单元,直流电源(输出电压0~30 V,电流0~100 A,SK1730SL10A),电化学氧化反应器和气体分析单元组成。电化学反应器是棒-圆筒反应器(内径30 mm,长350 mm),涂附有RuO2层的Ti棒为阳极(直径10 mm,长350 mm)。不锈钢网(长300 mm)连接到玻璃圆筒反应器的内壁作为阴极。RuO2/Ti阳极和不锈钢网阴极之间距离为9 mm。实验采用氮气和THF混合组成模拟废气,氮气分成两路,一路经过玻璃转子流量计3以30 mL·min-1的流量通入装有THF液体的气体发生瓶4,吹出易挥发的THF,与另一路氮气在缓冲瓶5中混合配制成THF模拟废气,THF的浓度调节至约1 000 mg·m-3。模拟废气由反应器底部进入,在电化学反应器7底部安装有气体分配器,使含THF的废气以微小的气泡均匀分布在液相中。经反应器内电化学氧化反应净化后的气体,由反应器上端的出气口排出。气体采样点6、10分别设在电化学反应器的进口和出口处,以便定时采样测定进出口THF废气的浓度;9为液体采样点,用于定时采集电解前后的溶液,进行电化学氧化产物的检测分析。
|
图 1 实验流程图 Fig.1 Schematic diagram of the experimental setup Schematic diagram of the experimental setup 1. gas cylinder 2, 3. gas flow meter 4. THF bubbling bottle 5. buffer 7. electrochemical reactor 8. DC power supply 9. liquid sampling port 6, 10. gas sampling port |
通过气相色谱仪(7890B,Agilent)对模拟废气在反应器进出口的浓度进行测定。气相色谱分析条件:HP-5毛细管柱(30 m×320 μm×0.25 μm),FID检测器,色谱柱温度180 ℃,检测器温度200 ℃,气化室温度180 ℃,氮气压力50 kPa,氢气压力25 kPa,空气压力50 kPa,进样量1 mL。用傅里叶红外光谱仪(AVATAR370,Nicolet)对气相反应产物进行鉴定。
通过气相色谱-质谱联用仪(7890A-5775C,Agilent)检测分析电化学氧化后的液相产物。分析条件:DB-5M毛细管柱(30 m×320 μm×0.25 μm);程序升温初温30 ℃保持1 min,以20 ℃·min-1的速率升温至80 ℃后保持1 min,再以8 ℃·min-1的速率升温至250 ℃,保持0.5 min;进样口温度270 ℃,氮气压力50 kPa,氢气压力25 kPa,空气压力50 kPa,进样1 μL,分流比20:1,溶剂延迟6 min。
THF废气的去除率按式(1)计算:
| $ \eta = \frac{{C{\rm{in}} - C{\rm{out}}}}{{C{\rm{in}}}} \times 100\% $ | (1) |
式中:Cin和Cout分别为反应前、后模拟废气的浓度,mg·m-3。
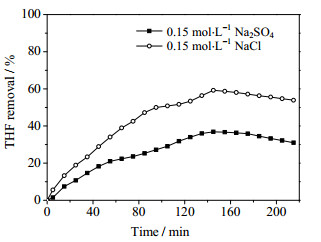
3 结果与讨论 3.1 不同电解液对四氢呋喃去除效果的影响电流密度为39 mA·cm-2的条件下,研究不同电解液(分别为0.15 mol·L-1 NaCl和0.15 mol·L-1 Na2SO4两种水溶液,pH = 3)对浓度为1 000 mg·m-3 THF废气去除效果的影响,实验结果如图 2所示。从图 2可以看出,THF在NaCl溶液中的去除效果明显好于在Na2SO4溶液中的去除效果。
|
图 2 不同电解质对四氢呋喃去除率的影响 Fig.2 Effects of electrolytes on THF removal |
RuO2/Ti阳极被认为是废水处理中降解有机污染物的有效阳极材料[9-10]。RuO2阳极是一种析氯电极,导致THF在NaCl溶液和Na2SO4溶液中的去除差异[10-11]。在Na2SO4溶液中,THF的去除主要归因于阳极上发生反应(2)产生的羟基自由基氧化THF,并且在阳极表面也可能存在THF的直接氧化[11-13]。但是阳极直接氧化和阳极产生羟基自由基等间接氧化THF的作用比较弱[14-15]。而NaCl溶液作为电解液时,RuO2析氯电极上发生反应(3)产生氯气,通过反应(4)形成溶于水的次氯酸盐或次氯酸等氧化性物质。这些氧化性物质与被水吸收的THF发生反应,从而促进THF的吸收和降解,致使THF在Na2SO4溶液中的去除效果往往不如在NaCl溶液中。
| $ {{\rm{H}}_{\rm{2}}}{\rm{O}}\to{\rm{H}} \cdot {\rm{ + }} \cdot {\rm{OH}} $ | (2) |
| $ {\rm{2C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + 2}}{{\rm{e}}^ - } $ | (3) |
| $ {{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{l}}_{\rm{2}}} \to {\rm{HOCl + HCl}} $ | (4) |
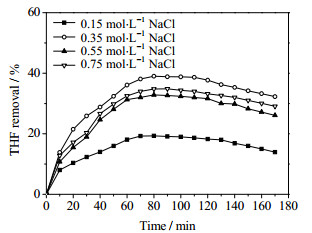
在电流密度39 mA·cm-2的条件下,研究Cl-浓度(分别为0.15,0.35,0.55和0.75 mol·L-1)对浓度为1 000 mg·m-3的THF废气去除效果的影响,实验结果如图 3所示。从图中可以看出,随着Cl-浓度的增大,THF的去除率逐渐增大,但当Cl-浓度再进一步增加时,THF的去除率反而下降。这被认为是在一定的电流密度范围内,Cl-的浓度越大,产生的次氯酸越多,对THF的去除率就越高。但Cl-浓度过大导致盐析效应增强,不利于THF的吸收。同时,部分氯气可能与废气一起释放,溶液中的Cl-损失,降低THF的去除效果。这也是随着反应时间延长,反应后期THF去除率逐渐降低的原因。如在0.35 mol·L-1 NaCl溶液中,经电化学氧化反应80~100 min后,THF的去除率达39%左右。但随着反应时间增加,THF去除率逐渐下降,反应180 min后去除率下降为29.6%。此外,溶液中的次氯酸和次氯酸盐也可能在某些条件下转化为亚氯酸盐和氯酸盐[16],导致溶液中有效氯含量下降[17],从而降低THF的去除率。
|
图 3 氯化钠浓度对四氢呋喃去除效果的影响 Fig.3 Effects of NaCl concentration on THF removal |
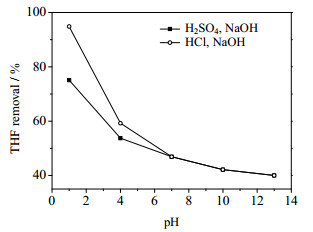
电流密度为39 mA·cm-2条件下,研究溶液初始pH对THF (1 000 mg·m-3)废气去除效果的影响。电解液为250 mL浓度0.35 mol·L-1的NaCl溶液。实验通过滴加稀硫酸、稀盐酸和氢氧化钠调节NaCl溶液的pH分别为1、4、7、10和13。实验结果如图 4所示。
|
图 4 初始pH对四氢呋喃去除效果的影响 Fig.4 Effects of initial pH on THF removal |
从图 4可以看出,pH对THF去除效果影响比较大。酸性条件下THF去除率高,而碱性条件下THF的去除率较低。这可能是因为电解NaCl溶液时,有多个氧化还原反应同时进行,如HOCl/Cl2、ClO-/Cl-等。HOCl与ClO-在溶液中所占的比例与溶液的pH有关,在酸性环境中以HOCl为主,在碱性环境中以ClO-为主[18]。HOCl的标准氧化还原电位为1.63 V,而ClO-仅为0.90 V[10, 19-21],即HOCl的氧化能力远强于ClO-。此外,通过滴加稀盐酸调节NaCl溶液pH在保持溶液酸性的同时,溶液中的也增加Cl-,有利于反应(3)和(4)的进行,因此去除率也大大提高,pH为1时,去除率达到94.83%。所以酸性条件下更有利于有效氯参与的间接氧化。另一方面,碱性条件下发生反应(5),生成副产物ClO3-,而ClO3-是十分稳定的物质,不起氧化作用[22-23],从而导致废气中THF的去除率下降。
0.35 mol·L-1 Na2SO4溶液作为电解液时也得出了一样的结论:酸性条件更有利于THF的吸收与降解。pH为3时,THF的去除率为37%;pH为10时,THF的去除率仅有10%。这可能是因为酸性Na2SO4溶液中的H+可以抑制阳极表面析氧反应的发生。氧气析出等副反应的减少,提高了THF的去除效果。
| $ {\rm{2HOCl + Cl}}{{\rm{O}}^ - }{\rm{ + 2O}}{{\rm{H}}^ - } \to {\rm{ClO}}_{\rm{3}}^ - {\rm{ + 2C}}{{\rm{l}}^ - }{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (5) |
浓度0.35 mol·L-1的NaCl溶液在pH为4,电流密度为39 mA·cm-2时,研究紫外光照射对THF (1 000 mg·m-3)废气去除效果的影响。实验结果如图 5所示。
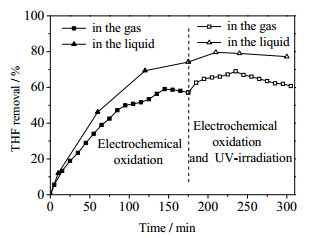
|
图 5 紫外光照射对四氢呋喃去除效果的影响 Fig.5 Effects of UV-irradiation on THF removal |
由图 5可见,电化学氧化反应对THF的去除达稳定状态后,打开紫外灯(28 W,254 nm)照射电化学反应器,可以使THF的去除率小幅度增加。这可能是因为次氯酸根和次氯酸极不稳定,在吸收紫外光后迅速分解,发生如反应(6)、(7)和(8)等一系列链反应,形成氯自由基和羟基自由基等氧化性物质,这些物质的氧化性比活性氯更强,可以加强对有机物质的降解[24-27]。
| $ \mathrm{HOCl} \stackrel{{hv}}{\longrightarrow} \cdot \mathrm{Cl}+\cdot \mathrm{OH} $ | (6) |
| $ {\rm{OC}}{{\rm{l}}^ - }\mathop \to \limits^{hv} \cdot {\rm{Cl + }} \cdot {{\rm{O}}^ - } $ | (7) |
| $ {{\rm{O}}^ - }{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\mathop \to \limits^{hv} \cdot {\rm{OH + O}}{{\rm{H}}^ - } $ | (8) |
采用GC-MS对电化学氧化后溶液中的产物进行鉴定,如图 6所示。检测到THF电化学氧化后的溶液中存在γ-丁内酯。这与WERMECKES等[28]研究发现电化学氧化THF得到的产物以γ-丁内酯为主的结果一致。如图 7所示,以反应前气体为光谱背景,用FTIR测定THF在气相中最终氧化产物为CO2。
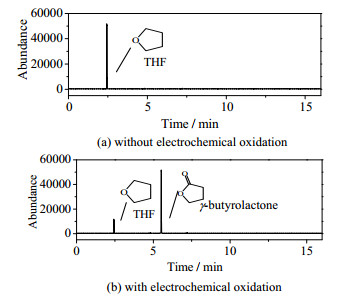
|
图 6 溶液中产物的气相图 Fig.6 Gas chromatographic spectra of compounds in solution |
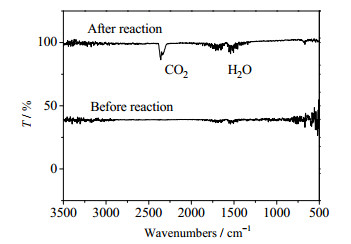
|
图 7 反应后气体产物的红外图(反应前气体为背景) Fig.7 Infrared spectra of the products in gas stream after reaction (Inlet gas as a background gas) |
THF氧化在液相中反应的机理如图 8所示:THF在次氯酸、羟基自由基等氧化性物质的攻击下,脱氢并得到一个羟基,生成2-羟基THF,随后2-羟基THF进一步被氧化生成γ-丁内酯[29-31]。
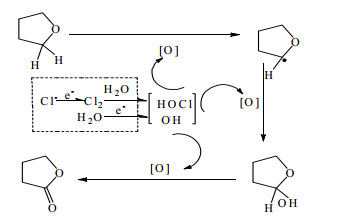
|
图 8 四氢呋喃电化学氧化反应机理 Fig.8 Degradation pathway of THF |
在pH为1,电解液为0.35 mol·L-1的NaCl溶液中,THF去除率最高,实验过程中1 000 mg·m-3的THF浓度对应气流量为600 mL·min-1,使用20 W输出功率的直流电源,此时THF对应的单位能耗为0.5 mg·kJ-1。本方法以氯化钠的水溶液为电解质结合电化学氧化,药剂循环使用,降解过程中无需其他药剂,降低了处理成本,具有较理想的经济效益。
4 结论(1) 溶液吸收耦合电化学氧化能在吸收的同时通过电化学反应降解溶液中的THF,从而提高了气流中THF的吸收效率。
(2) THF在NaCl溶液中比在Na2SO4溶液中的去除效果好。这主要是由于电解NaCl溶液产生有效氯对THF进行间接氧化。
(3) NaCl溶液作为电解液时,酸性条件更有利于THF的吸收与降解,在pH约为1时,去除效果最高可达94.83%;酸性Na2SO4溶液中THF的去除率也高于碱性溶液。
(4) 紫外光照射可以增强溶液吸收结合电化学氧化体系对THF的去除效果,这是因为次氯酸根和次氯酸极不稳定,在吸收紫外光后会迅速分解,形成氧化性更强的氯自由基和羟基自由基,加强对THF的降解。
(5) THF经溶液吸收结合电化学氧化处理后得到的液相产物主要是γ-丁内酯,最终气相产物为二氧化碳。
| [1] |
王宏伟. 有机化工的基础原料—THF[J]. 化学工程师, 2010, 24(1): 29-30. WANG H W. The basic raw material of organic chemicals – Tetrahydrofuran[J]. Chemical Engineer, 2010, 24(1): 29-30. |
| [2] |
傅慰祖. 有机溶剂四氢呋喃的毒性及其危害[J]. 职业卫生与应急救援, 1996, 14(2): 22-23. FU W Z. Toxicity and harm of organic solvent tetrahydrofuran[J]. Occupational Health and Emergency Rescue, 1996, 14(2): 22-23. |
| [3] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.工业用四氢呋喃中华人民共和国国家标准: GB/ T24772-2009[S].北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Industrial tetrahydrofuran national standard of the people's republic of China: GB/T24772-2009[S]. Beijing: Standards Press of China, 2015. |
| [4] |
王莉莉, 黄立维, 黄桂凤, 等. 溶液吸收结合铁碳微电解法处理三氯乙烯废气实验研究[J]. 高校化学工程学报, 2014, 28(5): 1166-1171. WANG L L, HUANG L W, HUANG G F, et al. Experimental study on treatment of trichloroethylene emission by absorption combined with iron filings-activated carbon micro-electrolysis[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(5): 1166-1171. |
| [5] |
余涛, 张萌, 林秋健, 等. 猪场废水Fenton法深度除碳研究[J]. 高校化学工程学报, 2018, 32(3): 667-674. YU T, ZHANG Y, LIN Q J, et al. Advanced removal of organics from swine wastewater by Fenton process[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(3): 667-674. |
| [6] |
顾执奇, 张士汉, 徐丹华, 等. 氮磷共掺杂TiO2的制备、结构表征及高湿度下光催化净化氯苯废气的研究[J]. 高校化学工程学报, 2017, 31(5): 1201-1209. GU Z Q, ZHANG S H, XU D H, et al. Nitrogen and phosphorus Co-doped TiO2 for photocatalytic removal of gaseous chlorobenzene under high humidity condition: preparation, characterization and performance[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(5): 1201-1209. |
| [7] |
徐晓华, 许青枝, 黄桂凤, 等. RuO2/Ti阳极电化学氧化吸收氨废气[J]. 化工学报, 2016, 67(6): 2568-2574. XU X H, XU Q Z, HUANG G F, et al. Absorption of ammonia waste gas by RuO2/Ti anode electrochemical oxidation[J]. CIESC Journal, 2016, 67(6): 2568-2574. |
| [8] |
LUU T L, KIM J, YOON J. Physicochemical properties of RuO2 and IrO2 electrodes affecting chlorine evolutions[J]. Journal of Industrial and Engineering Chemistry, 2015, 21: 400-404. DOI:10.1016/j.jiec.2014.02.052 |
| [9] |
KHATAEE A, AKBARPOUR A, VAHID B. Photoassisted electrochemical degradation of an azo dye using Ti/RuO2 anode and carbon nanotubes containing gas-diffusion cathode[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(3): 930-936. DOI:10.1016/j.jtice.2013.08.015 |
| [10] |
FAJARDO A S, SECA H F, MARTINS R C, et al. Electrochemical oxidation of phenolic wastewaters using a batch-stirred reactor with NaCl electrolyte and Ti/RuO2 anodes[J]. Journal of Electroanalytical Chemistry, 2017, 785: 180-189. DOI:10.1016/j.jelechem.2016.12.033 |
| [11] |
KAUR P, KUSHWAHA J P, SANGAL V K. Evaluation and disposability study of actual textile wastewater treatment by electro-oxidation method using Ti/RuO2 anode[J]. Process Safety and Environmental Protection, 2017, 111: 13-22. DOI:10.1016/j.psep.2017.06.004 |
| [12] |
KAUR R, KUSHWAHA J P, SINGH N. Electro-oxidation of ofloxacin antibiotic by dimensionally stable Ti/RuO2 anode: Evaluation and mechanistic approach[J]. Chemosphere, 2018, 193: 685-694. DOI:10.1016/j.chemosphere.2017.11.065 |
| [13] |
KUMAR S, SINGH S, SRIVASTAVA V C. Electro-oxidation of nitrophenol by ruthenium oxide coated titanium electrode: Parametric, kinetic and mechanistic study[J]. Chemical Engineering Journal, 2015, 263: 135-143. DOI:10.1016/j.cej.2014.11.051 |
| [14] |
KIM K W, KIM Y J, KIM I T, et al. The electrolytic decomposition mechanism of ammonia to nitrogen at an IrO2 anode[J]. Electrochim Acta, 2005, 50(22): 4356-4364. DOI:10.1016/j.electacta.2005.01.046 |
| [15] |
FAN N W, LI Z K, ZHAO L, et al. Electrochemical denitrification and kinetics study using Ti/IrO2-TiO2-RuO2 as the anode and Cu/Zn as the cathode[J]. Chemical Engineering Journal, 2013, 24(1): 83-90. |
| [16] |
POLCARO A M, VACCA A, MASCIA M, et al. Product and by-product formation in electrolysis of dilute chloride solution[J]. Journal of Applied Electrochemistry, 2008, 38(7): 979-984. DOI:10.1007/s10800-008-9509-3 |
| [17] |
李晓萍, 林海波, 吴岩, 等. Ti/PbO2阳极在氯化钠溶液中电解生成活性氯的研究[J]. 吉林大学学报(理学版), 2005, 43(3): 358-362. LI X P, LIN H B, WU Y, et al. Study on electrolysis of Ti/PbO2 anode in sodium chloride solution to produce active chlorine[J]. Journal of Jilin University (Science Edition), 2005, 43(3): 358-362. |
| [18] |
RICARDO G M, NOEMI P H, PAUL W, et al. Influence of the dentinal wall on the pH of sodium hypochlorite during Root Canal irrigation[J]. Journal of Endodontics, 2014, 40(7): 1005-1008. DOI:10.1016/j.joen.2013.12.018 |
| [19] |
周相武, 汪晓军, 刘姣, 等. 次氯酸钠溶液的氧化性研究[J]. 氯碱工业, 2006, 8: 28-30. ZHOU X W, WANG X J, LIU J, et al. Study on oxidation of sodium hypochlorite solution[J]. Chlor-Alkali Industry, 2006, 8: 28-30. |
| [20] |
JUNGBLUTH H, MARENGING M, DE-DEUS G, et al. Stabilizing sodium hypochlorite at high pH: Effects on soft tissue and dentin[J]. Journal of Endodontics, 2011, 37(35): 693-696. |
| [21] |
POLCARO A M, VACCA A, MASCIA M, et al. Electrochemical treatment of waters with BDD anodes: Kinetics of the reaction involving chlorides[J]. Journal of Applied Electrochemistry, 2009, 39(11): 2083-2093. DOI:10.1007/s10800-009-9870-x |
| [22] |
VLYSSIDES A G, ISRAILIDES C J. Detoxification of tannery waste liquors with an electrolysis system[J]. Environmental Pollution, 1997, 97(1/2): 147-152. |
| [23] |
VANLANGENDONCK Y, Corbisier D, LIER dE A V. Influence of operating conditions on the ammonia electro-oxidation rate in wastewaters from power plants (ELONITATM technique)[J]. Water Research, 2005, 39(13): 3028-3034. DOI:10.1016/j.watres.2005.05.013 |
| [24] |
XIAO S H, QU J H, ZHAO X, et al. Electrochemical process combined with UV light irradiation for synergistic degradation of ammonia in chloride-containing solutions[J]. Water Research, 2009, 43(5): 1432-1440. DOI:10.1016/j.watres.2008.12.023 |
| [25] |
吴照学, 李海军, 杨智良, 等. 电解与紫外协同去除工厂化养殖循环水中氨氮效果研究[J]. 农业机械学报, 2016, 4: 272-279. WU Z X, LI H J, YANG Z L, et al. Study on the synergistic effect of electrolysis and ultraviolet on removing ammonia nitrogen from circulating water in factory culture[J]. Transactions of the Chinese Society of Agricultural Machinery, 2016, 4: 272-279. |
| [26] |
DING W, JAMES R B, RON H. Medium pressure UV combined with chlorine advanced oxidation for trichloroethylene destruction in a model water[J]. Water Research, 2012, 46(15): 4677-4686. DOI:10.1016/j.watres.2012.06.007 |
| [27] |
何鹏, 李绍兴, 余龙. 紫外光协同NaClO氧化法处理双甘膦生产废水[J]. 化工环保, 2011, 5: 447-449. HE P, LI S X, YU L. Treatment of wastewater from glyphosate production by UV-assisted NaClO oxidation process[J]. Chemical Environmental Protection, 2011, 5: 447-449. |
| [28] |
WERMECKES B, BECK F, SCHULZ H. Selective anodic oxidation of tetrahydrofuran[J]. Tetrahedron, 1987, 43(7): 577-583. |
| [29] |
王猛, 惠永海, 张雪华, 等. 四氢呋喃的氧化[J]. 化学进展, 2013, 25(7): 1158-1165. WANG M, HUI Y H, ZHANG X H, et al. Oxidation of tetrahydrofuran[J]. Progress in Chemistry, 2013, 25(7): 1158-1165. |
| [30] |
AVGOUSTI C, GEORGOLIOS N, KYRIACOU G, et al. The electrochemical oxidation of tetrahydrofuran in sulphuric acid solution[J]. Electrochimca Acta, 1999, 44(19): 3295-3301. DOI:10.1016/S0013-4686(99)00051-1 |
| [31] |
龚啸.吸收-电化学氧化降解气态杂环化合物的研究[D].杭州: 浙江大学, 2017. GONG X. Absorption-electrochemical oxidation degradation of gaseous heterocyclic compounds[D]. Hangzhou: Zhejiang University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018001066.htm |




